阿折地平肠溶固体分散体的制备及质量评价
2021-12-10蒋婷郑玲利袁明勇蒋学华
蒋婷 郑玲利 袁明勇 蒋学华
摘 要 目的:制备阿折地平肠溶固体分散体并评价其质量。方法:采用溶剂法制备阿折地平肠溶固体分散体,以累积释放度为考察指标,通过单因素试验对载体材料型号和用量等处方条件进行优化,并采用差示量热扫描法(DSC)、X-射线衍射法(XRD)和傅里叶红外光谱法(FTIR)对其进行质量评价,同时对其稳定性进行考察。结果:将阿折地平与肠溶载体材料Eudragit L100-55型丙烯酸树脂按照1 ∶ 5(m/m)的比例制备成肠溶固体分散体后,其体外释放情况明显改善;DSC法、XRD法和FTIR法均验证了其晶型发生了改变,以无定形状态存在;稳定性考察结果显示,阿折地平肠溶固体分散体在高温(60 ℃)、高湿(相对湿度75%)、强光[(4 500±500) lx]条件下放置10 d内稳定性较好。结论:采用溶剂法以Eudragit L100-55型丙烯酸树脂为载体材料所制得的阿折地平肠溶固体分散体可消除晶型影响、提高释放度且具有较好的稳定性。
关键词 阿折地平;肠溶固体分散体;溶剂法;质量评价;稳定性
ABSTRACT OBJECTIVE: To prepare Azelnidipine enteric solid dispersion and evaluate its quality. METHODS: Azelnidipine enteric solid dispersion was prepared by solvent method. Taking cumulative dissolution rate as the index, single factor test was used to optimize carrier material type and its ratio. The quality of the product was evaluated by DSC, XRD and FTIR, and its stability was investigated. RESULTS: After azelnidipine and carrier material of Eudragit L100-55 acrylic resin were prepared to enteric solid dispersion at a ratio of 1 ∶ 5 (m/m), its dissolution rate was significantly improved. DSC, XRD and FTIR method had all verified the crystal form of azelnidipine changed and it existed in amorphous form. The results of stability test showed that Azelnidipine enteric solid dispersion was stable under high temperature (60 ℃), high humidity (75%) and strong light [(4 500±500) lx] for 10 days. CONCLUSIONS: Azelnidipine enteric solid dispersion by solvent method with Eudragit L100-55 acrylic resin as carrier can eliminate the influence of crystal form, improve dissolution and has good stability.
KEYWORDS Azelnidipine; Enteric solid dispersion; Solvent method; Quality evaluation; Stability
阿折地平(Azelnidipine)最早于2003年在日本獲准上市,其适应证为高血压[1]。目前我国已有阿折地平普通片剂上市,但阿折地平存在多晶型、遇光不稳定、溶解度低、呈弱碱性及在酸中不稳定等理化性质,从而导致其普通片剂的稳定性较差、生物利用度较低,临床应用大大受到限制[2-3]。固体分散体是固体药物分散在固体载体中制成的高度分散体系,药物通常以分子、胶体、微晶或无定形状态分散于载体材料中,其不仅具有高效、速效、缓释等特点,还具有稳定药物、减少胃功能障碍、遮避苦味、提高生物利用度等作用[4-5]。目前国内已有部分研究将阿折地平制成固体分散体来解决其溶解性问题,但因没有考虑到药物晶型对释放的影响和药物在体内的吸收情况,导致其生物利用度并没有得到提高[6]。本研究将阿折地平和丙烯酸树脂类肠溶载体材料制备成肠溶固体分散体,一方面使多晶型、低溶解度的阿折地平分子以无定形状态高度分散于载体材料中,以消除晶型对释放的影响,并提高溶解度和释放速率;另一方面,使呈弱碱性、在酸中不稳定的阿折地平分子在患者肠道释放,以消除胃中酸性环境对整个制剂崩解和吸收的影响,从而提高模型药物的释放度和生物利用度。
1 材料
1.1 主要仪器
本研究所用的主要仪器有BSA224S-CW型万分之一电子天平、BSA2235-CW型千分之一电子天平(德国Sartorius公司),JJ1000型百分之一电子天平(常熟市双杰测试仪器厂),TU-1901型紫外可见分光光度计、XD-2型自动X射线粉末衍射(XRD)仪(北京普析通用仪器有限公司),pHS-3C型pH计(上海仪电科学仪器股份有限公司),S212型恒速搅拌器、W201B型恒温水浴锅(上海申顺生物技术有限公司),7100型全自动智能溶出仪(美国DISTEK公司),DZF-3型真空干燥箱(上海医用恒温设备厂有限公司),SHB-B95型真空泵(郑州长城科工贸有限公司),KQ-500DB型数控超声仪(昆山市超声仪器有限公司),RE-205型旋转蒸发仪(上海予华仪器设备有限公司),DSC1型热分析仪(瑞士Mettler-Toledo公司),Spectrum400型傅里叶变换红外光谱(FTIR)仪(英国PE公司),JY-DSC-1000型差示扫描量热(DSC)仪(上海君翼仪器设备有限公司),药品强光照射试验箱(重庆市永生实验仪器厂)。
1.2 主要药品与试剂
本研究所用的主要药品与试剂有阿折地平原料药(成都医学院药学院药化实验室制备,批号180301,纯度100.1%),磷酸二氢钠(分析纯,湖南九典制药股份有限公司),磷酸氢二钠、磷酸二氢钾(分析纯,成都市科龙化工试剂厂),氢氧化钠(分析纯,湖南尔康制药股份有限公司),丙烯酸树脂(型号分别为Eudragit L100、Eudragit L100-55、Eudragit S100,德国赢创工业集团),浓盐酸(分析纯,成都金山化学试剂有限公司),胃蛋白酶、胰酶[生工生物工程(上海)股份有限公司];纯化水为成都医学院药学院药化实验室自制。
2 方法与结果
2.1 制备工艺
2.1.1 阿折地平肠溶固体分散体的制备 采用溶剂法,分别称取处方量的阿折地平原料药和丙烯酸树脂,加入适量乙醇,超声(功率500 W,频率40 kHz)5 min溶解后置于旋转蒸发仪中,于40~60 ℃恒温水浴中减压干燥,待乙醇被蒸发除尽后置于真空干燥箱中干燥24 h;取出,研细,过60目筛,于干燥、避光条件下保存。
2.1.2 阿折地平物理混合物的制备 按一定比例称取阿折地平原料药和肠溶载体材料(阿折地平与丙烯酸树脂的质量比分别为1 ∶ 4、1 ∶ 8、1 ∶ 12),研细,过24目筛,混匀,于干燥、避光条件下保存。
2.2 释放度的测定和累积释放度的计算
在人工胃液(取稀盐酸16.4 mL,加水约800 mL与胃蛋白酶10 g,摇匀后加水稀释成1 000 mL后即得,下同)和人工肠液[磷酸盐缓冲液(PBS,含胰酶,pH 6.8),下同]中,以2020年版《中国药典》(四部)通则“0931溶出度与释放度测定法第一法(篮法)”测定释放度[7],转速为100 r/min,温度为(37±0.5) ℃。分别于样品开始溶出后5、10、15、30、45、60、90、120 min时定时定位取样5 mL,取样后补充同温介质5 mL;溶出液滤过,取续滤液作为供试品溶液,在270 nm波长处测定吸光度,再根据吸光度值计算不同时间点的药物累积释放度,具体公式为:CRi=DRi+[(DR1+DR2+DR3+…+DRi-1)×V2]/V1[8]。
式中,DR=(A×V1×n)/(F×d×1 000)×100%;CR为累积释放度,DR为释放度,i为取样次数(i≥2),A为吸光度,V1为介质体积,V2为取/补液体积,F为响应因子,d为规格(mg),n为稀释倍数。
2.3 处方筛选
分别选择不同型号的丙烯酸树脂及其混合物作为肠溶载体材料,以累积释放度为指标,通过调节药物与载体的质量比,对肠溶固体分散体的处方进行筛选。
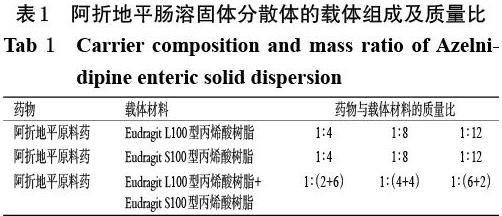
2.3.1 载体材料的选择 分别取阿折地平原料药及其与不同载体材料制备的肠溶固体分散体,按“2.2”项下方法分别测定其在人工胃液和人工肠液中的累积释放度。阿折地平肠溶固体分散体的载体组成及质量比如表1所示,溶出曲线如图1所示。
由图1可知,在人工胃液中,阿折地平与不同比例的肠溶载体材料形成的固体分散体在2 h内的累积释放度均小于10%,明显低于阿折地平原料药的累积释放度,满足2020年版《中国药典》(四部)通则“9013 缓释、控释和迟释制剂指导原则”对迟释(肠溶)制剂的耐酸要求[7]。在人工肠液中,以Eudragit S100型丙烯酸树脂为载体材料的固体分散体的累积释放度较低,而以Eudragit L100型丙烯酸树脂为载体材料的固体分散体几乎全部释放,表明比例相同而载体型号不同的阿折地平肠溶固体分散体的释药行为有较大差异。此外,用不同比例的混合肠溶载体材料制备的阿折地平肠溶固体分散体的释放不完全,其释放速率和累积释放度均较原料药低。
因此,本研究选用Eudragit L100型丙烯酸树脂作为載体材料来制备阿折地平肠溶固体分散体。当阿折地平原料药与Eudragit L100型丙烯酸树脂的质量比在1 ∶ 4~1 ∶ 12时,所制备的肠溶固体分散体在人工肠液中释放较好。但因Eudragit L100型丙烯酸树脂的溶解环境为pH大于6.0,而Eudragit L100-55型丙烯酸树脂的溶解环境为pH大于5.5[9],为进一步拓宽肠溶固体分散体在小肠中的释放和吸收环境,故本研究选择Eudragit L100-55型丙烯酸树脂作为载体材料,并在适宜的质量比范围内对载体用量进行优化。
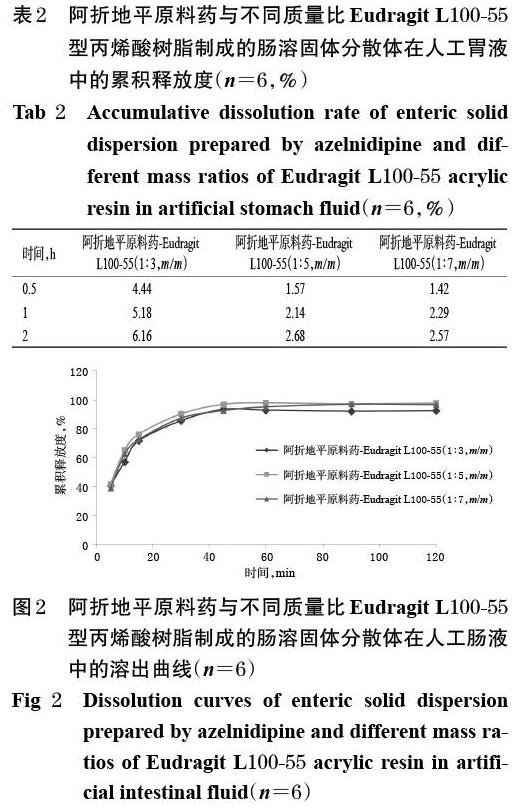
2.3.2 载体用量的优化 根据上述研究内容并经过前期优化试验,在筛选Eudragit L100-55型丙烯酸树脂的用量时,以原料药与载体质量比为1 ∶ 3~1 ∶ 7设计本实验。取阿折地平原料药与Eudragit L100-55型丙烯酸树脂,分别按1 ∶ 3、1 ∶ 5、1 ∶ 7的质量比制备肠溶固体分散体,再按“2.2”项下方法分别测定各肠溶固体分散体在人工胃液和人工肠液中累积释放度,如表2(由于数据太小,故以表格展示)和图2所示。
由表2、图2可知,载体材料型号相同、质量比不同的阿折地平肠溶固体分散体在人工肠液中的累积释放度均高于其在人工胃液中的累积释放度;不同质量比的肠溶固体分散体在人工肠液中的释放速率无明显差异,但在人工胃液中的释放速率随着载体用量的增加而降低;不同质量比的肠溶固体分散体在人工胃液中2 h内的释放度均小于10%,但在人工肠液中2 h内几乎完全释放(累积释放度在85%以上)。可见,阿折地平原料药与Eudragit L100-55型丙烯酸树脂的质量比范围在1 ∶ 3~1 ∶ 7时,其肠溶固体分散体的释放度均满足2020年版《中国药典》规定[7]。因此,优选阿折地平原料药与Eudragit L100-55型丙烯酸树脂的质量比为1 ∶ 5,允许质量比范围为1 ∶ 3~1 ∶ 7。
2.4 质量评价
为进一步验证所制备的肠溶固体分散体的质量,笔者分别采用DSC、XRD和FTIR法对其进行分析,并对其稳定性进行考察。
2.4.1 DSC分析 设置DSC仪初始温度为30 ℃、终止温度为230 ℃、升温速率为10 ℃/min,对阿折地平原料药、阿折地平原料药与Eudragit L100-55型丙烯酸树脂的物理混合物(1 ∶ 5,m/m)进行分析;再设置DSC仪初始温度为30 ℃、终止温度为120 ℃、升温速率为10 ℃/min,对Eudragit L100-55型丙烯酸树脂、阿折地平原料药与Eudragit L100-55型丙烯酸树脂所制成的肠溶固体分散体(1 ∶ 5,m/m)进行分析,结果如图3所示。
由图3可知,阿折地平原料药的特征吸收峰约为125 ℃,Eudragit L100-55型丙烯酸树脂无吸收峰,二者物理混合物的吸收峰与阿折地平原料药一致,而肠溶固体分散体中阿折地平的特征吸收峰基本消失。这说明阿折地平原料药被制备成肠溶固体分散体后,其晶型发生了改变,在载体材料中以无定形状态存在。
2.4.2 XRD分析 设置XRD仪的工作电压为40 kV、电流为40 mA、扫描步长为0.013°、每步扫描时间为50 s,对阿折地平原料药、Eudragit L100-55型丙烯酸树脂、阿折地平原料药与Eudragit L100-55型丙烯酸树脂的物理混合物(1 ∶ 5,m/m)、阿折地平原料药与Eudragit L100-55型丙烯酸树脂所制成的肠溶固体分散体(1 ∶ 5,m/m)进行扫描分析,结果如图4所示。
由图4可知,阿折地平原料药在0°~10°扫描范围(2θ)内有强的晶体衍射峰,说明阿折地平原料药以晶体形式(α晶型)存在,而Eudragit L100-55型丙烯酸树脂在该处无明显衍射峰;在物理混合物中,阿折地平原料藥的晶体衍射峰在此扫描范围内仍明显存在;但在其肠溶固体分散体中,晶体衍射峰基本消失,说明阿折地平在肠溶固体分散体中的晶型发生了改变,以无定形状态存在。
2.4.3 FTIR分析 采用FTIR法对阿折地平原料药、阿折地平原料药与Eudragit L100-55型丙烯酸树脂的物理混合物(1 ∶ 5,m/m)、阿折地平原料药与Eudragit L100-55型丙烯酸树脂所制成的肠溶固体分散体(1 ∶ 5,m/m)进行分析,检测方法为衰减全反射,光谱扫描范围为4 000~650 cm-1,所得色谱图如图5所示。
由图5可知,物理混合物中阿折地平的晶型形态与原料药一致,并无改变;但肠溶固体分散体的红外扫描图谱与原料药和物理混合物的图谱明显不同,说明阿折地平与Eudragit L100-55型丙烯酸树脂制备成肠溶固体分散体后,其晶型发生了明显改变。
2.4.4 稳定性考察 取一定量的阿折地平肠溶固体分散体平铺在培养皿中,于高温(60 ℃)、高湿(相对湿度75%)、强光[(4 500±500) lx]条件下放置10 d,考察其稳定性,平行操作3次,结果如表3~表5所示。
由表3~表5可知,在高温、高湿、强光条件下,阿折地平肠溶固体分散体的主药含量和释放度等都无明显变化,表明其在10 d内的稳定性良好,处方及工艺设计可行,可以进行进一步的稳定性考察。
3 讨论
本研究采用丙烯酸树脂类肠溶材料作为载体制备阿折地平肠溶固体分散体,该载体材料生产工艺成熟、简单易得。其中,Eudragit S型丙烯酸树脂可在pH 7.0以上的碱性介质中溶解,通常作为结肠定位释放药物的载体材料[9];研究发现其在pH 6.8的PBS中也能溶解,但溶解度较低[10] 。而Eudragit L型丙烯酸树脂有L100和L100-55两个规格的产品,前者可在pH 6.0以上的PBS中溶解,而后者在pH 5.5以上的介质溶液中就可溶解。因模型药物阿折地平主要预期在小肠释放并吸收,所以本研究采用Eudragit L100-55型丙烯酸树脂作为载体材料进行肠溶固体分散体的制备。通过质量评价证实,所制得的肠溶固体分散体符合预期的设计要求。
阿折地平在酸性介质中的溶解度较高,将其制备成肠溶固体分散体后,不仅可确保药物在pH 5.5以上的介质溶液中释放,还能显著降低其在人工胃液中的累积释放度。阿折地平肠溶固体分散体的释放实验结果证明,其在酸性介质溶液(人工胃液)中的累积释放度非常低,在碱性介质溶液(人工肠液)中能够完全释放,推测其能够有效防止阿折地平原料药在胃酸中释放和被破坏,从而提高了药物的稳定性。
DSC分析结果显示,阿折地平在肠溶固体分散体中以无定形状态存在,解决了因晶型不同而影响药物的释放及晶型稳定性问题;XRD和FTIR分析结果进一步验证了阿折地平制备成肠溶固体分散体后晶型发生明显改变、以无定形状态存在的结论,说明该肠溶固体分散体制备工艺可行。固体分散体在储存过程中可能发生老化现象,从而导致释放速率下降,相关学者对此进行了研讨并提出了改善方法[11-12]。在下一步的稳定性试验中,笔者需对此进行进一步的研究和考察。
综上所述,采用溶剂法以肠溶载体材料Eudragit L100-55型丙烯酸树脂制备阿折地平肠溶固体分散体的方法可行;所制得的阿折地平肠溶固体分散体可消除晶型影响、提高释放度且具有较好的稳定性。
参考文献
[ 1 ] 陈爱华,邬蓉,陶霞. 阿折地平:一种新型二氢吡啶类钙拮抗药[J].中国新药与临床杂志,2006,25(12):946-950.
[ 2 ] PAN Y,PANG W Z,LV J,et al. Solid state characterization of azelnidipine-oxalic acid co-crystal and co-amorphous complexes:the effect of different azelnidipine polymorphs[J]. J Pharm Biomed Anal,2017,138:302-315.
[ 3 ] GAIKWAD S S,AVARI J G. Improved bioavailability of Azelnidipine gastro retentive tablets-optimization and in-vivo assessment[J]. Mater Sci Eng C Mater Biol Appl,2019,103:109800.
[ 4 ] 杨明.中药药剂学[M].北京:中国中医药出版社,2016:378.
[ 5 ] CID A G,SIMONAZZI A,PALMA S D,et al. Solid dispersion technology as a strategy to improve the bioavailability of poorly soluble drugs[J]. Ther Deliv,2019,10(6):363-382.
[ 6 ] 王悦,刘欢,王成港,等.阿折地平固体分散体的制备及溶出度的考察[J].中国医药导报,2012,9(24):118-120.
[ 7 ] 國家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:132,472.
[ 8 ] 黄阿农.阿折地平片溶出测定方法研究[J].现代中西医结合杂志,2009,18(15):1756-1757.
[ 9 ] 白靖,李骞,王静,等.药用丙烯酸树脂在制剂中的应用进展[J].中国药房,2011,22(17):1613-1616.
[10] 李文芳,金青,陈璐,等.聚丙烯酸树脂包衣膜对不同性质药物结肠部位释放动力学研究[J].西北药学杂志,2017,32(3):333-336.
[11] 付亭亭,左文宝,郭珏铄,等.固体分散体的释药机制及其物理稳定性研究进展[J].中国新药杂志,2020,29(3):275-280.
[12] 欧丽泉,赵国巍,曾庆云,等.聚合物载体对固体分散体稳定性影响的研究进展[J].中国医院药学杂志,2020,40(19):2077-2081.
(收稿日期:2021-01-05 修回日期:2021-07-05)
(编辑:胡晓霖)
