固相萃取/气质联用法测定水中乙草胺的方法探讨
2021-12-09邓智友王建蓉周智勇蔡雨含
邓智友, 王建蓉, 周智勇, 胥 川, 蔡雨含, 马 懿
(四川省城市供排水水质监测网绵阳监测站, 四川 绵阳 621000)
乙草胺(Acetochor)是一种选择性芽前酰胺类除草剂,广泛应用于花生、玉米等豆类植物,但由于乙草胺及其代谢产物醌亚胺具有致癌作用且容易残留,已被美国国家环境保护局(USEPA)定为B-2类致癌物[1-2]。乙草胺会经过雨水、灌溉等方式进入水体从而造成水体污染,目前国内外农业以及水质检测方面对乙草胺的检测方法报道较少,因此有必要建立一种快速可靠检测乙草胺的方法。
1 方法原理
水样中乙草胺被Waters Oasis HLB固相萃取小柱富集吸附,依次用不同溶剂洗脱,洗脱液经浓缩后用气相色谱毛细柱分离,然后进入质谱仪检测。通过目标组分的质谱图和保留时间与标准物质的质谱图和保留时间作对照进行定性,目标组分定量离子的响应值大小与浓度成正比,以此进行水中有机化合物的定量。
2 实验部分
2.1 实验仪器与试剂
2.1.1 实验仪器
气相色谱-质谱(GC-MS)仪:带自动进样器的Agilent 7890A GC-5975C MS,配工作站;固相萃取仪Supelco VISIPREP DL;无油真空泵Lab Tech;抽滤瓶。
2.1.2 标准溶液
乙草胺Acetochlor(34256-82-1)标准溶液:100 μg/mL;色谱纯有机溶剂:甲醇,乙酸乙酯,丙酮;硫酸:1+3硫酸溶液;亚硫酸钠(2%),优级纯。
2.1.3 实验材料
移液管:5和10 mL;C18、Waters HLB固相萃取小柱;微量注射器:10 μL。
2.2 GC-MS检测条件
2.2.1 气相色谱条件
Agilent 190915-433毛细管柱(30 m×0.25 mm×0.25 μm);色谱柱温度:100℃保持2 min,然后以10℃/min 升温至200℃,再以30℃/min升温至270℃,保持10 min;不分流进样方式;进样量:1.0 μL;进样口温度: 250℃;载气:氦气(纯度≥99.999%);流速:1 mL/min。
2.2.2 质谱条件
色谱-质谱接口温度:280℃;电离方式:EI;电子能量:70 eV;离子源温度:230℃;四级杆温度:150℃;溶剂延迟:3.6 min。
选择SIM离子模式,在NIST标准谱库中检索到乙草胺的EI 质谱图,其特征碎片离子主要为m/z 59,132,117,146,162,174,223,但是m/z 59 的碎片过小,对其干扰明显,故不采用。根据除草剂中检测乙草胺的相关文献[3],最终选择146为定量离子,确定146,162,223为定性离子。
2.3 水样前处理和固相萃取小柱活化
采集自来水水样时,先放水数分钟以排除水管中存水,再用采样瓶采集水样。加入约2%亚硫酸钠1 mL,盖好瓶盖后混匀,静止数分钟去除余氯待萃取。
固相萃取小柱活化条件:固相萃取柱预先用5 mL甲醇、5 mL纯水过柱,注意不让甲醇和水流干。
2.3.1 萃取吸附
取500 mL已去除余氯且混合均匀的水样,用1+3硫酸溶液约1.5 mL调节pH值为1.5左右,混匀后用HLB固相萃取小柱进行萃取。控制真空泵压力,萃取水样以2 mL/min的流速通过活化后的HLB小柱,进行固相萃取。
2.3.2 洗脱与浓缩
结合其化学分子结构,乙草胺是一种极性化合物,在非极性的正己烷难溶。根据这一特点,先后采用极性比较好的不同溶剂组合乙酸乙酯+丙酮(1 ∶1)、丙酮+甲醇(1 ∶1)、丙酮、甲醇对其小柱进行洗脱;洗脱液浓缩至1 mL,待气相色谱质谱仪检测用。
2.4 定性分析
通过目标组分的质谱图和保留时间与标准物质的质谱图和保留时间作对照进行定性(保留时间随柱长不同而略有变化),乙草胺保留时间在14 min,见图1。目标组分定量离子的响应值大小与浓度成正比,以此确定水中乙草胺含量。
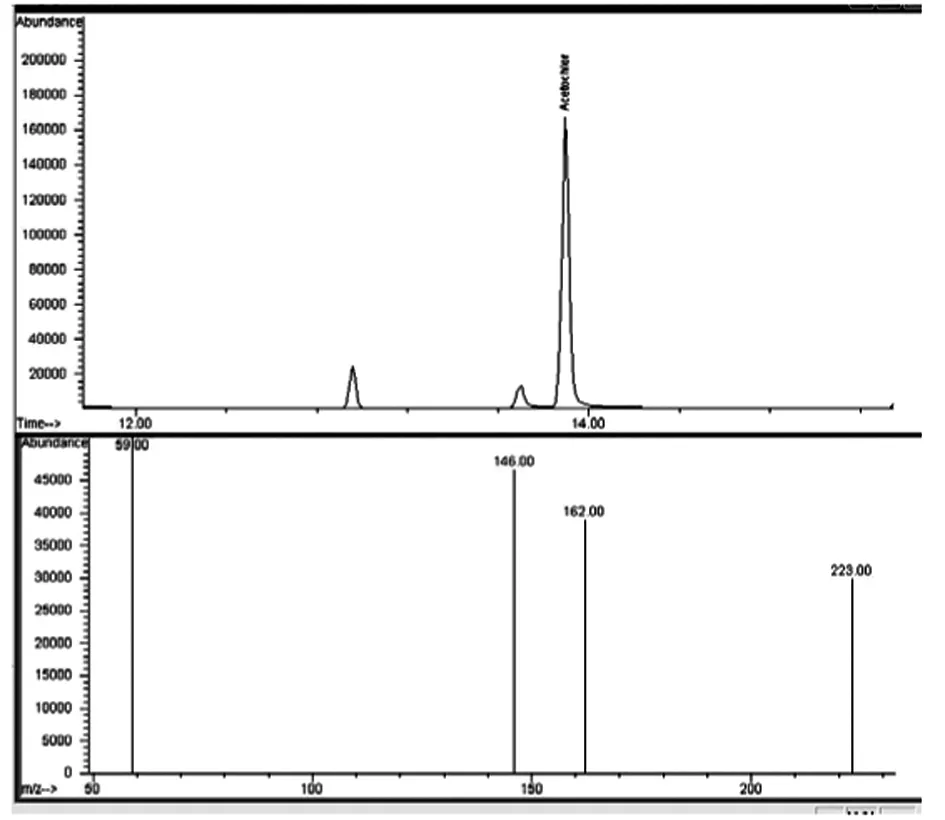
图1 乙草胺标准的总离子色谱
2.5 标准曲线的绘制
用乙草胺标准物质配成不同浓度梯度的标准系列,在与待测样品完全相同的操作条件下,分别在给定的色谱质谱条件下进行测定。
由于低浓度与高浓度的水平梯度跨度较大,绘制成一个标准曲线的线性效果较差,因此将标准物质分别按照低浓度和高浓度范围配制成标准系列。以目标化合物峰面积为纵坐标、浓度为横坐标绘制标准曲线,曲线线性良好,如表1所示。
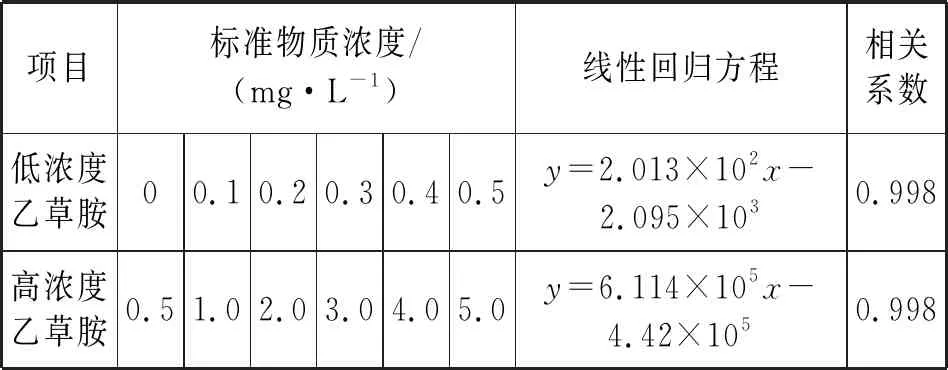
表1 标准系列和线性方程
2.6 萃取小柱与洗脱溶剂
用乙草胺标准物质加标浓度2 μg/mL至纯水平行水样中,在与待测样品完全相同的操作条件下,分别用C18小柱与HLB小柱进行萃取,萃取结束后分别按照不同组合溶剂乙酸乙酯+丙酮(1 ∶1)、丙酮+甲醇(1 ∶1)、丙酮、甲醇对其小柱进行洗脱,分别在给定的色谱质谱条件下进行测定。
3 结果与讨论
3.1 线性范围、检出限和测定下限
在试验所采用的色谱和质谱条件下,乙草胺分离情况和响应较好,浓度在0~0.5 mg/L内线性良好,相关系数为0.998;0.5~5.0 mg/L内呈良好线性,相关系数为0.998。
测定7个平行加标浓度为0.10 μg/L的乙草胺水样,测定结果分别为105,97,103,94,107,110和96 ng/L。计算得到标准偏差Si=6.1 ng/L,检出限[3]MDL=19.2 ng/L,测定下限LOD=77 ng/L。
3.2 萃取小柱与洗脱溶剂的选择
从表2可以看出,加标回收(加标2 μg/mL)实验检测结果受柱子的影响不大,因此实验选择HLB小柱。对萃取实验影响较大的因素为溶剂的选择,乙酸乙酯+丙酮(1 ∶1)和丙酮洗脱的回收率相差不大且效果明显;丙酮+甲醇(1 ∶1)和甲醇单独对其小柱进行洗脱,洗脱效果相当且较差,所以实验选择洗脱方式为乙酸乙酯+丙酮(1 ∶1)或者丙酮洗脱。
3.3 精密度与准确性评估
分别取500 mL自来水水样各7份,进行低浓度2.0 μg/L和高浓度8.0 μg/L水平的加标回收试验,结果见表3。乙草胺加标回收率在90.5%~112.5%,相对标准偏差RSD为4.5%~4.8%。
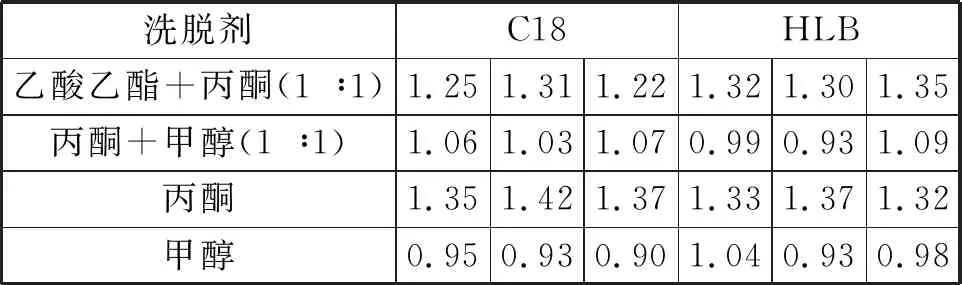
表2 不同柱子萃取与溶剂洗脱的回收率
4 结论
采用固相萃取气相色谱-质谱法测定水样中的乙草胺,获得对称平滑正态分布的色谱峰,精密度较好,相对标准偏差在4.5%~4.8%,加标回收率在90.5%~112.5%,该方法准确、稳定、简单可靠。
