一种盐螺旋菌耐盐耐碱蛋白酶的分离纯化及性质研究
2021-12-08许真真刘建国
闫 函,许真真,李 静,刘建国
(中国石油大学(华东) 化学工程学院,山东 青岛 266580)
碱性蛋白酶(EC 3.4.21.14)是一类能够催化蛋白质水解的生物酶,广泛存在于动物、植物和微生物体中[1-2]。目前,微生物来源的碱性蛋白酶已经成为最重要的工业水解酶类之一,占工业应用总量的65%以上,主要用于洗涤剂生产、皮革加工、银回收、制药、食品加工以及废物处理等[3]。但相对日益增长的市场需求,碱性蛋白酶依然是资源紧缺的蛋白酶种类[4],特别是具有耐盐特性的碱性蛋白酶,仍无法满足高盐度加工行业(如咸味动植物蛋白风味食品加工)的需求[5]。
近年来,为了获得性质优良的耐盐耐碱蛋白酶,人们将研究重点集中于嗜盐古菌[6-7]和海洋微生物[8-9]。但是嗜盐古菌的生长速度普遍较慢,而蛋白酶的产量较低[6]。此外,已有的海洋微生物来源的碱性蛋白酶的耐盐性并不理想,限制了该酶在高盐行业中的应用[8]。因此,寻找耐盐耐碱蛋白酶的新来源依然是碱性蛋白酶工作的重要任务。
我国内蒙古自治区地处中高纬地区,气候干燥,多风少雨,地形和气候条件有利于碱湖的形成,而碱湖的高盐环境为嗜盐嗜碱微生物的生长提供了理想条件。本实验室前期从内蒙古碱湖水样中筛选出一株嗜盐嗜碱菌,经鉴定为盐螺旋菌。本研究对该菌生产的耐盐耐碱蛋白酶的分离纯化及酶学性质的分析,这是盐螺旋菌属来源碱性蛋白酶的首次报道。
1 材料与方法
1.1 菌株与培养基
盐螺旋菌Salinispirillumsp. LH52由作者实验室从内蒙古自治区碱湖水样中筛选获得,已保存于中国典型培养物保藏中心,保藏号:CCTCC NO. M 2020375。
培养基:胰蛋白胨的质量浓度10.0 g/L,酵母提取物的质量浓度5.0 g/L,氯化钠的质量浓度30.0 g/L,利用碳酸钠溶液调pH至10.0。
1.2 粗酶液的制备
将盐螺旋菌Salinispirillumsp. LH52按5%接种量接种至灭菌后的LBH培养基中,于37 ℃、170 rpm的条件下培养48 h。取培养后的发酵液于4 ℃、8 000 rpm离心15 min,收集上清液,即为粗酶液。
1.3 蛋白酶的分离纯化
取500 mL粗酶液,在低温搅拌下加入硫酸铵粉末,使其饱和度为75%。待硫酸铵完全溶解后,将溶液在4 ℃静置12 h,10 000 rpm离心20 min,将沉淀溶于20 mM的Tris-HCl缓冲溶液(pH 7.5)中,透析过夜。将样品上至凝胶过滤层析柱Superdex 200 GL进行分离,流动相为20 mM的Tris-HCl缓冲溶液(pH 7.5),按峰接样,通过活性检测,确认蛋白酶所在的样品,最后利用截留分子量为3 kDa的浓缩离心管,将蛋白酶样品进行浓缩。
1.4 蛋白酶的活性测定
利用福林酚法测定蛋白酶的活性[10]。取质量分数1.0%的酪蛋白溶液2.5 mL (pH 7.5),于40 ℃恒温水浴5 min,加入0.5 mL纯化后的蛋白酶溶液,快速混匀,于40 ℃恒温10 min,然后向体系中加入2.5 mL三氯乙酸溶液(0.4 M)终止反应。将混合溶液于12 000 rpm离心10 min,取1.0 mL上清液先后与2.5 mL碳酸钠溶液(0.4 M)、1.0 mL Folin试剂混合,40 ℃恒温显色30 min,在680 nm处测定样品的吸光度。蛋白酶活力单位(U)定义为:在上述条件下,1 min内水解酪蛋白产生1 μg酪氨酸所需的酶量[11]。
1.5 蛋白酶纯度及总蛋白质含量分析
纯化后的蛋白酶纯度采用聚丙烯酰胺凝胶电泳进行分析。另外,溶液中的总蛋白质含量采用Bradford法进行测定[12]。
1.6 温度对蛋白酶活性的影响
将蛋白酶活性测定方法中的酶(蛋白酶)与底物(酪蛋白)反应温度分别设置为30、40、50、60、70、80和90 ℃, 保持其他测活过程及参数不变,将最高酶活定义为100%,计算各温度下的相对酶活。
1.7 pH对蛋白酶活性的影响
将蛋白酶与底物酪蛋白反应体系的pH分别调整为7.0、8.0、9.0、10.0、11.0、12.0和13.0,保持其他测活过程及参数不变,同样将最高酶活定义为100%,计算不同pH下的相对酶活。调整溶液pH所用的缓冲溶液为:Tris-HCl缓冲溶液(pH 7.0~9.0)和甘氨酸-NaOH缓冲溶液(pH 9.0~13.0)。
1.8 盐度对蛋白酶活性的影响
向蛋白酶与底物酪蛋白反应体系中分别加入终浓度为1.0、2.0、3.0和4.0 M的氯化钠,保持测活过程的其他参数不变,考察NaCl浓度对蛋白酶活性的影响。
1.9 金属离子、EDTA和PMSF对蛋白酶活性的影响
向蛋白酶与底物酪蛋白反应体系中分别加入终浓度为0.5 mM的金属离子(Ca2+、Mn2+、Zn2+、Co2+、Ni2+、Cu2+、Mg2+、Hg2+、Fe3+)、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)和苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF),保持测活过程的其他参数不变,以未添加金属离子的样品活性为100%,计算各样品的相对酶活。
1.10 有机溶剂和表面活性剂对蛋白酶活性的影响
向蛋白酶与底物酪蛋白反应体系中分别加入终浓度为5%(V/V)的有机溶剂(二甲基甲酰胺(dimethylformamide,DMF)、苯、甲醇、乙醇、丙酮和正己烷)和表面活性剂(十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、吐温40、吐温80和曲拉通X-100),保持测活过程的其他参数不变,以未添加有机溶剂的样品活性为100%,考察有机溶剂对蛋白酶活性的影响。
1.11 蛋白酶动力学常数的测定
利用20 mM的Tris-HCl缓冲液(pH 7.5)分别配制质量分数为0.2%、0.4%、0.6%、0.8%和1.0%的酪蛋白溶液,测定5种不同浓度酪蛋白底物的酶活,使用Leonora软件[13]计算动力学常数Km和Vmax。
2 结果与分析
2.1 蛋白酶的分离与纯化
采用硫酸铵沉淀和凝胶过滤层析相结合的方法,对盐螺旋菌Salinispirillumsp. LH52分泌的胞外蛋白酶进行了分离纯化。由表1可知,蛋白酶在粗酶液中的比酶活为321.2 U/mg,经硫酸铵沉淀和凝胶过滤层析分离后,其比酶活分别增加至1 254.7和3 962.2 U/mg,纯化倍数分别为3.9倍和12.3倍,总酶活回收率为55.8%。

表1 蛋白酶的纯化结果Tab. 1 Purification of the protease

M—标准蛋白;I—粗酶液;II—纯化后的蛋白酶图1 蛋白酶聚丙烯酰胺凝胶电泳分析结果Fig. 1 SDS-PAGE analysis of the protease
图1是蛋白酶样品的聚丙烯酰胺凝胶电泳分析结果。可以看出,蛋白酶的分子量约为38 kDa。此外,经凝胶成像软件分析得知,纯化后的蛋白酶纯度约为98.6%。
2.2 温度对蛋白酶活性的影响
图2是温度对蛋白酶活性的影响结果。由图可知,20~50 ℃范围内,蛋白酶的活性随温度的升高而增加,当温度超过50 ℃以后,蛋白酶的活性逐渐降低。因此,盐螺旋菌Salinispirillumsp. LH52来源蛋白酶的最适温度为50 ℃,该数值与OceanobacillusiheyensisO.M.A18[14]和HaloalkaliphilicbacteriumSj-1[15]来源蛋白酶的最适温度相同。另外,由图2还可以看出,该蛋白酶在90 ℃时,依然能够保持73%的最高酶活,表明该酶可以在高温下使用。
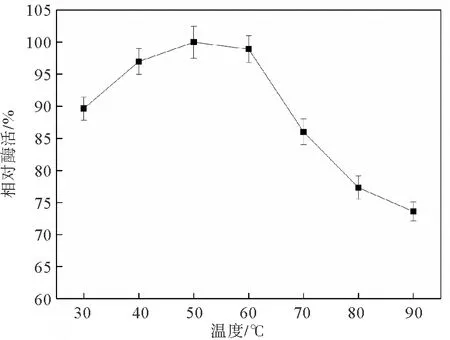
图2 温度对蛋白酶活性的影响Fig. 2 Effect of temperature on protease activity
2.3 pH对蛋白酶活性的影响
图3是蛋白酶在不同pH下的活性测定结果。可以看出,在pH 7.0~13.0范围内,蛋白酶的活性呈先增加后下降的趋势,并在pH 9.0处获得最大酶活。需要说明的是,pH 9.0处的两个数据点是因为使用了两种不同的缓冲溶液造成的。因此,盐螺旋菌Salinispirillumsp. LH52来源蛋白酶的最适pH为9.0。根据碱性蛋白酶的定义可知[16],该蛋白酶为碱性蛋白酶。
另外,由图3还可得知,盐螺旋菌Salinispirillumsp. LH52来源的蛋白酶在pH 7.0~13.0范围内,均能保持80%以上的最大酶活,这种现象在之前报道的所有蛋白酶中从未发现,但这一特殊性质能够使该酶在更复杂的环境中使用。
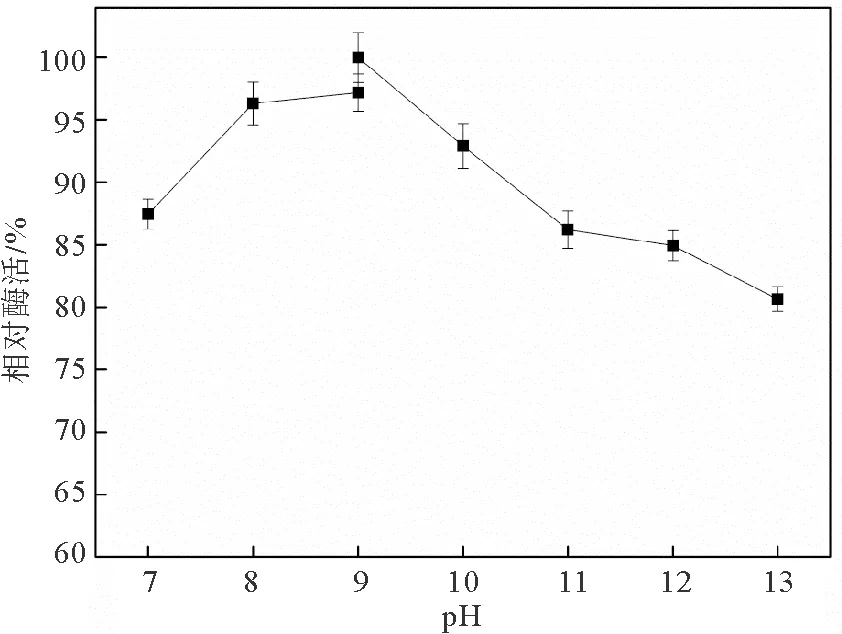
图3 pH对蛋白酶活性的影响Fig. 3 Effect of pH on protease activity
2.4 盐度对蛋白酶活性的影响
盐度对蛋白酶活性的影响结果如图4所示。可以看出,虽然盐螺旋菌Salinispirillumsp. LH52来源的蛋白酶在未加入氯化钠时的活性最高,但加入氯化钠对该酶的活性影响很小。当氯化钠浓度从1.0 M增加至4.0 M时,该蛋白酶的活性基本没有变化,且都保持90%的最大酶活。表明盐螺旋菌Salinispirillumsp. LH52来源的蛋白酶对盐度具有优良的耐受性,这也是迄今报道的活性受盐度影响最小的碱性蛋白酶。

图4 NaCl浓度对蛋白酶活性的影响Fig. 4 Effect of NaCl concentrations on protease activity
2.5 金属离子、EDTA和PMSF对蛋白酶活性的影响
表2是金属离子对盐螺旋菌Salinispirillumsp. LH52来源蛋白酶活性的影响结果。由表可知,Ca2+、Mg2+、Cu2+对蛋白酶的活性有促进作用,Mn2+、Zn2+和Hg2+对蛋白酶的活性基本无影响,Ni2+对蛋白酶的活性有中度抑制作用,而Co2+、Fe3+对蛋白酶活性有严重抑制作用。毛丙永等[17]同样报道了Fe3+对米曲霉来源耐盐蛋白酶的活性起抑制作用,但也发现Ca2+和Cu2+对蛋白酶的活性有抑制作用,这与本研究的结果不符。此外,Gupta等[18]发现Mg2+对Bacillussp.来源碱性蛋白酶的活性基本无影响。这些情况表明,相同的金属离子对不同来源蛋白酶的活性影响不同,这可能与蛋白酶的结构有关,且这种现象在其他酶类中已有报道[19]。
此外,由表2还可以看出,金属螯合剂EDTA对盐螺旋菌Salinispirillumsp. LH52来源蛋白酶的活性有促进作用,说明该酶的催化活性不需要金属离子的配合。丝氨酸蛋白酶抑制剂MPSF对该蛋白酶的活性有中度抑制作用,表明盐螺旋菌Salinispirillumsp. LH52来源的蛋白酶是一种丝氨酸蛋白酶。

表2 金属离子、EDTA和PMSF对蛋白酶活性的影响Tab. 2 Effects of metal ions, EDTA and PMSF on protease activity
2.6 有机溶剂和表面活性剂对蛋白酶活性的影响
有机溶剂对蛋白酶活性的影响结果如图5所示。由图可知,所考察有机溶剂(二甲基甲酰胺、苯、甲醇、乙醇、丙酮和正己烷)对盐螺旋菌Salinispirillumsp. LH52来源蛋白酶的活性基本无影响或起轻微的促进作用。这表明该蛋白酶具有一定的耐有机溶剂特性,这一性质也使得该酶能够在低水活度下应用。
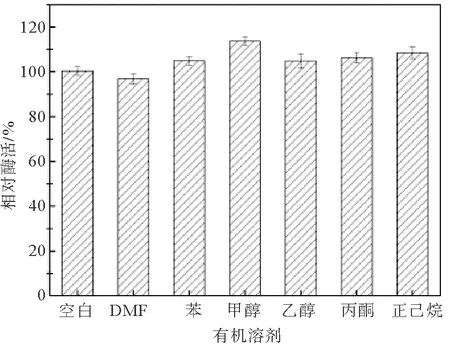
图5 有机溶剂对蛋白酶活性的影响Fig. 5 Effect of organic solvents on protease activity
洗涤剂是蛋白酶工业应用的重要领域。为此,考察了表面活性剂SDS、吐温40、吐温80和曲拉通X-100对盐螺旋菌Salinispirillumsp. LH52来源蛋白酶活性的影响。结果表明,吐温40和吐温80对蛋白酶的活性有促进作用,而SDS和曲拉通X-100对蛋白酶的活性基本无影响。
2.7 蛋白酶的动力学参数
酶的动力学参数对于酶反应器设计和开发酶在不同条件下的应用至关重要,因其对于酶、底物和反应条件均具有特异性。经测定、分析得知,盐螺旋菌Salinispirillumsp. LH52来源蛋白酶的动力学常数Km和Vmax分别为1.6 mg/mL和673 U/mL。其Km值小于Bacillussp.来源蛋白酶的Km值(2.5 mg/mL)[18],这说明盐螺旋菌Salinispirillumsp. LH52来源的蛋白酶对酪氨酸的亲和力更强。
3 结语
对盐螺旋菌Salinispirillumsp. LH52来源的蛋白酶的分离纯化及性质进行了研究。结果表明,经硫酸铵沉淀和凝胶过滤层析纯化后,得到的蛋白酶的比酶活为3 962.2 U/mg,纯度为98.6%。该蛋白酶的最适温度和pH分别为50 ℃和pH 9.0,且该酶在30~90 ℃、pH 7.0~13.0及氯化钠浓度1.0~4.0 M范围内,均能保持较高的活性。Ca2+、Mg2+、Cu2+、Mn2+、Zn2+和Hg2+对蛋白酶的活性有促进作用或无影响。另外,所考察的有机溶剂二甲基甲酰胺、苯、甲醇、乙醇、丙酮和正己烷对蛋白酶的活性有轻微的促进作用或无影响。这些优良的性质,将进一步拓宽盐螺旋菌Salinispirillumsp. LH52来源蛋白酶的应用领域。
