重组蛋白药物的生产技术进展
2021-12-01安泰
周 娜 娜,王 小 艳,张 媛,王 靖,赵 国 淼,魏 超,杨 凯,安泰*
1.中粮营养健康研究院有限公司,北京102209;
2.营养健康与食品安全北京市重点实验室,北京102209;
3.老年营养食品研究北京市工程实验室,北京102209
重组蛋白药物是生物医药中的重要组成部分,在各种重大疾病治疗中应用广泛,是基因工程技术应用于制药工业的典范[1]。重组蛋白类药物是利用基因工程技术表达的产物,用于弥补人体内某些功能蛋白的缺失,主要分为八个大类,具体包括多肽类激素、人造血因子、人细胞因子、人血浆蛋白因子、人骨形成蛋白、重组酶、融合蛋白和外源重组蛋白等[2]。经过三十多年的发展,目前国内重组蛋白药物已经占据生物药物市场的1/3。2019年全球的药物市场约12 000亿美元[3],仅重组蛋白药物的销售额就达835亿美元,年复合增长率为4.6%,欧美国家占据全球主导地位,占全球市场份额的81%[4]。中国重组蛋白药物的市场规模为436.66亿元,年复合增长率8.9%,发展前景广阔[4]。
由于重组蛋白药物的创新成本高,基因工程药物中仿制药生产较多。但随着重组蛋白药物生产技术的发展和成熟,国内重组蛋白药物也在不断创新研发。2020年新型冠状病毒肺炎疫情全球大流行,危及世界人口健康和经济发展,疫苗的开发与接种是控制疫情的有效手段。多种候选疫苗——肽、病毒类粒子、病毒载体(复制和非复制)、核酸(DNA或RNA)、减毒活病毒、重组设计蛋白和灭活病毒等被大量研究[5]。我国在新型冠状肺炎病毒疫苗的研发,尤其是重组蛋白疫苗的研发中,技术不断提升,目前已经跻身世界前列。
重组蛋白药物的整体产业链分为上、中、下游,上游是基于基因工程技术、细胞工程技术的研发环节;中游为药物及给药系统生产制造,包括大规模细胞培养、重组蛋白纯化与质控;下游是销售流通环节[6]。本文主要针对重组蛋白药物产业链上游和中游的表达系统、细胞培养及纯化质控等环节的最新技术进展进行综述,以期为重组蛋白药物生产企业的技术提升提供一定的参考。
1 重组蛋白药物生产的表达系统
目前在工业应用中,涉及到多种重组表达系统,其中在生产重组蛋白药物中,主要应用到大肠杆菌、酵母和哺乳动物CHO细胞系3种表达系统。借助于这几种系统表达的重组药物蛋白已经成功地在世界范围内商业化投放。几种表达系统的优缺点列于表1中。
1.1 大肠杆菌系统
在3种表达系统中,大肠杆菌系统最为简单。此系统涵盖多种类型的菌株,这些菌株的主要差异在于筛选标记、诱导方式、有无信号序列、营养缺陷型及特殊蛋白质折叠机制[7]。对于大肠杆菌的基因工程改造更好地完善了大肠杆菌表达系统,如编码二硫键异构酶的基因已稳定整合到大肠杆菌的基因组中,确保蛋白正确折叠,提高胞内蛋白的折叠和溶解性[8]。改进的菌株Shuffle被开发用于生产全长效应结合免疫球蛋白(1~25 mg·L−1),并且无体外再折叠加工[9]。此外,重组蛋白在大肠杆菌周质空间中的有效分泌可提高大肠杆菌表达的蛋白可溶性[10]。大肠杆菌表达系统主要用于多肽类药物的生产,如重组人胰岛素和重组甲状旁腺激素等[11]。
1.2 酵母系统
酿酒酵母(Saccharomyces cerevisiae)是被广泛研究的酵母表达系统之一,用于生物制药合成的宿主[12]。糖基化是重要的翻译后修饰之一,尽管酵母可以进行N-糖基化和O-糖基化,但与人源细胞的糖基化模式有显著差异,其分泌的重组蛋白会形成α-1,3-甘露糖化,导致蛋白免疫原性增加、半衰期缩短。通过在酵母中准确引入人源糖基转移酶和糖苷酶,删除超甘露糖化基因[13],可以使酵母糖基化途径与人糖基化途径相似[14−15],从而保证治疗蛋白的药代动力学特性[16]。此外,对于酿酒酵母进行工程化改造,使其表达融合转运体和人源O-FucT-1基因,可以生成末端带有O-岩藻糖的人表皮生长因子[12]。
甲醇营养型酵母——毕赤酵母(Pichia pastoris)生长快,发酵细胞浓度高,可产生大量重组人源蛋白[17−18]。毕赤酵母系统能够灵活地选择合适的载体和兼容宿主,高效、经济地表达重组蛋白,保证产品成功开发。毕赤酵母表达载体中的AOX1基因可以驱动所需蛋白的高表达量表达[19],用甲醇诱导AOX1可使蛋白表达至极高水平,约占细胞总可溶性蛋白的30%。除可诱导启动子外,毕赤酵母载体还含有pGAP组成型启动子,在葡萄糖培养下表达水平与AOX启动子几乎相同。此外,Thermo Scientific还引入了一种新的平台Pichiap-Ink表达系统,通过营养缺陷互补抗性来代替抗生素,可以获得高达12 g·L−1的蛋白表达量[20]。
除了酿酒酵母和毕赤酵母外,一些非传统的酵母种类,如汉森菌多形酵母、脂酵母、裂殖酵母和乳酸克鲁维酵母菌也已发展为合成各种不同特性蛋白药物的宿主[21]。表2中列出了酵母系统所表达的重组蛋白药物。
1.3 CHO细胞系(哺乳动物)
CHO细胞系是一种来源于中国仓鼠卵巢的上皮细胞系,其可以产生人同源性蛋白。人体组织纤溶酶原激活剂是1986年第一个在CHO细胞系中成功生产并批准临床使用的重组治疗蛋白[22]。随后,越来越多的治疗性蛋白质在哺乳动物细胞中被制造出来,并且随着工艺的优化,在该表达系统中生产重组蛋白的技术得到了迅速发展。
虽然CHO细胞系产生的重组蛋白糖基化谱与人相似,但二者并不完全相同。CHO细胞的差异糖基化是导致重组蛋白异质性的重要因素,包括核心聚焦、半乳糖基化和唾液酸化[22]。通过CRISPR-Cas9技术,尤其是一种新型Cpf1酶,可以更加精准的实现对于细胞系通路的改造,更好地实现糖基化途径的人源化[23−24]。智飞生物公司生产的重组新冠疫苗就是将关键抗原成分利用改造后的CHO细胞系生产的,最后制成了重组蛋白亚单位疫苗[25]。
1.4 表达系统及宿主的筛选
在广泛筛选表达系统时,蛋白的高表达量、翻译后修饰质量和遗传稳定性是主要的标准[26]。不同的表达系统具有各自的优缺点,需要根据产品的特性选择合适的系统和宿主(表1)。已用于生产重组蛋白药物的酵母系统及生产情况见表2。优势宿主的筛选是生产异源蛋白的关键步骤。在选择优势宿主时,通常采用高通量筛选技术,这种技术的出现彻底改变了宿主筛选技术领域,通过使用96深孔板或类似技术对多个批次实验进行平行筛选[21],提高了宿主的筛选效率。最终选择的宿主要在产品质量、滴度、特定生产率、工艺可行性、预期的电荷变体和糖基化配置、无或较少的聚集形成和克隆稳定性上满足标准[43]。

表1 重组药物蛋白的多种表达系统Table 1 The different expression systems for recombinant therapeutic proteins

表2 酵母系统所表达的重组蛋白药物情况Table 2 The recombinant therapeutic proteins expressed by yeast systems
2 细胞培养
在选择好最佳宿主后,下一个重要环节是细胞培养的开发。为了更好的控制和优化细胞培养过程,开发了各种新的技术和工具。
通常,在宿主发酵生产蛋白药物时,通过优化培养基、温度、pH、接种量和生产动力学[44]等参数来提高蛋白质的合成。生物量增长率是促进产品合成的关键因素[21],对于补料分批生产技术至关重要,某些医药公司将宿主细胞增长率保持在小于最大增长率的特定值,通过补料来控制宿主细胞以特定增长率生长[12]。不过,近年来制药行业越来越关注通过将分批生产转变到连续生产来提高生物合成效率。Rahimi等[45]研究发现,与补料分批工艺相比,利用巴斯德毕赤酵母连续发酵乙型肝炎表面抗原(HBsAg)具有更高的效率,HBsAg抗原滴度可达4.26 mg·L−1·h−1。
在发酵工具上,使用自动化控制的一次性生物反应器系统是当今生物制药公司的一个新趋势。与传统的不锈钢系统相比,一次性系统投资成本和操作成本更低,生产周期更短,灵活性更好,大大减少了污染的几率。这些一次性生物反应器及其附件可从50 L扩大到2 000 L的规模[46]。从细胞工程到细胞培养方法的创新开发,使得单克隆抗体的产量从50 mg·L−1提高到5~20 g·L−1[47]。但是,一次性系统在产品安全方面也有一些限制,这种系统的塑料材料也会与介质组分结合,导致加工性能下降[48]。
3 重组蛋白药物分离纯化进展
通过优化好的细胞上游培养工艺,特定的表达系统会产生大量的重组药物蛋白,其中还包含一些宿主本身的蛋白、核酸等杂质,这些杂质可能对人体产生不利的生物活性。因此,对药品的纯度要求非常严格[11],这就需要对产品蛋白进行精度纯化。此环节是重组药物蛋白制备技术的关键,是决定蛋白药物品质的核心。单克隆抗体或任何其他蛋白(包括重组酶)一般是通过各种过滤步骤和色谱层析等技术进行纯化的[47]。色谱法是纯化有价值产品最合适的技术,许多成熟的色谱方法已经应用到实际的生物制药生产中[49]。
3.1 收获澄清
细胞培养完成后,离心、大孔径切向流过滤和深度过滤是用于初级细胞澄清的常用技术[50],深度过滤和生物减重过滤器有助于二次澄清过程[51]。近年来,KSep公司开发了一种可从低转速到高转速的连续离心装置,这是一个全自动系统,可回收97%以上的产品/细胞生物量,该系统可用于重组蛋白和疫苗的收获澄清。有时,在离心步骤后会增加一步深度过滤,更进一步澄清细胞[52]。
不同的表达系统可能会有不同的分泌部位(图1),导致收集方式不同。如在大肠杆菌中表达的重组蛋白通常以包涵体的形式积累,需要回收后在体外重新折叠这些蛋白质,使其具有生物活性[54]。
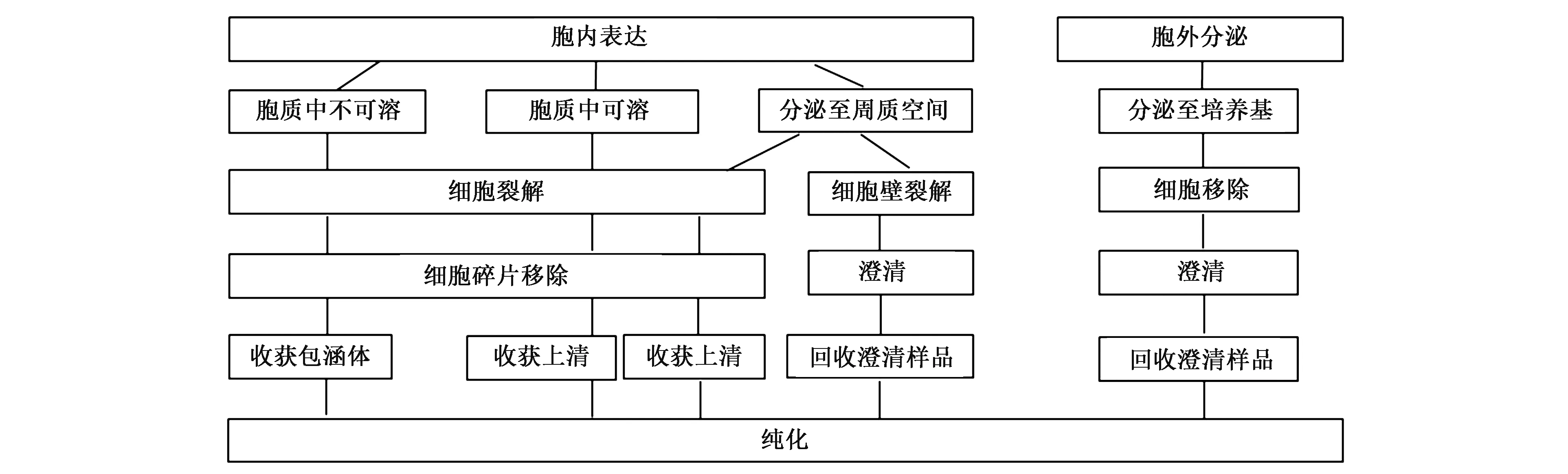
图1 不同表达体系的样品收集过程[53]Fig.1 The sample collection process for different expression systems[53]
3.2 色谱分离
由于蛋白药物混合物中含有大量不同化学性质的杂质,单一的色谱技术往往不足以获得良好的分离。传统的重组蛋白药物纯化工艺,是在收获澄清后进行超滤浓缩,随后进行逐级的单柱色谱分离纯化(表3)[47],在充分了解目标蛋白和杂质的理化性质后,尽量减少纯化步骤,一般分离纯化不超过4步[54]。
随着技术的发展,一种创新的固定相被开发出来,其结合了两种分离机制(反相或HILIC和离子交换)[55],形成一种混合模式的纯化方式(表3)。Khalaf等[56]使用C8链和季胺功能化的Zeochem色谱柱进行多肽的分离,流动相采用醋酸盐和CAN的混合液,结果证明多肽的选择性和生产率提高了2倍,产量提高了约20%。
考虑到蛋白药物混合物通常需要结合基于多种不同分离原理的色谱技术来提高分辨率[57],从而产生多维色谱分离技术(表3)。在线多维色谱中,从第一根色谱柱流出的产物会立即注入第二根色谱柱,并加快分析时间[58]。通常,在分离过程中,质谱与多维色谱联用可提高纯度[59]。
近年来,为了处理复杂生物分子混合物的纯化,又开发了一种称为多柱逆流溶剂梯度纯化(MCSGP)技术[60](表3)。MCSGP技术的原理是流动相相对于固定相逆流运动,通过一系列切换阀进行模拟,使整个过程实现循环和自动化。使用MCSGP技术可以使目标蛋白和杂质之间的重叠峰在内部循环,以便再加工,并且可以使用溶剂梯度进行洗脱。这种技术已被用于多个需要加强纯化的案例中,如单克隆抗体[65]、寡核苷酸[66]、大麻二酚[67]和多肽[68]的纯化。

表3 重组蛋白药物的不同纯化方式Table 3 The purification methods of recombinant therapeutic proteins
4 重组蛋白药物质量控制
与化学药物相比,重组药物蛋白结构复杂,稳定性相对较差,生产工艺需要严格控制,对其进行质量控制也更具挑战性。重组蛋白药物的生产和测试受到世界各国监管机构的严格监管,批次间的一致性至关重要。原料药经过纯化后会根据当前的监管指南进行严格的质量控制测试,以确保药品的安全性、纯度、特性、效力和强度[36],以便提供给诊所和患者。
我国在《中华人民共和国药典》中,已将39种重组蛋白药物纳入,这些质量标准和鉴定方法在保证我国重组药物的安全、有效和质量可控方面发挥了重要作用[69]。
高分辨率质谱(MS)仪器和半自动化软件的最新进展推动了基于质谱的cGMP级重组蛋白药物的质量控制[70]。与目前用于重组蛋白药物的质量检测的传统方法相比,这种新方法是基于肽谱液相色谱-MS(LC-MS)的方法,使用串联质谱(MS/MS)和数据库搜索对消化的蛋白质产品进行深入的初步表征,以评估目标产品的质量属性。这种方法可以很好地替代用于聚糖分析的亲水相互作用液相色谱、用于电荷变异分析的色谱和用于剪切变异分析的诱导毛细管电泳,从而提高产品质量控制的效率。
5 展望
虽然在全球生物药物领域中重组蛋白药物占比不到50%,但在临床治疗上却发挥关键的作用。目前,大量用于治疗多种人类疾病的重组蛋白药物,已获批准并上市。
经过几十年的技术发展,我国重组蛋白药物也取得了很大的进步,尤其是近两年新冠疫苗的研发上。随着分子和细胞技术的不断发展,重组蛋白药物的产量和质量也有了很大的提高,加工周期大幅缩短。随着基因编辑技术的发展,特别是CRISPR/Cas9等新型技术的应用,载体工程取得新的突破,未来越来越多特定改造的细胞系将被用于重组蛋白药物的生产。重组蛋白药物的重要性也推动着蛋白纯化工艺的提升,从先前的单柱色谱纯化,到混合模式色谱纯化,再到在线多维色谱纯化系统和MCSGP技术,大大提高了重组蛋白药物的纯度和回收率,缩短了纯化时间。一系列技术的进步推动了重组蛋白药物产品的开发进程。
虽然目前在重组蛋白药物生产技术上有了很大的提升,但其半衰期短的问题仍然存在,还需进行更深入的研究,进一步提高国内重组蛋白药物的长效性,推动相关标准的升级和创新,促进长效性蛋白药物的开发,使我国生物医药行业达到国际领先水平。
