大辽河口及其毗邻区域水体反硝化功能基因的定量研究
2021-11-25李雯雯刘瑞志徐慧韬王丽平
李雯雯, 刘瑞志, 徐慧韬, 王丽平
中国环境科学研究院, 国家环境保护河口与海岸带环境重点实验室, 北京 100012
反硝化作用是指反硝化细菌在微氧或无氧条件下,经过一系列酶(包括硝酸盐还原酶、亚硝酸盐还原酶、NO还原酶和N2O还原酶)催化反应将NO3-(或NO2-)还原为气态氮(NO、N2O或N2)的过程[1]. 反硝化作用一方面减少了环境中过多的氮,进而减少大型和浮游植物对氮的利用,避免了因富营养化引起的环境问题[2];另一方面,其过程还可产生温室效应大于CO2的N2O气体[3]. 随着我国经济的发展,各种工业和农业废水、生活垃圾、农药化肥等排入水体,造成我国水体出现严重的富营养化[4];此时,具有反硝化作用的反硝化细菌,在水体修复与净化及氮素循环中扮演着重要的角色[5]. 因此,对于水体中微生物结构特别是与氮功能相关的功能菌的研究,已成当前环境科学研究的热点问题之一,且开展水体中微生物反硝化作用的研究能够为减少氮的污染、进行水体治理和保护提供技术支持.
随着辽河口两岸经济的发展,辽河水质污染越来越严重,大辽河作为辽河的下游也受到了污染,开展辽河口水质状况的研究显得尤为重要[6]. 目前流入辽河河口的氮素主要有亚硝态氮、硝态氮和氨氮等各种形式的氮,这些氮素均可通过硝化与反硝化作用去除[5]. 有研究[7]表明全球输入到河口的氮中,约有一半的氮可通过反硝化作用去除. 目前对于辽河口反硝化作用的研究多集中在反硝化细菌数目、反硝化速率及其影响因素、硝氮和亚硝氮的含量等方面,如陈立广等[8]在2007年开展了辽河口沉积物中硝化细菌数量的时空变化分析,发现使用MPN-PCR法测量硝化细菌数量比MPN-Griess法灵敏10~100倍;雷坤等[9]在2003年开展了大辽河N、P营养盐的研究,发现辽河口附近海域水体和远海水体分别呈富营养化和贫营养化状态;樊景凤等[10]在2007年利用MPN-Griess 和PCR-RFLP技术分别研究辽河口沉积物中反硝化细菌的数目和多样性,发现春季最高,从辽河口下游到远海区数目递减. 以上研究距今时间较长,且多半研究介质为沉积物,仍然缺乏对辽河水体反硝化细菌与水环境因子之间的研究.
反硝化细菌是进行反硝化作用的功能菌群,反硝化作用中亚硝酸盐转化为NO的反应为反硝化过程中最关键的一步,此过程由具有不同结构形态但功能相似的nirK和nirS基因编码的亚硝酸还原酶完成[11-12]. 很多研究均将nirK和nirS基因作为环境样品中反硝化微生物的分子标识物[13-14]. 反硝化作用的最后一步是nosZ基因编码的氧化亚氮还原酶将有害气体N2O转化为无害N2,这一步在反硝化路径中起着重要作用[15]. 前人大多通过nosZ基因的多样性来探讨反硝化细菌的群落结构与多样性[16-17]. 因此,nosZ、nirS和nirK基因通常被多数人选择作为研究反硝化作用的目标基因. 实时荧光定量PCR技术是目前定量分析反硝化功能基因较为成熟的方法[18],具有特异性强、灵敏度高、定量准等优点[19]. 该文采用定量PCR对反硝化细菌3种主要功能基因nirK、nirS和nosZ的空间分布特征进行研究,获取大辽河入海河段、大辽河口及其近岸海域中反硝化细菌的基因丰度,并用因子分析和冗余分析(RDA)探讨了微生物基因数量与水环境因子的关系,以期为降低辽东湾陆源氮污染提供基础数据.
1 材料与方法
1.1 水样采集
大辽河口位于我国东北地区南部辽宁省境内,由浑河与太子河汇合后自营口市入海,全长95 km. 2017年《中国海洋生态环境状况公报》中报道了大辽河携带氮素入海监测结果,入海的氨氮(NH3-N)、硝酸盐氮(NO3--N)、亚硝酸盐氮(NO2--N)分别达到 4 434、44 765、5 295 t,水体受到严重污染. 2017年《辽宁省近岸海域水环境质量》中指出,大辽河河口是主要的GB 3097—1997《海水水质标准》劣四类海水集中地,综合水质不理想.
根据大辽河口的环境特征,调查站位在大辽河入海河段和河口河段分别采取线状站位与辐射条状站位设置,共设站位18个,确保了所采集样品区域的代表性. 所设站位中河口河段9个(L01~L09站位)、近海河段9个(EL1~EL3、EM1~EM3、ER1~ER3站位),如图1所示. 水体样品于2017年5月进行采集,所采集水体为表层水. 水体温度(T)、pH、盐度、DO浓度等常规理化参数使用YSI便携式多参数水质监测仪(6600V2型,美国)现场测定. 采集水样置于含冰盒的保温箱中并尽快运回实验室进行样品分析:河口河流段与河口近海段水体硅酸盐(SiO32-)、NO2-、NO3-、TN等营养盐指标浓度分别按照GB 3838—2002《地表水环境质量标准》和GB 17378—2007《海洋监测规范》有关要求进行测定;部分水样经0.45 μm的滤膜过滤后,用硝酸调节pH小于2,4 ℃保存后使用电感耦合等离子体质谱仪(ICP-MS,7500cx型,美国Agilent公司)测定重金属含量;其余水样经0.22 μm的滤膜过滤后,将滤膜置于-20 ℃冻存,用于DNA提取.

图1 大辽河口及其毗邻区域采样站位布设
1.2 DNA提取
取出-20 ℃保存的滤膜,使用PowerWater®DNA Isolation Kit试剂盒,根据试剂盒说明书提取水样微生物DNA. 最后,将提取的DNA置于-80 ℃冰箱中保存待用.
1.3 定量PCR
经过Q-PCR测试,采用表1中的引物和扩增条件对反硝化细菌nirS基因、norZ基因和nirK基因进行PCR扩增. PCR扩增体系包括0.25 μL TaKaRa和Taq(5 U/μL)、5 μL的10×Ex和buffer(Mg2+Plus)、4 μL的dNTP和Mixture(各2.5 mmol/L)、1 μL的模板DNA、1 μL 引物1(20 μmol/L)、1 μL引物2(20 μmol/L),最后用灭菌蒸馏水补至50 μL. PCR产物采用1.5%的琼脂糖凝胶电泳检测;琼脂凝胶PCR产物的回收采用TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0,且严格根据说明书进行操作.

表1 该研究所使用的定量PCR(qPCR)引物
进行TA克隆以及采用TaKaRa Mini BEST Plasmid Purification Kit Ver.4.0提取质粒DNA. 鉴于pMD18-T Vector的特性采用M13-47和RV-M这对引物进行PCR鉴定. 采用染料为SYBR GREEEN,试剂盒为KAPA SYBR® FAST qPCR Kit Master Mix(2×) universal(北京阅微基因技术股份有限公司)进行Real-time PCR. Q-PCR反应条件见表2,并按表2中的程序进行扩增.

表2 Real-time PCR的反应条件
1.4 数据处理
试验数据采用Excel 2019软件进行整理,每个站位3个平行,取平均值和标准差. 运用ArcGIS 10.2和Origin 9.1软件分别进行站位绘图和各基因丰度的作图. 使用SPSS 26.0软件对基因和环境因子数据进行因子分析,分析调查水体的主要环境问题,同时对基因丰度进行正态分布检验和Pearson相关性分析. 采用Canoco 5生态学软件对微生物基因数据作趋势对应分析(DCA),根据分析结果中样品矩阵第一轴的梯度长度来确定分析环境因素对反硝化细菌基因数量影响的方法,梯度长度大于4,选择典型相关分析(CCA);梯度长度在3~4之间,选冗余分析(RDA)和CCA均可;梯度长度小于3,选择RDA[23]. 最后,使用蒙特卡罗测试检验环境因素对基因数量的影响程度[24].
2 结果与讨论
2.1 反硝化细菌功能基因定量分析
2.1.1水体中nirK和nirS基因的丰度
作为反硝化微生物中最为重要的2种功能基因,nirK和nirS基因均负责将NO2-转化为NO. 图2为大辽河口及其毗邻区域5月水体中反硝化细菌nirK和nirS的基因丰度. 由图2可知,nirS的基因丰度范围为3.19×105~3.19×107copies/L(平均值为7.76×106copies/L),L5站位nirS基因丰度最低,EL1站位的nirS基因浓度最高. L1、L2、EL1、EM1、ER1这5个站位的nirS基因丰度均高于平均值,其余站位均低于平均值. 前人在研究其他水体nirS基因丰度时也得到了相似的结果,如Zheng等[25]研究长江口nirS基因空间分布,发现其丰度范围为1.77×105~1.42×108copies/L;陈玲[26]在研究淡水湖泊滇池与洱海水体nirS基因时,得出其丰度为1.13×105~3.66×107copies/L.

图2 大辽河口及其毗邻区域5月水体中反硝化细菌nirK和nirS的基因丰度
nirK的基因丰度范围为7.73×105~2.54×108copies/L(平均值为2.5×107copies/L). L9站位的nirK基因丰度最低,L5站位的nirK基因丰度最高且明显高于其他几个站位. L2、L5、EL1、EM1和ER1这5个站位的nirK基因丰度均高于平均值,其余站位均低于平均值. Desnues等[27]研究发现,含有nirK的反硝化细菌分布在pH、O2和含硫量等环境因子波动较大的生境;Knapp等[28]研究发现,含有nirK基因的反硝化细菌在DO浓度随昼夜变化较大的环境中和夜间硝酸盐吸收率较高的生境中,丰度也较高. 这可能是L5站位nirK基因丰度较高的原因.
由图2也可以看出,除L5站位nirK基因丰度较高、nirS基因丰度较低外,其他站位nirK和nirS基因丰度的站位变化趋势基本相同且位点间差异不大.nirK和nirS基因均高于平均值的站位大多位于上游河流和河流的入海口位置. 这可能与上游河流人类活动密集,农药化肥、养殖废水、居民生活污水等排入河流造成水体富营养化,为nirK和nirS反硝化细菌的生存提供了良好的环境有关;而河流下游靠近营口化工厂和造纸厂,水体受到严重污染,化学物质可能导致nirK和nirS反硝化细菌受到抑制[29],因nirK型反硝化细菌耐污染能力比nirS型好,因此nirK型细菌丰度高于nirS型[30];河口区域靠近污水处理厂,营养物质丰富造成nirK和nirS反硝化细菌增多,而由河口到近海由于受到海水的稀释,营养物质变少、海水盐度变大,导致nirK和nirS反硝化细菌减少[29]. 总体来看,nirK和nirS两种基因在不同站位上有着相同的数量级,变化规律同步,这与Yin等[31]研究结果一致.nirK基因丰度波动大于nirS基因,这主要与nirK基因对环境的敏感程度要远大于nirS基因有关[32].
2.1.2水体中nosZ基因的丰度
nosZ基因是反硝化过程中将NO还原为N2O的功能基因[33]. 图3为大辽河口及其毗邻区域5月水体中nosZ的基因丰度. 由图3可知,nosZ的基因丰度范围为3.22×103~4.92×105copies/L(平均值为1.13×105copies/L). L7站位的nosZ基因丰度最高,ER2站位最低. L2、L5、L6、L7、EL1、EL2和EM1站位的nosZ基因丰度均高于平均值,且不同站位间nosZ的基因丰度差别较大. 已有研究发现不同压力深度、咸淡水及不同季节均会影响nosZ的基因丰度,如Barrett等[34]研究了爱尔兰的农用地下水,得出4处不同压力深度下nosZ的基因丰度在1.03×102~9.4×102copis/L之间,比该研究结果高出1~3个数量级;陈玲[26]在研究淡水湖泊滇池与洱海水体nosZ基因时,得出其丰度为8.76×105~1.22×107copies/L,比该研究结果高出2个数量级;张健伟等[35]运用real-time PCR方法研究了丰水期和枯水期温榆河中不同站位nosZ的基因丰度,分别为nd~2.37×108和2.0×106~3.04×109copies/L,比该研究结果高2~4个数量级. 总体来看,nosZ的基因丰度在河流河段由上游到河口站位逐渐增高,与nirK和nirS的基因丰度呈先升后降的变化趋势有所不同,可能是因为不同基因对环境的响应程度和耐受性不同,河流段末端虽然污染严重,但总体污染程度未超过nosZ型反硝化细菌的耐受性;由河口到近海呈现降低的趋势,可能同nirK和nirS基因一样与河口到近海海水稀释、盐度变大有关.

图3 大辽河口及其毗邻区域5月水体中nosZ的基因丰度
2.1.3水体中nirK、nirS和nosZ基因的丰度对比
图4为水体中反硝化细菌功能基因(nirK、nirS和nosZ基因)在不同站位的基因丰度和相对丰度. 由图4可见,nirK、nirS和nosZ基因在不同站位基因丰度不同,说明这3种基因在大辽河口调查水体中普遍存在.nosZ基因丰度在不同站位较低,nirK基因和nirS基因在不同站位基因丰度大小相似且变化趋势相同. 3种基因在所有采样站位的平均丰度大小表现为nirK(2.5×107copies/L)>nirS(7.76×106copies/L)>nosZ(1.13×105copies/L). 总体来看,辽河口水样中,反硝化细菌中占比最高的是nirK型细菌,nosZ型细菌的平均丰度最低,nirS基因的占比与nirK基因相近. 郭丽芸[36]在研究江苏省湖泊反硝化细菌群落结构时也得到了同样的结论;毛铁墙等[30]在研究湛江湾沉积物中反硝化和厌氧氨氧化细菌丰度时,发现nosZ型细菌丰度占比最低,nirS基因的占比最高,与该研究结果相似.
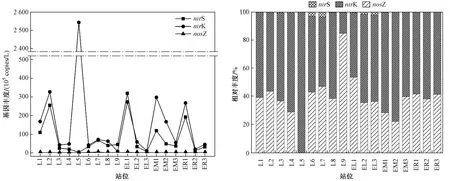
图4 大辽河口及其毗邻区域5月水体中反硝化细菌功能基因(nirK、nirS和nosZ)的基因丰度和相对丰度
2.2 大辽河口及其毗邻区域水体中不同调查站位(nirK +nirS)/nosZ的变化
Szukics等[37]研究发现,(nirK+nirS)/nosZ的大小与N2O气体的产生量有一定的关系,其值越大表明N2O气体排放得越多. 由图5可见,大辽河口及其毗邻区域调查站位(nirK+nirS)/nosZ在28.3~1 760 之间(平均值为454.77),其中河流段变化范围为28.3~486(平均值为205),而河口到近海段变化范围为45.4~1 500(平均值为499). 总体看来,(nirK+nirS)/nosZ较大,存在较多N2O气体排放[38],并且河口到近海段N2O气体排放大于河流段. 在河流段除L5站位因nirK基因丰度较大导致(nirK+nirS)/nosZ较大外,其余站位的(nirK+nirS)/nosZ变幅基本在一个数量级以内且无明显变化规律. 在河口近海区域,三条辐射条状站位(EL1~EL3、EM1~EM3、ER1~ER3)中EL1~EL3站位线的(nirK+nirS)/nosZ由河口到近海轻微下降,由河口到近海区域nirK和nirS基因降幅大于nosZ基因,导致(nirK+nirS)/nosZ有所下降,另外两条辐射条状站位线则呈现相反的趋势. 对比三条辐射条状站位线和3种基因的丰度图知,nosZ基因丰度显著下降,导致(nirK+nirS)/nosZ由北到南(EL1—EM1—ER1、EL2—EM2—ER2、EL3—EM3—ER3)显著上升,说明近海三条辐射站位南边N2O气体排放高于北边. 可见,由河口到近海和由北到南的三条近海辐射线nosZ基因丰度均逐渐减少,导致不能将无机氮彻底还原为N2. 曹林桦等[38]研究发现,高浓度的硝态氮会使nosZ基因活性得到抑制,进而减慢N2O转化为N2的速率,因此nosZ基因丰度的减少与硝态氮的积累有关. 总体看来,根据从河口到近海3种基因在站位线的变化情况,nosZ基因受到的影响大于nirK和nirS基因,说明大辽河河口及其毗邻近海区域主要进行的反硝化为NO2-还原形成NO,因此N2O的产生较多.

图5 大辽河口及其毗邻区域5月水体中(nirK+nirS)/nosZ
2.3 反硝化功能基因与水环境因子的关系
根据影响水体细菌的非生物因素[39],对所采集的大辽河口水体中12项环境因子进行了测定,结果如图6所示. 盐度作为影响反硝化细菌的非生物因素之一,可改变其生理方面特性进而影响其活性[40],浓度越高活性越低,5月大辽河河口区盐度变化范围为0.27‰~21.87‰,其中河流段盐度变化范围为0.27‰~0.35‰,而近海段由于受到海水的输入变化比较明显,变化范围为10.11‰~21.87‰. 温度对反硝化作用所需酶的活性有一定影响,研究发现反硝化作用的最适温度为30 ℃[41]. 采样期间辽河河口区各站位水温变化范围为16.1~18.5 ℃,平均值为16.8 ℃,各站位间变化不明显;pH变化范围为7.04~8.07,平均值为7.68,各站位pH整体比较平稳,并呈现中性偏碱性水平. 已有[42]研究发现,低pH可减慢反硝化速率,pH在7~8之间最有利于反硝化过程的进行. O2对反硝化作用的影响较大,高浓度的氧会促进好氧反硝化细菌反硝化作用的进行,减慢厌氧反硝化细菌反硝化作用的步伐[43],该研究站位DO浓度的变化范围为5.1~9.33 mg/L,平均值为6.56 mg/L,河口河流段DO浓度变化不明显,河口近海段出现小幅波动. 大辽河河口区营养盐的检测中,SiO32-、NO2-、NO3-和TN浓度变化范围分别为0.834~3.336、0.127~0.377、1.187~4.206和2.620~7.515 mg/L,平均值分别为2.2、0.221、2.816、5.391 mg/L,SiO32-、NO2-、NO3-浓度总体表现为河流段高于近海区,而TN浓度除L5站位较低外,总体呈现由河流上游到河口逐渐上升、由河口到近海逐渐降低的趋势. 这主要是因为大辽河河流段受人为影响因素众多,注入了丰富的营养盐,而由河口到近海输送的过程中营养盐在多种生物化学过程中得到消耗. 已有[44]研究发现,重金属对反硝化基因也有影响,因此该研究进行了大辽河河口区水体重金属的研究. 重金属检测结果中,金属Cu和Pb在调查区域均未检出;金属Zn在河口河流段被检出,其含量由河流上游河段到河口逐渐升高,金属As、Cr和Cd在河流段含量较低,且无明显规律,Zn、As、Cr和Cd在近海段含量较大,且波动较明显.

图6 大辽河口及其毗邻区域5月水体中水质参数的空间分布
因子分析是指研究从变量群中提取共性因子的统计技术,其根据众多变量之间的内部依赖关系,通过降维和简化数据,使用少数几个因子来表示基本的数据结构,反映出原来众多变量的主要信息[45]. 该研究将上述12项环境指标进行因子分析,意图推导出影响大辽河口及其毗邻区域水环境状况的主导因子. KMO检验得出其统计量为0.757(>0.7),说明该研究环境因子适合做因子分析. Bartlett球形检验得出Sig.<0.01,进一步说明各环境变量间具有相关性,因子分析有效. 公因子方差中12项指标“提取”的值几乎均大于0.5且多数在0.8以上,因此变量较好地得到了表达. 为尽量减少具有较大因子荷载量的变量个数,使用方差最大正交旋转. 表3为特征值大于1的3个主成分,旋转后累积方差贡献率达80.893%,可以反映12项指标的整体水环境状况. 表4为各因子旋转后的载荷率,因子载荷率的绝对值大于0.75,说明二者相关性很好,由此得出主成分因子与水环境状况之间的相关程度[46]. 由表4可知,与F1关系最为密切的因子是As、Cd、Cr、SiO32-、NO3-和盐度;与F2关系最为密切的因子是pH,因此F2可以用pH来表征;与F3关系最为密切的是T,因此F3可以用T来表征. 综上,As、Cd、Cr、SiO32-、NO3-、T、pH和盐度主导了大辽河口及其毗邻区域水环境的整体状况. 前人也开展了水体中微生物与环境因子的研究,发现不同生境条件下影响微生物的主要环境因子有所不同[47];孙海美等[48]研究发现,Fe是影响布吉河群落结构的主要水环境因子;Yan等[49]研究发现,SiO32-、DO和NO3-是影响三峡水库细菌群落结构的主要水环境因子;张健伟等[35]研究温榆河中硝化和反硝化基因数量变化时发现,T和总有机碳对微生物基因影响最大;吕明姬等[50]在进行滇池湖体浮游细菌与水环境因子的研究时发现,氮类无机营养物是影响浮游细菌分布的主要因子. 微生物基因丰度的改变反映了水环境质量的变化情况,但因影响微生物基因数量的因素很多,在实际河流污染治理时统筹考虑各环境因子的变化和影响,才能取得较好的治理效果.

表3 大辽河口及毗邻区域水环境指标的因子特征值

表4 大辽河口及毗邻区域水环境指标旋转后因子载荷率
将该研究中3种基因的基因丰度数据做DCA分析,发现第一轴长度为0.16(小于3),表明该研究的基因与环境因子之间存在线性相关,因此更加适合进行RDA分析[23]. 将反硝化细菌基因数量与12项水环境因子做RDA分析,意图得出影响细菌数量的主要水环境因子. 根据RDA分析结果(见图7)可知,第一、二排序轴的特征值分别为 0.859 1 和 0.015 4,两排序轴共解释了变异的87.45%,因此两个排序轴可真实反映环境因子对反硝化功能基因丰度的影响程度. 第一、二排序轴基因丰度与环境因子的相关系数分别为 0.937 9 和 0.813 7,说明排序轴与环境因子相关性高,分析结果可靠. 从nirS基因与nosZ基因、nirK基因与nosZ基因的夹角可知,两对基因间有一定相关性. 为了使各基因的丰度数据符合正态分布,将3种基因的丰度进行对数转换后进行Pearson相关性分析,结果发现除nirK基因与nosZ基因呈显著相关(P<0.05)外,其余基因间无显著性相关,因此进一步研究环境因子与3种基因的相关性. 根据图7中环境因子与基因之间的夹角可以看出,各环境因子均对nirK、nirS和nosZ基因丰度有一定程度影响,水环境因子对反硝化功能基因丰度影响程度表现为ρ(DO)>ρ(TN)>ρ(NO2-)>ρ(SiO32-)>ρ(Cd)>ρ(NO3-)>盐度>ρ(As)>ρ(Cr)>T>ρ(Zn)>pH,且DO浓度对nirS基因的影响最大,NO3-浓度对nirK基因和nosZ基因的影响最大. 易能等[51]研究富氧灌溉池塘中反硝化细菌丰度时发现,nirK、nirS和nosZ基因均与DO浓度、pH和T呈显著相关,而与NO3-浓度相关性不显著,这与该研究结果有所不同,说明不同环境条件下反硝化基因对环境因子的响应不同. 由图7中不同环境因子与反硝化功能基因之间的夹角不同可知,该研究中3种反硝化基因的微生物种群对环境因子变化的响应不同[52]. 将数据进行蒙特卡罗检验发现P均大于0.05,说明没有显著影响的因子大辽河口及毗邻区域反硝化功能基因丰度是由各项环境因子相互作用、共同影响的结果.
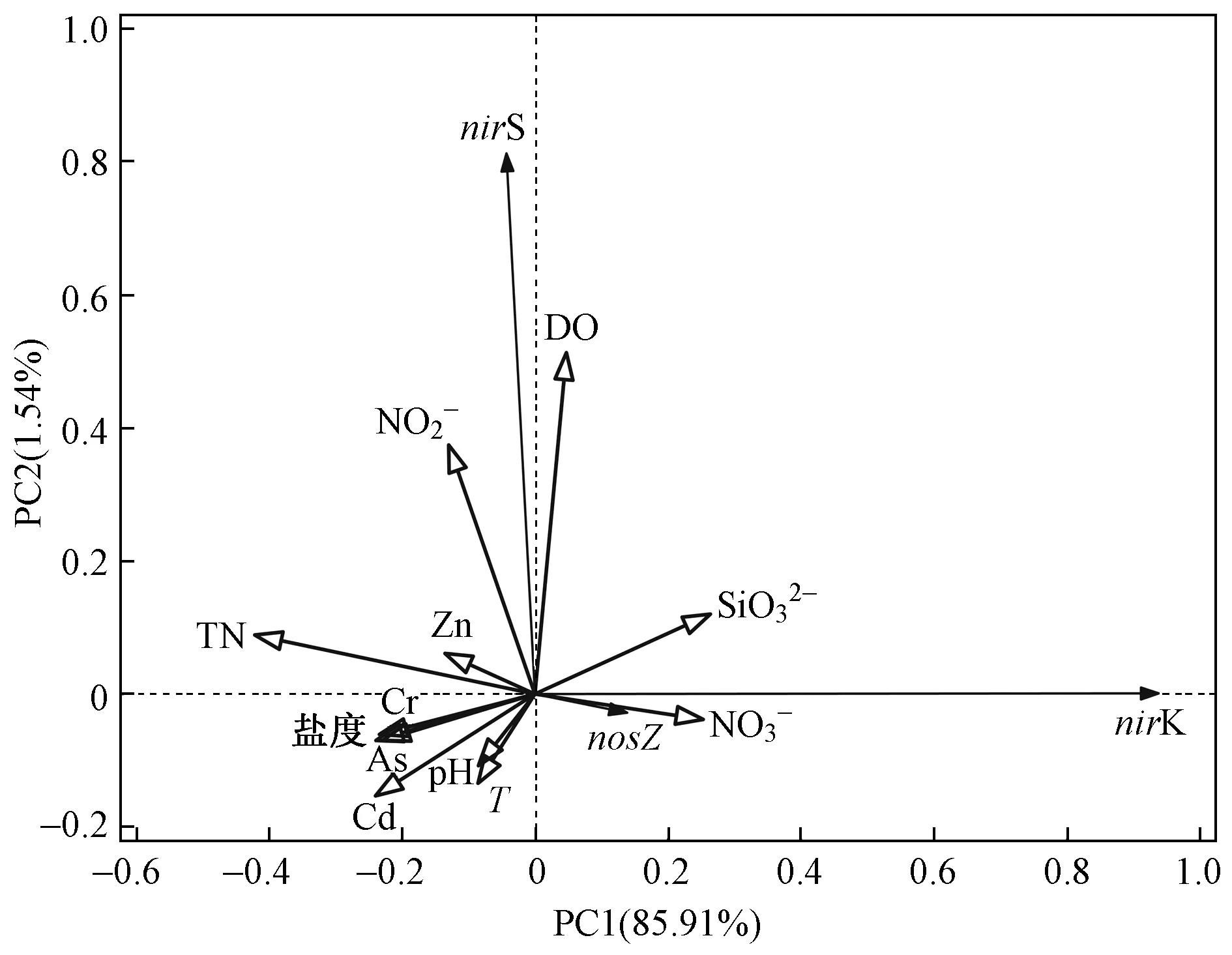
注: TN、NO2-、NO3-、SiO32-、DO均表示其浓度;Zn、Cr、Cd、As均表示其含量.
2.4 不确定分析
该研究通过一系列全面的调查确定了一些最具代表性的采样点,但由于人力、物力有限,只可反映调查时期所研究区域反硝化细菌的丰度变化. 另外,在进行反硝化细菌的研究时还存在一些不确定因素:除了该研究的环境因子,也还有其他环境因子对细菌和反硝化细菌产生影响;基因测定方法的不同对结果也会有一定影响;反硝化细菌群落的组成和分布的影响因素很多,不同功能基因型的反硝化细菌对环境因素的响应程度也不一样. 因此,不同人为活动和污染的影响以及不同的环境条件都会对其分布产生影响. 在后续研究中,会进一步优化基因测定方法、环境因子、监测站位和监测时间,完善海洋与河口水体中反硝化细菌的变化规律,为指导海湾污染治理和生态恢复提供更完整的功能微生物背景资料.
3 结论
a) 大辽河口水样中反硝化功能基因nirK、nirS和nosZ基因的丰度变化范围分别为7.73×105~2.54×108、3.19×105~3.19×107、3.22×103~4.92×105copies/L,平均值分别为2.5×107、7.76×106和1.13×105copies/L. 总体来看,大辽河口水体中反硝化细菌占比最高的是nirK型细菌,nosZ型细菌的平均丰度最低.nirK和nirS基因均高于平均值的站位大多位于调查河流的起始段和河流的入海口位置.nosZ基因丰度总体在河流河段由上游到河口逐渐增高,由河口到近海呈现降低的趋势. 除nosZ基因丰度在不同站位较低外,nirK和nirS基因在不同站位基因丰度相似且具有相同趋势.
b) 大辽河流域(nirK+nirS)/nosZ较大,存在较多N2O气体排放,由河口到近海站位线上主要进行的反硝化为NO2-还原形成NO,因此N2O的产生较多.
c) As、Cd、Cr、SiO32-、T、NO3-、pH和盐度主导了大辽河口及其毗邻区域水环境的整体状况,水环境因子对反硝化功能基因丰度影响程度表现为ρ(DO)>ρ(TN)>ρ(NO2-)>ρ(SiO32-)>ρ(Cd)>ρ(NO3-)>盐度>ρ(As)>ρ(Cr)>T>ρ(Zn)>pH,且DO浓度对nirS基因的影响最大,NO3-浓度对nirK和nosZ基因的影响最大. 各环境因子对反硝化功能基因影响不显著,大辽河口及其毗邻区域反硝化功能基因丰度是由各项环境因子相互作用、共同影响的结果.
