我国医药制造业危险废物产生特性及污染防治分析
2021-11-24姚光远刘玉强刘景财徐亚
姚光远, 刘玉强, 刘景财, 徐亚*
1.环境基准与风险评估国家重点实验室, 中国环境科学研究院 2.国家环境保护危险废物鉴别与风险控制重点实验室, 中国环境科学研究院
医药制造业是关系国计民生的重要产业,是我国“十二五”规划中确定的朝阳型战略性新兴产业,是《中国制造2025》的重点发展领域,更是推进健康中国建设的重要保障[1]。随着国民经济的不断发展和人民生活水平的不断提高,医疗保健的意识也不断增强,极大促进了我国医药制造行业的发展。此外,随着2019年“一带一路”倡议的全面推进和健康中国行动的全面实施,医药制造业将得到持续发展。医药制造业的飞速发展导致污染物大量排放,随之而来的是区域环境风险的增加,这将会制约医药制造业的可持续发展。
医药制造业是《国家环境保护“十二五”规划》中要求重点治理的12个行业之一,属于精细化工行业,具有产品种类多,生产工序复杂,原材料种类多、数量大且原料利用率低等特点。因此医药制药业的“三废”产量巨大,且成分复杂[2-3]。医药制造业产生的危险废物具有毒性、易燃性、腐蚀性、化学反应性、感染性等危害特性,对生态环境和人体具有极大的潜在危害[4]。国家高度重视生态环境保护工作,《重点行业挥发性有机物综合治理方案》《重点流域水污染防治规划(2016—2020年)》以及《“十三五”生态环境保护规划》中均对医药制造业的污染防治工作提出了具体要求[5-7]。笔者对我国医药制造业的产排污环节进行分析,系统梳理了其危险废物的产生特性,并对医药制造业危险废物的污染防治工作提出建议,以期为提高医药制造业危险废物识别能力以及医药制造业危险废物的安全处置提供指导。
1 医药制造业现状
我国是世界医药制造大国之一,制药生产企业遍布全国29个省(自治区、直辖市),2008—2019年我国医药制造业主营业务收入和企业数见图1[8]。从图1可以看出,医药制造业的主营业务收入呈先升高后降低的趋势,在2016年达到峰值,之后随着生态环境监管工作持续收紧,生态环境部、工业和信息化部等多部委不断出台监管政策,企业进行提质改造,导致其主营业务收入下降。医药制造业企业数量呈先增高后降低再升高的趋势。
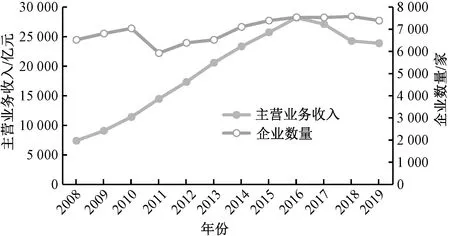
图1 2008—2019年我国医药制造业主营业务收入和企业数量Fig.1 Business income and number of enterprises of pharmaceutical manufacturing industry in China from 2008 to 2019
GB/T 4754—2017《国民经济行业分类》将药企分为8类,包括化学药品原料药制造、化学药品制剂制造、中药饮片加工、中成药生产、兽用药制造、生物药品制品制造、卫生材料及医药用品制造、药用辅料及包装材料。根据药品种类、生产工艺及产排污情况,将药企分为6类,包括化学合成类、中药类、发酵类、混装制剂类、提取类、生物工程类,其中化学合成类、发酵类以及提取类归入化学原料药。
《中国医药统计年报2016》中医药制造业主营业务收入排名前500的企业信息如表1所示。由表1可知,制药企业工业总产值占医药制造业的94.63%,其中化学药品行业占比最大,达到59.77%。据统计,目前我国医药工业中约80%的污染是由于化学原料药生产所造成的,且所有被纳入国家重点监控的制药企业均为化学原料药生产企业。

表1 2016年医药制造业主营业务收入排名前500企业信息Table 1 Information of pharmaceutical manufacturing industry for Top 500 enterprises in 2016
我国化学原料药具有上千个品种,涉及的各类原辅料达万种以上;全国化学原料药规模以上生产企业已超过 1 000 家,还不包括生产医药中间体的众多化工企业。化学原料药可分为抗微生物药、抗肿瘤药、免疫抑制及免疫调节剂、抗寄生虫药、中枢神经系统药、呼吸系统药、心血管系统药、消化系统药、血液及造血系统药、泌尿系统药、抗过敏药、内分泌系统药等24类以及单列品种类药物。2016年医药制造业原料药产量按地区统计汇总如图2所示。由图2可知,原料药生产主要集中在山东省、河北省、浙江省、上海市、安徽省等地区。

图2 2016年医药制造业原料药产量按主要生产地区统计汇总Fig.2 Statistics of chemical raw drugs production in 2016 by major production regions
2016年化学原料药产量、出口量以及各大类化学原料药中主要产品类型、产量和出口量汇总如表2 所示。由表2可知,我国是世界上主要的医药产品出口国,其中化学原料药出口量占产量的29.10%,中枢神经系统药物、维生素类药物、生化药物出口量分别占产量的72.35%、45.53%、41.58%。

表2 2016年主要化学原料药产量和出口量汇总Table 2 Production and export volume summary of main chemical raw drugs in 2016
2 医药制造业标准及政策分析
由于我国制药生产技术水平的进步,GB 8978—1996《污水综合排放标准》不能满足制药工业水污染物的排放要求。2003年,我国启动了制药工业水污染物排放标准的制订工作,2008年,制药工业水污染物排放标准正式实施,包括GB 21903—2008《发酵类制药工业水污染物排放标准》、GB 21904—2008《化学合成类制药工业水污染物排放标准》、GB 21906—2008《中药类制药工业水污染物排放标准》、GB 21905—2008《提取类制药工业水污染物排放标准》、GB 21907—2008《生物工程类制药工业水污染物排放标准》、GB 21908—2008《混装制剂类制药工业水污染物排放标准》。
我国制药工业大气污染物排放标准此前执行GB 16297—1996《大气污染物综合排放标准》和GB 14554—1993《恶臭污染物排放标准》,由于未考虑医药制造业的生产工艺特点及污染治理的实际状况等,2013年启动了制药工业大气污染物排放标准的制订工作。2018年《排污许可管理办法(试行)》开始实行,同年,为了进一步明确和细化对制药工业企业自行监测行为的指导,支撑制药行业排污许可制度的落实,HJ 882—2017《排污单位自行监测技术指南 发酵类制药工业》、HJ 881—2017《排污单位自行监测技术指南 提取类制药工业》、HJ 883—2017《排污单位自行监测技术指南 化学合成类制药工业》以及HJ 858.1—2017《排污许可证申请与核发技术规范 制药工业—原料药制造》相继实施。2019年,HJ 1064—2019《排污许可证申请与核发技术规范 制药工业—中成药生产》、HJ 1062—2019《排污许可证申请与核发技术规范 制药工业—生物药品制品制造》、HJ 1063—2019《排污许可证申请与核发技术规范 制药工业—化学药品制剂制造》、HJ 992—2018《污染源源强核算技术指南 制药工业》以及GB 37823—2019《制药工业大气污染物排放标准》也开始实施。
2019年12月《推动原料药产业绿色发展的指导意见》发布[9],提出“到2025年,突破20项以上绿色关键共性技术,基本实现行业绿色生产技术替代,建立原料药绿色工厂、绿色园区、绿色管理标准评价体系,主要污染物排放强度逐步下降,标志着医药制造业向着绿色化方向发展”。针对化学原料药制造业高消耗、高排放的特点[10-11],为进一步落实工业和信息化部《工业绿色发展规划(2016—2020年)》,积极推行清洁生产,2020年底,国家发展和改革委员会、生态环境部、工业和信息化部联合发布了《化学原料药制造业清洁生产评价指标体系》[12],该指标体系既能够作为相关主管部门对行业实施清洁生产的有效管理工具和评价绩效手段,满足主管部门对推动各行业实施清洁生产的要求,又能够减轻企业负担,提高清洁生产工作效率。
3 危险废物产生分析
我国医药制造业中化学药品原料药制造具有产品种类多、原辅材料(包括有机溶剂)类别多、用量大、生产工艺复杂、污染因子成分复杂、排放量大等特点。因此,主要分析化学合成原料药的产排污环节,按照其产生工艺又可细分为发酵类、化学合成类和提取类药物。
3.1 发酵类药物
发酵类制药是指通过发酵的方法产生抗生素或其他的活性成分,然后经过分离、纯化等工序生产出药物的过程[13]。发酵类药物最开始是从抗生素的生产发展起来的,截至目前,发酵类药物仍以抗生素为主。根据其生产工艺特点,可将其分为抗生素类、维生素类、氨基酸类以及其他类药物,其生产工艺和产排污过程如图3所示。
从图3可以看出,发酵类制药的生产工艺流程一般为种子培养、微生物发酵、发酵液预处理和固液分离、提炼纯化、精制、干燥、成品等步骤[14]。种子培养阶段通过摇瓶种子培养、种子罐培养及发酵罐连续的扩增培养,获得足够量健壮均一的种子投入发酵生产。发酵液预处理的主要目的是将菌体与滤液分离开(通常采用过滤法处理),便于后续处理。提取工艺过程分为从滤液和菌体中提取2种,提取的方法主要有萃取、沉淀、盐析等。产品精制纯化主要采用结晶、喷雾干燥、冷冻干燥等方式。

图3 发酵类制药的生产工艺及排污环节Fig.3 Production process and pollution discharge links of fermentation pharmacy
由发酵类制药工业的生产工艺和排污环节可知,发酵类制药工业产生的危险废物包括以下几类[15]:1)抗生素类药物生产过程中产生的菌丝废渣,蒸馏浓缩、母液分离产生的蒸馏釜残和高浓度母液;2)生产过程中产生的废酸和废碱;3)粉碎、筛分、混合、包装过程产生的含尘废气经除尘后收集的粉尘;4)脱色、过滤、分离等工序产生的不能回收或再生处理的废活性炭、吸附剂和有机溶剂等;5)含有或直接接触药品的废包装材料、废滤芯(滤膜)、废容器及清洗杂物等;6)企业设备运行过程中产生的废矿物油、废乳化液等。此外,维生素、氨基酸以及其他非抗生素类药物发酵药物生产过程中产生的菌丝废渣。废水处理过程中产生的格栅截留物和污水处理污泥按照GB 5085.7—2019《危险废物鉴别标准 通则》中的有关规定进行鉴别。
3.2 化学合成类药物
化学合成类制药是以化学原料或药物中间体为起始反应物,采用一个化学反应或一系列化学反应生产药物活性成分的过程[16]。化学合成类制药以不同种类的化学原料为基础,根据配方生产各种产品,其中最常见的化学原料为有机溶剂,如丙酮、苯胺、苯、氯仿等,通常具有毒性、腐蚀性和易燃性等特点[17]。
化学合成类药物具体包括镇静催眠药(如巴比妥类、氨基甲酸酯类等)、抗癫痫药、抗精神失常药、麻醉药、解热镇痛药和非甾体抗炎药、镇痛药和镇咳祛痰药、中枢兴奋药和利尿药、合成抗菌药(如喹诺酮类、磺胺类等)、拟肾上腺素药、心血管系统药物、解痉药及肌肉松弛药、抗过敏药和抗溃疡药、寄生虫病防治药物、抗病毒药和抗真菌药、抗肿瘤药、甾体药物等16个种类约近千个品种[18],其生产工艺和产排污过程如图4所示。
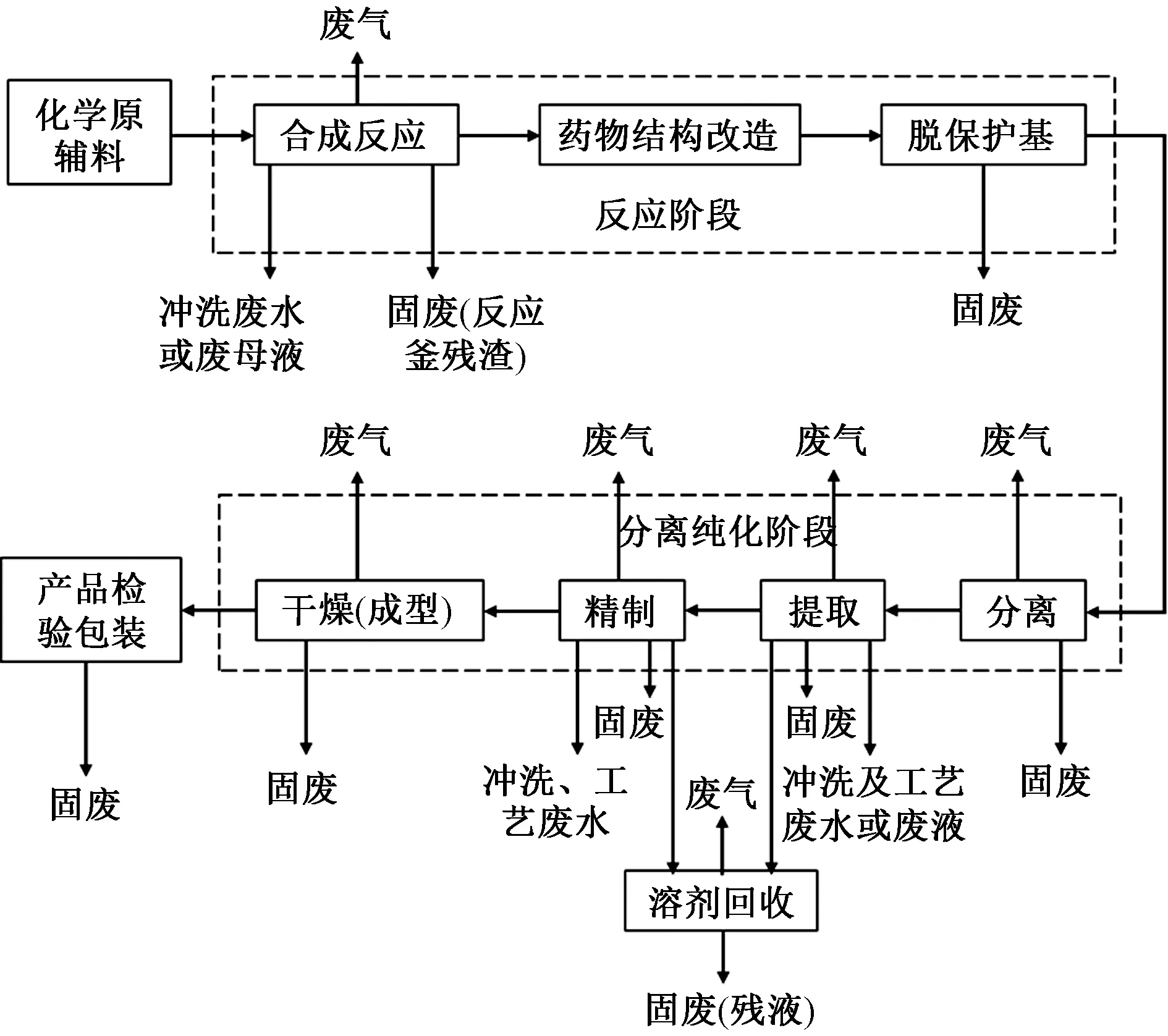
图4 化学合成类制药的生产工艺及排污环节Fig.4 Production process and pollution discharge links of chemical synthesis pharmacy
由图4可知,化学合成类制药的生产流程大致包括原辅料的投加、反应阶段、分离纯化、产品检验包装4个步骤[19],其中,反应和分离纯化2个阶段是核心生产环节,是污染物产生的主要环节。化学合成类制药的反应阶段包括合成、药物结构改造、脱保护基等过程。具体的化学反应类型包括酰化反应、裂解反应、硝基化反应、缩合反应和取代反应等。纯化阶段包括分离、提取、精制和成型等。其中分离主要包括沉降、离心、过滤和膜分离技术;提取主要包括沉淀、吸附、萃取、超滤技术;精制包括离子交换、结晶、色谱分离和膜分离等技术;成型主要包括浓缩、干燥、无菌过滤和成型等技术。纯化阶段中的分离、提取、精制过程与发酵类药物制造过程相似。
由化学合成类制药工业的生产工艺和排污环节可知,化学合成类制药工业产生的危险废物包括以下几类[15]:1)反应阶段产生的废催化剂;2)蒸馏浓缩、母液分离产生的蒸馏釜残和高浓度母液;3)生产过程中产生的废酸和废碱;4)粉碎、筛分、混合、包装过程产生的含尘废气经除尘后收集的粉尘;5)脱色、过滤、分离等工序产生的不能回收或再生处理的废活性炭、吸附剂和有机溶剂等;6)含有或直接接触药品的废包装材料、废滤芯(滤膜)、废容器及清洗杂物等;7)企业设备运行过程中产生的废矿物油、废乳化液等。此外,废水处理过程中产生的格栅截留物和污水处理污泥按照GB 5085.7—2019的有关规定进行鉴别。
3.3 提取类药物
提取类制药是指运用物理、化学、生物化学方法,将生物体中起重要生理作用的各种基本物质采用提取、分离、纯化等手段生产药物的过程[20]。提取类制药分为生化制药(以动物提取为主)、天然药物(以植物提取为主)和海洋药物,提取类制药企业相对于其他类别的制药企业而言规模较小,其生产工艺和产排污过程如图5所示。
从图5可以看出,提取类制药工艺大体可分为原料的选择和预处理、原料的粉碎、提取、分离纯化、干燥及保存、制剂6个阶段。其中提取过程可分为酸解、碱解、酶解、盐解及有机溶剂提取等;提取过程常用的溶剂包括水、稀盐、稀碱、稀酸、有机溶剂,如乙醇、丙酮、三氯甲烷、三氯乙酸、乙酸乙酯、草酸、乙酸。精制过程可分为盐析法、有机溶剂分级沉淀法、等电点沉淀法、膜分离法、层析法、凝胶过滤法、离子交换法、结晶和再结晶等几种工艺的组合。

图5 提取类制药的生产工艺及排污环节Fig.5 Production process and pollution discharge links of extraction pharmacy
由提取类制药工业的生产工艺和排污环节可知,提取类制药工业产生的危险废物包括以下几类[15]:1)生产过程中产生的废酸和废碱;2)粉碎、筛分、混合、包装过程产生的含尘废气经除尘后收集的粉尘;3)脱色、过滤、分离等工序产生的不能回收或再生处理的废活性炭、吸附剂和有机溶剂等;4)含有或直接接触药品的废包装材料、废滤芯(滤膜)、废容器及清洗杂物等;5)企业设备运行过程中产生的废矿物油、废乳化液等。此外,提取废渣、高浓度釜残液、废水处理过程中产生的格栅截留物和污水处理污泥按照GB 5085.7—2019的有关规定进行鉴别。
4 危险废物危害特性及处置分析
医药制造业产生的危险废物具有毒性、易燃性、腐蚀性、化学反应性、感染性、浸出毒性等危害特性,如残留的抗生素、菌体使其具有毒性、感染性,有机溶剂使其具有毒性、易燃性、腐蚀性和化学反应性,残留的重金属离子使其具有浸出毒性。其中的有毒有害污染物可以通过大气、土壤、地下水进入生态系统,从而对人体健康和周围环境产生危害。医药制造业危险废物的污染特性汇总如表3所示。

表3 医药制造业危险废物的危害特性汇总Table 3 Hazardous characteristics of hazardous wastes in pharmaceutical manufacturing industry
虽然菌丝废渣中含有大量粗脂肪、蛋白质等有机物,具有较好的肥料化利用前景,但是由于其中残留的抗生素,通常只能采用焚烧的方式进行处置;废吸附介质则通过回收加工或再生处理后,用作化工或其他行业的生产原材料;蒸馏釜残和高浓度母液的热值较高,主要通过焚烧的方式进行处置,还可以进行回收利用;废水处理污泥主要通过焚烧的方式进行处置。
5 危险废物利用处置对策建议
5.1 促进源头减量,减少环境风险
对于化学合成类药物,可通过工艺改进、原材料替代以及催化剂选择实现绿色生产[21-23]。通常药物合成具有多条反应路径,因此应选择合成路线简短、所需要原辅材料少、中间体容易提纯、反应条件温和、废物产量少的合成路径。原材料的替代一般采用以无毒、低毒的原材料替代有毒、剧毒的原材料,从而降低或消除污染物的毒性。药物合成通常需要催化剂的作用,因此应选择高效催化剂,提高原材料的转化效率。
5.2 加强回收利用,提升医药制造业清洁生产水平
医药制造业涉及的原辅料种类繁多,其中有机溶剂的用量巨大,且环境危害性显著[24]。因此,对于有回用价值的溶剂应加强回收利用,一方面可以减少原辅料的用量,另一方面可以减少危险废物的产生,提升企业清洁生产水平。此外,制药废液中通常含有较高含量的铵盐,可采用蒸发、浓缩、结晶的方式进行回收。通过开展企业间点对点的合作,充分利用区域内的各企业原料和废物的关联,将对方排出或回收的废物作为原材料加以利用,形成生态产业链,促进区域内的清洁生产,助力碳达峰、碳中和。
5.3 推进末端利用,提升医药制造业危险废物资源化水平
发酵类制药企业会产生数量巨大的废菌丝渣[25],其中抗生素类废菌丝渣为危险废物,维生素、氨基酸及其他类型的废菌丝渣则需要鉴别。而目前对于废菌丝渣综合利用的标准规范尚不完善。因此应强化废菌丝渣无害化预处理技术创新,为其后续安全利用处置奠定基础。因此,应健全废菌丝渣利用处置标准规范,循序渐进构建完善抗生素废菌丝渣利用处置污染控制及产品质量标准体系。
6 结语
医药制造业中化学原料药产生的危险废物具有毒性、易燃性、腐蚀性、化学反应性、感染性、浸出毒性等危害特性,对生态环境和人体健康具有极大的潜在危害。应从源头上减少环境风险,如通过工艺改进、原材料替代以及催化剂选择实现绿色生产;过程中提高企业清洁生产水平,如通过提高原辅料的回收利用水平、加强企业间点对点的合作实现产业生态循环;末端利用中提升医药制造业危险废物资源化水平,如强化相关危险废物处置技术创新,建立其综合利用标准规范,奠定安全利用基础。
