新型蛋白纳米系统用于口腔颌面部腺样囊性癌治疗的实验研究
2021-11-22吴情肖国岫徐斌
吴情 肖国岫 徐斌
[摘要]目的:本研究构建了一种新型的牛血清白蛋白纳米药物递送系统,该系统可共递送抗肿瘤药物,用于口腔颌面部腺样囊性癌及其导致的转移性肺癌的治疗。方法:制备的蛋白纳米颗粒负载疏水性化疗药物阿霉素(Dox),并在颗粒表面修饰肿瘤坏死因子相关凋亡诱导配体(TRAIL),以实现靶向共递送治疗性药物,用于治疗转移性肿瘤。结果:本次合成的多功能纳米颗粒具有较好的形貌特征和电位值。体外实验表明,该纳米递送系统具备还原敏感性,在谷胱甘肽(GSH)诱导下能断裂,并释放出Dox,在48h后释放率超过60%。该纳米颗粒不仅可以诱导涎腺腺样囊性癌细胞(SACC-LM)凋亡,还可以有效杀伤A549肺癌细胞,肿瘤细胞对其摄取能力显著增强。由于牛血清白蛋白的生物相容性,纳米颗粒可以在体内长效循环,在聚集到肺部后,有效减少了肺部结节的数量。结论:该纳米系统可以有效递送抗肿瘤药物,具有用于治疗腺样囊性癌的潜力。
[关键词]腺样囊性癌;口腔颌面部;牛血清白蛋白;纳米颗粒;化疗;响应释放
[中图分类号]R782 [文献标志码]A [文章编号]1008-6455(2021)06-0110-04
Experimental Study of Novel Protein Nanosystems in the Treatment of Adenoid Cystic Carcinoma of Oral and Maxillofacial Region
WU Qing,XIAO Guo-xiu,XU Bin
(Department of Stomatology,Shanghai Fifth People's Hospital,Fudan University,Shanghai 200240,China)
Abstract: Objective In this study, multifunctional bovine serum albumin nanoparticular delivery system has been developed for the co-delivery of Dox and TRAIL for Adenoid cystic carcinoma therapy. Methods The nanoparticle was constructed with green synthesis method, which only used conjugation linker (NHS-SS-NHS) without the addition of organic solvent. Results In the system, Dox was loaded into the synthesized albumin nanoparticle, followed by the modification with TRAIL on the surface. Importantly, the multifunctional nanoparticle was demonstrated to exhibit the reduction-responsive characteristic with over 60% Dox release under the stimulation of GSH within 48h. Besides, both SACC-LM cells and A549 cells could be induced apoptosis, while enhanced internalization of nanoparticle by SACC-LM cells was detected. The in vivo experiments validated the prolonged circulation of this system, which could also significantly decrease the number of metastatic nodules. Conclusion The novel system could exert excellent antitumor function and exhibited certain potential in clinical application.
Key words: adenoid cystic carcinoma; oral and maxillofacial region; bovine serum albumin; nanoparticles; chemotherapy; reduction-responsive
腫瘤的转移行为是导致死亡率持续增高的重要原因[1],腺样囊性癌是口腔颌面部常见的恶性肿瘤之一,易转移到肺部,具有较高的致死率[2-3]。对于此类肿瘤的治疗,通常以手术治疗和化疗为主,但效果常常不尽如人意[4]。化疗所用药物难以有效富集到转移肿瘤部位,并且药物体内随机分布所引起的毒副作用也成为死亡率增高的因素[5]。纳米药物递送系统在肿瘤的治疗方面展现出优越的潜能,近年来已被广泛用于肿瘤的治疗[6-8]。白蛋白纳米颗粒是一种具有良好生物相容性以及长循环能力的载体,因此得到了学界的广泛关注[9-10]。该纳米颗粒可以显著改善药物的毒副作用,经体内注射之后,显著改善了患者的生存期,为肿瘤患者带来了福音[11-12]。目前研究的蛋白纳米颗粒治疗功能单一,治疗安全性也有待提高。本项目构建了一种绿色的白蛋白负载阿霉素的纳米药物递送系统,该系统不使用有机溶剂,在修饰肿瘤坏死因子相关凋亡诱导配体(TRAIL)[13],能够协同Dox的抗肿瘤作用,从而增强肿瘤治疗效果。期待纳米颗粒可以选择性的富集到病灶部位,并在肿瘤微环境中有效释放药物,杀伤肿瘤。
1 材料和方法
1.1 主要试剂:二甲基亚砜(DMSO),牛血清白蛋白(Bovine serum albumin,BSA),阿霉素(Doxorubicin,Dox)购于阿拉丁试剂(上海)有限公司;4-(N-马来酰亚胺基甲基)环己烷-1-羧酸琥珀酰亚胺(SMCC),肿瘤坏死因子相关凋亡诱导配体(TRAIL)购于Sigma;NHS-SS-NHS购于西安瑞禧生物科技有限公司;磷酸盐缓冲液(PBS),胎牛血清(FBS),RPMI 1640培养基,青霉素和链霉素,胰蛋白酶,购于Hyclone公司;其他试剂为分析纯。
涎腺腺样囊性癌细胞株(SACC-LM)由北京大学口腔医学院提供。
1.2 BSA纳米颗粒(BSA NP),载Dox颗粒(BDN)和修饰TRAIL的载Dox颗粒(TBDN)的合成:BSA NP的合成:称取1.5mg BSA加入到100μl的PBS中,充分震荡至BSA完全溶解。随后,称取NHS-SS-NHS,溶解在DMSO中,配成终浓度为10mg/ml的母液。将BSA溶液放置在室温下以450rpm条件持续搅拌,缓慢滴加10μl新配置的NHS-SS-NHS母液,常温反应40min,透析24h,即形成了二硫键交联的BSA纳米颗粒。
BDN的合成:在上述BSA NP形成过程中,加入15μl溶解在DMSO中的Dox溶液(终浓度10mg/ml),以450rpm条件持续搅拌,常温反应40min,用超纯水透析24h,即得到了BDN。
TBDN的合成:为了增加BDN的靶向性以及肿瘤杀伤作用,将TRAIL修饰到BDN表面,具体步骤如下:将合成好的BDN分散在PBS中,加入SMCC,室温反应30min后,缓慢加入TRAIL,接着室温反应6h,超濾(10k),即得到TBDN。
1.3 粒径、电位以及形貌:将收集的TBDN稀释到一定浓度,通过动态光散射仪测定水合粒径大小以及电位值变化。将TBDN滴加到铜网上,使用醋酸铀负染,通过TEM观测纳米颗粒形貌。
1.4 稳定性测定:将TBDN分别分散在PBS和含有10% FBS的1640培养基中,混匀后,每隔24h取出样品,通过DLS测定粒径数值。
1.5 还原响应性研究:将TBDN分散在含有10mM GSH的PBS溶液中,震荡混匀后,分别在1h和2h取出溶液用DLS测定粒径大小。为了进一步测定在还原条件下的响应释放行为,本实验测定了在不同浓度GSH刺激条件下Dox的释放情况。具体步骤如下:将TBDN分散在含有0mM,2μM和10mM GSH的PBS缓冲液中,装于1K的透析袋中。将透析袋分别置于50ml的PBS缓冲液体系中,其中缓冲液中分别含有0mM,2μM和10mM的GSH。分别在第1、2、4、8、12、24和48h取出一定体积溶液,测定Dox含量。
Mt代表在t时刻的释放总量,Mo代表初始的Dox含量。
1.6 体外细胞毒性研究:将细胞种植在96孔板上(1×104个/孔),加入1640全培养基,放在培养箱中(5%CO2,37℃)孵育24h,用PBS洗涤2次,加入新鲜不含FBS的培养基,其中含有BDN与TBDN,浓度分别为2.5、5、10、20μg/ml,孵育24h,用PBS洗涤3次,加入含有20μl MTT(5mg/ml)的纯培养基,继续孵育4h,去除培养基,加入DMSO 180μl,在570nm条件下测定每个孔中的吸收值。
1.7 体外肿瘤细胞摄取:为了进一步验证Dox的细胞摄取增强,通过TBDN与SACC-LM的细胞孵育,用流式细胞仪检测细胞吞噬纳米材料后的荧光强度来阐述TBDN对转移癌细胞的靶向能力。将SACC-LM细胞(1×105个/孔)接种于6孔板中,放于培养箱中培养24h,加入Dox,BDN与TNDN孵育4h,用PBS洗涤2次后,采用流式细胞术仪定量分析细胞的荧光信号强度。
1.8 体内循环时间:为了探究Dox,BDN与TNDN的体内动力学行为,将15只小鼠平均分为3组,通过静脉注射Dox,BDN与TNDN(阿霉素剂量为5mg/kg)。在静脉注射后的第1、2、4、8、12、24h,收集小鼠血样,以800g离心分离10min。测定上清液中Dox的含量。
1.9 抗肿瘤转移研究:构建小鼠转移瘤模型,即通过尾静脉将4×106个SACC-LM细胞注射入裸鼠体内(18~22g),将20只小鼠随机分为4组。24h后,分别给小鼠注射PBS,Dox,BDN和TBDN(Dox剂量5mg/kg),每隔1d给药一次,一共给药5次。治疗结束后,为了进一步评估肺转移结节,处死小鼠并取出肺部组织,计算肺部的转移性结节数量。
1.10 统计学分析:采用SPSS 20.0软件进行,各组数据以均数±标准差(x?±s)表示,n代表组数,多组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
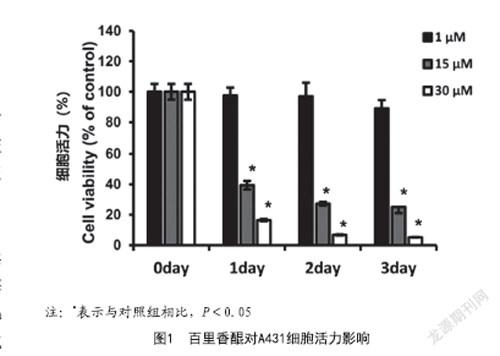
2.1 新型蛋白纳米系统的构建以及材料学表征测定:BSA合成过程如图1所示,通过交联分子NHS-SS-NHS,可以将BSA组装成BSA纳米颗粒。将疏水药物Dox负载到BSA中,即得到了载药的BSA纳米颗粒。为了增强纳米颗粒的主动靶向性以及对原位肿瘤、转移肿瘤的杀伤能力,在BSN表面修饰了TRAIL分子,即制备了TBDN。透射电镜结果表明纳米颗粒形貌较为均一(见图2),动态光散射仪表征颗粒的水合粒径大概为80nm(见图3)。进一步测定纳米颗粒的Zeta电位值,BDN的Zeta电位值约为-25mV(见图4),TBDN的电位值接近BDN,约为-24mV。将TBDN分别分散在PBS和含有10% FBS的1640培养基中,在连续监测96h内,颗粒尺寸基本不变(见图5)。
通过DLS测定该纳米颗粒在模拟体内GSH的条件下粒径的变化情况,如图6所示,纳米颗粒在GSH刺激1h后,粒径快速地从82nm增大到580nm,在2h后,粒径增加到950nm。
為了评估GSH诱导的纳米颗粒体外药物释放,将TBDN放置在三种不同的pH值为7.4的PBS溶液中,其中分别包含0mM,2μM和10mM的GSH。GSH水平下TBDN中Dox的释放曲线表明(见图7),Dox在2μM的GSH中释放受到抑制。48h后,只有不到20%的Dox被释放。在无GSH下,Dox也有类似的释放行为。在10mM GSH水平下,前10h内(约50%)Dox释放显著增强。58%的Dox在12h内被释放,大约是无GSH刺激下时的4倍。在10mM的GSH环境中,约60%的药物在48h后释放,另两组只有20%的药物随着时间的增加表现出持续释放的行为。
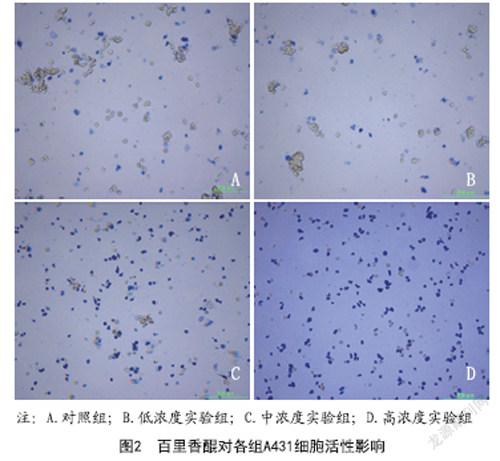
2.2 体内外实验评价蛋白纳米系统的肿瘤杀伤能力:如图8所示,通过MTT法测定了BDN与TBDN对SACC-LM细胞A549细胞的体外毒性。当Dox浓度为10和20μg/ml时,SACC-LM细胞和A549细胞的生存率皆小于50%,而与BDN相比,TBDN表现出显著增强的细胞毒性。
图9显示,BDN呈现出比Dox高的荧光强度,表明纳米颗粒容易被细胞内吞。而TBDN的强度显著增加,约是Dox的2倍,是BDN的1.5倍。
图10所示,在体内循环5h后,游离的Dox在血液中基本被清除。与游离的Dox相比,BDN与TBDN显著延长了血液循环时间。在循环4h时,TBDN的血液中的浓度大概是游离Dox的5倍。而在循环24h后,TBDN组中Dox浓度仍占约1%。
为了评估TBDN对转移肿瘤的治疗效果,对肺转移结节的数量进行了量化(见图11)。PBS组肺部可见大量转移结节,Dox组的肺部结节数量略有减少。与Dox组相比,BDN组的转移性结节数量减少了约30%,经过TRAIL修饰后,TBDN可以增强肿瘤的治疗,以及对转移肿瘤的靶向,从而减少了肺转移结节。
3 讨论
涎腺腺样囊性癌容易肺转移,致死率高[14]。患者可以带瘤生存,但预后效果差,其治疗方法常以化疗为主[15]。然而,化疗药物缺少靶向性以及毒副作用使得治疗效果不佳。对于转移到肺部的肿瘤,通常也缺少有效的治疗措施。利用蛋白纳米给药系统能够共递送治疗性药物,不仅可以改善药物毒性,还可以对转移的癌症具有治疗作用。
本研究制备的白蛋白纳米递送系统,具有较为均一的粒径,并且合成的纳米颗粒Zeta电位值较小,表明以BSA为基础的纳米颗粒具有良好的稳定性。修饰TRAIL之后,纳米颗粒的电位也未发生明显变化,体外稳定性监测,表明该纳米颗粒具有良好的储存稳定性。体外GSH刺激纳米颗粒,在10mM GSH条件刺激下,纳米颗粒可以断裂,释放药物,体外有效的药物释放,是因为在GSH条件下纳米颗粒发生了的解离和聚集。这种体外Dox释放行为与10mM GSH中纳米颗粒的快速尺寸变化一致。该体外释放行为的数据表明,通过GSH诱导,纳米颗粒中的二硫键被裂解,从而导致颗粒的解体。由此可见,BSA不仅能够有效地负载Dox,而且对肿瘤相关GSH水平具有较高的敏感性,能够显著加速Dox的释放。这种独特的依赖GSH的药物释放体系在肿瘤细胞的按需释放方面具有较大优势。
体外细胞毒性实验结果证实了,表明了TBDN具有较强的肿瘤杀伤作用。而与BDN相比,TBDN表现出显著增强的细胞毒性,这是由于TBDN表面修饰的TRAIL诱导的肿瘤凋亡,并在此基础上内吞入细胞后Dox释放,进一步诱导肿瘤凋亡。总的来说,这些结果证实了,通过TRAIL和Dox的联合,TBDN启动的TRAIL和Dox的特异性递送,可以有效地诱导肿瘤细胞凋亡。
由于肿瘤微环境中高表达GSH,该还原响应的BSA纳米颗粒在肿瘤微环境中二硫键网络将被打断,纳米颗粒结构被破坏,使得Dox可以从颗粒中释放,杀伤肿瘤。纳米颗粒在GSH刺激后,粒径快速增加,这是因为部分二硫键网络在被GSH破坏,直至体系中出现了更大的聚集体,主要是因为二硫键交联网络彻底被打断,并使得多肽片段出现热力学的聚集。体外释放行为的数据表明,通过GSH诱导,纳米颗粒中的二硫键裂解,从而导致颗粒的解体。由此可见,BSA不仅能够有效地负载Dox,而且对肿瘤相关GSH水平具有较高的敏感性,能够显著加速Dox的释放。这种独特的依赖GSH的药物释放体系在肿瘤细胞的按需释放方面具有较大优势。
而肿瘤细胞吞噬实验结果也表明,该纳米递送体系可以增强药物细胞内的递送,为进一步释放药物以及起到肿瘤杀伤作用至关重要。体内循环实验证明了BSA纳米颗粒可以延长Dox的血液循环时间,并且TRAIL修饰并不会影响药物的体内循环。相对较长的血液循环有助于在肿瘤部位以及转移瘤部位更有效地积累。纳米颗粒表面修饰的TRAIL,使得TBDN可以增强肿瘤的治疗,以及对转移肿瘤的靶向,从而减少了肺转移结节。该纳米系统可以有效递送药物具有用于治疗口腔肿瘤以及肺部转移肿瘤的潜力。
[参考文献]
[1]Konstantin S,Perrin HB,John DL.Novel therapeutic targets for cancer metastasis[J].Expert Rev Anticancer Ther,2020,20(2):97-109.
[2]苏文,杨宏宇.涎腺腺样囊性癌伴肺转移的治疗方案及预后[J].华西口腔医学杂志,2019,37(2):214-219.
[3]米磊,刘怀勤.白藜芦醇对人腺样囊性癌ACC-83侵袭与转移的影响[J].中国美容医学,2012,21(18):116.
[4]D'Cruz AK,Vaish R,Dhar H.Oral cancers: current status[J].Oral Oncol,2018,87:64-69.
[5]Steven PB,Akira S,Michel P,et al.Treatment tolerance and side effects of intraperitoneal carboplatin and dose-dense intravenous paclitaxel in ovarian cancer[J].J Obstet Gynaecol Can,2018,40(10):1283-1287.
[6]Ho YJ,Wu CH,Jin QF,et al.Superhydrophobic drug-loaded mesoporous silica nanoparticles capped with beta-cyclodextrin for ultrasound image-guided combined antivascular and chemo-sonodynamic therapy[J].Biomaterials,2020,232:119723.
[7]Maksimenko O,Malinovskaya J,Shipulo E,et al.Doxorubicin-loaded PLGA nanoparticles for the chemotherapy of glioblastoma: Towards the pharmaceutical development[J].Int J Pharm,2019,572:118733.
[8]El-Sawy HS,Al-Abd AM,Ahmed TA,et al.Stimuli-responsive nano-architecture drug-delivery systems to solid tumor micromilieu: past, present, and future perspectives[J].ACS Nano,2018,12(11):10636-10664.
[9]Liu L,Hu FL,Wang H,et al.Secreted protein acidic and rich in cysteine mediated biomimetic delivery of methotrexate by albumin-based nanomedicines for rheumatoid arthritis therapy[J].ACS Nano,2019,13(5):5036-5048.
[10]Yang QY,Zhou CH,Zhao Q,et al.Sonochemical assisted synthesis of dual functional BSA nanoparticle for the removal of excessive bilirubin and strong anti-tumor effects[J].Mater Sci Eng C Mater Biol Appl,2019,100:688-696.
[11]Chung HJ,Kim HJ,Hong ST.Tumor-specific delivery of a paclitaxel-loading HSA-haemin nanoparticle for cancer treatment[J]. Nanomedicine,2019,23:102089.
[12]Gawde KA,Sau S,Tatiparti K,et al.Paclitaxel and di-fluorinated curcumin loaded in albumin nanoparticles for targeted synergistic combination therapy of ovarian and cervical cancers [J].Colloid Surf B Biointerfaces,2018,167:8-19.
[13]Shi YS,Pang X,Wang JQ,et al.NanoTRAIL-Oncology: A Strategic Approach in Cancer Research and Therapy [J].Adv Healthc Mater,2018,7(11):e1800053.
[14]Wang WW,Ma JL,Jin FR,et al.Hyperbranched polymer drug delivery treatment for lung metastasis of salivary adenoid cystic carcinoma in nude mice[J].Exp Ther Med,2017,14(4):3105-3111.
[15]张骞予,杨培新,陈柏深,等.舌腺样囊性癌与肺腺癌双原发恶性肿瘤病例报告及文献复习[J].口腔疾病防治,2020,28(9):586-589.
[收稿日期]2020-07-31
本文引用格式:吳情,肖国岫,徐斌.新型蛋白纳米系统用于口腔颌面部腺样囊性癌治疗的实验研究[J].中国美容医学,2021,30(6):110-113.
