α-1,6-岩藻糖基转移酶的生物信息学分析
2021-11-22王子豪钱荣凯苏林杰孙钦儒
王子豪, 钱荣凯, 苏林杰, 贾 宁, 孙钦儒
(1.西安交通大学医学部, 西安 710061; 2.西安交通大学医学部基础医学院, 西安 710061; 3.西安交通大学医学部法医学院, 西安 710061)
哺乳动物拥有复杂的基因表达调控机制,其中翻译后修饰是重要的调控方式,可以快速改变蛋白质的生物学性质。蛋白质糖基化通过产生具有不同特性的多种糖蛋白极大地放大了蛋白质组的功能,在哺乳动物细胞的识别[1-2]、增殖[3]以及代谢活动[4]中均具有重要的作用。
大多数蛋白质通过14种不同糖基化途径中的一种或多种进行修饰,包括N-糖基化、11种O-糖基化、C-甘露糖基化和GPI锚定蛋白,这些途径在人类中涉及至少173种糖基转移酶以及许多其他修饰聚糖的酶[5]。对于N-糖基化,糖链通过共价作用结合在目标蛋白的天冬酰胺残基[6]。其中,核心岩藻糖糖基化是较常见的一种方式,由GDP-岩藻糖(GDP-fucose)作为供体,在α-1,6-岩藻糖基转移酶(α-1,6-fucosyltransferase, FUT8)的催化下,将岩藻糖残基共价连接至位于目标蛋白糖链核心最内侧的N-乙酰氨基葡萄糖(GlcNAc),从而形成α-1,6-糖苷键,完成核心岩藻糖糖基化[7-8]。
多项研究表明,FUT8介导的核心岩藻糖糖基化与上皮组织再生、神经炎症、乳腺癌及肺癌等多种疾病相关[9],细胞内的多种代谢及信息传递途径受其调节。然而,FUT8的作用机制还不甚清楚,Wang等[10]认为FUT8可以调节表皮生长因子受体与其配体的亲和力。另有实验表明,抑制FUT8可导致细胞对促炎细胞因子(如IFN-γ和IL-6)的敏感性增加[11-12]。这些研究虽然探索了FUT8的部分作用,但是对于全面揭示FUT8的生物学特性还远远不够,近年来的生物信息学的蓬勃发展为蛋白质结构和功能的研究打开新的大门。因此,现利用生物信息学分析fut8基因的结构及表达特点;分析FUT8的结构和功能特征、蛋白质作用网络关系及其参与的蛋白质通路,为进一步研究该蛋白在肥胖及相关疾病、肿瘤转移、炎症及免疫和造血异常中的作用以及相应药物的研发提供分子依据。
1 材料与方法
1.1 材料
所用fut8基因及其转录产物序列来自NCBI网站的GenBank数据库。产物蛋白FUT8的一级序列信息源自NCBI网站的GenPept数据库,空间结构数据来自PDB数据库。
1.2 方法
通过ExPASy网站旗下ProtParam分析工具预测FUT8蛋白的理化性质;使用TMHMMServer和SignalP-5.0在线数据库预测FUT8蛋白的跨膜区段和信号肽信息;使用Prabi数据库下的SOPMA和GOR4两种分析引擎推断FUT8蛋白的二级结构元件;通过在线数据库网站STRING研究蛋白质FUT8的分子相互作用关系(PPI分析),KEGG Pathway数据库分析蛋白质通路(KEGG分析);利用BLAST在线工具进行蛋白序列比对并获取保守位点,DNAMAN软件绘制分子进化树图。
2 结果与分析
2.1 fut8基因结构及特点
人类fut8基因定位于14号染色体长臂2区3带3亚带(14q23.3),外显子合计共16个,其中编码序列含外显子9个,其拼接关系如图1所示。
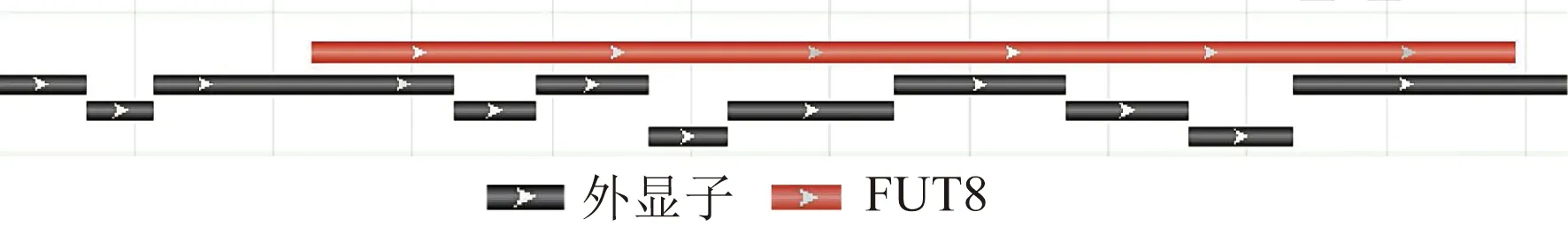
图1 FUT8编码序列外显子拼接关系 Fig.1 FUT8 coding sequence exon splicing relationship
人类fut8基因转录产物共有7种,分别称为变体1~6,其中变体6又根据长度不同分为两种,除变体5为非编码序列外,其余均编码不同的同工酶。FUT8同工酶分a、b、c三种,各剪接变异体及其编码产物如表1。变体1又称为变体B6,全长3 895 bp,编码较长的同工酶即同工型a,含氨基酸数575个,后文分析所用均为变体1及其翻译产物同工酶a。
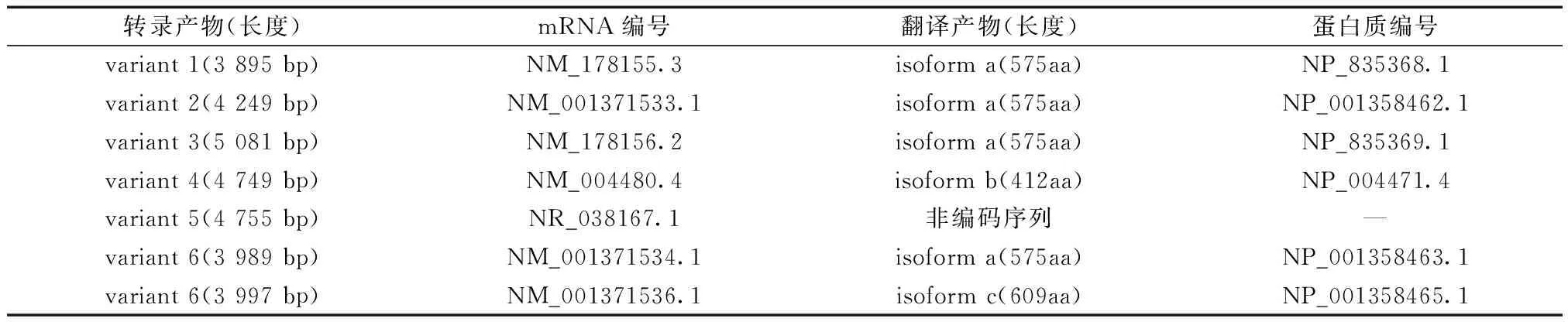
表1 各剪接变异体及其编码产物关系Table 1 Relationship between splice variants and coding products
2.2 FUT8蛋白的理化性质分析
FUT8蛋白分子式为C2986H4636N838O856S17,原子总数9 333个,分子量为66 515.78 D,理论等电点7.36。其中酸性氨基酸残基77个,碱性氨基酸残基77个,为弱碱性蛋白质分子。亮氨酸为含量最丰富的氨基酸,占到整个氨基酸组成的9.7%。
FUT8在哺乳动物的网织红细胞中半衰期为30 h,不稳定系数为42.22,因此认为是不稳定蛋白质。根据推断,理论脂肪系数为84.56,平均亲水性(GRAVY)达-0.551,故将FUT8认为是亲水性蛋白质。
2.3 蛋白的跨膜区域分析
通过TMHMMServer在线分析预测,如图2所示,FUT8蛋白序列存在理论跨膜区段6个。综合考虑可信度最高的模型为单次跨膜结构,即由17个疏水氨基酸构成的由内向外的跨膜区段,范围从第10~26位氨基酸,总得分2 561分。使用SignalP-5.0在线工具分析,FUT8不存在信号肽序列。
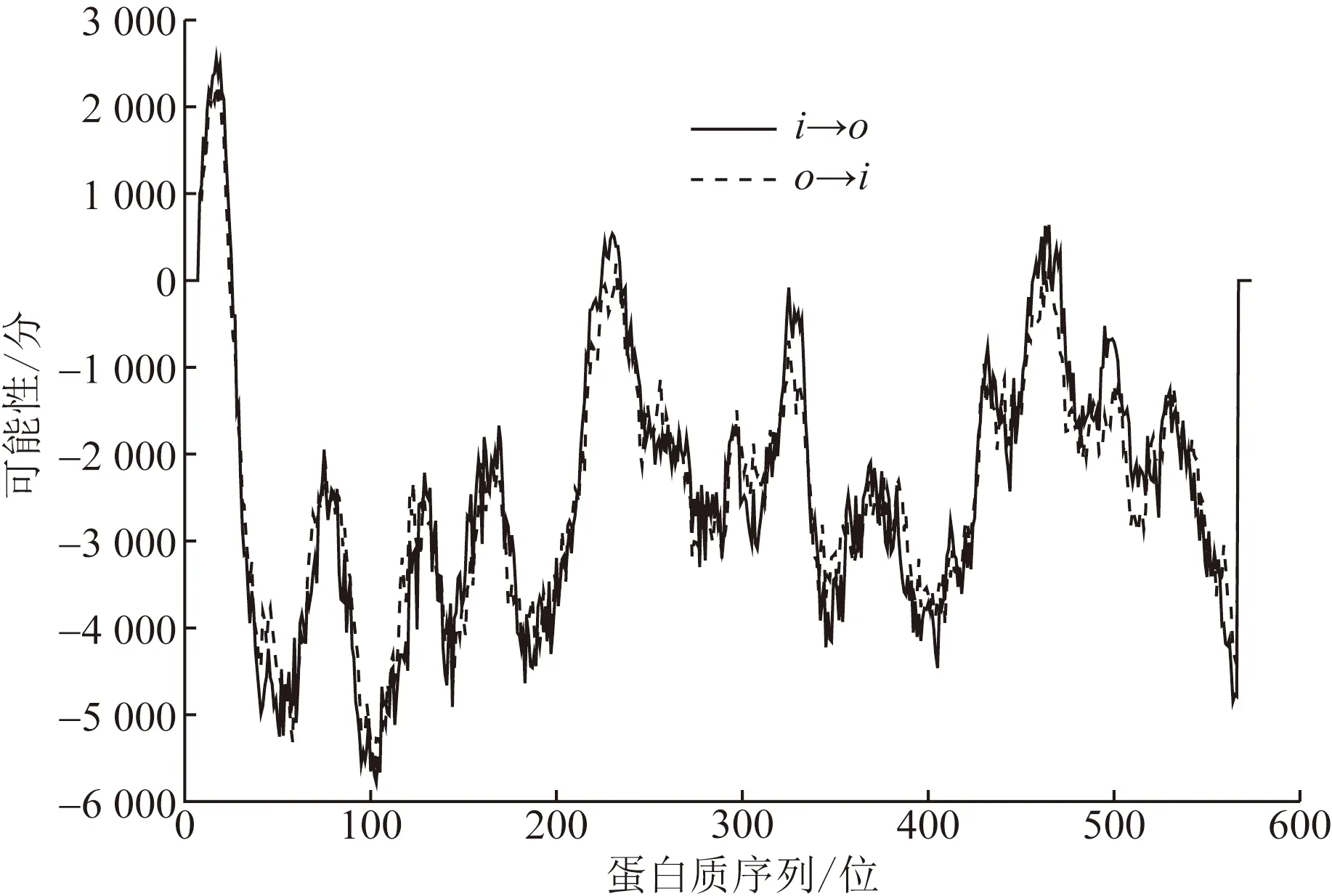
i→o为跨膜由内向外;o→i为跨膜由外向内图2 FUT8蛋白跨膜区段分析结果Fig.2 Analysis of transmembrane segment of FUT8 protein
2.4 FUT8蛋白的空间结构分析
使用Prabi网站旗下SOPMA工具得出结果如图3所示,该多肽链中α螺旋结构占48.00%,为最主要的结构元件,β片层占12.52%,β转角占4.35%,无规则卷曲占35.13%。而GOR4工具没有将β转角纳入考虑,认为在FUT8蛋白序列中α螺旋和β片层结构分别占32.17%和22.09%,无规则卷曲则占到了45.74%。

图3 FUT8蛋白分子二级结构分析Fig.3 Secondary structure analysis of protein FUT8
FUT8的三级结构如图4所示,共有4个结构域,分别为氨基端胞浆域、跨膜区、茎区以及羧基端催化域。
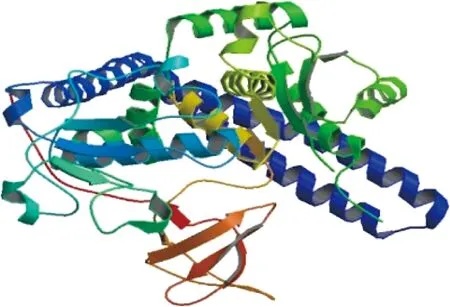
图4 蛋白质分子FUT8的三级结构Fig.4 Tertiary structure of protein molecule of FUT8 protein
2.5 蛋白的分子相互作用分析
FUT8与B4GALT3、B4GALT1、MGAT3、MGAT4D、MGAT2等有着密切的互相联系,如图5所示。
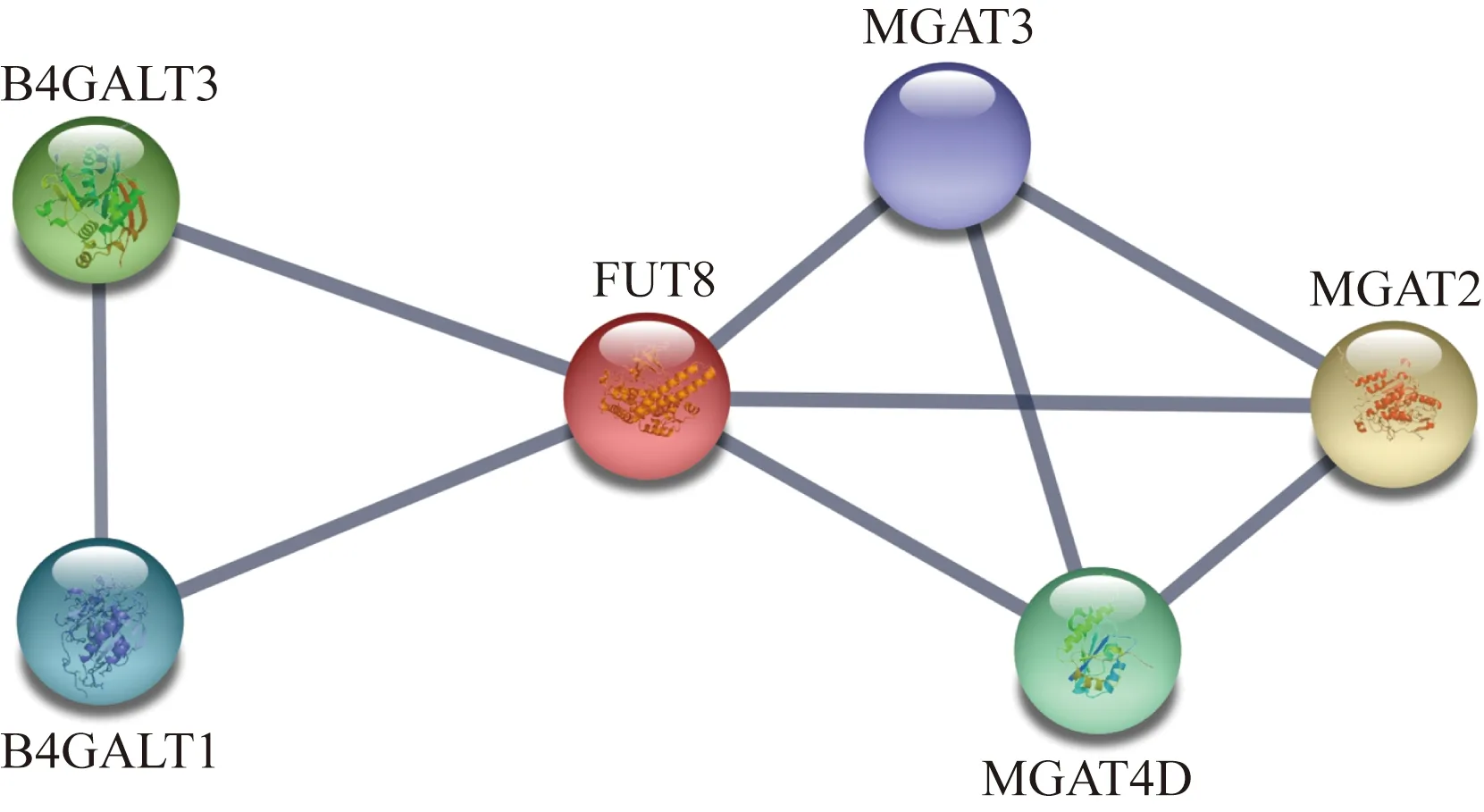
图5 FUT8蛋白分子相互作用关系Fig.5 Protein-protein interaction (PPI) of FUT8 protein
B4GALT3又称β-1,4-半乳糖基转移酶3,负责在多种糖蛋白以及糖脂的糖链部分中添加较为复杂的N-连接寡糖链。
B4GALT1又称β-1,4-半乳糖基转移酶1,在哺乳期乳腺腺泡细胞高尔基复合体中催化乳糖的产生,同时参与其他N-连接寡糖链的形成。
MGAT3又称β-1,6-N-乙酰氨基葡萄糖基转移酶3(GnT-Ⅲ),参与糖链的生物合成和调节,催化N-乙酰氨基葡萄糖添加到N-连接糖链的三甘露糖核心上形成β-1-4糖苷键。是糖蛋白生物合成调控过程中的最重要的酶之一。
MGAT4D又称α-1,3-甘露糖基糖蛋白4-β-N-乙酰氨基葡萄糖转移酶,属于糖基转移酶54家族。定位于高尔基体中,在精母细胞和精子中高表达。
MGAT2又称α-1,6-甘露糖基糖蛋白2-β-N-乙酰氨基葡萄糖转移酶或N-乙酰葡糖氨基转移酶Ⅱ,参与催化低聚甘露糖转化为复杂N-聚糖的关键步骤。
2.6 蛋白质通路分析
聚糖不是主要的基因产物,与蛋白质相比,它们的合成是在没有模板的情况下进行的。图6展示了核心岩藻糖生物合成的三个步骤,首先进行的是N-连接糖蛋白前体的合成,随后前体末端的几个糖基将被逐渐水解,并装配出糖链的核心结构,之后多种糖基转移酶相继将寡糖基转移至核心结构上从而使糖基得以延长。FUT8则将岩藻糖残基转移至糖链核心最内侧的N-乙酰氨基葡萄糖(GlcNAc)上,最终形成α-1,6-糖苷键。

图6 核心岩藻糖基化形成过程 Fig.6 Core fucosylation formation process
2.7 FUT8的序列比对及保守性分析
通过对蛋白序列的比对分析,发现其在不同物种间高度保守,图7和图8分别展示了FUT8的保守结构域和分子进化树。人与黑猩猩FUT8蛋白序列几乎完全相同,与大鼠、小鼠相似度高达96.7%和96.5%,与鸡、热带爪蟾及东方果蝇FUT8蛋白序列相似度分别为93.9%、90.1%和46.1%。

图7 FUT8蛋白序列保守位点Fig.7 Protein sequence conserved site of FUT8
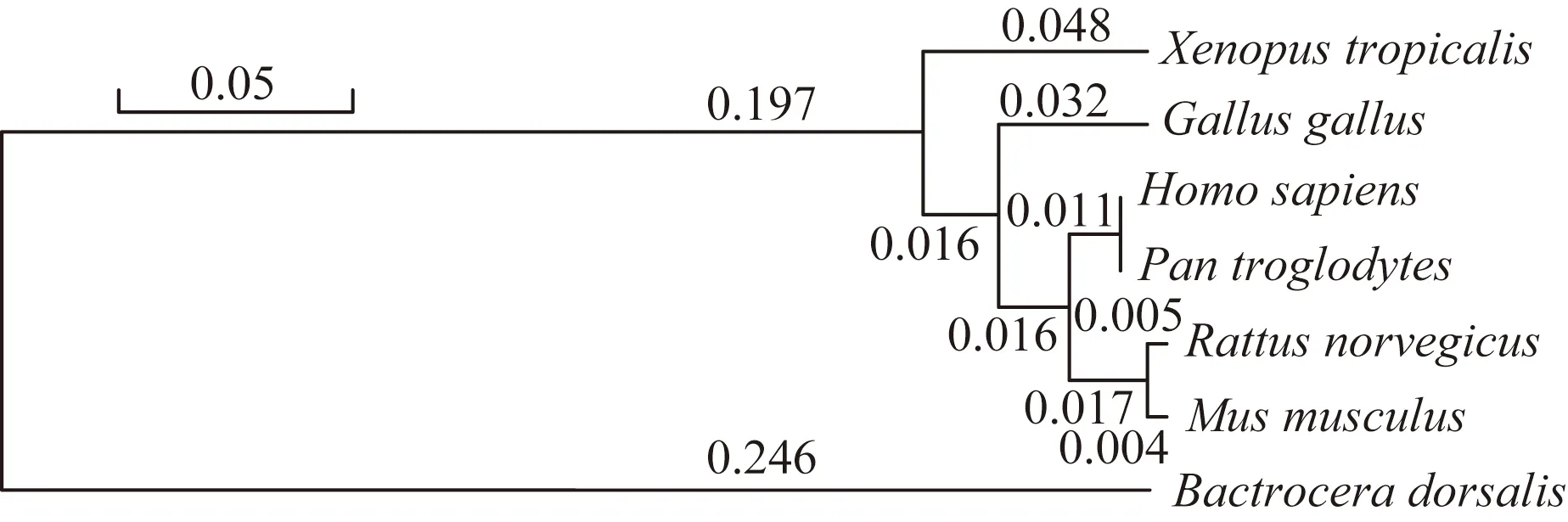
图8 FUT8蛋白分子进化树Fig.8 The phylogenetic tree of FUT8
3 讨论
FUT8是哺乳动物体内唯一的N-连接的核心岩藻糖基转移酶[13],本研究利用生物信息学分析方法,得知人fut8基因位于14号染色体长臂2区3带3亚带,编码序列共有外显子9个,转录产物共有剪接变异体5种,其中最主要的变体长度为3 895 bp,其翻译产物含氨基酸575个,为弱碱性、亲水性的蛋白质,细胞内不稳定,存在由内向外的跨膜区段,α螺旋是最主要的二级结构元件。序列比对发现,从非哺乳动物到人的不同物种中FUT8蛋白高度保守,且其在不同哺乳动物间的差别较其他岩藻糖转移酶小[14],因此推测FUT8较其他岩藻糖转移酶分化晚。
FUT8与多种蛋白质及受体相互作用,广泛参与调节细胞内的多种代谢及信息传递途径。蛋白分子的相互作用分析结果显示,FUT8与B4GALT1、B4GALT3,以及MGAT2、MGAT3、MGAT4D的作用密切相关。B4GALTs是一类进化保守的半乳糖基转移酶,作为穿膜蛋白定位于高尔基/反面高尔基网状结构,参与蛋白折叠、细胞相互作用和免疫抵抗等生物过程[15-16]。最近的研究发现,FUT8与B4GALT1都可以通过糖基化免疫球蛋白G(IgG)而调节其作用[17],具体机制还有待于进一步的实验验证;体外实验证下调FUT8的表达,同样可通过改变IgG的糖基化进而对炎症疾病产生影响[18]。MGAT2是三酰甘油在体内吸收和积累途径中的关键酶,此过程在肥胖及其相关疾病的发生中起重要作用[19];FUT8与MGAT2均参与尿素转运蛋白A-1(UT-A1)的糖基化,从而调节肾的尿素转运活性,与糖尿病人渗透性利尿症状的减轻有关[20]。MGAT3可以抑制上皮-间充质转化,从而抑制肿瘤的转移[21];FUT8和MGAT3的高表达均可易化急性髓性白血病细胞(KG1a细胞)对缺氧的敏感性而启动p53依赖性细胞凋亡[22]。全基因组关联分析也发现fut8和MGAT4D的编码基因mgat4d均与高血压的发生相关[23-24],提示这两者之间可能存在密切联系。这些结果表明,FUT8与B4GALTs、MGATs可能具有协同作用,具体机制还需要进一步的研究证明。
利用生物信息数据库及工具成功获取人FUT8蛋白的理化性质、理论跨膜域信息、立体结构,以及其与多种蛋白通路及其的相互作用网络,为深入未来进一步研究FUT8在肥胖及相关疾病、肿瘤转移、炎症及免疫和造血异常中的作用提供重要的理论依据。
