硼酸化量子点荧光微球免疫层析试纸条定量检测甲胎蛋白
2021-11-22郭徐静武敬宇熊勇华
林 童,郭徐静,武敬宇,熊勇华,郭 亮
(南昌大学中德联合研究院,江西 南昌 330047)
基于纳米材料的免疫检测探针因优异的信号输出能力在分析测试领域已被广泛应用[1-3]。充分暴露纳米材料表面抗体的抗原结合区Fab片段有利于免疫探针捕获抗原,提高免疫检测性能。目前,在纳米粒子表面固定抗体的方法有物理吸附法、共价偶联法和生物亲和法等。其中,物理吸附法[4-5]相对简单。但是使用该方法制备的抗体-纳米颗粒复合物不稳定,重复性差,且抗体在纳米粒子表面无法定向。生物亲和法是通过亲和素-生物素系统或抗体结合蛋白介导的偶联方式。其偶联产物的稳定性虽优于物理吸附,但所用蛋白价格昂贵。共价偶联法可形成稳定的抗体-纳米颗粒复合物,有效避免抗体在检测及储存过程中脱落,且无需使用额外的结合蛋白。利用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺(EDC)活化羧基使纳米粒子与抗体间通过酰胺键连接是最为常用的共价偶联方法[6-7]。然而由于抗体中广泛分布氨基和羧基,使抗体与纳米材料的结合不是位点特异性的,导致抗体在纳米粒子表面仍是随机取向。由于无法充分暴露Fab片段,该方法制备的复合物表面的有效抗体数不足4%[8]。同时,通过酰胺键连接抗体还可能导致抗体自交联,由此形成的多层抗体可产生空间位阻效应,使抗体的抗原结合能力进一步降低。IgG是一种糖基化蛋白,其恒定区Fc片段具有寡糖链。因此通过氧化Fc片段上的碳水化合物可获得醛基[9],从而可与氨基修饰的纳米粒子实现位点特异性的共价偶联。然而,其氧化反应及醛基氨基偶联步骤易破坏抗体天然构象,降低抗体活性。另一种相对简单的位点特异性抗体偶联策略是在纳米粒子表面修饰可特异性结合Fc片段的蛋白[10],如蛋白A、蛋白G和Fc受体。但是这种结合是非共价偶联,且此类结合蛋白价格昂贵,使检测成本增加。
硼酸在适当的pH条件下可以与含顺式二醇的分子,如糖类和糖蛋白等,快速形成稳定的环状酯。因此,表面修饰硼酸基团的各类材料最初被广泛应用于捕获糖蛋白及构建糖蛋白传感器[11]。此后,Lin等[12]制备硼酸功能化磁珠并利用抗体Fc片段上的寡糖和硼酸间的亲和作用在其表面定向结合抗体,用于捕获富集相应抗原。与表面抗体非定向偶联的磁珠相比,其提取效率可提高5倍。该研究使硼酸化纳米材料的应用拓展至不含糖的靶标的捕获,如药物[13]、毒素[14]等。近年来,硼酸介导的抗体固定化在相应抗原的免疫法检测中也开始有所应用。例如,Zeininger等人[15]在硼酸化的直径为100 μm的荧光液滴表面偶联肠道沙门氏菌抗体,利用抗体与沙门氏菌结合后液滴荧光的变化进行检测。Wang等人[16]则在硼酸化的荧光氮化碳纳米片表面偶联抗体,利用抗体与抗原结合后氮化碳纳米片荧光的变化检测多种生物标志物。本研究在合成硼酸修饰的聚马来酸酐-alt-1-十八碳烯(PBA-PMAO)的基础上,采用超声乳化法制备表面硼酸改性的量子点荧光微球(PBA-QBs),并将其与甲胎蛋白(AFP)单克隆抗体结合制备高抗体活性的荧光检测探针用于定量免疫层析检测AFP。
1 实验部分
1.1 试剂与仪器
CdSe/ZnS量子点,美国Ocean NanoTech公司;十二烷基磺酸钠(SDS)、聚马来酸酐-alt-1-十八烯(PMAO,MW=30000-50000),美国Sigma公司; 3-氨基苯硼酸 (3-APBA)、4-二甲基氨基吡啶(DMAP),上海Aladdin公司;山羊抗IgG抗体,重庆欣源佳和生物科技有限公司;AFP标准品、一对抗AFP单克隆抗体(标记与包被),上海经科化学科技有限公司。硝酸纤维素膜(NC膜)、吸水纸、PVC粘性底板,上海捷宁生物技术有限公司;其他化学品均为分析级。AFP阴性人血清样品由江西省第一人民医院医院提供。
UNICELL干式荧光免疫分析仪,亚辉龙生物科技股份有限公司;F-4500荧光分光光度计,日立公司;电热恒温鼓风干燥箱,上海福玛实验设备有限公司;可编程切条机、HGS510划膜喷金机,杭州峰航科学仪器有限公司;TGL-16型高速冷冻离心机,湖南湘仪离心机仪器有限公司;粒度与Zeta电位分析仪,马尔文公司;超纯水仪,Millipore公司;JEOL JEM 2100型透射电镜,JEOL公司;分析天平,梅特勒-托利公司;ZF-2型三用紫外仪,上海市安亭电子仪器厂。
1.2 PBA-PMAO的合成
用15 mL三氯甲烷充分溶解350.0 mg PMAO、136.9 mg 3-APBA和122.0 mg DMAP后,将溶液转至圆底烧瓶并置于50 ℃油浴中匀速搅拌反应24 h。反应结束后,将反应液快速冷却至室温,向其中加入60 mL pH=5.0的硫酸氢钾水溶液,充分振荡,4 ℃、10 000 r·min-1离心10 min。离心结束后,去除上层水相,用移液枪吸取下层油相转移至新离心管中,重复洗涤3次。随后将油相置于含15 mL超纯水的圆底烧瓶中,25 ℃减压旋转蒸发至不再析出白色固体。旋蒸产物经减压过滤后,将白色固体转至洁净、干燥的玻璃培养皿中,置于60℃烘箱中干燥12 h,即可得到PBA-PMAO。
1.3 PBA-QBs的合成
PBA-QBs的合成采用微乳液法[17]。将5 mg量子点和10 mg PBA-PMAO充分溶解于110 μL三氯甲烷中,再向其中加入250 μL一定浓度的SDS水溶液,充分振荡混匀。混合液用细胞破碎仪超声乳化后(超声条件:超声总时间2 min;运行时间10 s;暂停时间5 s;超声功率 80 W),将微乳液置于60 ℃水浴加热4 h除去三氯甲烷。PBA-QBs悬液离心15 min后,将沉淀重悬于于1 mL碱水(pH=10)中,振荡水解过夜。最后将悬液离心除去上清,用超纯水重复洗涤PBA-QBs 2次后复溶至1 mL超纯水中,置于4 ℃保存备用。
1.4 PBA-QB免疫探针的制备
将0.6 mg PBA-QBs、45 μg抗AFP单克隆抗体(标记)及4 mL pH=7的 0.01 M PB缓冲液充分混匀,室温搅拌反应5 min。加入0.2 mg葡萄糖,封闭反应3 min后以13 500 r·min-1的转速离心15 min,沉淀复溶于2 mL PB复溶液中(含0.01M pH 7.4 PB缓冲液,含0.1% NaN3(w/v)),4 ℃保存备用。
1.5 PBA-QBs荧光试纸条的制备及免疫层析检测流程
PBA-QBs荧光试纸条的制备[18]过程如下:将1.5 mg·mL-1的抗AFP单克隆抗体(包被)、1.0 mg·mL-1羊抗鼠IgG抗体以6 mm 的距离喷分别涂于NC膜上做为检测AFP的检测线(T线)与质控线(C线 );随后将NC膜置于电热恒温鼓风干燥箱中37 ℃干燥12 h;最后将制备好的NC膜、样本垫、吸水纸依次黏贴于PVC 底板上,再使用可编程切条机将其切割为宽度3.9 mm的成品试纸条,室温密封干燥保存备用。
样品中AFP的检测流程如下:将2 μL PBA-QB免疫检测探针与68 μL AFP样本溶液充分混合孵育5 min后,加入到试纸条的样品孔中,室温层析20 min后用干式荧光免疫分析仪读取其T线荧光强度(FIT)、C线荧光强度(FIC)。
免疫层析检测原理如图1所示:当样本溶液中含有AFP时,PBA-QB免疫探针与AFP结合形成的免疫复合物,随溶液在NC膜中向前涌动至试纸条T线,并与固定在T线上的抗AFP单克隆抗体(包被)结合形成双抗夹心免疫复合物,使T线区域显现荧光;而当样本溶液中不含AFP时,PBA-QB免疫检测探针不会被T线上的抗AFP单克隆抗体(包被)捕获,无法形成夹心免疫复合物,T线区域无荧光;无论样本溶液中是否含有AFP,未被T线捕获的PBA-QB免疫检测探针均会继续向前迁移至C线区域,并被C线上的羊抗鼠IgG抗体捕获产生荧光。若C线无荧光条带产生,则说明该检测结果无效。
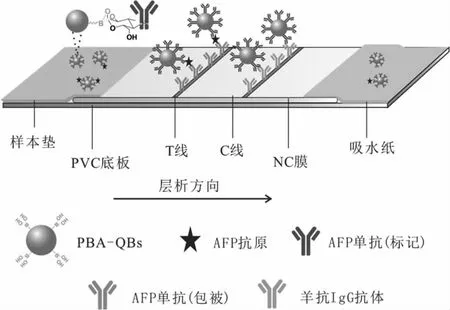
图1 PBA-QBs荧光免疫层析试纸条检测AFP的原理图
1.5 PBA-QBs荧光试纸条标准曲线的建立
通过倍比稀释法将AFP标准品从250 ng mL-1稀释至0.98 ng mL-1,用PBA-QBs荧光试纸条检测各浓度的标准品溶液,每个浓度重复检测3次,在最佳读取时间记录FIT与FIC。以AFP浓度为横坐标,FIT/FIC值为纵坐标,绘制检测AFP的标准曲线。将20个阴性样本(AFP浓度为:0 ng·mL-1)的FIT/FIC值的平均值加上其3倍标准偏差(SD)带入标准方程中,以计算出的AFP浓度作为最低检测限。
1.6 PBA-QBs荧光试纸条性能评价
将经化学发光法测定为AFP阴性的血清样品用PBS缓冲液(pH=7.4)稀释10倍。取3份上述血清稀释液,向其中添加不同量的AFP标准品制备浓度分别为10,4和1 ng mL-1的加标血清样品。在一天内,使用同一批次试纸条检测以上加标样品,每个浓度重复检测5次,计算回收率与变异系数,评价检测的准确度和批内稳定性;按上述方法重复检测3天,计算回收率与变异系数,评价检测的准确度和批间稳定性。将制备好的PBA-QBs荧光试纸条用铝箔进行单个塑封,隔绝光线以及防止空气湿度的变化,置于25 ℃恒温培养箱中保存。每隔7 d测定1次HBsAg阳性样品(200 ng mL-1),连续测定56 d,记录试纸条的FIT/FIC值,以评价PBA-QBs荧光试纸条的稳定性。
2 结果与讨论
2.1 PBA-PMAO的表征
PBA-PMAO合成的原理如图2所示。PBA的氨基作为亲核基团进攻PMAO中酸酐基团的羰基碳,形成酰胺键和游离的羧基。合成产物的傅里叶变换红外光谱(FTIR)如图3所示:2 925和2 853 cm-1峰是-CH2中的C-H伸缩振动峰;1 650 cm-1为酰胺(-CONH-)Ⅰ带中C=O伸缩振动峰;1 552 cm-1峰为酰胺Ⅱ带中C-N伸缩振动和N-H弯曲振动耦合形成的特征吸收峰;1 343,1 188和1 028 cm-1峰分别为硼酸基团(-B(OH)2)中的B-O伸缩振动峰、B-O-H弯曲振动峰和C-B伸缩振动峰[19]。由上可知,产物分子中含有酰胺键和苯硼酸基团,表明PBA-PMAO成功合成。
2.2 PBA-QBs的表征
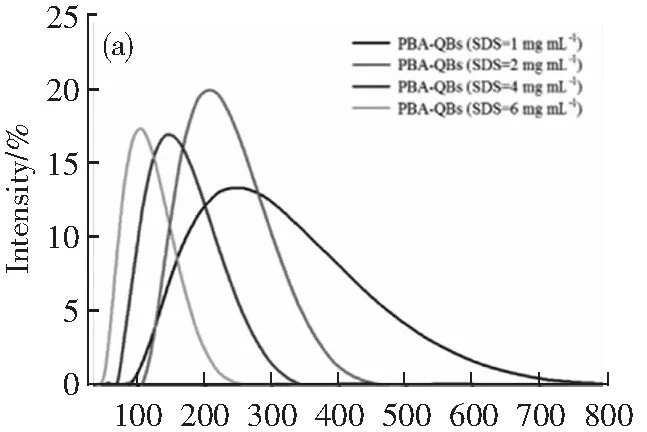
通过调节SDS的浓度制备不同粒径的PBA-QBs。如图4a所示,当SDS浓度为1,2,4和6 mg·mL-1时,PBA-QBs的水化粒径分别为239.1,202.5,139.8和98.8 nm,多分散指数(PDI)分别为0.181,0.106,0.084和0.086。在同等质量浓度下,以波长为365 nm的激发光激发,其荧光强度(发射波长:618 nm)分别为2 994,2 883,2 427和1 593(图4b)。由于大粒径的QBs粒径分布相对不均一且可能产生相对较强的检测背景信号[20],而小粒径QBs因荧光强度低不利于提高检测灵敏度,因此本实验选择使用水化粒径为202.5 nm的PBA-QBs制备免疫探针。其透射电镜图显示(图4c),制备的PBA-QBs成规则的球形,且粒径分布较均匀;单个粒子的高分辨率透射电镜图显示,大量油溶性CdTe /ZnSe 量子点紧密的包埋于聚合物中。

图2 PBA-PMAO的合成

λ/cm-1图3 PBA-PMAO的红外图谱
Sizc/nm

λ/nm
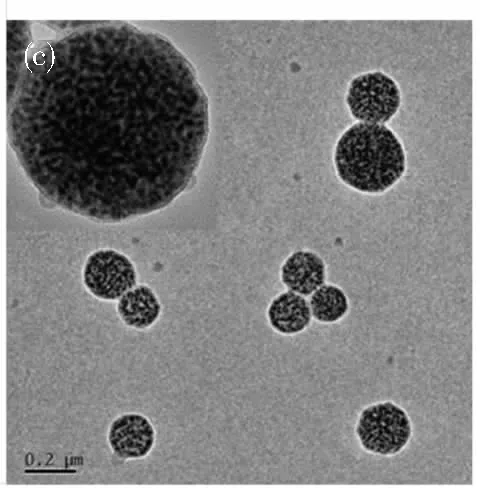
图4 使用不同浓度SDS溶液制备时PBA-QBs的水化粒径(a)与荧光图谱(b); 使用2 mg mL-1SDS溶液制备的PBA-QBs的透射电镜图(c)
2.3 PBA-QB免疫探针的合成及表征
2.3.1 偶联缓冲液pH的优化
pH是决定硼酸与含顺式二醇生物分子结合稳定性的最重要因素。当pH<硼酸pKa时,硼酸构型趋向平面三角型(sp2杂化),与顺式二醇之间的结合有限;当pH>硼酸pKa时,硼酸构型趋向四面体型(sp3杂化),可与顺式二醇之间形成稳定五元或六元环状酯。由于传统的硼酸材料pKa值相对较高(如氨基苯硼酸[21],pKa=8.8),其与IgG抗体结合通常需要一个偏碱性的pH值。而生物样品的pH值一般在4.5~8.0之间,这会降低偶联物在待测样品中的稳定性。本研究制备的PBA-PMAO(图5a)是一种wulff型硼酸[22](O→B),可降低PBA的pKa,使其硼酸基团在较低的pH下即可与抗体上糖基结合,从而避免偶联过程中抗体失活及检测时抗体脱落。
在不同pH的缓冲液中偶联PBA-QB和AFP单抗制备免疫探针并将其用于AFP溶液检测,优化实验均重复检测3次并计算标准偏差,依据FIT值的大小评价偶联效率。从图5b可知,随着缓冲溶液pH值的升高,其FIT值逐渐增大;当pH=7时,FIT达到最大值。其原因可能是pH=7时硼酸基团的构型趋向四面体型,同时缓冲液pH值接近AFP单抗的等电点[23](IgG的pI= 6.95),抗体带电量较低,与硼酸间的静电斥力较弱,利于抗体吸附在PBA-QBs表面并与硼酸结合。而当pH值大于7时,FIT逐渐降低。其原因可能是溶液pH值大于抗体的等电点时,均带负电的抗体与PBA-QBs发生静电排斥,降低了抗体在微球表面的可及性,不利于与硼酸的共价结合。因此,选择pH7做为最佳偶联pH。
2.3.2 抗体添加量的优化
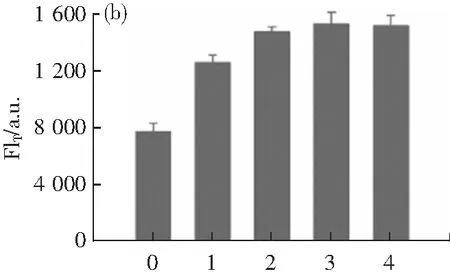
使用不同量的AFP单抗在pH 7的缓冲液中偶联PBA-QB制备免疫探针,并将其用于AFP溶液检测,各实验均重复3次并计算标准偏差,依据FIT值的大小考察抗体最佳用量,结果如图5c所示。当AFP单抗添加量从15增加至 75 μg mg-1时,试纸条FIT逐渐上升;当进一步增加抗体用量时,FIT反而降低。其原因可能是当固定在QBs表面的抗体密度过高时,抗体间相互挤压导致其天然构象破坏或产生空间位阻效应。因此,选择75 μg·mg-1作为最佳抗体添加浓度。
2.3.3 PBA-QB免疫探针表征
在最佳pH值和最佳抗体用量条件下制备免疫探针并表征其水化粒径、Zeta电位及荧光图谱。表征结果如图6a与6b所示,抗AFP单克隆抗体(标记)与PBA-QBs偶联后,其平均水化粒径从202.5增大至225.4 nm,Zeta电位从-47.9 mV上升为-39.7 mV,表明AFP单抗成功偶联至PBA-QBs表面。由荧光发射光谱图(图6c)可知,偶联抗体前后PBA-QBs的荧光峰型和荧光强度均基本一致,表明所制备的探针具有良好的荧光特性。
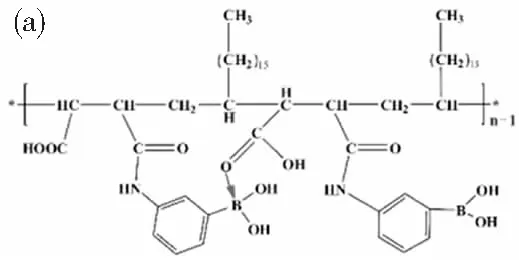
(a)PBA-PMAO中的wulff型硼酸
pH(b)偶联缓冲液pH对FIT的影响

Amount of added AFP mAb/(μg mg-1) (c)抗体添加量对FIT的影响图5 免疫探针制备条件优化
λ/nm
Zeta Potcntial/mV
λ/nm图6 PBA-QBs与抗体偶联前后的水化粒径(a)、Zeta电位(b)及荧光图谱(c)
2.4 PBA-QBs荧光试纸条优化
PBA-QBs荧光试纸条T线上AFP单克隆抗体(包被)喷涂浓度和探针用量是影响试纸条灵敏度的关键参数。在不同喷涂浓度和探针用量下检测AFP溶液,各实验均重复3次并计算标准偏差,依据FIT值的大小进行优化。从图7a可知,当T线上AFP单克隆抗体喷涂浓度从0.5 mg mL-1提高至1.5 mg mL-1时,FIT随之升高;但当浓度高于1.5 mg mL-1时,FIT基本无变化。图7b表明,当PBA-QB免疫探针的用量从0.5增加至2 μL时,FIT随之升高;但当用量大于2 μL时,FIT基本无变化。因此,本实验试纸条制备时,T线AFP单克隆抗体(包被)浓度为1.5 mg mL-1,PBA-QBs探针用量为2 μL。
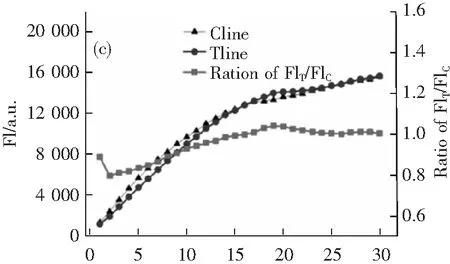
免疫层析时间是影响荧光试纸条定量分析的重要因素之一。因此需要通过建立FIT、FIC和FIT/FIC与免疫层析时间的反应动力学曲线,确定最佳免疫层析时间。如图7c所示,随着免疫层析时间的延长,FIT、FIC及FIT/FIC值持续增大,且FIT、FIC值在30 min内仍未达到稳定值;而 FIT/FIC比值在层析20 min 后即趋于稳定,并且在后 20 min内比值无明显变化。因此PBA-QBs荧光试纸条检测AFP最佳定量判读时间为20 min。
2.5 PBA-QBs荧光试纸条检测AFP的标准曲线
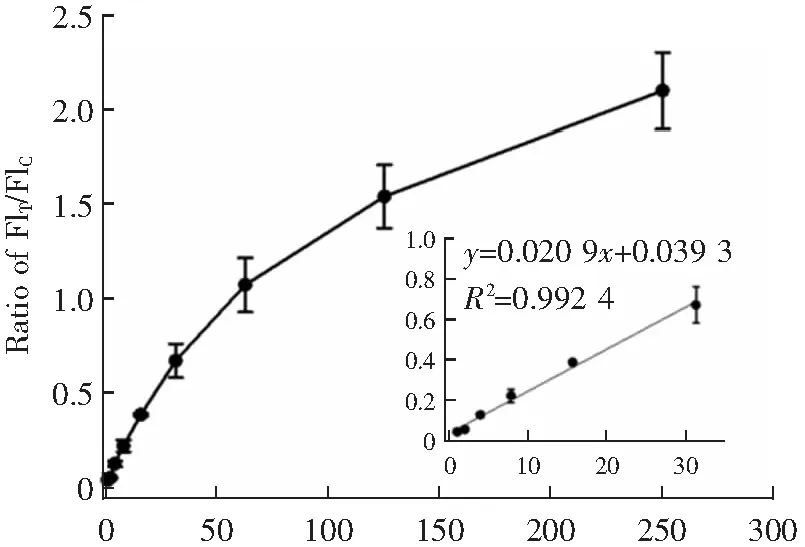
PBA-QBs荧光免疫层析试纸条检测AFP的标准曲线如图8所示。在浓度为0.98~31.25 ng mL-1的范围内,FIT/FIC值随AFP浓度的增加而线

Concentration of AFP mAbs on T line/(mg·mL-1)(a)T线上AFP抗体(包被)喷涂浓度对FIT的影响
Volume of PBA-QB probes/μL(b)PBA-QB免疫探针用量对FIT的影响
t/min(c)PBA-QBs荧光试纸条FIT、FIC和FIT/FIC的免疫动力学曲线图7 试纸条制备及检测条件优化
AFP concentration/(ng·mL-1)图8 PBA-QBs 荧光试纸条定量检测AFP的标准曲线
性增大。其线性方程为y=0.020 9x+0.039 3(R2=0.992 4),最低检测限(LOD)为0.45 ng mL-1,表明PBA-QBs荧光试纸条对AFP具有优异的检测性能。
2.6 PBA-QBs荧光试纸条准确性评价
批内、批间加标实验结果如表1所示,PBA-QBs荧光试纸条检测AFP的批内回收率介于91.0%~106.6%之间,CV值介于3.65%~6.92%之间;批间回收率介于91.2%~107.1%之间,CV值介于4.75%~ 10.42%之间。该结果表明,本研究建立的PBA-QBs荧光试纸条检测AFP的方法具有良好的准确性和精密度。PBA-QBs荧光试纸条稳定性测试结果表明,测试期间试纸条的FIT/FIC值稳定(CV<4.3%),说明该试纸条有较好的检测稳定性。
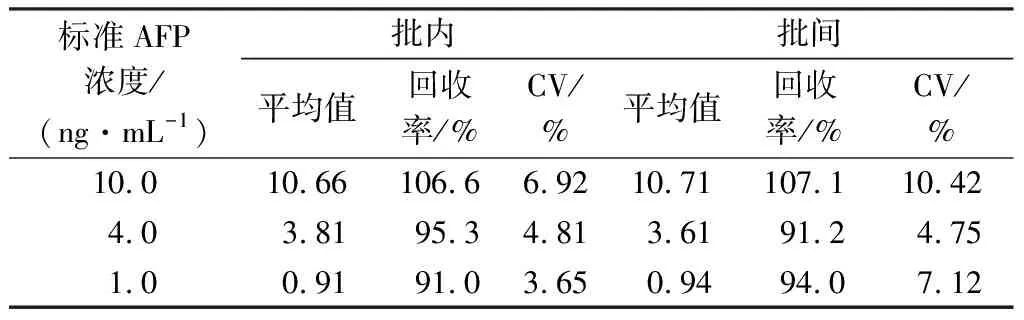
表1 血清加标回收实验结果
3 结论
本研究建立了一种简单的基于PBA-PMAO的表面硼酸功能化PBA-QBs的制备方法。该微球既可与抗体简便、快速地定向偶联,又因量子点含量高而具有很强的荧光信号,是一种优良的免疫探针制备材料。将其与AFP单克隆抗体结合制备高抗体活性的荧光免疫层析检测探针用于定量检测血清中的AFP,效果良好。
