Shh信号通路对宫颈癌细胞增殖与凋亡影响的机制研究
2021-11-22邵帅朱清刘洁
邵帅,朱清,刘洁
1.荆门市第二人民医院生殖医学中心,湖北 荆门 448000;
2.广州医科大学附属第二医院康复科,广东 广州 511436;
3.荆门市第二人民医院病理科,湖北 荆门 448000
宫颈癌是一种常见的恶性肿瘤,影响着全球数百万妇女的生活。据报道宫颈癌是女性第4常见癌症,在南非、印度、中国和巴西等中低收入国家尤其常见,2018年宫颈癌新增人数大约570 000人,死亡约311 000人[1],84%的新病例以及87%~90%的死亡率发生在中低收入国家。尽管如此,与发达国家的妇女相比,中低收入国家的妇女死于宫颈癌年龄普遍偏低[2-3]。宫颈癌已经严重威胁女性的健康和生命,宫颈癌的防治已经显得极其重要。尽管近年来治疗技术不断改进,但手术、化疗以及放疗仍有很多的局限性,因此,从机制上研究宫颈癌的预防和治疗更为迫切。
研究发现Sonic hedgehog(Shh)信号通路与癌症的发生发展紧密相关,并且与宫颈癌也存在着关联。Shh信号通路的上游部分在宫颈癌细胞系中稳定表达,而且在上皮间质转化中Shh信号通路的激活可以调节宫颈癌干细胞的特性[4];SGLT2抑制剂也可以通过激活AMPK调节Shh表达,抑制宫颈癌细胞迁移,诱导细胞凋亡[5]。本课题组前期研究发现Cyclopamine抑制Shh通路能够抑制宫颈癌细胞的增殖、促进凋亡[6],但具体机制尚不明确,需要进一步研究。近年来有研究显示二甲双胍在宫颈癌细胞中能够激活AMPK/p53轴和抑制PI3K/AKT信号,诱导宫颈癌细胞凋亡并抑制迁移[7];miR-214通过调控PI3K/AKT/mTOR信号通路对宫颈癌细胞增殖、凋亡和侵袭的影响[8]。除此之外,报道也显示PI3K/Akt信号通路通过下调Shh-Gli1信号参与抑制SASH1诱导的肝癌细胞侵袭转移[9],Shh信号通路也可以通过PI3K/AKt信号通路来调节缺氧诱导的H9C2心肌细胞的凋亡[10]。鉴于Shh、PI3K/AKt信号通路以及宫颈癌之间的相互作用,因此,本文主要探讨Shh信号通路对宫颈癌细胞的增殖和凋亡作用是否与PI3K/AKt通路有关。
1 材料与方法
1.1 材料 宫颈癌海拉细胞(Hela)来自广州医科大学,RPMI-1640培养基、青-链霉素、胎牛血清、0.25%胰蛋白酶来自GIBCO公司(美国);Purmorphamine来自Santa Cruz公司(美国);LY294002来自CST公司(美国);Trizol来自Invitrogen公司(美国);荧光定量PCR试剂盒、RT-PCR反转录试剂盒、RNase-free H2O来自大连TaKaRa公司(中国);MTT检测试剂盒、半胱氨酸蛋白酶-3(Caspase-3)和半胱氨酸蛋白酶-9(Caspase-9)活性检测试剂盒来自碧云天公司(中国);抗体AKt、Bax、P-AKt、Bcl-2来自Abcam公司(英国);β-acting、HRP-山羊抗兔来自中杉金桥生物技术有限公司(中国)。
1.2 方法
1.2.1 Hela细胞培养 将Hela细胞培养于含有10%胎牛血清和100 U/mL双抗的RPMI-1640培养液中,将接种Hela细胞的培养皿放于通有5%CO2、37℃的CO2培养箱中培养,每天更换新的培养液,待细胞贴壁生长到70%~80%进行消化传代,进行下述实验。
1.2.2 Hela细胞分组及处理 将1.2.1培养的Hela细胞消化传代时,以1×105/mL接种于含有2 mL培养液6孔板中进行培养。实验分为对照组、Shh组、Shh+LY294002(LY)组、LY组。Shh组添加2μmol Purmorphamine(Pur)孵育24 h;Shh+LY组经Pur处理前半小时添加20μmol LY294002处理;LY组则添加20μmol LY294002处理孵育;对照组则加入等量的生理盐水。
1.2.3 实时荧光定量PCR检测 按1.2.2中Hela细胞分组及处理后,Trizol手提法对各组细胞总RNA进行提取,提取完毕加入RNase-free水进行溶解,通过NanoDrop-1000分光光度计对RNA纯度进行检测(OD260/280为1.8~2.0表示合格)。将合格的RNA按反转录试剂盒说明逆转录为cDNA,以cDNA为模板,添加下表中的Smo、Gli1、β-actin引物扩增基因,ABI 7500仪器进行检测7次跨膜蛋白(Smo)、Gli家族锌指蛋白-1(Gli1)mRNA表达水平。每组实验均重复3次。引物由invitrogen公司合成,见表1。

表1 相关引物序列
1.2.4 MTT检测细胞抑制率 将Hela细胞以1×104/的细胞接种于含有100μL的96孔板中,按1.2.2中Hela细胞分组及处理后,孔板边缘用PBS填充,每组6个重复,置于37℃、5%CO2的培养箱中培养,24 h后加入20μL MTT溶液(5μg/mL),培养4 h后加入DMSO 150μL振荡15 min,以490 nm波长测定吸光度OD值。
1.2.5 Caspase-3和Caspase-9活性检测 Hela细胞按上述1.2.2方法培养和处理细胞后,去掉培养液,用PBS清洗两次,胰蛋白酶消化收集各组细胞,每孔加150μL RIPA裂解液充分裂解细胞,冰浴裂解30 min,若裂解不充分可通过超声波震碎,裂解完全后12 000 r/min、4℃条件下离心10 min收集EP管中上清液。根据检测试剂盒说明,以405 nm波长测定吸光度OD值。
1.2.6 Western blot检测B细胞淋巴瘤-2基因(Bcl-2)和Bcl-2相关X蛋白(Bax)蛋白表达 Hela细胞按上述1.2.2方法培养和处理细胞,去掉培养液,用PBS清洗两次,胰蛋白酶消化收集各组细胞,每孔加150μL RIPA裂解液充分裂解细胞,若裂解不充分可通过超声波震碎,裂解完全后BCA法检测蛋白浓度,与5×Loading Buffer混合后煮沸10 min,加样,各组取40μg蛋白样品于聚丙烯酰胺凝胶电泳,然后275 mA电流2 h将蛋白转印至PVDF膜,待蛋白Mark分散开来,根据Mark蛋白分子指示裁剪相关PVDF膜,将各PVDF膜分别置于孵育盒中,分别加入对应的AKt、P-AKt、Bax、Bcl-2、β-actin抗体(1:1 000),孵育盒置于4℃冰箱水平摇床上过夜;取出后待孵育盒恢复到室温,使用TBST洗涤三遍后,HRP-山羊抗兔抗体室温孵育2 h,化学发光显影。
1.3 统计学方法 应用SPSS13.0软件进行数据统计学分析,计量数据以均数±标准差(±s)表示,两均数间比较采用独立样本t检验,多组间比较均采用ANOVA单因素方差分析,两两比较采用LSD-t法。以P<0.05为差异具有统计学意义。
2 结果
2.1 Pur对Shh信号通路的影响 与对照组比较,Shh组能够明显增加Shh信号通路分子Smo和Gli1 mRNA表达量,差异有显著统计学意义(P<0.01),见表2。
表2 Pur对Shh信号通路的表达影响(±s)

表2 Pur对Shh信号通路的表达影响(±s)
组别对照组Shh组t值P值Smo mRNA 1.00±0.098 2.23±0.105-14.836 0.001 Gli1 mRNA 1.00±0.087 1.99±0.041-17.809 0.001
2.2 LY294002对PI3K/AKt信号通路的影响 与对照组比较,Shh组够上调P-AKt表达量以及P-AKt/AKt比值,LY294002能够下调P-AKt表达量以及P-AKt/AKt比值,差异均有显著统计学意义(P<0.01);与Shh组比较,LY294002能够抑制Pur的上调P-AKt表达量以及P-AKt/AKt比值,差异均有显著统计学意义(P<0.01);与其他各组比较,LY组P-AKt表达量以及P-AKt/AKt比值明显下降,差异均有显著统计学意义(P<0.01),见图1和表3。

图1 四组AKt、P-AKt蛋白的表达水平

images/BZ_9_1271_230_2269_264.pngP-AKt/AKt 1.00±0.058 1.66±0.045a 1.34±0.031c 0.77±0.025b 100.725 0.001组别对照组Shh组Shh+LY组LY组F值P值AKt 1.00±0.053 0.90±0.060 0.98±0.068 1.03±0.042 0.961 0.457 P-AKt 1.00±0.058 1.52±0.045a 1.28±0.031c 0.83±0.025b 91.863 0.001注:与对照组比较,a P<0.01,b P<0.05;与Shh组比较,c P<0.01。
2.3 LY294002对Hela细胞增殖的影响 MTT检测结果显示:与对照组比较,Shh组中Hela细胞的增殖明显,差异有显著统计学意义(P<0.01);与Shh组比较,Shh+LY组中Shh信号诱导Hela细胞的增殖明显受到LY294002抑制,差异有显著统计学意义(P<0.01);与Control组、Shh组以及Shh+LY组比较,LY组能够明显抑制Hela细胞的增殖,差异有显著统计学意义(P<0.01),见表4。
表4 LY294002对Hela细胞增殖的影响(±s)

表4 LY294002对Hela细胞增殖的影响(±s)
注:与对照组比较,a P<0.01,b P<0.05;与Shh组比较,c P<0.01。
存活率(%)100±10.1 128±11.1a 113±9.5c 081±8.1b 57.126 0.001组别对照组Shh组Shh+LY组LY组F值P值
2.4 LY294002对Caspase-3和Caspase-9表达的影响 Elisa检测结果显示:与对照组比较,Shh组激活Shh信号通路能够抑制Caspase-3和Caspase-9表达,差异有显著统计学意义(P<0.01);与Shh组比较,Shh+LY组中抑制PI3K/AKt信号通路能够缓解Shh信号诱导Caspase-3和Caspase-9的抑制作用,差异有显著统计学意义(P<0.01);与对照组比较,LY组能够促进Caspase-3和Caspase-9表达,差异有统计学意义(P<0.05);与Shh组和Shh+LY组比较,LY组能够明显促进Caspase-3和Caspase-9表达,差异有显著统计学意义(P<0.01),见表5。
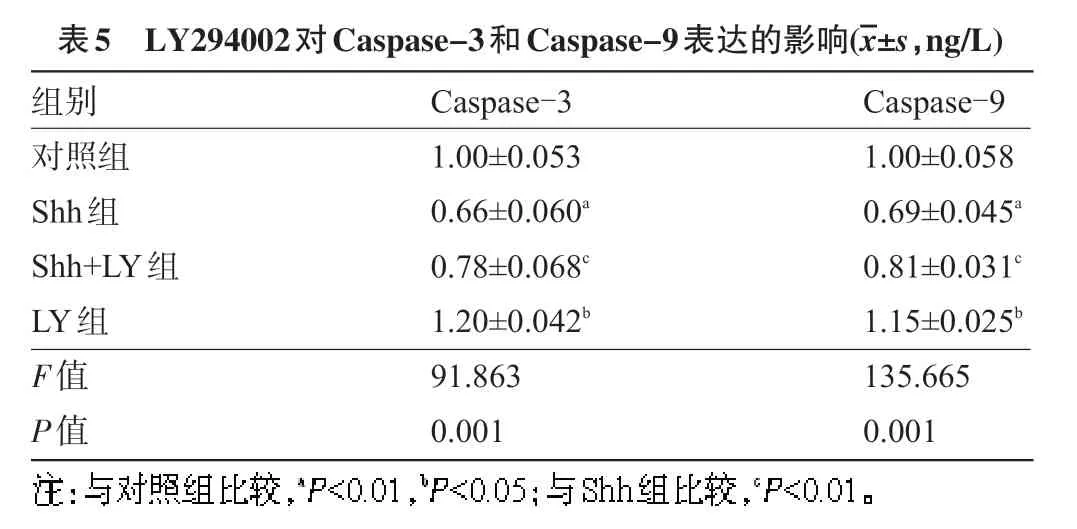
表5 LY294002对Caspase-3和Caspase-9表达的影响(images/BZ_37_1351_1170_1373_1213.png±s,ng/L)组别对照组Shh组Shh+LY组LY组F值P值Caspase-3 1.00±0.053 0.66±0.060a 0.78±0.068c 1.20±0.042b 91.863 0.001 Caspase-9 1.00±0.058 0.69±0.045a 0.81±0.031c 1.15±0.025b 135.665 0.001images/BZ_9_1271_2970_2113_3004.png
2.5 LY294002对Bcl-2和Bax蛋白表达的影响 Western Blot检测结果显示:与对照组比较,Shh组激活Shh信号通路能够抑制促凋亡蛋白Bax表达,促进抗凋亡蛋白Bcl-2表达,差异均有显著统计学意义(P<0.01);与Shh组比较,Shh+LY组中抑制PI3K/AKt信号通路能够缓解Shh信号诱导Bax表达的抑制作用以及Bcl-2表达的促进作用,差异均有显著统计学意义(P<0.01);与对照组比较,LY组能够促进Bax表达以及抑制Bcl-2表达,差异均有显著统计学意义(P<0.05);与Shh组和Shh+LY组比较,LY组能够明显促进Bax表达以及抑制Bcl-2表达,差异均有显著统计学意义(P<0.01),见图2和表6。

图2 四组Bcl-2和Bax蛋白的表达水平

表6 LY294002对Bcl-2和Bax蛋白表达的影响(images/BZ_37_1351_1170_1373_1213.png±s)组别对照组Shh组Shh+LY组LY组F值P值Bcl-2 1.00±0.053 1.37±0.060a 1.18±0.068c 0.76±0.042b 48.546 0.001 Bax 1.00±0.058 0.78±0.045a 0.98±0.031c 1.22±0.025b 122.125 0.001images/BZ_10_207_1614_1049_1647.png
3 讨论
手术、放疗、化疗等方法仍然是早期宫颈癌的治疗的主要方法,即使同时进行化疗和近距离放疗,Ⅲ期和Ⅳ期患者的预后仍然较差,5年无进展生存期和总生存期分别为51%和55%。此外,在诊断时伴有腹主动脉旁淋巴结转移的女性预后明显较差。对于持续性、复发性和转移性宫颈癌,贝伐单抗联合细胞毒性化疗可将总生存期从13.3个月提高到17.0个月[11]。尽管有这些进展,对于许多淋巴结阳性的局部晚期和转移性宫颈癌妇女的治疗仍满足不了需求。因此,从发病机制探讨宫颈癌的治疗方法就显得极其重要。
PI3K/AKT通路是参与正常细胞过程最重要的信号通路之一,它的异常激活调节自噬、上皮间充质转化、凋亡、化疗耐药性和许多人类癌症的转移[12]。新的证据表明,宫颈癌中HMQ-T-F2可以通过PI3K/AKt信号通路来抑制上皮间质转化,从而抑制宫颈癌Hela细胞的侵袭和转移[13],不仅如此,Shh信号通过PI3K/AKt通路来调节MMP-2和MMP-9的表达来促进胶质母细胞瘤的侵袭和转移[14]。PI3K/AKT通路作为相关癌症治疗潜在策略的不同分子靶点。因此,本实验主要探讨其机制是否通过PI3K/AKt信号通路进行调控。
Purmorphamine作为小分子激活剂,能够直接结合Smoothened(Smo)受体,阻断BODIPY-cyclopamine与Smo结合,激活Sonic hedgehog(Shh)信号通路,研究结果证实其激活效果。从而可以开展后续实验。Shh激活能够促进Hela细胞的增殖,这与SAMARZIJA等[15]研究结果一致,抑制剂LY294002作用于PI3K/AKt通路后能够逆转Shh的作用,而LY294002作用后能够抑制Hela细胞的增殖作用,这与DIAO等[16]研究显示LY294002能够抑制宫颈癌细胞增殖的结果一致。细胞凋亡受分子水平的调控,细胞凋亡主要受Caspases酶家族以及Bcl-2家族蛋白调控,因此,本研究将对以上两条凋亡途径进行检测,分析PI3K/AKt通路是否也涉及凋亡途径。Caspases在细胞凋亡中起关键途径的酶家族,在细胞凋亡中起到介导者和执行者的作用,其异常表达会导致细胞凋亡。因此,本研究对Caspases酶家族中的Caspase-3和Caspase-9进行检测,Caspase-3和Caspase-9的表达能够反映Hela细胞凋亡的情况。研究显示Shh的激活能够抑制Caspase-3和Caspase-9的表达,抑制了Caspase-3/Caspase-9凋亡途径,而LY294002作用后能够逆转Shh诱导的Caspase-3和Caspase-9抑制作用,说明PI3K/AKt信号通路参与宫颈癌细胞Caspase-3/Caspase-9凋亡途径过程,而且Shh抑制Caspase-3和Caspase-9的表达也与PI3K/AKt通路有关。Bcl-2家族蛋白作为凋亡调控的另一条重要途径,Bcl-2蛋白能够阻止线粒体的细胞色素C释放到细胞质,抑制Caspase蛋白酶,从而抑制细胞凋亡的发生;Bax蛋白可以使细胞色素C穿过线粒体膜,解除蛋白酶Caspase的抑制作用,使其激活,从而使细胞凋亡。Bcl-2/Bax细胞凋亡在宫颈癌的凋亡中也发挥着关键性的作用。本研究通过激活Shh通路后,发现其能够抑制促凋亡蛋白Bax表达,促进抗凋亡蛋白Bcl-2表达,而抑制PI3K/AKt信号通路能够缓解Shh信号诱导Bax表达的抑制作用以及Bcl-2表达的促进作用,单独抑制PI3K/AKt信号通路能够促进Bax表达以及抑制Bcl-2表达,说明PI3K/AKt信号通路参与宫颈癌细胞Bcl-2/Bax凋亡途径过程,而且也参与了Shh信号诱导Bax表达的抑制作用以及Bcl-2表达的促进作用。
综上所述,本研究发现激活Shh能够促进宫颈癌细胞增殖、抑制凋亡,并且具体机制可能与PI3K/AKt信号通路有关;抑制PI3K/AKt通路能够抑制宫颈癌的增殖、激活Caspase-3/Caspase-9凋亡途径以及Bcl-2/Bax凋亡途径。本研究存在一定的局限性,只局限于宫颈癌Hela细胞,并且凋亡途径研究极其有限,需要进一步深入研究相关途径和机制。
