花椒属植物非苯丙素类成分研究进展
2021-11-21袁海梅谢贞建杨龙飞
袁海梅,张 崟,邹 亮, ,谢贞建,彭 聪,宋 雨,黄 旭,杨龙飞,付 强*
花椒属植物非苯丙素类成分研究进展
袁海梅1,张 崟1,邹 亮1, 2,谢贞建1,彭 聪1,宋 雨2,黄 旭3,杨龙飞4,付 强4*
1.成都大学食品与生物工程学院,四川 成都 610106 2.成都大学农业农村部杂粮加工重点实验室,四川 成都 610106 3.旺苍县葳蕤种植专业合作社,四川 旺苍 628207 4.成都大学药学院四川抗菌素工业研究所,四川 成都 610106
花椒属植物化学成分包括苯丙素和非苯丙素类。近年来,非苯丙素类成分被证实具有广泛的生物活性而备受关注。非苯丙素类化学成分包括生物碱类、黄酮类、萜类、有机酸类、酚类等。主要综述了花椒属植物中非苯丙素类化学成分的研究进展,以期为花椒属植物的新药研发和临床应用提供参考。
花椒属;非苯丙素类;生物碱类;黄酮类;萜类;有机酸类;酚类
花椒属L.为刺乔木或灌木,或木质藤本,常绿或落叶,主要分布于亚洲、非洲、美洲及大西洋地区。在全世界约有250种,在我国约有16属81种36变种或变型。花椒属植物具有活血化瘀、行气止痛、祛风通络、解毒消肿、杀虫止痒之功效,广泛用于泌尿道感染、妇科疾病、呕吐、泄泻、疝气,胃痛、牙痛、风湿痹痛、虫积腹痛、毒蛇咬伤等疾病的治疗[1-2]。花椒属植物中的化学成分可简单地分为苯丙素和非苯丙素类。其中,苯丙素含量较为丰富,具有广泛的药理活性,目前,对于苯丙素类的研究较为深入。同时,花椒属中非苯丙素类化合物发挥着苯丙素类化合物不可替代的作用。花椒属中非苯丙素类化合物包括生物碱类、黄酮类、萜类、有机酸类、酚类等。虽然《中国药典》2020年版[3]中只收录3个花椒属品种,分别为青花椒Sieb.,花椒Maxim.和两面针(Roxb.) DC.,但仍有相当多花椒属植物化学成分未被完全探究和利用。本文对近年来花椒属植物中非苯丙素类成分的研究进展进行综述,以期为花椒属植物的新药研发和临床应用提供参考。
到目前为止,研究者已从近30余种花椒属植物中分离得到305个非苯丙素类化合物,花椒属植物的来源见表1,部位见表2。这些化合物按分子结构分为生物碱类(1~213)、黄酮类(214~234)、萜类(235~255)、有机酸类(256~269)、酚类(270~278)和其他类(279~305)。
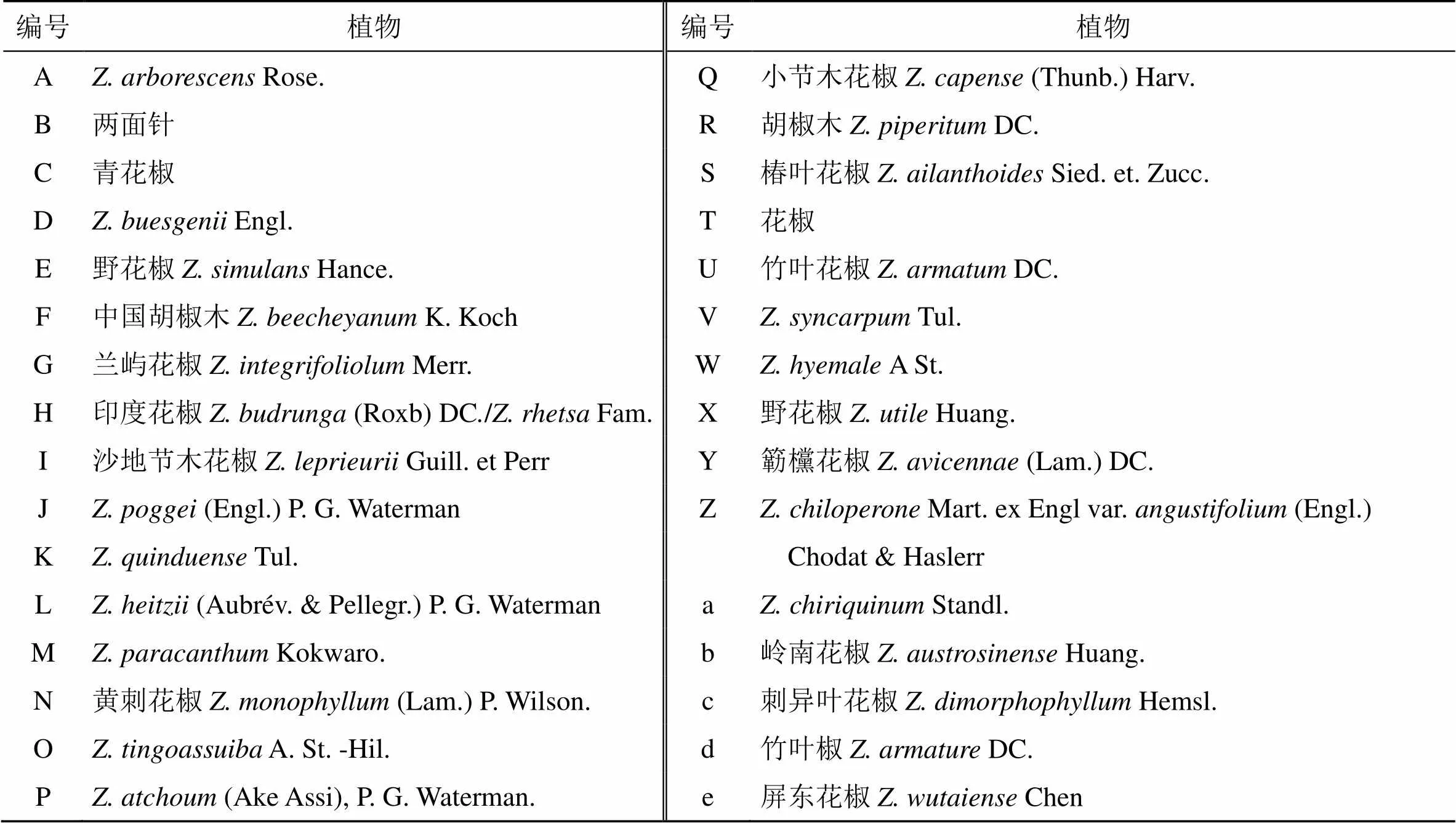
表1 花椒属植物中非苯丙素类化合物的植物来源
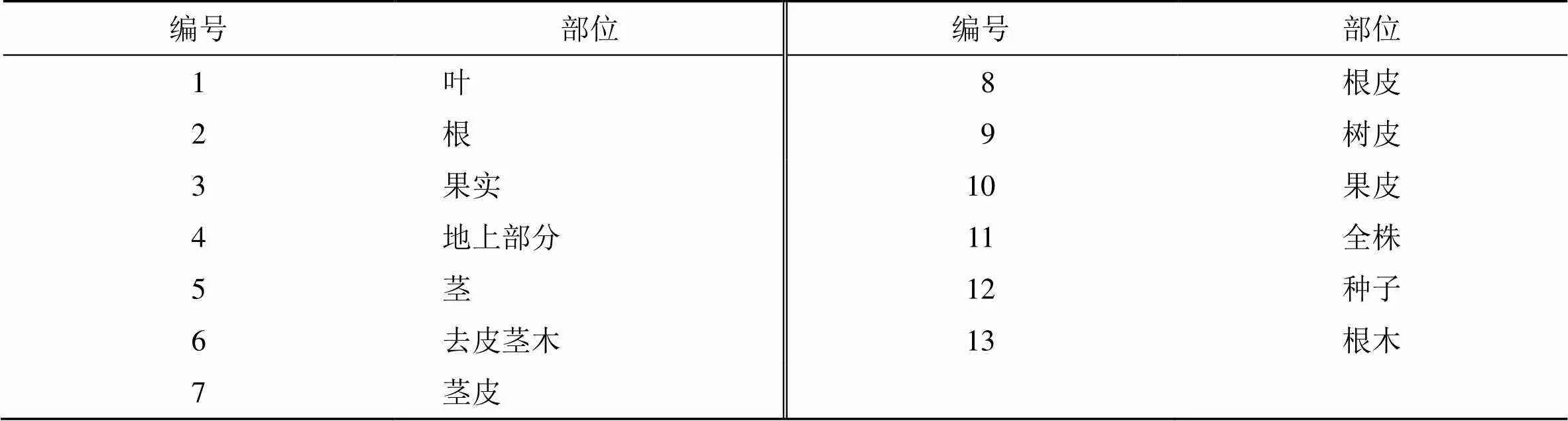
表2 植物材料的部位
1 生物碱
大部分花椒属植物中都含有生物碱,尤其是根和茎皮中含量较为丰富。目前为止,已从该属植物中分离出200多个生物碱,其中,以异喹啉类生物碱和酰胺类生物碱为主。此外,这些植物还含有喹啉类生物碱、吖啶酮类生物碱、吲哚类生物碱和萜类生物碱等。
1.1 喹啉类生物碱
喹啉类生物碱是由邻氨基苯甲酸途径产生的喹啉类衍生物,广泛分布于芸香科大部分属中。迄今为止,在花椒属植物中已报道了27种喹啉类生物碱(1~27),包括呋喃喹啉类生物碱,吡喃喹啉类生物碱、喹啉酮类生物碱和双喹啉酮类生物碱,见表3。其中,4种呋喃喹啉类生物碱(1~4)广泛分布于花椒属不同植物的各种部位。化合物2是芸香科最常见的生物碱,在50%以上的物种中都存在。化合物1~4结构相同的是在喹啉环上同一位置均含有1个甲氧基。而结构不同的是化合物3的喹啉环无取代基;化合物4的喹啉环上含有1个甲氧基;化合物1比化合物4多1个羟基,而化合物2可以认为是化合物1喹啉环上的羟基变成了甲氧基。已经证实,化合物3、4为化合物2的前体化合物,因此,最可能的生物合成方案是化合物3→化合物4→化合物1→化合物2[4]。Yang等[5]从两面针分离的喹啉类生物碱中,只有化合物2具有明显的乙酰胆碱酯酶抑制活性。进一步研究表明,C-7处甲氧基取代能够显著增强抑制活性。Li等[12]从两面针叶中分离得到喹啉酮类生物碱(14),该化合物为首次从花椒属植物报道,可能为两面针植物的特征成分。进一步研究发现,该化合物在自然资源中仅存在于芸香科花椒属和芸香草属中,因此,可以将其作为芸香科植物的特征成分,用于鉴别芸香科和其他科植物。另外,Chen等[13]从兰屿花椒中分离得到2个双喹啉类生物碱(26、27)。
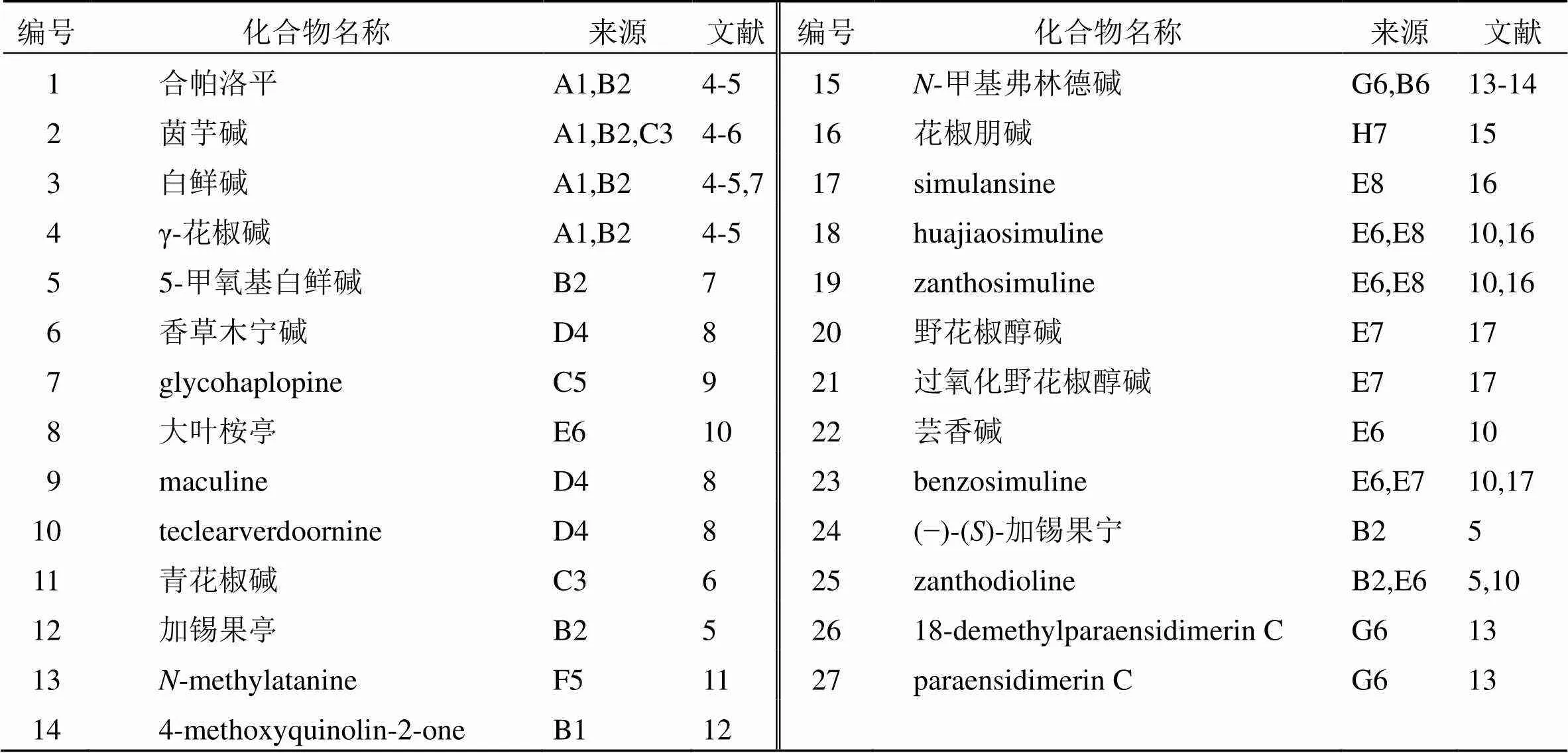
表3 花椒属植物中分离的喹啉类生物碱
来源中英文字母代表植物编号,数字代表部位编号,下表同
English letters represent plant numbers and numbers represent part numbers in source, same as the following tables
1.2 吖啶酮类生物碱
据报道,从花椒属植物中分离得到了15个吖啶酮类生物碱(28~42),均来自于沙地节木花椒和,见表4。2010年,Ngoumfo等[18]从沙地节木花椒果实中分离得到2个新吖啶酮类生物碱(29、30)。Bunalema等[19]还从沙地节木花椒的茎皮中分离得到2个已知的吖啶酮类生物碱(36、37)。另外,Wansi等[20]从茎皮的二氯甲烷萃取物中分离得到1个具有C-O-C键的新型二聚吖啶酮类生物碱(38)。
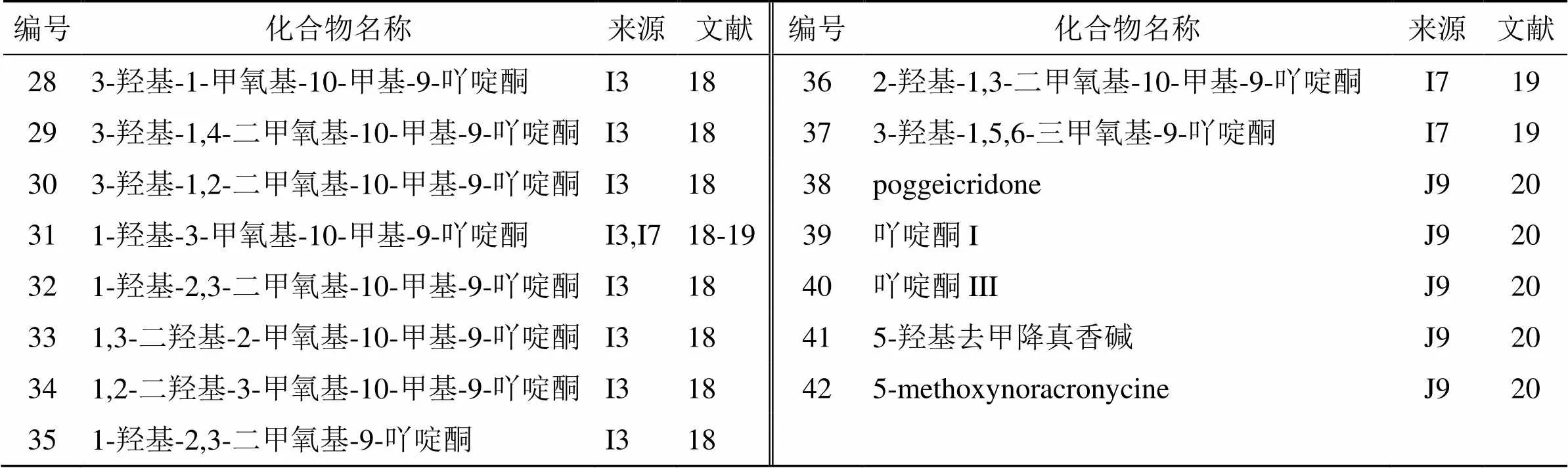
表4 花椒属植物中分离的吖啶酮类生物碱
1.3 异喹啉类生物碱
异喹啉类生物碱是由苯丙氨酸和酪氨酸途径合成的异喹啉类或四氢异喹啉类衍生物,主要分布在花椒属植物中[1]。目前,从花椒属植物中分离得到65个异喹啉类生物碱(43~107)。按其结构分类,从花椒属植物中分离得到的异喹啉类生物碱可分为4大类:苯菲啶类生物碱、小檗碱类生物碱、阿朴啡类生物碱和苄基四氢异喹啉类生物碱。其中,苯菲啶类生物碱是含量最丰富的一类生物碱,其生物活性也被广泛研究。
1.3.1 苯菲啶类生物碱 苯菲啶类生物碱是花椒属植物的主要化合物之一,大部分花椒属植物中的苯菲啶类生物碱都包含1个在C-2和C-3之间通过C原子桥形成的五元氧杂环结构。依据菲啶环上氢饱和程度,此类生物碱分为常规苯菲啶类生物碱和四氢苯菲啶类生物碱。此外,菲啶环可被不同的化学基团(如羟基、甲氧基和羰基)取代,不同基团的取代赋予了其不同的生物活性。苯菲啶类生物碱仅分布在罂粟科、芸香科和紫堇科植物中,被认为是该科具有化学分类标记的化合物。此外,从芸香科花椒属植物中提取的苯菲啶类生物碱因具有较强的抗肿瘤和抗菌活性而受到越来越多的关注。
据报道,已从花椒属植物中分离鉴定出47个苯菲啶类生物碱(43~89),见表5。2012年,Tantapakul等[24]等从印度花椒中分离得到化合物45、46、58,并对其进行抗菌活性研究,发现化合物46对耐甲氧西林金黄色葡萄球菌表现出较强的活性,对大肠杆菌表现出中等的活性,而其余化合物对耐甲氧西林金黄色葡萄球菌表现出弱活性。构效关系研究表明,C-6上无取代基的苯菲啶类生物碱(46)在抗革兰阳性和革兰阴性菌活性中都起着重要作用。为了从中药中寻找抗类风湿性关节炎的生物活性成分,Yang等[33]从野花椒中分离得到一系列苯菲啶类生物碱(59、61、63、66、67、79),其中化合物59、66、67为新化合物。
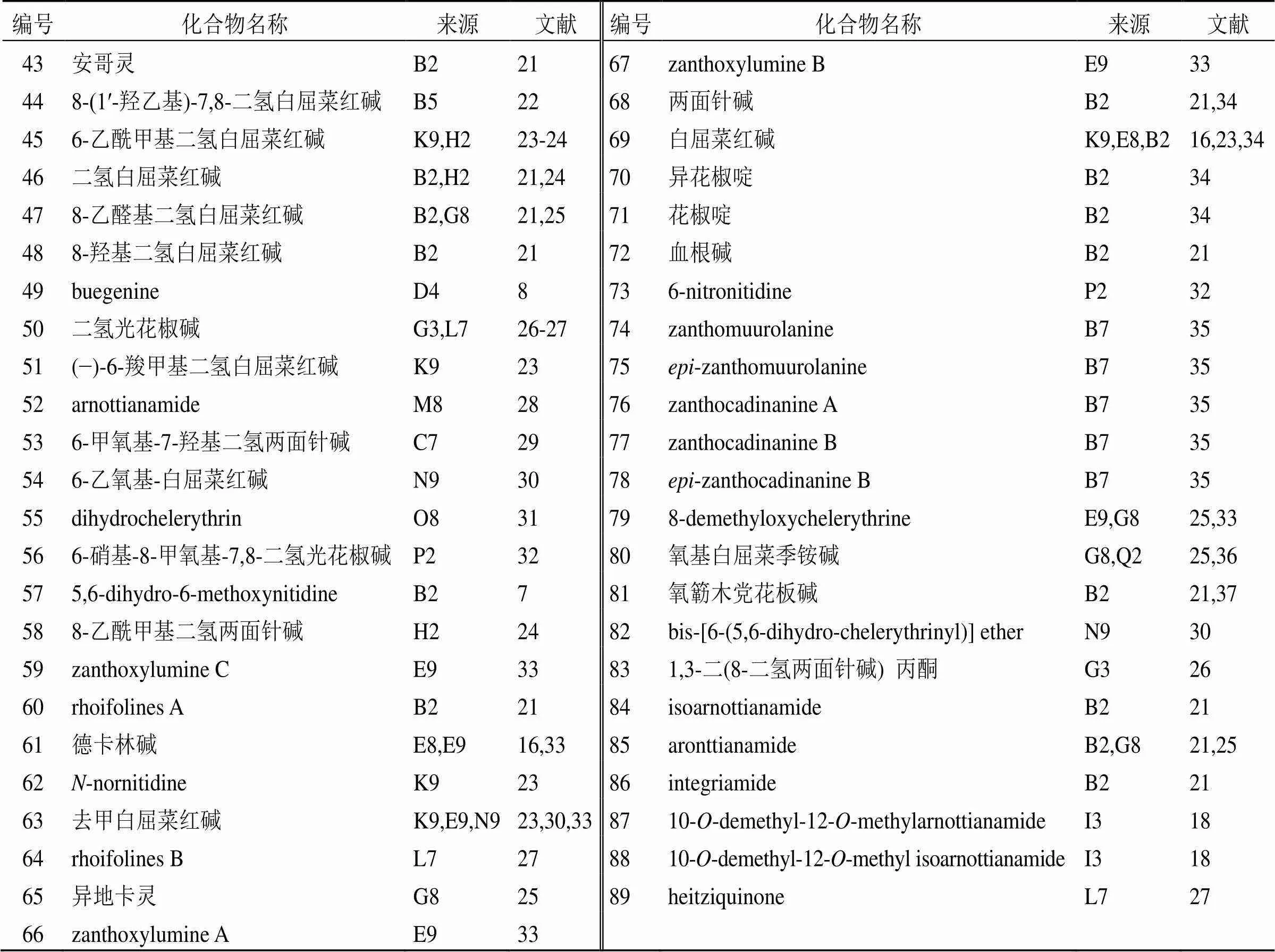
表5 花椒属植物中分离的苯菲啶类生物碱
此外,花椒属植物中的化合物68、69也具有抗肿瘤活性,其机制是通过抑制拓扑异构酶I介导的DNA分解,稳定DNA和酶之间的共价二元复合物[34]。2008年,Yang等[35]从两面针茎皮中分离得到5个具有二氢白屈菜红碱结构,并且通过亚甲基桥连接杜松烷型倍半萜的新型苯菲啶类生物碱(74~78)。然而,这些拥有二氢苯菲啶结构的生物碱对人肺癌NCI-H460细胞、人乳腺癌MCF-7细胞和中枢神经系统癌SF-460细胞均无细胞毒性,可能是由于B环中缺少1个亚胺离子,因为亚胺基团中的碳代表了1个有效的烷基化位点,它可以用来解释相关生物碱的细胞毒性。2011年,Rodríguez-Guzmán等[30]从黄刺花椒茎皮中分离到1个二聚体(82)。
1.3.2 其他异喹啉类生物碱 花椒属植物中的异喹啉生物碱除了苯菲啶类生物碱,还有小檗碱类生物碱、阿朴菲类生物碱和苄基四氢异喹啉类生物碱,见表6。小檗碱类生物碱是由2个喹啉环缩合而成。到目前为止,在花椒属植物中共发现8个小檗碱类生物碱(90~97)。2010年,Patiño Ladino等[23]首次从中分离得到化合物90、95、96,其中化合物95是首次从花椒属植物中分离得到,此外,化合物90、95、96广泛分布于花椒属植物中,但在芸香科其他属中却未曾广泛分布,因此这些小檗碱类生物碱可以作为花椒属化学分类学的代表物和标记物。2017年,Costa等[31]从根皮中分离得到化合物97,进一步研究表明,该化合物对金黄色葡萄球菌ATCC 25923的抑制作用强于氯霉素。
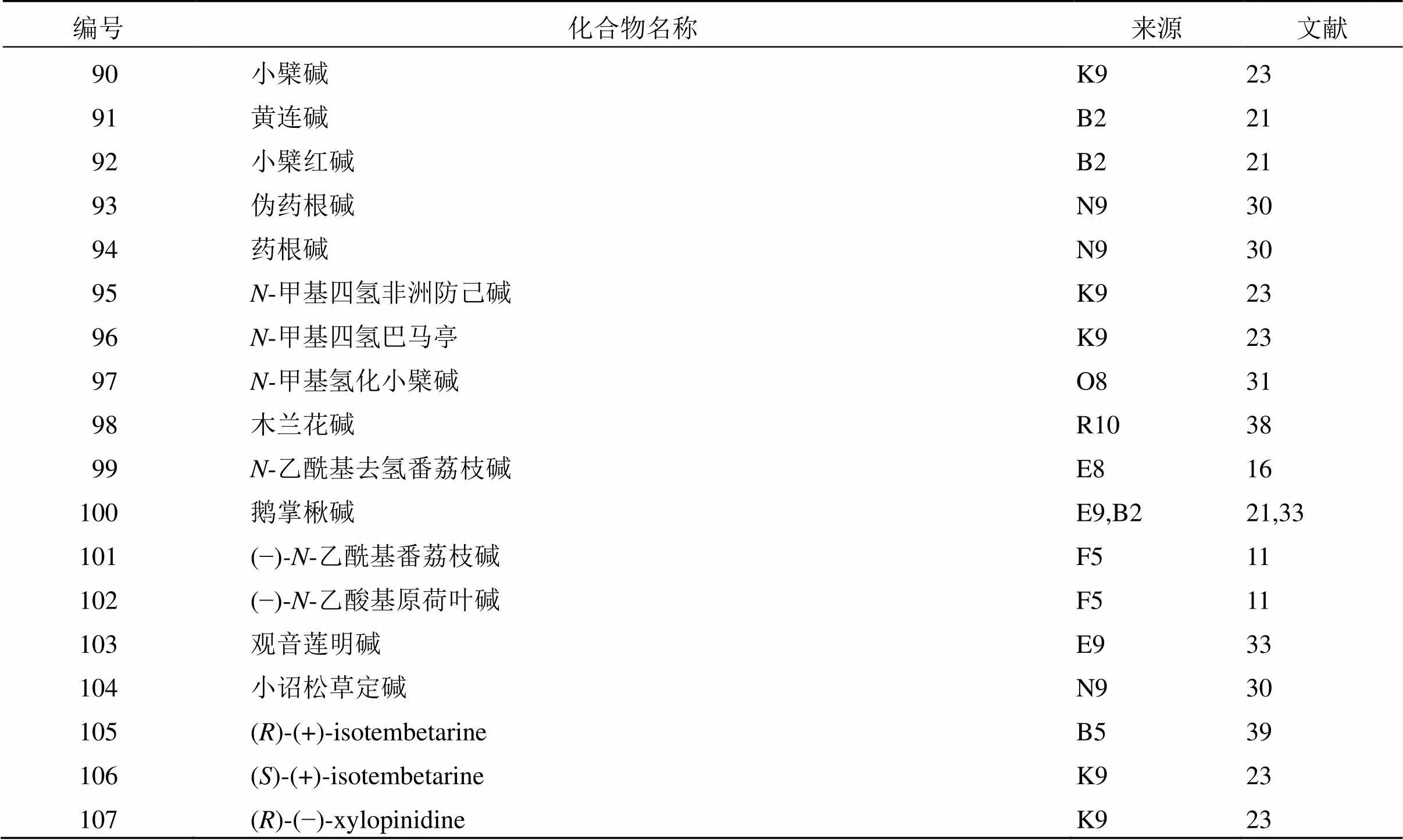
表6 花椒属植物中分离的其他异喹啉类生物碱
阿朴菲类生物碱是由苄基四氢异喹啉的苄基部分苯环与四氢异喹啉部分的8位脱去一分子氢形成的四环化合物。截至目前,从花椒属植物中已发现7个阿朴菲类生物碱(98~104)。1996年,Chen等[16]从野花椒的根皮中发现了1个6α,7-脱氢新型阿朴菲类生物碱(99)。其中,阿朴菲类生物碱(100)具有细胞毒性,是强效的拓扑异构酶II抑制剂[21]。
苄基四氢异喹啉类生物碱是异喹啉类基本母核的1位连有苄基。目前,已从两面针和的茎中首次分离得到3个四氢异喹啉类生物碱(105~107)。其中,首次从两面针中分离得到新化合物106[39]。
这些化合物中,仅有化合物101、102、105~107鉴定了手性结构,而其他具有手性的化合物并未进行手性鉴定,因此,应进一步进行手性结构的鉴定,为新药研发提供研究基础。
1.4 酰胺类生物碱
酰胺类生物碱具有良好的抗肿瘤、抗炎和杀虫活性,在花椒属和芸香科的化学分类中发挥着重要作用。迄今为止,从该属植物中分离鉴定出71个酰胺类生物碱(108~178)。一般来说,花椒属的酰胺类生物碱可分为2大类:烷基胺类和芳香酰胺类生物碱。花椒酰胺又称为花椒麻味素,是一系列结构相似的链状不饱和脂肪酸酰胺和其他连有芳环的酰胺,也是花椒呈麻味的主要特征成分。花椒中的多烯酰胺类物质以“山椒素”为代表,主要含有α-山椒素、β-山椒素和γ-山椒素,以及它们在氨基部分含有1个羟基的同系物。
1.4.1 烷基酰胺类生物碱 烷基酰胺类生物碱是花椒属植物中广泛存在的一类重要化合物。其中,不饱和烷基胺在花椒属植物中非常常见,其脂肪链分子结构大多含有酮、醛或羟基。
目前,已从花椒属植物中分离鉴定出52个烷基胺(108~159),主要分布在花椒的果皮和果实中,见表7。1999年,Chen等[41]首次从兰屿花椒的果实中分离得到3个具有反式-2-反式-4-二烯酰胺骨架的新化合物130~132。2012年,Huang等[43]从花椒果皮中分离得到2个新的不饱和烷基酰胺(138、139)。其中,化合物138含有2个酮碳,这种结构在天然的不饱和烷基酰胺中并不常见,化合物139含有1个醛基,这种构型的不饱和烷基酰胺是首次从花椒中分离得到。此外,2013年,Devkota等[44]还从竹叶花椒果皮中分离到4个新的烷基酰胺(140~143)。2015年,Tian等[45]从花椒果皮中分离到3个新的异丁基羟基酰胺(147~149)。其中,化合物147、148是首次分离得到含有乙氧基的异丁基羟基酰胺,化合物149是花椒属中罕见的含有C11脂肪酸的山椒麻素。2018年,Chakthong等[50]从两面针茎中分离得到1个新的烷基酰胺类生物碱(150)。2020年,Qin等[52]从两面针的全株中分离得到5个新的烷基酰胺类生物碱(155~159)。
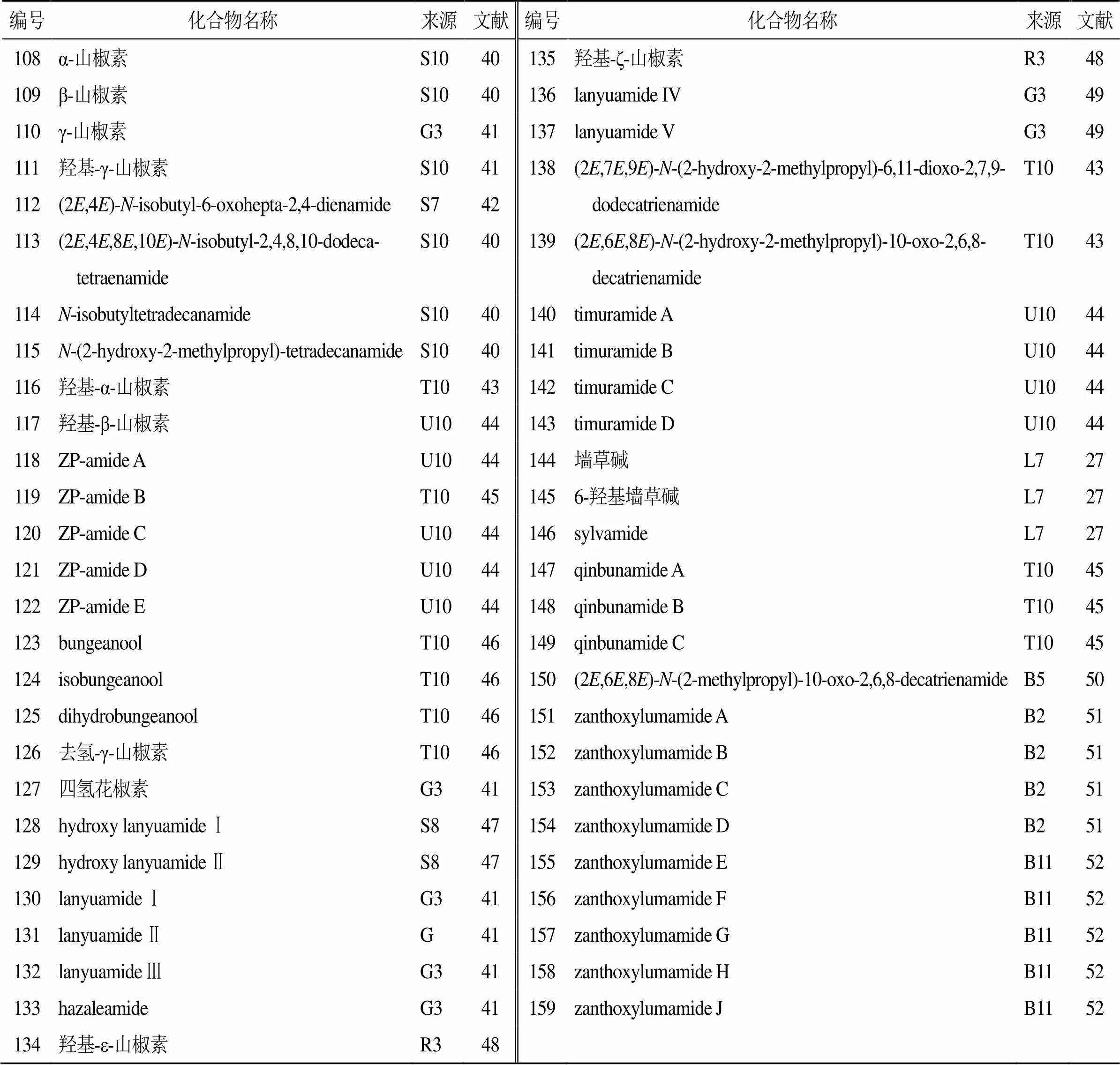
表7 花椒属植物中分离的烷基酰胺类生物碱
1.4.2 芳基酰胺类生物碱 目前,从花椒属植物中鉴定出19种芳香族化合物(160~178),见表8。与烷基酰胺相比,这些化合物含有可被甲氧基或羟基取代的苯环。
2005年,Ross等[53]从叶中分离鉴定了2个新化合物(160~161)。此外,2009年,Chen等[42]还从椿叶花椒茎皮中分离鉴定出2个新的芳香酰胺(167、168)。2020年,Li等[12]从两面针叶中分离得到芳基酰胺类生物碱-反式-香豆酰基酪胺(166)和-苯甲酰基--苯丙氨醇(169),化合物166为首次从芸香科植物报道,化合物169为首次从该植物分离得到,表明化合物166可能在芸香科花椒属植物的化学分类学中起重要作用。
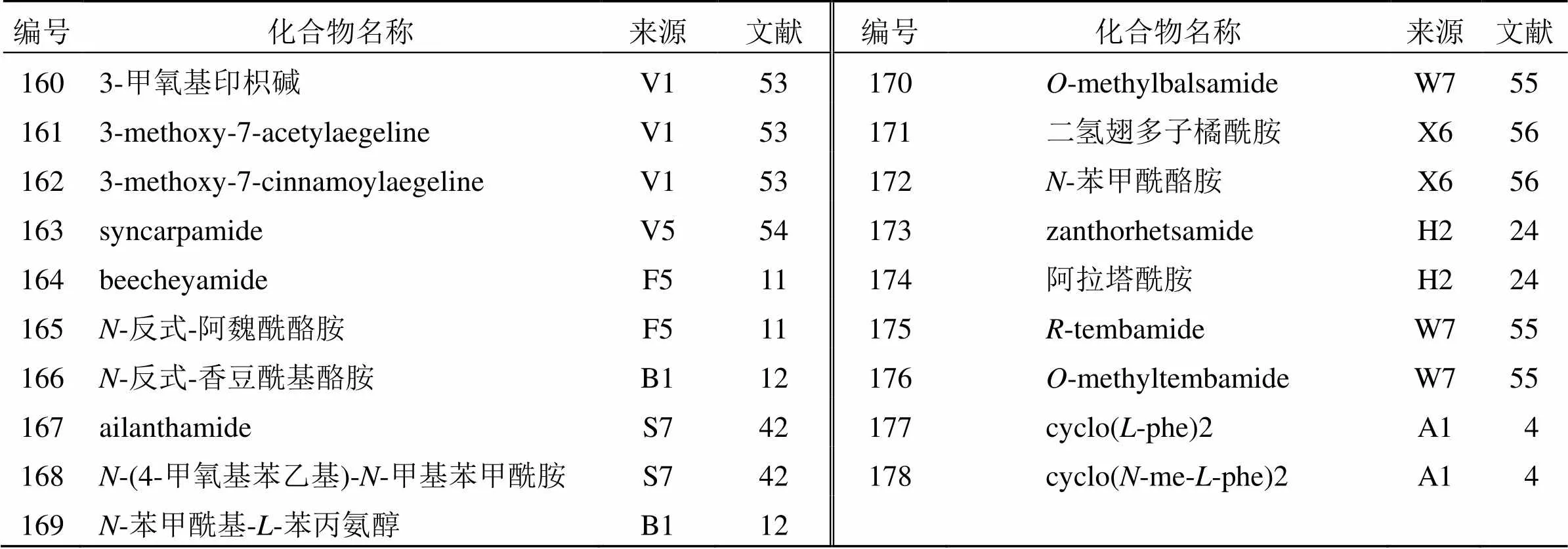
表8 花椒属植物中分离的芳基酰胺类生物碱
1.5 吲哚类生物碱
迄今为止,从花椒属植物中共分离出16个吲哚类化合物(179~194),见表9。这些化合物按结构分为简单吲哚(179~182)和单萜类吲哚(183~194)。1982年,Grina等[4]从叶中分离得到1个已知的单萜吲哚类生物碱(179),并且为该属植物首次报道。2005年,Chen等[25]从兰屿花椒的根皮中分离得到化合物183、186、187、193,其中,化合物183为新化合物。化合物193广泛分布于花椒属植物中,具有多种生物活性,如抗肿瘤、抗真菌、杀虫和抗血小板聚集等。
1.6 萜类生物碱
目前,已从和簕欓花椒叶中共分离到9个萜类生物碱(195~203),见表10。1990年,Marcos等[59]首次从叶中分离到新的双甾烯基萜类生物碱(195)和3个已知的萜类生物碱(196~198)。这是首次从同一种植物中分离出2种骨架类型的双甾烯萜生物碱。1999年,Thuy等[60]发现了双癸烯萜类生物碱(199、201)。此外,化合物200、202为从簕欓花椒中分离得到的混合物,二者未被很好分离。
1.7 其他类型生物碱
除上述生物碱外,还从花椒属植物中分离到2个新的喹唑酮生物碱(204、205)、3个有机胺生物碱(206~208)、1个新的哌嗪生物碱(209)、1个新的吡咯生物碱(210)和3个咔唑生物碱(211~213),见表11。其中,化合物209是自然界中首次报道的此类哌嗪[4]。Fu等[61]从岭南花椒根中分离得到3个新的咔唑生物碱(211~213),在抗肿瘤活性研究中发现,其对5种人早幼粒白血病HL-60细胞、肝癌SMMC-7721细胞、人非小细胞肺癌A549细胞、人乳腺癌MCF-7细胞和人结肠癌SW480细胞具有显著抑制作用,抑制活性与对照药顺铂相当,甚至有些活性比顺铂还强。
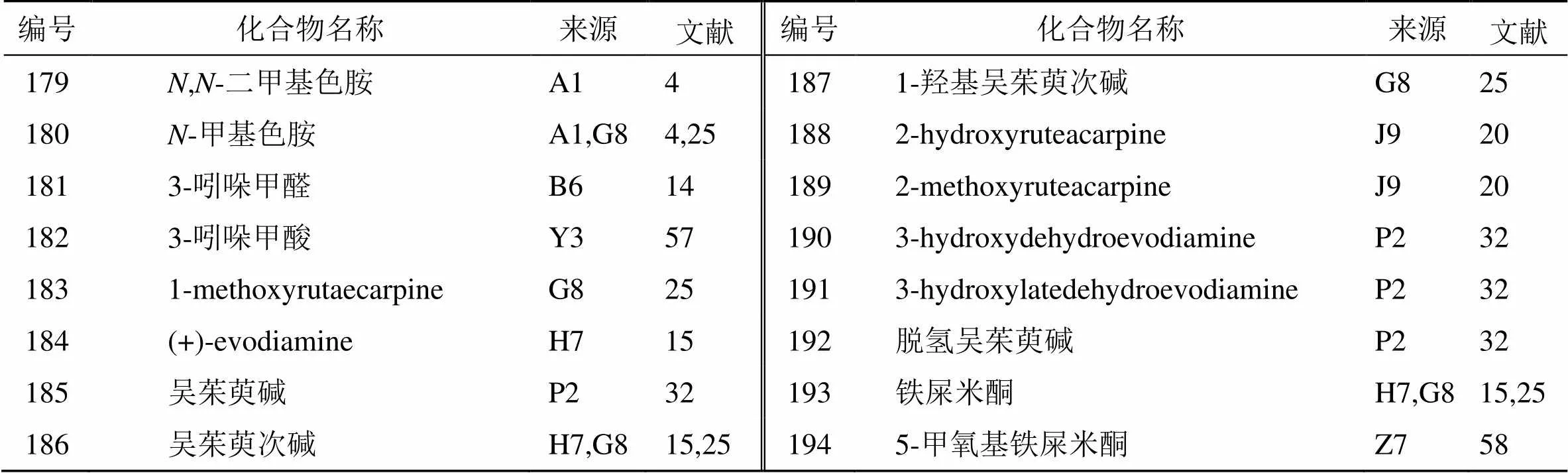
表9 花椒属植物中分离的吲哚类生物碱
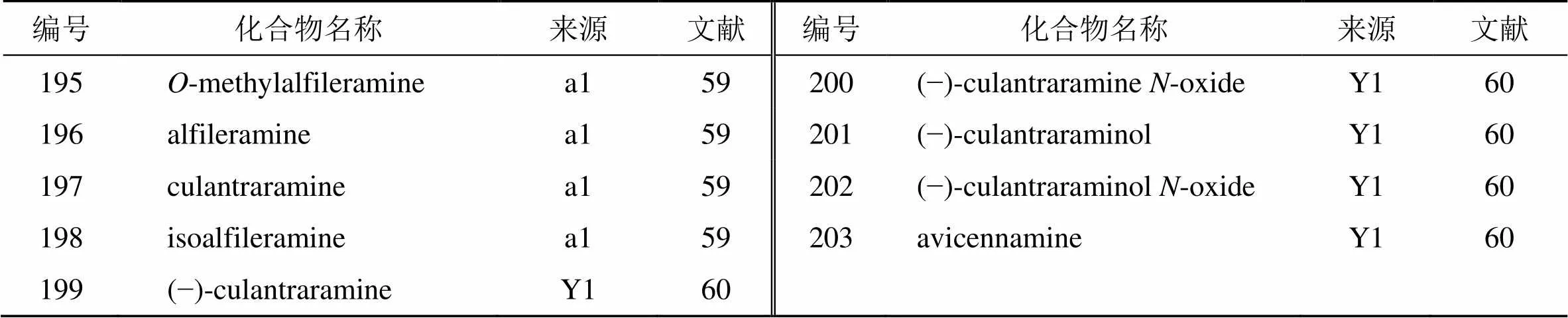
表10 花椒属植物中分离的萜类生物碱
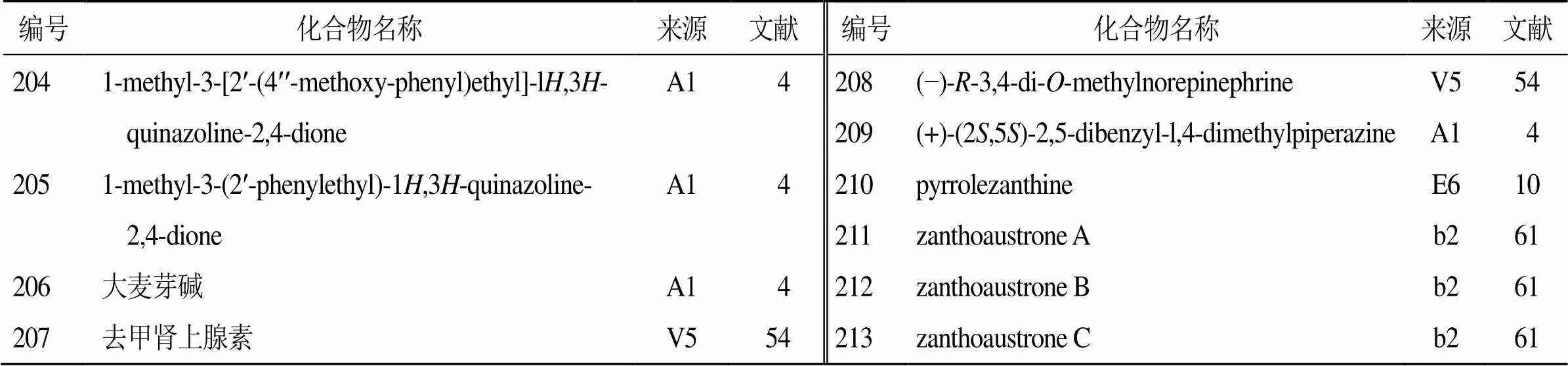
表11 花椒属植物中分离的其他生物碱
2 黄酮类化合物
黄酮类化合物主要是指基本母核为2-苯基色原酮类化合物,广泛分布于植物界。黄酮类化合物也是花椒属中重要的活性化合物。目前,已从花椒属植物中分离鉴定出21个黄酮类化合物(214~234),其中大部分为黄酮类和黄酮醇类,见表12。特别是,其优异的抗氧化活性越来越受到人们的关注。1999年,Chen等[26]从兰屿花椒中分离得到1个新的黄酮类化合物(214),不过这个黄酮类化合物的A环和B环上均不含有酚羟基。2014年,Zhang等[64]从花椒叶中分离到9个黄酮类化合物(223~231),其中化合物226~231为花椒属植物首次报道。在这些黄酮类化合物中,槲皮素类和槲皮素苷类化合物(223~227)表现出了最强的抗氧化活性。构效关系研究表明,B环上C-4′位的羟基和A环上C-7′位的羟基具有较强的抗氧化活性。因此,B环或A环有邻近羟基取代可以增强其抗氧化能力。
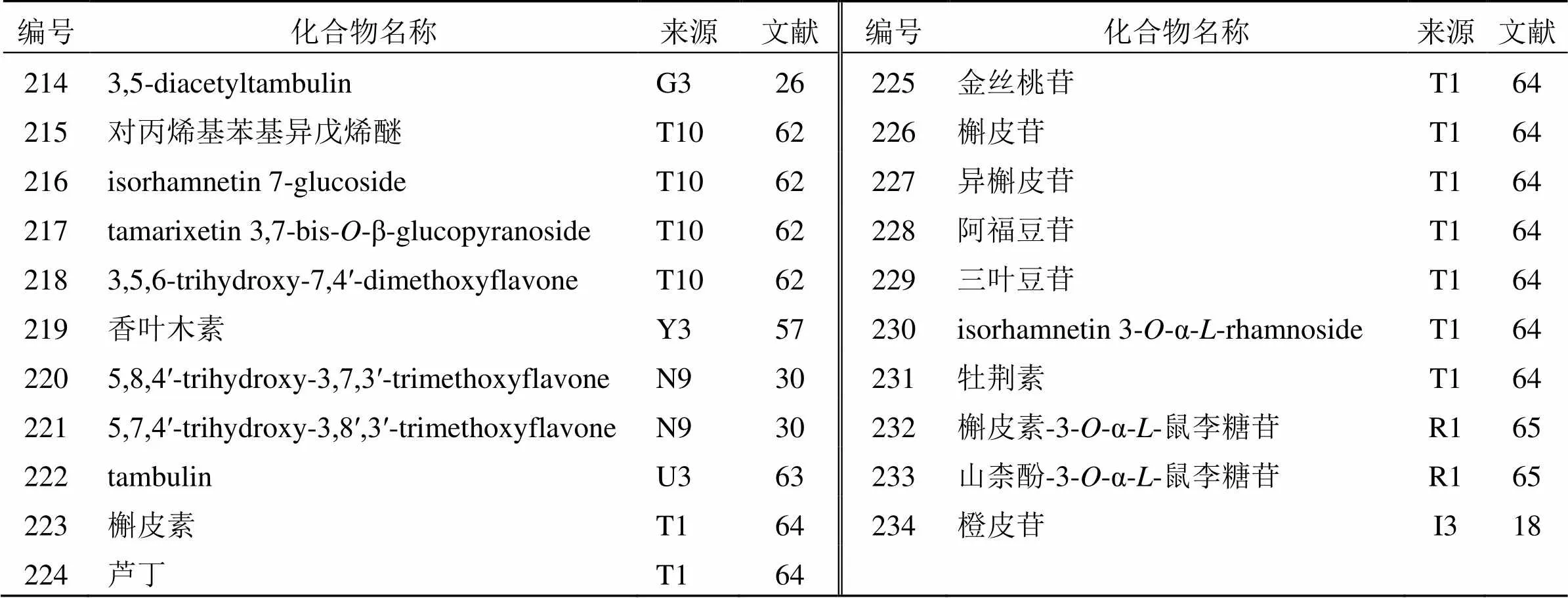
表12 花椒属植物中分离的黄酮类化合物
3 萜类
目前,已从花椒属植物中分离得到21个萜类化合物(235~255),见表13。按异戊二烯单元的数量分类,这些分离得到的萜类化合物分为无环单萜(235~240)、单环单萜(241~246)、双环倍半萜(247~249)、四环三萜(250)和五环三萜(251~255)。2011年,Jiang等[66]首次从胡椒木叶中分离得到2个新的无环单萜类化合物(239、240),以及单环单萜类化合物(241、242),并且首次确定化合物241的绝对构型。
4 有机酸
含羧基的有机酸广泛存在于各种中草药中,从花椒属植物中分离得到14个有机酸,包括10个脂肪酸(256~265)和4个芳香酸(266~269),见表14。2004年,Cheng等[11]从中国胡椒木茎中分离到化合物260,这是一种不饱和脂肪酸,对AA和胶原蛋白诱导的血小板聚集具有抑制作用。此外,2014年,Yang等[70]从花椒中分离得到的化合物261能延长胶原蛋白-肾上腺素诱导血栓形成小鼠的出血凝血时间。
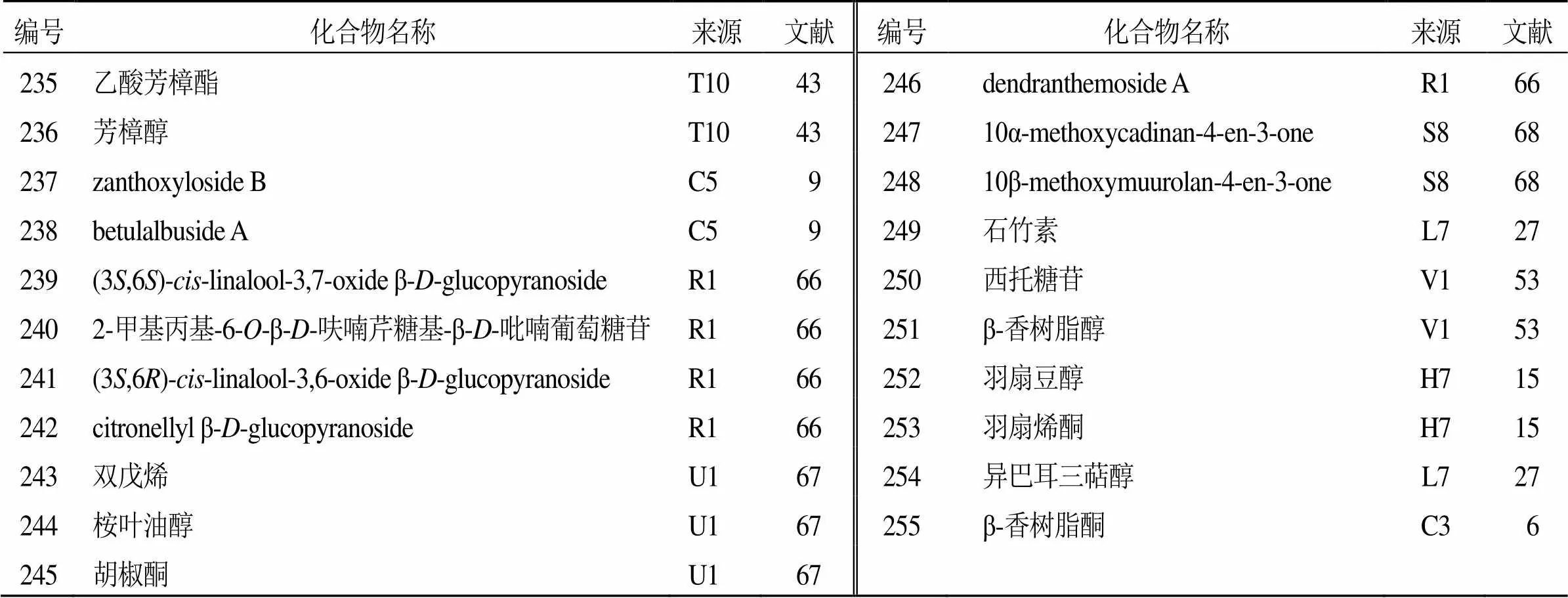
表13 花椒属植物中分离的萜类化合物
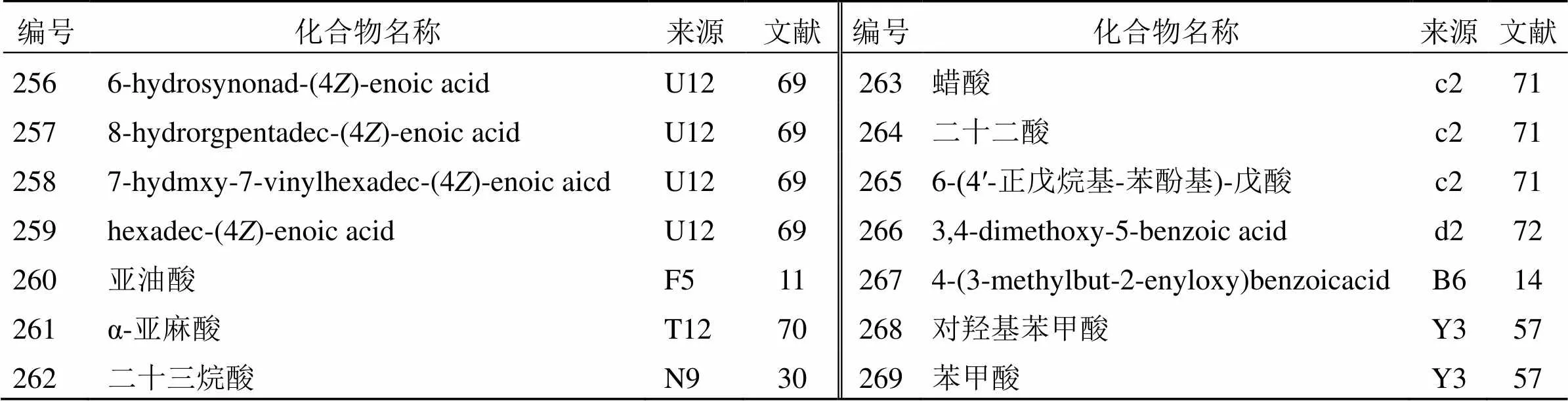
表14 花椒属植物中分离的有机酸
5 酚类
迄今为止,从花椒属植物中共分离得到了9个酚类化合物,包括酚苷(270、271)和酚类化合物(272~278),见表15。2000年,Hisatomi等[38]从胡椒木中分离到化合物270,并对其进行了抗氧化活性研究,发现该化合物具有抗亚油酸和清除1,1-二苯基-2-三硝基苯肼自由基的活性。通过气相色谱-质谱联用仪测定,在果皮中,其含量为35 mg/100 g。
6 其他类
此外,从花椒属植物中还发现了一系列其他化合物(279~305),见表16。2012年,Talontsi等[74]首次从沙地节木花椒发酵的内生真菌sp.CAFT122-1中分离得到醌类化合物(280),其能够通过葡萄霜霉病菌游动孢子的溶解达到运动抑制。
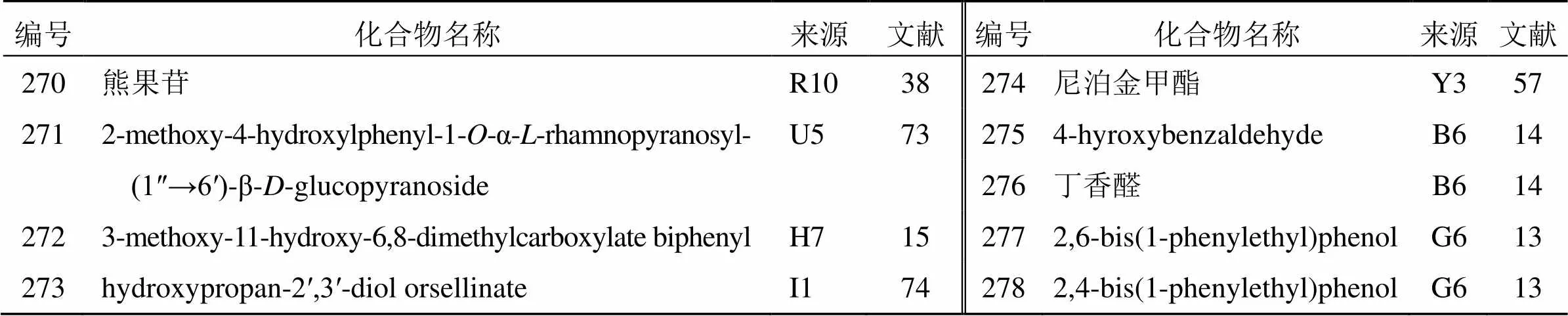
表15 花椒属植物中分离的酚类化合物
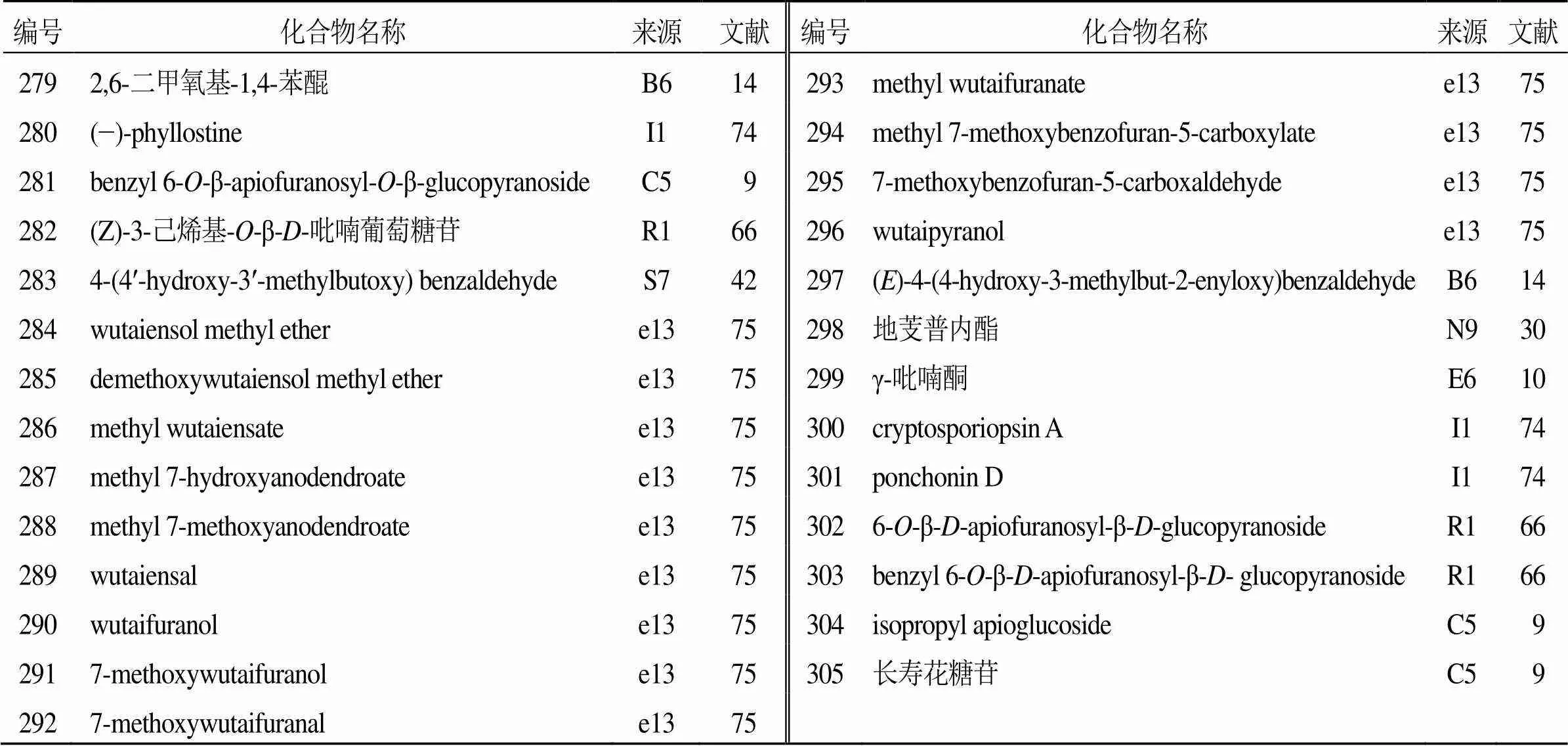
表16 花椒属植物中分离鉴定的其他类化合物
此外,该化合物还能抑制另外2种产孢植物病原菌终极腐霉和黑腐丝囊霉的菌丝生长,以及担子菌类真菌立枯丝核菌的菌丝生长。另外,Huang等[75]从屏东花椒根木中分离得到11个新化合物284~288、290~294、296,以及2个已知化合物289、295。其中,化合物295为首次在植物中报道,化合物288、289、292对结核分歧杆菌H37Rv具有抑制活性。
7 结语
花椒属植物具有可观的食用和药用价值,国内外学者对花椒属植物进行了大量的化学成分分离鉴定研究。本文归纳了近年来研究报道的花椒属植物非苯丙素类化学成分,包括生物碱、黄酮类、萜类、有机酸、酚类等300多个化合物。其中,生物碱是非苯丙素的主要成分,广泛存在于花椒属植物的各种部位中。
在花椒属植物的生物活性中,非苯丙素类化合物发挥着重要作用。我国作为花椒属植物资源大国,具有花椒属植物食用和药用研发的绝对优势,国内外学者对花椒属植物的果实、根、茎、叶等各部位的非苯丙素类化学成分进行了大量研究,在现有研究基础上,基于非苯丙素的作用机制和生理毒性研究可能是未来的研究方向,从而进一步推动非苯丙素类化合物的新药开发和临床应用向前发展。
利益冲突 所有作者均声明不存在利益冲突
[1] 王宇, 巨勇, 王钊.花椒属植物中生物活性成分研究近况 [J].中草药, 2002, 33(7): 666-670.
[2] 娄京荣, 郑重飞, 李莹, 等.花椒属植物抗感染作用研究进展 [J].中草药, 2018, 49(22): 5477-5484.
[3] 中国药典[S].2020: 167, 179.
[4] Grina J A, Ratcliff M R, Stermitz F R.Old and new alkaloids from[J]., 1982, 47(13): 2648-2651.
[5] Yang Z D, Zhang D B, Ren J,.Skimmianine, a furoquinoline alkaloid fromas a potential acetylcholinesterase inhibitor [J]., 2012, 21(6): 722-725.
[6] Liu Z L, Chu S S, Jiang G H.Feeding deterrents fromagainst two stored-product insects [J]., 2009, 57(21): 10130- 10133.
[7] Yang G H, Chen D F.Alkaloids from the roots ofand their antiviral and antifungal effects [J]., 2008, 5(9): 1718-1722.
[8] Sandjo L P, Kuete V, Tchangna R S,.Cytotoxic benzophenanthridine and furoquinoline alkaloids from(Rutaceae) [J]., 2014, 8(1): 61.
[9] Li W, Yang S Y, Yan X T,.NF-κB inhibitory activities of glycosides and alkaloids fromstems [J]., 2014, 62(2): 196-202.
[10] Yang Y P, Cheng M J, Teng C M,.Chemical and anti-platelet constituents from Formosan[J]., 2002, 61(5): 567-572.
[11] Cheng M J, Wu C C, Tsai I L,.Chemical and anti- platelet constituents from the stem of[J]., 2004, 51(5A): 1065-1072.
[12] Li L S, Wu H X, Liu S Y,.Chemical constituents from the leaves of(Roxb.) DC [J]., 2020, 91: 104080.
[13] Chen J J, Chen P H, Liao C H,.New phenylpropen- oids, bis(1-phenylethyl)phenols, bisquinolinone alkaloid, and anti-inflammatory constituents from[J]., 2007, 70(9): 1444-1448.
[14] Chen J J, Lin Y H, Day S H,.New benzenoids and anti-inflammatory constituents from[J]., 2011, 125(2): 282-287.
[15] Mukhlesur Rahman M, Anwarul Islam M, Khondkar P,.Alkaloids and lignans from(Rutaceae) [J]., 2005, 33(1): 91-96.
[16] Chen I S, Wu S J, Leu Y L,.Alkaloids from root bark of[J]., 1996, 42(1): 217-219.
[17] Chen I S, Tsai I W, Teng C M,.Pyranoquinoline alkaloids from[J]., 1997, 46(3): 525-529.
[18] Ngoumfo R M, Jouda J B, Mouafo F T,.cytotoxic activity of isolated acridones alkaloids fromGuill.et Perr [J]., 2010, 18(10): 3601-3605.
[19] Bunalema L, Fotso G W, Waako P,.Potential ofas a source of active compounds against drug resistant[J]., 2017, 17(1): 89.
[20] Wansi J D, Tadjong Tcho A, Toze F A A,.Cytotoxic acridone and indoloquinazoline alkaloids from[J]., 2016, 17: 293-298.
[21] Hu J, Zhang W, Shen Y H,.Alkaloids from(Roxb.) DC [J]., 2007, 35: 114-117.
[22] Geng D, Li D X, Shi Y,.A new benzophenanthridine alkaloid from[J]., 2009, 7(4): 274-277.
[23] Patiño Ladino O J, Cuca Suárez L E.Isoquinoline alkaloids of(Rutaceae) [J]., 2010, 38(4): 853-856.
[24] Tantapakul C, Phakhodee W, Ritthiwigrom T,.Antibacterial compounds from[J]., 2012, 35(7): 1139-1142.
[25] Chen J J, Fang H Y, Duh C Y,.New indolopyrido- quinazoline, benzo[c]phenanthridines and cytotoxic constituents from[J]., 2005, 71(5): 470-475.
[26] Chen I S, Chen T L, Chang Y L,.Chemical constituents and biological activities of the fruit of[J]., 1999, 62(6): 833-837.
[27] Wangensteen H, Ho G T, Tadesse M,.A new benzophenanthridine alkaloid and other bioactive constituents from the stem bark of[J]., 2016, 109: 196-200.
[28] Kaigongi M M, Lukhoba C W, Yaouba S,.antimicrobial and antiproliferative activities of the root bark extract and isolated chemical constituents ofKokwaro (Rutaceae) [J]., 2020, 9(7): E920.
[29] Wang C F, You C X, Yang K,.Antifeedant activities of methanol extracts of fourspecies and benzophenanthridines from stem bark ofagainst[J]., 2015, 74: 407-411.
[30] Rodríguez-Guzmán R, Fulks L C, Radwan M M,.Chemical constituents, antimicrobial and antimalarial activities of[J]., 2011, 77(13): 1542-1544.
[31] Costa R S, Lins M O, Le Hyaric M,.antibacterial effects ofroot bark extracts and two of its alkaloids against multiresistant[J]., 2017, 27(2): 195-198.
[32] Yao-Kouassi P A, Caron C, Ramiarantsoa H,.New nitro-benzo[c]phenanthridine and indolopyridoquinaz- oline alkaloids from[J]., 2015, 18(8): 891-897.
[33] Yang S H, Liu Y Q, Wang J F,.Isoquinoline alkaloids fromand their biological evaluation [J]., 2015, 68(4): 289-292.
[34] Fang S D, Wang L K, Hecht S M.Inhibitors of DNA topoisomerase I isolated from the roots of[J]., 1993, 58(19): 5025-5027.
[35] Yang C H, Cheng M J, Chiang M Y, et al.Dihydrobenzo [c]phenanthridine alkaloids from stem bark of[J]., 2008, 71(4): 669-673.
[36] Cabral V, Luo X, Junqueira E,.Enhancing activity of antibiotics against:constituents and derivatives [J]., 2015, 22(4): 469-476.
[37] Wang C F, Fan L, Tian M,.Cytotoxicity of benzophenanthridine alkaloids from the roots of(Roxb.) DC.var.How ex Huang [J]., 2015, 29(14): 1380-1383.
[38] Hisatomi E, Matsui M, Kubota K,.Antioxidative activity in the pericarp and seed of Japanese pepper (DC) [J]., 2000, 48(10): 4924-4928.
[39] Moriyasu M, Ichimaru M, Nishiyama Y,.()-(+)- isotembetarine, a quaternary alkaloid from[J]., 1997, 60(3): 299-301.
[40] Yasuda I, Takeya K, Itokawa H.Two new pungent principles isolated from the pericarps of[J]., 1981, 29(6): 1791- 1793.
[41] Chen I S, Chen T L, Lin W Y,.Isobutylamides from the fruit of[J]., 1999, 52(2): 357-360.
[42] Chen J J, Chung C Y, Hwang T L,.Amides and benzenoids fromwith inhibitory activity on superoxide generation and elastase release by neutrophils [J]., 2009, 72(1): 107-111.
[43] Huang S, Zhao L, Zhou X L,.New alkylamides from pericarps of[J]., 2012, 23(11): 1247-1250.
[44] Devkota K P, Wilson J, Henrich C J,.Isobutylhydroxyamides from the pericarp of Nepaleseinhibit NF1-defective tumor cell line growth [J]., 2013, 76(1): 59-63.
[45] Tian J M, Wang Y, Xu Y Z,.Characterization of isobutylhydroxyamides with NGF-potentiating activity from[J]., 2016, 26(2): 338-342.
[46] Xiong Q B, Shi D W, Yamamoto H,.Alkylamides from pericarps of[J]., 1997, 46(6): 1123-1126.
[47] Cheng M J, Tsai I L, Chen I S.Chemical constituents from the root bark of Formosan[J]., 2003, 50(6): 1241-1246.
[48] Bader M, Stark T D, Dawid C,.All-- configuration inalkylamides swaps the tingling with a numbing sensation and diminishes salivation [J]., 2014, 62(12): 2479- 2488.
[49] Tsai I L, Lin W Y, Huang M W,.-isobutylamides and butyrolactone from the fruits of[J]., 2001, 84(4): 830-833.
[50] Chakthong S, Ampaprom R, Inparn S,.New alkylamide from the stems of[J]., 2019, 33(2): 153-161.
[51] Zhu L J, Ren M, Yang T C,.Four new alkylamides from the roots of[J]., 2015, 17(7): 711-716.
[52] Qin F, Wang C Y, Hu R,.Anti-inflammatory activity of isobutylamides fromvar.[J]., 2020, 142: 104486.
[53] Ross S A, Al-Azeib M A, Krishnaveni K S,.Alkamides from the leaves of[J]., 2005, 68(8): 1297-1299.
[54] Ross S A, Sultana G N N, Burandt C L,.Syncarpamide, a new antiplasmodial (+)-norepinephrine derivative from[J]., 2004, 67(1): 88-90.
[55] de Moura N F, Morel A F, Dessoy E C,.Alkaloids, amides and antispasmodic activity of[J]., 2002, 68(6): 534-538.
[56] 朱德荣, 祝丹, 陈玉, 等.野花椒中2个新苯丙素成分的研究 [J].有机化学, 2013, 33(6): 1345-1348.
[57] Cho J Y, Hwang T L, Chang T H,.New coumarins and anti-inflammatory constituents from[J]., 2012, 135(1): 17-23.
[58] Thouvenel C, Gantier J C, Duret P,.Antifungal compounds fromvar.[J]., 2003, 17(6): 678-680.
[59] Marcos M, Villaverde M C, Riguera R,.A new bishordeninyl terpene alkaloid from[J]., 1990, 53(2): 459-461.
[60] Thuy T T, Porzel A, Ripperger H,.Bishordeninyl terpene alkaloids from[J]., 1999, 50(5): 903-907.
[61] Fu Y H, Guo J M, Xie Y T,.Structural characterization, antiproliferative and anti-inflammatory activities of alkaloids from the roots of[J]., 2020, 102: 104101.
[62] Xiong Q B, Shi D W, Mizuno M.Flavonol glucosides in pericarps of[J]., 1995, 39(3): 723-725.
[63] Nooreen Z, Singh S, Singh D K,.Characterization and evaluation of bioactive polyphenolic constituents fromDC., a traditionally used plant [J]., 2017, 89: 366-375.
[64] Zhang Y J, Wang D M, Yang L N,.Purification and characterization of flavonoids from the leaves ofand correlation between their structure and antioxidant activity [J]., 2014, 9(8): e105725.
[65] Ha S Y, Youn H, Song C S,.Antiviral effect of flavonol glycosides isolated from the leaf ofon influenza virus [J]., 2014, 52(4): 340-344.
[66] Jiang L, Kojima H, Yamada K,.Isolation of some glycosides as aroma precursors in young leaves of Japanese pepper (DC.) [J]., 2001, 49(12): 5888-5894.
[67] Wang C F, Zhang W J, You C X,.Insecticidal constituents of essential oil derived fromagainst two stored-product insects [J]., 2015, 64(8): 861-868.
[68] Cheng M J, Lee K H, Tsai I L,.Two new sesquiterpenoids and anti-HIV principles from the root bark of[J]., 2005, 13(21): 5915-5920.
[69] Ahmad A, Misra L N, Gupta M M.Hydroxyalk-(4)- enoic acids and volatile components from the seeds of[J]., 1993, 56(4): 456-460.
[70] Yang Q, Cao W D, Zhou X X,.Anti-thrombotic effects of α-linolenic acid isolated fromMaxim seeds [J]., 2014, 14: 348.
[71] 陶朝阳.刺异叶花椒根抗肝纤维化活性物质基础研究 [D].上海: 第二军医大学, 2002.
[72] 黄艳.竹叶椒乙酸乙酯部位化学成分及降血糖活性初步研究 [D].兰州: 兰州理工大学, 2014.
[73] Guo T, Dai L P, Tang X F,.Two new phenolic glycosides from the stem ofDC [J]., 2017, 31(20): 2335-2340.
[74] Talontsi F M, Facey P, Tatong M D,.Zoosporicidal metabolites from an endophytic fungussp.of[J]., 2012, 83: 87-94.
[75] Huang H Y, Ishikawa T, Peng C F,.Constituents of the root wood ofwith antitubercular activity [J]., 2008, 71(7): 1146-1151.
Research progress on non-phenylpropanoid constituents from plants ofspecies
YUAN Hai-mei1, ZHANG Yin1, ZOU Liang1, 2, XIE Zhen-jian1, PENG Cong1, SONG Yu2, HUANG Xu3, YANG Long-fei4, FU Qiang4
1.School of Food and Biologilcal Engineering, Chengdu University, Chengdu 610106, China 2.Key Laboratory of Coarse Cereal Processing, Ministry of Agriculture and Rural Affairs, Chengdu University, Chengdu 610106, China 3.Wangcang County Luxuriant Planting Professional Cooperative, Wangcang 628207, China 4.Sichuan Industrial Institute of Antibiotics, School of Pharmacy, Chengdu University, Chengdu 610106, China
Chemical constituents ofplants include phenylpropanoids and non-phenylpropanoids.In recent years, non-phenylpropanoids have been proved to have a wide range of biological activities and have attracted much attention.Non-phenylpropanoids chemical constituents include alkaloids, flavonoids, terpenes, organic acids and phenols, etc.Research progress on non-phenylpropanoids from plants ofspecies were reviewed in this article, in order to provide a reference for the development and clinical application of new drugs ofplants.
L.; non-phenylpropanoids; alkaloids; flavonoids; terpenes; organic acids; phenols
R282.71
A
0253 - 2670(2021)22 - 7044 - 13
10.7501/j.issn.0253-2670.2021.22.031
2021-03-18
四川省教育厅科研项目(18ZB0149);四川省科技扶贫专项(2020ZHFP0213);成都大学校青年基金资助项目(2080516034,2018XZA03)
袁海梅(1987—),女,四川简阳人,实验师,硕士,研究方向为天然产物化学与中药质量控制。 Tel: 13880722953 Email: m13880722953@163.com
通信作者:付 强,副研究员,硕士生导师,博士,研究方向为天然产物化学与中药质量控制。Tel: 18140128009 E-mail: peter028@126.com
[责任编辑 崔艳丽]
