中药治疗肺纤维化的研究进展
2021-11-21丁大力沈学彬姚佳慧喻丽珍周梦娟年四辉
丁大力,沈学彬, 2,姚佳慧,喻丽珍, 2,周梦娟,年四辉, 2*
·综 述·
中药治疗肺纤维化的研究进展
丁大力1,沈学彬1, 2,姚佳慧1,喻丽珍1, 2,周梦娟1,年四辉1, 2*
1.皖南医学院药学院,安徽 芜湖 241002 2.皖南医学院现代中药研究所,安徽 芜湖 241002
肺纤维化是由多种病因引起,并最终导致患者正常肺组织结构改变的一种慢性进行性肺间质疾病,预后较差。目前,治疗肺纤维化的药物主要是糖皮质激素与免疫抑制剂,但其具有较严重的不良反应。近年来,随着对肺纤维化研究的不断深入,利用中药治疗肺纤维化的探索与应用逐渐增多。中药及其有效成分能够通过转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smad、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)以及核因子E2相关因子-2(nuclear factor-erythroid 2-related factor-2,Nrf2)/谷胱甘肽(glutathione,GSH)等通路降低炎症因子表达、调节氧化还原平衡、诱导肺成纤维细胞凋亡、阻断纤维化进程,表现出了良好的抗肺纤维化作用,并能够有效改善纤维化症状并延缓病程进展。归纳并总结了近年来中药治疗肺纤维化的研究进展,以期为深入研究中药抗肺纤维化的具体机制以及发现有效中药活性成分提供参考。
中药;肺纤维化;黄酮类;酚类;萜类;皂苷类;生物碱类;中药复方
肺纤维化是由多种病因引起的,以巨噬细胞、中性粒细胞和淋巴细胞等炎症细胞在肺泡的堆积以及纤维结缔组织的发展为主要特点,并最终导致患者正常肺组织结构改变的一种慢性进行性肺间质疾病[1]。肺纤维化的预后较差,患者的肺功能会受到严重破坏,生命也会受到极大的威胁[2]。尽管目前有大量针对肺纤维化的研究,但其病因仍不明确,发病机制也较为复杂,主要与年龄、遗传以及环境因素等有关[3-6]。近年来其发病率与患病率呈逐年上升的趋势[7-8]。目前,治疗肺纤维化的药物主要是糖皮质激素与免疫抑制剂,该类药物的治疗效果较显著,但其不良反应也较为常见且严重[9]。
中医通过对病机辨证分析将肺纤维化归属于“肺搏”“肺痿”“喘症”“肺胀”“短气”的范畴,其中“肺搏”与“肺痿”最为常见,临床可以采用益气养阴、清热解毒、活血化瘀等方法进行治疗。中药是我国医药的伟大宝库,在我国使用已有超过2000年的历史,是中医在临床实践中的重要组成部分,从中药中寻找具有防治肺纤维化的药物备受关注。近年来,随着对肺纤维化研究的不断深入,利用中药对肺纤维化进行治疗的探索逐渐增多,有相当数量的中药活性成分或中药复方在研究中表现出对肺纤维化的防治作用。本文将从中药单体活性成分及中药复方2个方面对中药在肺纤维化治疗方面的实验及临床研究进行阐述,以期对近年来中药抗肺纤维化的成果与进展进行归纳与总结,并为深入研究中药抗肺纤维化的具体机制以及发现有效中药活性成分提供参考。
1 中药单体活性成分
1.1 黄酮类
1.1.1 黄芩素/黄芩苷 黄芩素和黄芩苷是天然的黄酮类物质,主要存在于黄芩中,二者均具有抗炎、抗氧化等药理作用。在博来霉素诱导的肺纤维化大鼠模型中,给药组大鼠体内羟脯氨酸以及α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)水平相比肺纤维化大鼠均降低,同时大鼠肺指数(肺湿质量/体质量)下降。组织病理学检查发现大鼠的肺泡炎及肺纤维化程度相比模型组均缓解。上述作用可能与黄芩素能够增强抗氧化能力、减轻炎症,同时抑制转化生长因子-β1(transforming growth factor-β1,TGF-β1)/Smad通路有关。各给药组与模型组相比均有显著性差异,且药物作用效果呈剂量相关性[10]。另外有报道提示黄芩素具有通过下调miR-21从而抑制TGF-β1诱导的肺成纤维细胞分化[11]以及下调结缔组织生长因子(connective tissue growth factor,CTGF)进而缓解肺组织中I型胶原蛋白(type I collagen,ColI)生成的作用[12]。此外,有研究发现黄芩苷可以刺激Treg细胞、抑制白细胞介素(interleukin,IL)-6与IL-23从而抑制T17细胞的分化进而减轻肺纤维化的程度[13]。近期的研究显示,黄芩苷可以通过细胞外信号调节激酶1/2(extracellular signal regulated kinase1/2,ERK1/2)通路[14]或磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)通路[15]实现抗肺纤维化的作用。此外,有研究显示黄芩总黄酮可以通过抗氧化损伤、抑制炎症并调控TGF-β1/Smad信号通路表现出对肺纤维化的治疗作用[16]。但目前有关黄芩素或黄芩苷的研究仅局限于实验研究中,尚缺乏临床试验证明其是否能缓解肺纤维化患者的症状。
1.1.2 槲皮素 槲皮素广泛存在于槐花等药材中,具有清除自由基和螯合过渡金属离子的能力。研究显示槲皮素可下调羟脯氨酸、丙二醛的表达,升高还原型谷胱甘肽/氧化型谷胱甘肽比值与总抗氧化能力(total anti-oxidative capacity,T-AOC),上调大鼠体内基质金属蛋白酶-1(matrix metalloprotein,MMP-1)与金属蛋白酶组织抑制剂-1(tissue inhibitor of metalloproteinase-1,TIMP-1)的表达[17],并下调ColI、Ⅲ型胶原蛋白(type Ⅲ collagen,ColⅢ)的表达[18],提示槲皮素有一定的抗肺纤维化作用,且该作用可能是通过调节肺纤维化患者体内的氧化还原平衡[19-20],诱导肺成纤维细胞凋亡[21]实现的,其中涉及到的通路包括鞘氨醇激酶1(sphingosine kinase 1,SphK1)/1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)通路[18],Smad及β-连环蛋白(β-catenin)等[22]。众多实验表明,槲皮素可能具有抗肺纤维化作用,但其对肺纤维化患者的治疗效果仍需临床研究来验证。
1.1.3 红花黄色素 红花是常用的活血化瘀类中药,临床一般用于治疗血液循环障碍性疾病。在博来霉素诱导的大鼠肺纤维化模型中,红花黄色素给药后,其体内α-SMA阳性细胞的增生以及TGF-b1的表达均受到抑制,且肺纤维化典型病理变化有一定程度的缓解,如体质量降低、肺组织中羟脯氨酸水平上升等。在细胞实验中,红花黄色素能够抑制TGF-b1介导的肺成纤维细胞向肌成纤维细胞的转分化[23]。另外,红花黄色素能够抑制脂多糖引起急性肺损伤时出现的肺部炎症[24],并通过哺乳动物绝育20样激酶-Yes相关蛋白通路(mammalian sterile -20-like kinase-yes-associated protein,MST-YAP)激活的Hippo通路实现对肺纤维化的缓解作用[25]。上述研究表明,红花黄色素在体内与体外实验中均表现出较好的抗肺纤维化作用。
1.1.4 柚皮苷 柚皮苷是一种双氢黄酮类化合物,具有抗炎、抗肿瘤等活性。研究发现,柚皮苷能够提高小鼠的存活率,下调肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、TGF-β1、MMP-9、TIMP-1的表达与肺组织中丙二醛、羟脯氨酸的水平,同时上调超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)[26-27]与血红素氧合酶1(heme oxygenase 1,HO-1)的活性[27],且组织学检测结果也表明柚皮苷对纤维化症状具有缓解作用[26]。以上研究从分子及组织学角度考察了柚皮苷的作用,提示其可能具有抗肺纤维化潜力。
1.1.5 鸢尾黄素 从肺纤维化大鼠体内取出肺成纤维细胞,在后续实验中给予不同浓度的鸢尾黄素并检测相关指标。研究人员发现鸢尾黄素能够显著抑制肺成纤维细胞增生,并能够上调肺纤维化大鼠肺成纤维细胞中miR-338*的表达,同时下调溶血磷脂酸受体1基因的表达[28],并且鸢尾黄素能够抑制急性肺损伤过程中的肺部炎症反应[29]。在卵清蛋白致肺纤维化豚鼠中,鸢尾黄素可通过下调TGF-β1、p-Smad2/3、Smad4、TNF-α、核转录因子-κB(nuclear factor-κB,NF-κB)、血管内皮细胞生长因子A(vascular endothelial cell growth factor A,VEGFA)的表达,并上调Smad7的表达缓解肺纤维化过程中的损伤[30]。鸢尾黄素在细胞与动物实验中均表现出对肺纤维化及肺部炎症的积极作用,但其能否应用于临床仍需进一步研究与探索。
1.1.6 原花色素 原花色素是一种多酚类黄酮。研究表明,原花色素能够有效缓解大鼠的肺纤维化程度,并抑制水肿及炎性细胞聚集。此外,原花色素还能降低诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达及羟脯氨酸水平[31]。目前有关原花色素抗肺纤维化的研究尚不多,其抗肺纤维化的作用及机制仍需要深入研究。
1.1.7 葛根素 葛根素是葛根的主要有效成分,研究发现葛根素能够显著缓解肺纤维化大鼠肺泡炎及肺纤维化程度,升高肺组织中SOD的活性,同时降低丙二醛的水平[32]。在细胞实验中,葛根素能够通过抑制TGF-β1表达从而下调IL-1、IL-2、IL-4表达[33]。葛根素所具有的抗氧化活性以及激活TGF-β1/ Smad3信号通路的作用可能是其抗肺纤维化机制。
1.2 酚类
1.2.1 白藜芦醇 白藜芦醇存在于葡萄及多种药用植物中,是植物防止真菌感染而产生的一种天然抗毒素。研究发现,白藜芦醇可缓解肺纤维化小鼠上皮细胞-间充质转化(epithelial mesenchymal transition,EMT),降低小鼠肺组织中胶原沉积,逆转羟脯氨酸、ColI水平以及TGF-β1表达的上升,并调节肺组织中的氧化应激状态,如降低丙二醛水平,升高T-AOC、过氧化氢酶及SOD的活性[34]。亦有研究表明白藜芦醇缓解肺纤维化的作用可能是通过抑制miR-21的表达实现的[35],且白藜芦醇在与α-硫辛酸合用时能够更好地缓解肺纤维化过程中的肺部炎症[36]。在有关环境颗粒PM2.5致肺部炎症及纤维化的研究中,白藜芦醇在体内及体外实验中均能够有效降低致炎因子的表达水平,表现出对因环境污染所导致肺损伤的保护作用[37]。上述研究表明,白藜芦醇在实验研究中表现出较好的抗肺纤维化作用。
1.2.2 丹酚酸 丹酚酸是丹参的水溶性成分,主要活性物质包括丹酚酸A和丹酚酸B。在肺纤维化大鼠模型中,肺泡壁厚度增加,同时肺部胶原沉积也增多,但上述病理改变均被丹酚酸A缓解,且作用效果随剂量的增加而增强。此外,丹酚酸A能显著抑制肺成纤维细胞的迁移、黏附和增生,并下调细胞周期蛋白D1、E1、B1与抗凋亡蛋白Bcl-2表达,上调p53、p21与切割型半胱氨酸天冬氨酸蛋白酶-3(cleaved cysteine-dependent aspartate-specifc proteases,cleaved Caspase-3)蛋白表达。上述结果提示丹酚酸A抗肺纤维化的作用可能与抑制肺成纤维细胞的增生并诱导其凋亡有关[38]。有关丹酚酸B抗肺纤维化的研究结果显示,丹酚酸B在动物实验中能够抑制炎症细胞浸润、肺泡结构破坏及胶原沉积。同时,丹酚酸B在细胞实验中通过抑制Smad与丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,阻断TGF-β1诱导的成纤维细胞MRC-5纤维化与人肺癌A549细胞EMT过程[39]。此外,丹酚酸B够缓解肺纤维化小鼠肺组织内正常结构破坏、胶原蛋白过表达、过度炎症细胞浸润、促炎细胞因子释放及氧化应激的损伤,并且该作用与给药剂量呈正相关[40-41]。丹酚酸B还能够促进核因子E2相关因子-2(nuclear factor-erythroid 2-related factor-2,Nrf2)表达,调节氧化还原平衡并降低氧化应激的损伤[40]。上述结果是关于丹酚酸A与丹酚酸B的作用及机制,但抗纤维化是否与体内其他通路或过程有关,以及丹酚酸A和丹酚酸B联合应用的效果是否较单一药物更佳,则需要进一步的实验。
1.2.3 姜黄素 姜黄素是一种多酚类化合物,具有抗氧化、抗炎和抗肿瘤等活性。在姜黄素抗肺纤维化的研究中,姜黄素能够抑制气道炎症与纤维化症状,同时降低MMP-9活性与α-SMA、MMP-9、TIMP-1及嗜酸性粒细胞趋化因子表达[42]。另外,姜黄素能够通过抑制TGF-β的表达调节肺纤维化中EMT的过程[43]。同时,姜黄素能够降低环氧酶-2(cyclooxygenase,COX-2)、NF-κB、CTGF的表达,升高磷酸化腺苷酸活化蛋白激酶α表达,且该作用可能与腺苷酸活化蛋白激酶α(adenosine monophosphate activated protein kinase,AMPKα)/ COX-2通路有关[44]。此外,还有采用新观念或方法探究姜黄素对肺纤维化保护作用的报道,如姜黄素激活结肠成纤维细胞中相关因子生成并转移至肺部发挥抗肺纤维化作用[45],姜黄素吸入给药新剂型抗肺纤维化作用强度优于普通剂型[46],以及通过蛋白质组学的方法研究姜黄素抗肺纤维化的具体机制,其中包括p38 MAPK,Janus激酶/信号转导子和转录激活子(Janus kinase/signal transducers and activators of transcription,JAK/STAT)等[47]。众多实验表明,姜黄素具有良好的抗肺纤维化作用,且姜黄素吸入给药剂型给药效果显著优于普通剂型,提示抗肺纤维化药物新剂型具有广泛的应用前景。
1.2.4 柯里拉京 柯里拉京是一种逆没食子酸鞣质,能够抑制NF-κB通路及促炎细胞因子(如IL-1β和TNF-α)的生成,并消除氧自由基。而促炎细胞因子及氧自由基的生成是肺纤维化的主要致病机制,因此柯里拉京对肺纤维化可能具有保护作用。研究人员开展了柯里拉京抗肺纤维化的实验,结果表明柯里拉京能够减少肺组织中凋亡细胞的数量,抑制肺正常组织的破坏,逆转博来霉素诱导引起的丙二醛、IκBα激酶复合物(IκB kinase complex α,IKKα)、p-IKKα、NF-κB p65、TNF-α及IL-1β表达增多及抑制因子κBα(inhibitory-κBα,I-κBα)表达的下降的现象,且作用效果随剂量上升而增强。柯里拉京还能够抑制TGF-β1的生成及α-SMA的表达[48]。另一项研究则证实柯里拉京通过其抗凋亡的活性及降低氧化应激水平与促炎介质释放从而缓解肺损伤[49]。综上所述,柯里拉京能够通过抗炎、抑制TGF-β1及α-SMA的表达来抑制肺纤维化进程。
1.2.5 表没食子儿茶素没食子酸酯 表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)是绿茶茶多酚的主要组成部分。研究提示EGCG通过激活Nrf2-Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)通路从而达到缓解肺组织内的氧化应激状态与炎症水平[50]。其他研究发现EGCG能够降低射线诱导的肺纤维化小鼠的死亡率,改善肺组织学变化,减少丙二醛、TGF-β1、IL-6水平与胶原沉积,并激活Nrf2、HO-1[51]。不仅如此,EGCG还能够逆转博来霉素诱导所致MMP-2、MMP-9、TGF-β1、p-Smad3及α-SMA表达上调的现象[52]。结合以上研究结果,EGCG可能是通过其较强的抗氧化能力,并激活体内相关通路从而缓解肺纤维化症状。
1.2.6 没食子酸 没食子酸存在于多种水果中,具有抗氧化、抗炎等药理活性。在抗肺纤维化的研究中,没食子酸能够逆转肺纤维化大鼠肺组织内炎症与纤维化,如胶原沉积、丙二醛与促炎因子水平上升的情况。没食子酸还能够显著升高非酶及酶属性抗氧化剂的含量,且高剂量组效果最优[53]。此外,有报道提示没食子酸能够抑制肺部病变,降低ColI、ColⅢ、纤连蛋白、CTGF及p-Smad3的表达。没食子酸还能够调控EMT过程中相关蛋白基因的表达的情况抑制EMT过程,如N-钙黏蛋白、E-钙黏蛋白、波形纤维蛋白、锌指转录因子(snail family zinc finger 1,Snail1)、twist家族转录因子1等[54]。近期研究发现没食子酸衍生物亦能够减少纤维化小鼠肺组织内炎症细胞浸润,降低ColI、ColⅢ、羟脯氨酸与α-SMA、IL-6、还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶-4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX-4)的表达,并增强抗氧化状态,且该作用与TGF-β1/Smad2信号通路及Nrf2/还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶-4(nicotinamide adenine dinucleotide phosphate oxidase 4,NOX-4)氧化还原平衡有关[55]。没食子酸与槲皮素合用可产生协同作用从而在抗肺纤维化过程中表现出更好的效果[56]。上述研究提示没食子酸能通过多种机制抑制肺纤维化,有望成为抗纤维化治疗药物之一。
1.3 萜类
1.3.1 雷公藤甲素 雷公藤甲素是雷公藤的主要有效成分之一。在射线诱导小鼠肺纤维化模型中雷公藤甲素能够改善小鼠的呼吸频率及肺顺应性,且给药组小鼠存活率高于模型组。此外,给药组小鼠肺组织中与肺纤维化直接相关的细胞因子水平显著降低,如IL-1β、TGF-β1及IL-13[57]。另有研究发现雷公藤甲素能够通过调节氧化还原平衡缓解肺纤维化的程度,主要表现在雷公藤甲素能够降低肺纤维化小鼠肺组织中产生的ROS、NOX-2及NOX-4的水平[58]。此外,雷公藤甲素还可通过调节TGF-β1介导的EMT过程,上调E-钙黏蛋白表达、下调波形纤维蛋白[59]及钙蛋白酶1、2表达[60],下调黏着斑激酶的表达[60],并通过IKKβ/NF-κB[61]通路实现对肺纤维化的治疗作用。尽管在体内实验中具有良好效果,其在临床是否有治疗作用仍需进一步验证。
1.3.2 南蛇藤素 南蛇藤素是从南蛇藤属中分离得到的五环三萜类物质。印度学者Divya发现南蛇藤素可以激活Nrf2,逆转肺纤维化大鼠体内的抗氧化物质如HO-1、谷胱甘肽-S-转移酶、等酶活性下降的病理现象,并降低TNF-α水平及MMP-2、MMP-9的活性[62]。Divya还发现南蛇藤素能够调节与细胞自噬相关因子表达的变化,如上调上调自噬效应蛋白(autophagy effector protein,Beclin-1)及囊泡转运蛋白34(vacuolar protein sorting 34,Vps-34)蛋白表达,促进自噬相关蛋白(autophagy related proteins,Atg,Atg-5-Atg12-16)复合物形成,提高微管相关蛋白轻链3蛋白1(light chain 3 protein-I,LC3-I)、LC3-Ⅱ脂化水平[63],同时调节EMT过程[64]。综上所述,南蛇藤素对肺纤维化的保护作用可能是通过调节氧化还原平衡、自噬以及EMT过程实现的。
1.3.3 紫杉醇 在紫杉醇抗肺纤维化的研究中,紫杉醇缓解了博来霉素导致的大鼠肺指数升高与体内胶原沉积的病理现象。在细胞实验中,紫杉醇通过抑制Smad3/p-Smad3的表达与上调miR-140水平可逆转肺上皮细胞的EMT过程,从而阻断肺纤维化进程[65]。在另外一项研究中,研究人员发现相比模型组,紫杉醇给药组肺纤维化小鼠的ColI、ColⅢ及TGF-β1的表达均下降[66]。紫杉醇对于治疗肺纤维化有一定研究依据,但也有报道显示紫杉醇有引起肺纤维化的可能性[67-68]。因此,如果使用紫杉醇治疗肺纤维化,首先要解决的问题是确认其是否能引起肺纤维化及其具体机制,并在权衡利弊后采用适当的方法规避该风险。
1.3.4 甘草酸 甘草酸是甘草的主要活性成分之一,具有抗炎作用。研究发现,甘草酸可以显著改善大鼠的肺纤维化症状,并能缓解肺部炎症、EMT过程及氧化应激的激活状态。此外,甘草酸还能够呈剂量相关性地抑制成纤维细胞3T6的增生、诱导细胞周期阻滞,并促进细胞凋亡[69]。进一步研究表明,甘草酸能够缓解博来霉素诱导产生的小鼠肺部炎症,并下调胶原沉积及TGF-β1的表达[70]。同时,甘草酸可以抑制肺纤维化过程中小鼠体内TGF-β1、IL-17、p-Smad2表达升高,提示甘草酸可能通过IL-17/TGF-β1/Smad2通路产生抗肺纤维化作用[71]。上述研究表明,甘草酸在实验研究中表现出较好的抗肺纤维化作用,然而,其在临床患者中的具体效果目前尚不明确。
1.3.5 穿心莲内酯 穿心莲内酯是穿心莲的主要有效成分之一,具有抗氧化等多种作用。在肺纤维化小鼠中,穿心莲内酯能够呈剂量相关性地减轻小鼠肺部胶原沉积与炎症细胞累积与浸润,并通过调节EMT相关蛋白的表达从而抑制EMT过程,如下调N-钙黏蛋白、α-SMA及波形纤维蛋白的表达,上调E-钙黏蛋白表达[72]。此外,穿心莲内酯还可以通过TGF-β1/Smad2/3或TGF-β1/ERK1/2通路抑制成纤维细胞增生与分化并诱导其凋亡实现对肺纤维化的保护作用[73]。综上所述,穿心莲内酯主要通过抗炎症、EMT过程或调控TGF-β通路来抗肺纤维化。
1.3.6 枇杷叶三萜酸 枇杷叶三萜酸是枇杷叶中的主要活性成分。研究发现,枇杷叶三萜酸能有效改善肺纤维化大鼠肺部组织结构病变,减轻纤维化程度。同时,枇杷叶三萜酸能显著降低肺纤维化大鼠肺组织中丙二醛水平、提高SOD活力调节氧化还原平衡[74]。体外研究发现,枇杷叶三萜酸能够抑制HFL-1细胞的增生,且该效应随作用时间与剂量的增加而增强。此外,枇杷叶三萜酸能够缓解ColⅠ、ColⅢ、α-SMA及CTGF的过表达,抑制ERK1/2通路[75]。以上研究显示,不论在体外还是体内研究中,枇杷叶三萜酸均表现出对肺纤维化的防治作用。
1.3.7 芍药苷 芍药苷是芍药根中的主要活性成分。研究发现,芍药苷可显著延长小鼠生存期,减轻炎症细胞浸润、间质纤维化程度、细胞外基质沉积,并降低小鼠肺组织内的羟脯氨酸、ColⅠ、α-SMA、TGF-β1与Smad4表达及Smad2/3磷酸化的水平,且作用效果与模型组相比具有显著性差异[76]。在另一项研究中,芍药苷能够减弱TGF-β1对Snail蛋白与Smad2/3的诱导作用,显著上调Smad7水平,提示芍药苷可能通过上调Smad7从而减少Snail蛋白的表达,进而抑制TGF-β诱导的EMT实现抗肺纤维化[77]。综上所述,芍药苷可通过抑制TGF-β通路、α-SMA、Snail蛋白水平来抑制肺纤维化进程。
1.3.8 双氢青蒿素 双氢青蒿素是青蒿素的一个重要衍生物,在抗肺纤维化研究中,双氢青蒿素能够激活Nrf2/HO-1通路,上调抗氧化因子如SOD、GSH的表达水平,同时下调丙二醛水平,显示其可以降低肺纤维化造成的氧化应激损伤[78]。
1.4 皂苷类
1.4.1 黄芪苷 黄芪苷是从黄芪中提取的单体,具有提高SOD活性、改善血管内皮细胞功能的作用。研究发现,黄芪苷能够逆转H2O2刺激BEAS-2B气道上皮细胞所致波形纤维蛋白及ColⅠ表达的上调的情况。在动物实验中,黄芪苷还能够缓解卵清蛋白致敏后导致的小鼠气道组织胶原纤维沉积,并降低ROS水平及波形纤维蛋白的表达,且各给药组均与模型组有显著性差异。除此之外,黄芪苷还能阻断H2O2对自噬相关蛋白如Beclin-1和LC3A/B的诱导表达。亚精胺诱导的自噬影响上皮细胞中E-钙黏蛋白下调及波形纤维蛋白表达上调的现象亦可被黄芪苷抑制[79]。上述研究结果表明,黄芪苷可通过抑制气道中自噬的形成从而缓解ROS介导的支气管纤维化。
1.4.2 人参皂苷Rg1研究显示,人参皂苷Rg1能够修复肺纤维化大鼠的肺组织形态,并显著降低肺指数、肺泡炎评分和肺纤维化评分,以及大鼠肺组织中α-SMA及羟脯氨酸含量。此外,人参皂苷Rg1还能够上调大鼠肺组织中小窝蛋白1表达水平,并下调TGF-β1表达水平[80]。
1.4.3 桔梗皂苷D 在抗肺纤维化的研究中,桔梗皂苷D能够降低大鼠血清Col Ⅰ、Ⅲ型前胶原蛋白肽及透明质酸的含量,并能下调大鼠肺组织mRNA表达。各给药组与模型组相比有显著性差异[81]。
1.4.4 柴胡皂苷d 柴胡皂苷是中药柴胡的主要有效成分,其化学结构有a、b、c、d 4种,其中以柴胡皂苷d的药理作用最强。有研究表明,柴胡皂苷d可通过TGF-β1/Smad信号通路逆转TGF-β1诱导HELF细胞中ColⅠ、α-SMA的表达上调,抑制Smad2/3的磷酸化,上调Smad7的表达实现抗肺纤维化的作用[82]。当柴胡皂苷d与咖啡酸苯乙酯合用时可降低小鼠肺泡炎及纤维化程度,降低肺组织中羟脯氨酸、丙二醛和血清丙二醛水平,并升高肺组织和血清中SOD含量从而调节肺纤维化过程中氧化还原失衡情况[83]。以上研究数据表明,柴胡皂苷d具有良好的抗肺纤维化效果,其作用可能与抗炎、抗脂质过氧化作用和抑制TGF-β1/Smad信号通路有关。
1.5 生物碱类
1.5.1 甲基莲心碱 甲基莲心碱是一种双苄基异喹啉类生物碱,具有降压、抗氧化等药理作用。甲基莲心碱能显著抑制肺纤维化小鼠肺组织中羟脯氨酸水平的升高,并逆转SOD活性下降与丙二醛、髓过氧化物酶(myeloperoxidase,MPO)活性上升,从而调节氧化还原平衡。同时,甲基莲心碱还能减轻博来霉素诱导后小鼠体内TNF-α、IL-6以及血浆或组织中内皮素-1的上升程度,阻断RAW264.7细胞经博来霉素对NF-κB与TGF-β1表达的诱导作用[84]。在另一项研究中,甲基莲心碱能够缓解肺组织病理学检查的异常状况,降低血清表面活性蛋白D的含量,并通过降低IL-4、升高干扰素-γ含量从而调节Th1/Th2平衡[85]。总之,甲基莲心碱在体内、体外研究中均表现出对肺纤维化的治疗作用。
1.5.2 延胡索乙素 延胡索乙素是延胡索的主要有效成分之一,具有抗氧化、抗炎等作用。实验发现延胡索乙素能够显著改善射线对大鼠肺组织造成的损伤,降低支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中细胞聚集及蛋白水平,并通过抑制胶原沉积缓解肺部炎症与纤维化症状[86],抑制细胞凋亡与细胞内ROS的累积[87]。延胡索乙素在实验室的研究中表现出对肺纤维化较好的治疗作用,然而有关延胡索乙素的临床研究目前尚无相关报道。
1.5.3 氧化苦参碱 研究表明,氧化苦参碱可逆转博来霉素所致小鼠肺部病理变化及MPO、丙二醛、TNF-α、IL-6与iNOS水平的上调,降低TGF-β/Smad信号通路中的重要因子如TGF-β1、p-Smad2、p-Smad3的表达[88]。在氧化苦参碱与阿魏酸钠联用治疗肺纤维化的研究中,氧化苦参碱能够显著降低肺纤维化大鼠的死亡率,延长大鼠生存时间、降低大鼠肺湿重/干重比值及组织病理学评分,并降低炎症、氧化相关因子如C-反应蛋白、IL-6、NF-κB、丙二醛的表达水平,上调抗氧化因子SOD活性,揭示氧化苦参碱可能通过抗炎以及抗氧化实现对肺纤维化的治疗作用[89]。上述研究表明,氧化苦参碱能通过抗炎、抗氧化应激来抑制肺纤维化。
1.6 醌类
1.6.1 丹参酮ⅡA丹参酮ⅡA是丹参最主要的脂溶性成分,具有抗炎、心肌保护等生物活性。在丹参酮ⅡA抗肺纤维化的研究中,丹参酮ⅡA能有效缓解肺纤维化的症状与炎症反应,降低TGF-β1的表达,并逆转小鼠肺组织血管紧张素转化酶Ⅱ(angiotensin-converting enzyme Ⅱ,ACE2)与血管紧张素(angiotensin,ANG)表达的下降[90]。研究进一步发现丹参酮ⅡA可抑制EMT过程[91],以及肺纤维化状态下TNF-α、IL-1β、IL-6、COX-2、丙二醛、iNOS、一氧化氮表达上调的情况[92]。在最新的报道中,丹参酮ⅡA可以下调Col Ⅰ、Col Ⅲ及α-SMA的表达[93-94],上调Nrf2的表达[93, 95],同时下调p-Smad2/3并上调Smad7的表达[94]。在与SAB联合应用时,二者通过抑制炎症因子以及肺成纤维细胞增生与分化实现抗肺纤维化的作用[96]。丹参酮ⅡA抗肺纤维化的作用可能与Nrf2/GSH、TGF-β/Smad或Nrf/硫氧还蛋白(thioredoxin,Trx)通路有关,但更明确的机制仍需进一步研究证实。
1.6.2 大黄素 大黄素是大黄中的主要成分。研究发现,大黄素能够降低肺纤维化大鼠肺组织中TGF-β1、Smad3[97]、p-Smad2/3、p-IκBα、NF-κB水平,上调Nrf2表达[98]。大黄素的抗肺纤维化作用可能与其具有的抗炎、抗氧化作用有关。
1.7 其他
1.7.1 藤黄酸 藤黄酸是藤黄的主要活性成分。体外研究表明,藤黄酸能够逆转EMT与内皮-间充质转化的过程与人肺纤维母HLF-1细胞的增生,体内研究发现藤黄酸能够通过调节调节血管生成抑制蛋白(vasohibin,VASH)-2/VASH-1的表达,并抑制TGF-β1/Smad3通路从而实现对肺纤维化的治疗[99]。
1.7.2 蛇床子素 蛇床子素是从蛇床子中提取获得的香豆素衍生物。最新研究发现,肺纤维化大鼠在蛇床子素给药后,其肺纤维化症状及肺部炎症得到缓解,炎症介质如ANGⅡ、TGF-β1表达下调,同时大鼠肺组织中ACE2与ANG(1-7)的生成增加,提示蛇床子素可能通过调节ACE2/ANG(1-7)和抑制炎症通路的途径缓解肺纤维化[100]。蛇床子素亦可以通过抑制NF-κB-Snail通路逆转TGF-β1诱导的A549细胞的EMT过程从而表现出对肺纤维化的积极作用[101]。
1.7.3 厚朴酚 在防治肺纤维化的研究中,厚朴酚能够逆转博来霉素引起的大鼠肺组织内羟脯氨酸水平、MPO活性、TNF-α以及TGF-β水平上升,并显著增强SOD活性,抑制胶原过度沉积,且各给药组与模型组相比均有显著性差异[102]。此外厚朴酚能够降低脂多糖所致急性肺损伤小鼠血清中TNF-α、IL-17、IL-22水平,以及胸腺组织中IL-17、TNF-α和NF-κB p65蛋白的表达水平[103]。上述结果表明厚朴酚可能通过抗炎、抗氧化作用防治肺纤维化。
1.7.4 叶黄素 叶黄素是一种有效的抗氧化剂,可减少游离自由基对人体细胞及器官造成的损伤,从而具有缓解机体衰老等药理活性。研究表明,叶黄素可以降低肺纤维化小鼠肺指数与丙二醛水平,升高GSH-Px、SOD及T-AOC水平,从而抑制肺纤维化进程[104]。叶黄素抗肺纤维化研究较少,仍需进一步实验验证其具体作用效果及作用机制。
1.7.5 红景天苷 红景天苷是红景天主要活性成分之一。研究人员发现红景天苷能够缓解博来霉素引起的大鼠肺组织变形、氧化应激损害以及过度的炎性浸润与炎性细胞因子释放等病理改变,并且该效应与剂量呈正相关。此外,红景天苷还能够抑制IκBα磷酸化及NF-κB p65核累积,下调波形纤维蛋白、纤连蛋白、α-SMA、TGF-β1、p-Smad2/3的表达,同时上调E-钙黏蛋白的表达,并激活Nrf2抗氧化信号通路,逆转体外研究中TGF-β1诱导的肺泡上皮细胞EMT样改变[105]。在另一项研究中,红景天苷表现出降低肺纤维化大鼠体内α-SMA及ColI相关mRNA表达的作用[106]。上述结果提示红景天苷对于肺纤维化有一定的缓解作用,但对于其具体作用机制,仍需要进一步探索。
1.7.6 大蒜素 大蒜素是大蒜中的主要有效成分,不仅能够降低大鼠肺组织内α-SMA与TGF-β1的表达及羟脯氨酸的水平[107],还能降低、mRNA的表达,缓解肺纤维化的症状[108]。中药单体成分往往是补气药、清热药、活血化瘀药、止咳平喘药中单味药主要成分或特征性成分,提示发现新的抗肺纤维化中药活性成分可以从具有这些功效的单味药中进行寻找。
中药单体活性成分抗肺纤维化的作用见表1。
2 中药复方
肺纤维化属本虚标实之证,病因主要为正气虚弱,虚火上炎,伤及肺阴,痰瘀阻络,临床主要表现为咳、喘、痰、痛、热、呼吸困难等,晚期还可出现口唇紫绀等症状。中药单体成分对肺纤维化的治疗作用具有局限性,难以完全治疗病机复杂的疾病。临床可以根据益气养阴、活血化瘀、化痰平喘、清热解毒等法采用复方进行治疗,取得了较好的治疗效果。

表1 中药单体活性成分的抗肺纤维化作用
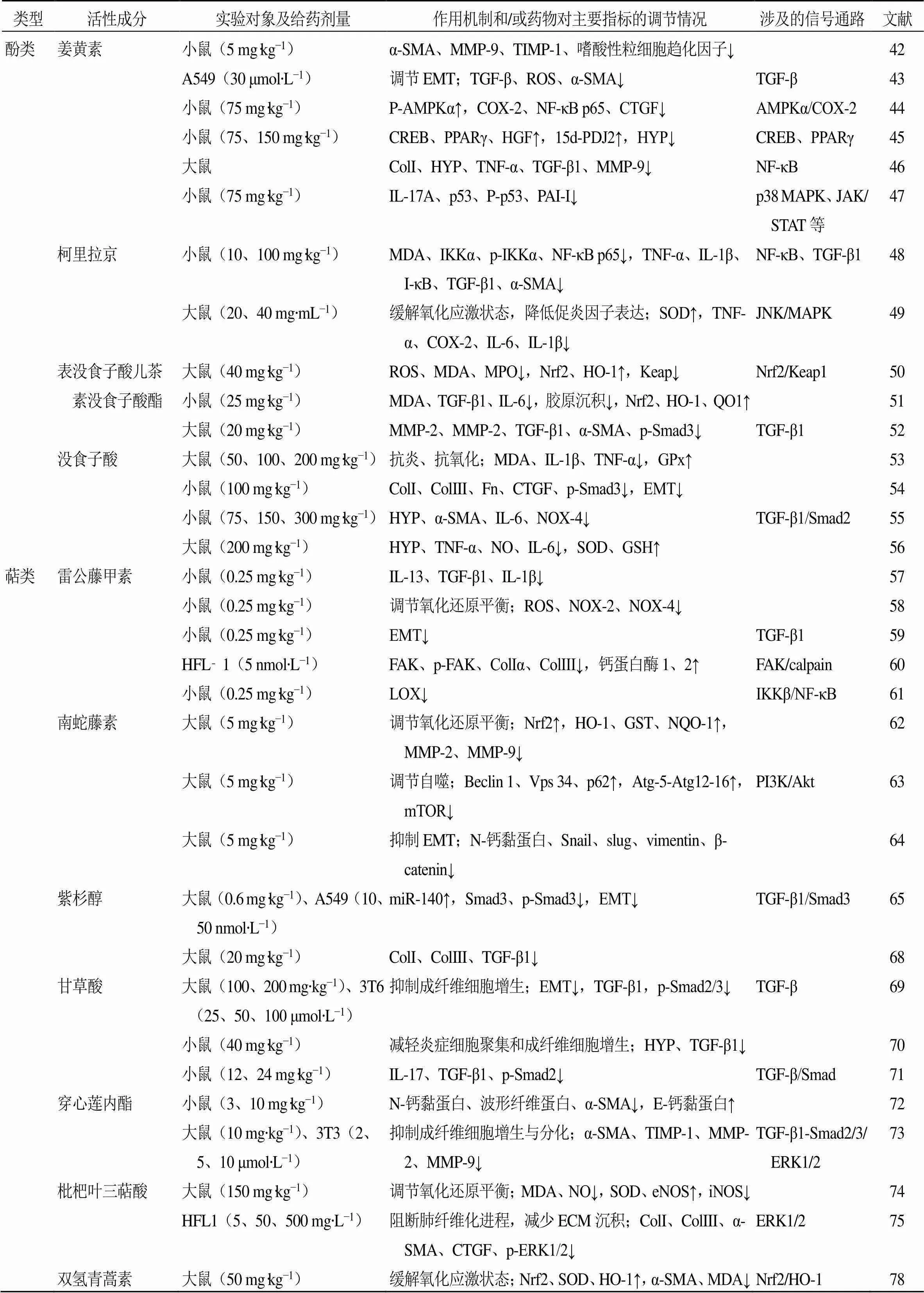
续表1
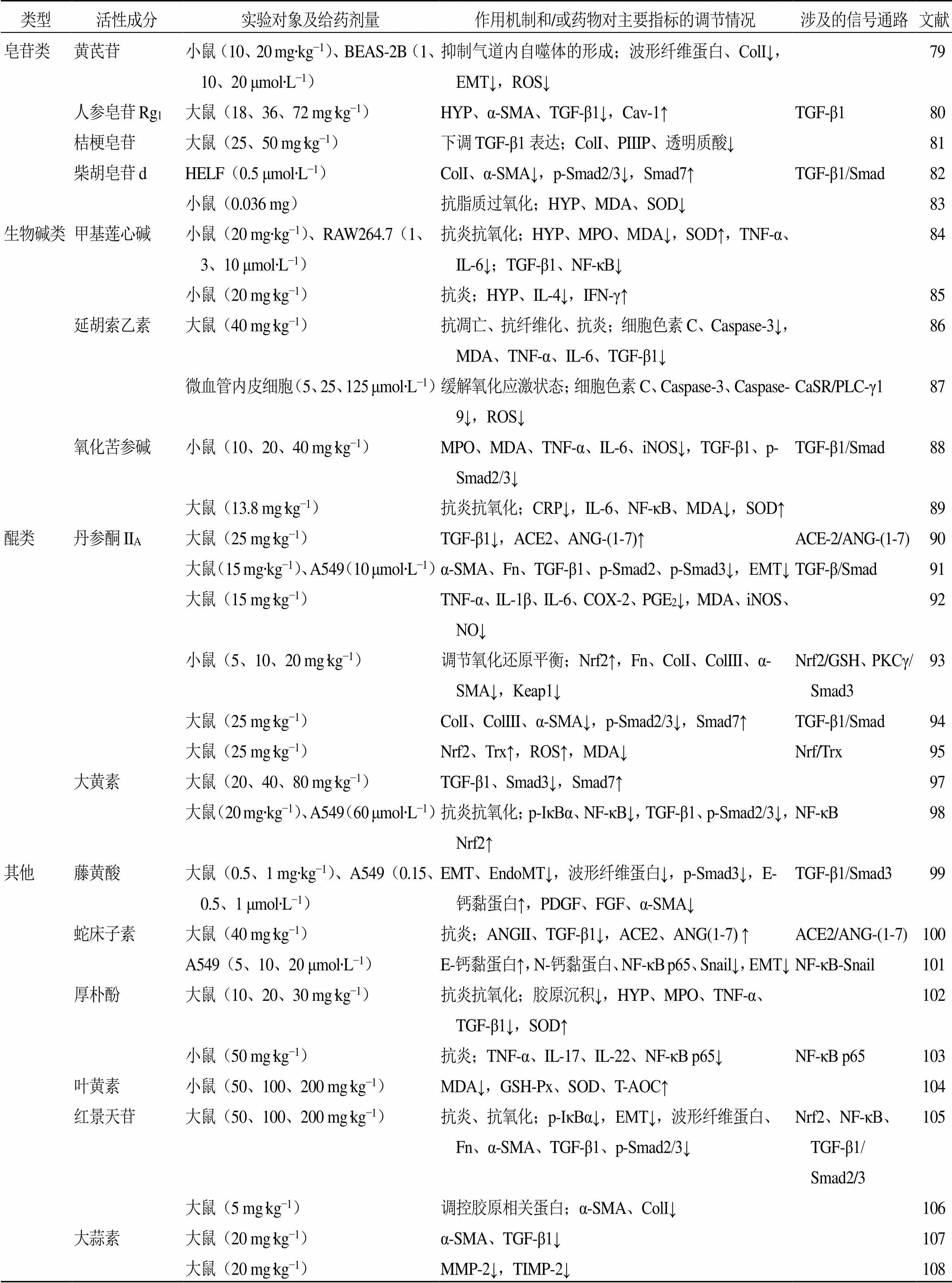
续表1
↑表示上升 ↓表示下降
↑ means rising ↓ means falling
2.1 益气养阴类
2.1.1 麦门冬汤 麦门冬汤由麦门冬、半夏等组成。据研究报道,麦冬门汤(10、20 g浓缩水煎剂/kg,ig)可降低肺纤维化大鼠肺组织中TGF-β1、Smad3蛋白含量,升高Smad7蛋白含量,从而实现抗肺纤维化的目的[109]。
2.1.2 养阴益气合剂 养阴益气合剂由黄芪、党参、北沙参、黄精、玄参等中药组成,具有益气养阴、祛瘀活血的功效。在22、44 g生药/kg给药剂量下,养阴益气合剂可改善肺纤维化大鼠肺组织胶原沉积,降低肺组织中羟脯氨酸、MMP-9和TIMP-1水平[110]。
2.1.3 玉屏风散 玉屏风由黄芪、白术、防风配伍而成,临床上可用于治疗呼吸道感染等呼吸系统疾病。研究发现,玉屏风能够缓解博来霉素所致大鼠的肺泡炎与纤维化程度,缓解大鼠体质量降低程度,并能降低肺指数。除此之外,玉屏风还能显著降低肺组织中羟脯氨酸、α-SMA、高迁移率蛋白1、层黏蛋白、透明质酸、波形纤维蛋白、ColI、TGF-β1的表达水平,并上调E-钙黏蛋白的含量[111-113]。上述实验结果表明,玉屏风抗肺纤维化的作用机制可能与抑制纤维化进程中的EMT过程以及相关蛋白表达相关。
2.2 活血化瘀类
2.2.1 血府逐瘀汤 血府逐瘀汤由桃仁、红花、甘草等组成。研究发现,血府逐瘀汤(3.51、7.02、14.04 g生药/kg,ig)可以降低肺纤维化大鼠肺组织中Smad3和MMP-7蛋白表达,降低大鼠肺指数,改善肺泡炎的程度,且各给药组与模型组差异显著[114]。另有研究表明,当ig剂量为18.75、31.25 g生药/kg时,血府逐瘀汤可降低肺纤维化大鼠肺组织羟脯氨酸水平,降低血清丙二醛、透明质酸的水平,增加血清SOD活性,并调节细胞外基质的代谢状况来改善肺纤维化[115]。综上所述,血府逐瘀汤可抑制Smad3、MMP-7表达从而减少ECM沉积及氧化应激过程来抑制肺纤维化。
2.2.2 丹芍化纤 丹芍化纤由丹参、赤芍、黄芪、银杏叶等组成,具有活血化淤、通络软坚之功效。丹芍化纤(0.8 g/kg,ig)能够降低肺纤维化大鼠肺指数、肺组织中胶原沉积、羟脯氨酸与CTGF水平[116],并降低肺组织中丙二醛水平,升高SOD酶活性,并降低TGF-β通路中TGF-β1及Smad3蛋白的表达来抑制肺纤维化进程[117-118]。以上研究提示丹芍化纤可能通过降低肺组织胶原沉积、抑制氧化应激与TGF-β通路发挥抗肺纤维化作用。
2.2.3 化瘀理肺方 化瘀理肺方由丹参、半夏、当归、黄芪等组成。研究发现,化瘀理肺方(13.41 g/kg,ig)可有效缓解大鼠肺泡炎和肺纤维化程度,升高大鼠肺组织中Smad7水平[119-120],降低Smad3水平[119]。另有研究表明,化瘀理肺方(13.41 g/kg,ig)能够降低肺纤维化大鼠肺组织中TNF-α、IL-4水平,提高INF-γ水平,从而缓解肺纤维化的症状[121]。以上研究揭示了化瘀理肺方对肺纤维化的治疗作用以及其可能的作用机制。
2.3 益气补肺、活血通络类
肺纤维的病机在于气阴两虚,并兼有痰、瘀、热之邪,中医治疗以益气养阴为主,活血化瘀为辅,标本兼治。
2.3.1 当归补血汤 当归补血汤由黄芪、当归组成。为补益剂,具有补血之功效。研究发现,其在肺纤维化的防治中具有一定功效,如减轻肺纤维化大鼠体质量降低的程度,降低肺指数,下调TNF-α、TGF-β1、ColⅠ水平。此外,当归补血汤还能缓解肺纤维化大鼠肺泡炎与肺纤维化程度,显著降低血清中透明质酸、层黏蛋白、Ⅲ型前胶原和ColⅣ水平,并降低、、mRNA的表达。高剂量组效果最显著,呈剂量相关性[122-123]。进一步的研究证实当归补血汤能够降低肺纤维化大鼠肺组织中TGF-β1、羟脯氨酸[124-125]、ColⅠ、α-SMA、丙二醛、NOX-4[125]、肺泡炎评分、PAI-1、IL-4、IL-7水平[124],并升高SOD、T-AOC水平[125]。上述研究提示当归补血汤的抗肺纤维化作用可能与抑制氧化应激、EMT过程有关。
2.3.2 人参平肺方 人参平肺方由人参、地骨皮、甘草、知母等组成。在抗肺纤维化的研究中,人参平肺方能够显著降低肺纤维化大鼠的肺指数,降低肺泡炎症及肺纤维化程度,降低BALF中TGF-β1、NF-κB及TNF-α水平,升高γ干扰素水平,同时肺组织中TGF-β1、Smad2、Smad3及ERK1/2的蛋白表达亦被药物抑制,提示人参平肺方能够抑制肺纤维化,其作用机制可能为抑制TGF-β1/Smad通路及炎症过程。在该项研究中,各给药组均与模型组差异显著,其中高、中剂量组效果较好[126]。
2.3.3 补阳还五汤 补阳还五汤由黄芪、当归尾、赤芍、地龙、川穹、红花、桃仁组成,是益气活血的代表方剂,具有补气祛瘀、改善机体炎症反应的功效。研究表明,补阳还五汤(5、10 g/kg)能够显著降低肺纤维化大鼠血清中ColⅠ、ColⅢ,以及p-Akt、CTGF水平,并能下调p-Akt与CTGF的表达[127]。补阳还五汤(4.62、9.24、18.48 g/kg)能够降低大鼠肺泡炎和肺纤维化评分,下调肺组织中TGF-β1、p-ERK、ERK1/2表达。此外,补阳还五汤还能够通过干预TGF-β1/Smad信号通路降低Smad3蛋白表达,同时促进Smad7蛋白表达[128-129]。大量研究表明,补阳还五汤能通过多种途径,抑制多种蛋白表达来抑制肺纤维化,其作用机制可能是:(1)降低胶原蛋白形成及p-ERK、ERK1/2表达来抑制肺纤维化进程;(2)抑制TGF-β1/Smad信号通路,减轻纤维化程度。
2.3.4 补肾益肺消癥方 补肾益肺消癥方由当归、熟地黄、陈皮、法半夏、浙贝母、水蛭、炙甘草组成,具有化痰理气、滋肾养血、通络消癥的功效。补肾益肺消癥方可以降低肺纤维化大鼠Caspase-12通路基因及相关蛋白表达[130],缓解内质网应激反应[131]。此外,补肾益肺消癥方还可下调肺纤维化大鼠血清中TGF-β1以及Smad2/3的表达[132]。上述实验说明,补肾益肺消癥方对大鼠肺纤维化有保护作用,其作用机制可能与抑制Caspase-12信号通路、TGF-β/Smad信号通路,缓解内质网应激反应有关。
2.3.5 参麦开肺散 参麦开肺散由丹参、西洋参、麦冬、绞股蓝、半夏等组成,具有益气通络、活血化瘀的作用。研究发现,参麦开肺散(0.2 g/mL,2次/d,0.2 mL/次,ig)可通过抑制TGF-β通路,降低ECM相关蛋白表达,上调抗氧化相关蛋白的表达水平[133],并在5 mg/(kg∙d) 剂量时可降低与肺纤维化发生发展相关的基因如、与的表达从而减少胶原的生成[134],缓解肺纤维化过程。上述实验表明,参麦开肺散对肺纤维化潜在保护机制可能是:(1)通过抑制TGF-β通路,氧化应激过程;(2)减少胶原表达,平衡ECM过程。
2.3.6 肺纤方 肺纤方是由柴胡、黄芩、党参等14味中药组成,具有补肺肾阴、化肺络瘀的功效。研究表明,肺纤方(0.8、1.6、3.2 g/kg,ig)能够改善肺纤维化大鼠肺指数,升高肺组织中GSH-Px和SOD水平,降低丙二醛、一氧化氮水平,并降低血清中TGF-β1、PDGF及TNF-α水平。各给药组与模型组相比均有明显差异,且作用效果与给药剂量呈正相关[135]。上述实验表明,肺纤方可能是通过缓解氧化应激过程、降低炎症因子表达从而抑制大鼠的肺纤维化进程。
2.3.7 三参保肺饮颗粒 三参保肺饮颗粒由党参、丹参、蛤蚧等组成,研究结果显示,ig 14 g/kg可以下调肺纤维化大鼠肺组织中ColⅠ、ColⅢ及TGF-β1的表达,缓解肺纤维化进程[136]。
2.3.8 参龙煎剂 参龙煎剂是由黄芪、北沙参、熟地黄、广地龙、当归、川芎、甘草等组成,具有益气养阴、活血通络的功效。参龙煎剂(0.755、1.51、3.02 g生药/kg,ig)能够上调大鼠血清中γ干扰素水平,并降低IL-4水平[137]。
2.3.9 养肺活血方 养肺活血方由丹参、川芎等组成,具有补气养阴、通络之功效。养肺活血方(6.75 g生药/kg,ig)可显著缓解平阳霉素诱导的肺纤维化大鼠肺泡炎症程度及评分,显著降低血清中IL-4、TNF-α及γ干扰素水平,显著降低肺组织TGF-β与CTGF蛋白含量[138]。
2.4 止咳平喘、利水平喘类
2.4.1 补肺汤 补肺汤是中医治疗肺气虚的经典处方,由人参、黄芪、熟地、五味子、紫菀、桑白皮组成,具有补气益肺、止咳平喘的功效。在其抗肺纤维化的研究中,研究人员发现其可降低肺纤维化大鼠肺组织TGF-β1水平[139],抑制大鼠肺部早期肺泡炎的发生,降低肺组织中MMP-9及TIMP-1蛋白的表达,并通过对细胞外基质异常代谢的调节实现对肺纤维化的改善作用[140]。结果表明,补肺汤能抑制纤维化大鼠病变程度,可能的作用机制为:(1)抑制TGF-β1表达;(2)降低肺组织MMP-9与TIMP-1蛋白表达,纠正MMP-9/TIMP-1失衡,改善细胞外基质的异常代谢。
2.4.2 泻肺汤 泻肺汤是由葶苈子、生地黄等组成,具有利尿平喘、润肺润燥、清热解毒之功效。在抗肺纤维化的研究中,泻肺汤(10、20、40 g生药/kg,ig)可呈剂量相关性地下调肺纤维化大鼠血清中TGF-β1、Smad2蛋白含量,上调肺组织中Smad7蛋白含量,并显著上调BALF中SOD的活性,下调丙二醛水平[141],降低肺纤维化大鼠肺指数以及肺组织中一氧化氮、羟脯氨酸水平和NOS活性,增强肺组织中SOD与血清中CAT的活性[142]。上述研究表明,泻肺汤对大鼠肺纤维化有较强的干预作用,且可能是通过抑制TGF-β1/Smad通路、氧化应激过程来发挥药效。
2.4.3 十枣汤 十枣汤由是由甘遂、大戟、芫花组成。研究表明,当ig剂量为135、270、710 mg生药/kg时,十枣汤可降低肺纤维化大鼠血清中TNF-α、TGF-β1水平,延缓肺纤维化进展,并减轻肺纤维化的程度[143]。
2.5 化痰平喘、活血通络类
2.5.1 润肺汤 润肺汤由桃仁、炙甘草、桔梗等组成,能够降低患者接受射线治疗后肺炎与纤维化的发生率,以及血清中TGF-β1、IL-6水平,提示润肺汤可用于降低放射性肺炎的损伤[144]。
2.5.2 益气化瘀化痰方 益气化瘀化痰方是由黄芪、白术、川穹等组成。研究发现,益气化瘀化痰方(3.6 g生药/kg,ig)可降低肺纤维化大鼠肺指数,下调TGF-β1、Snail1和纤连蛋白表达,上调E-钙黏蛋白表达[145]。结果表明,其抗肺纤维化作用机制可能与调控TGF-β1/Snail1信号通路从而抑制大鼠的EMT过程有关。
2.5.3 宣肺化瘀方 宣肺化瘀方由生石膏、苦杏仁、瓜蒌皮等组成,具有活血化瘀的功效。研究表明,宣肺化瘀方(3.60、7.19、14.38 g/kg,ig)能够降低肺纤维化大鼠肺组织中羟脯氨酸、TGF-β1、Smad2、Smad4、p-Smad2及α-SMA水平,并升高Smad7蛋白含量,从而抑制肺纤维化的进程。在该研究中,各给药组与模型组相比均有显著性差异,且作用效果随剂量增加而增强[146]。上述研究数据表明,宣肺化瘀方可能通过调控大鼠体内TGF-β/Smad信号通路,进而抑制α-SMA蛋白的过表达来发挥抗肺纤维化作用。
2.5.4 固本平喘汤 固本平喘汤由炙麻黄、苦杏仁、甘草等组成,具有宣肺平喘、培本固元、活血通络之功效。研究发现,当ig剂量为2.7、10.8 g生药/kg时,固本平喘汤能够降低肺纤维化大鼠血浆中层黏连蛋白的含量,且各给药组与模型组相比均具有显著性差异[147]。
2.5.5 小青龙汤 小青龙汤由五味子、干姜、炙甘草等组成,当ig剂量为4.8 g生药/kg时可通过降低大鼠血清中IL-5、IL-13水平来改善大鼠肺纤维化程度,且其与射干麻黄汤合方应用时效果更佳[148]。
2.6 其他治则类
2.6.1 助阳补肺除痹颗粒 助阳补肺除痹颗粒由鹿茸、熟地黄、当归等组成,有滋阴补血、益肾填精、散寒除湿、通络散结之功效。研究发现,助阳补肺除痹颗粒(2.32、4.64、9.28 g/kg,ig)能够增强肺纤维化大鼠肺组织SOD活性,降低丙二醛水平,其中高剂量组效果最佳,呈剂量相关性[149]。此外,助阳补肺除痹颗粒(3.5 g/kg,ig)可降低肺纤维化大鼠肺组织中Notch1、Jagged1、CD54、ADAM17、VCAM-1蛋白的表达,同时升高peroxiredoxin3蛋白表达[150]。综上所述,助阳补肺除痹颗粒有减弱肺纤维化的作用,其保护机制可能包括抑制自由基的产生与抗炎抗氧化。
2.6.2 虫草复方 虫草复方由冬虫夏草和三七总皂苷组成,其(75、150 mg/kg,ig)能够显著改善大鼠肺纤维化症状,降低肺纤维化大鼠肺指数以及肺组织中羟脯氨酸水平,并提高肺组织中SOD活性,减少TGF-β1、ColI、ColIII的表达[151]。
3 结语与展望
肺纤维化机制比较复杂,包括肺泡上皮细胞受损、炎症细胞聚集和活化、细胞凋亡和纤维细胞增生及胶原产生和沉积等,目前中药用于防治肺纤维化的研究中,涉及到的机制主要有抗自由基损伤、调节机体免疫功能、抑制炎性因子释放、降低应激反应强度、干扰胶原代谢、减少胶原蛋白生成等,涉及到的信号通路有TGF-β1/Smad、PI3K/Akt、Nrf2/Akt、SphK1/S1P、CaSR/PLC-γ1等,且各信号通路之间又相互联系、互相影响,肺纤维化过程中涉及到氧化应激、炎症、免疫等病理过程。当细胞损伤时,释放出各种生物因子包括TNF-α、TGF-β1、IL-1β、IL-6等使肺成纤维细胞活化、增生及产生胶原和细胞外基质形成纤维化。中药及其有效成分能够有效改善实验动物的纤维化症状并延缓病程进展,表明中药尤其复方在通过辨证论治采用益气养阴、活血化瘀、化痰平喘、清热解毒等治则防治肺纤维化的临床应用中具有较好的前景[152]。吸入剂新剂型使用方便,且给药后药物可有效沉积在肺部从而获取较好的治疗效果,近年来逐渐获得广泛关注。研究表明,吸入剂在治疗肺纤维化中表现出较好的作用[46,66,153],且相比ig给药,雾化吸入治疗的方法有更好的治疗效果[71]。
随着研究的不断深入,越来越多的中药在实验研究中表现出良好的抗纤维化活性。然而,肺纤维化机制较为复杂,中药复方组成也很复杂,抗肺纤维化新药的开发需在中医药理论指导下结合新方法、新技术如网络药理学、人工智能等开展对肺纤维化干预、治疗,深入阐明其机制,进而精简处方,发现活性成分,实现精准用药,进一步开发成国际认可、临床确切有效的抗肺纤维化药物。
利益冲突 所有作者均声明不存在利益冲突
[1] Fernandez I E, Eickelberg O.New cellular and molecular mechanisms of lung injury and fibrosis in idiopathic pulmonary fibrosis [J]., 2012, 380(9842): 680-688.
[2] Nathan S D, Shlobin O A, Weir N,.Long-term course and prognosis of idiopathic pulmonary fibrosis in the new millennium [J]., 2011, 140(1): 221-229.
[3] Coward W R, Saini G, Jenkins G.The pathogenesis of idiopathic pulmonary fibrosis [J]., 2010, 4(6): 367-388.
[4] Selman M, Buendía-Roldán I, Pardo A.Aging and pulmonary fibrosis [J]., 2016, 68(2): 75-83.
[5] Sgalla G, Iovene B, Calvello M,.Idiopathic pulmonary fibrosis: Pathogenesis and management [J]., 2018, 19(1): 32.
[6] Roskova E, Solovic I, Matula B.Idiopathic pulmonary fibrosis-unknown cause, global occurrence and new medical possibilities [J]., 2018, 8(2): 272-276.
[7] Hutchinson J, Fogarty A, Hubbard R,.Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review [J]., 2015, 46(3): 795-806.
[8] Sgalla G, Biffi A, Richeldi L.Idiopathic pulmonary fibrosis: Diagnosis, epidemiology and natural history [J]., 2016, 21(3): 427-437.
[9] Idiopathic Pulmonary Fibrosis Clinical Research Network, Raghu G, Anstrom K J,.Prednisone, azathioprine, and-acetylcysteine for pulmonary fibrosis [J]., 2012, 366(21): 1968-1977.
[10] Gao Y, Lu J, Zhang Y,.Baicalein attenuates bleomycin-induced pulmonary fibrosis in rats through inhibition of miR-21 [J]., 2013, 26(6): 649-654.
[11] Cui X J, Sun X H, Lu F Q,.Baicalein represses TGF-β1-induced fibroblast differentiation through the inhibition of miR-21 [J]., 2018, 358: 35-42.
[12] Sun X H, Cui X J, Chen X H,.Baicalein alleviated TGF β1-induced type I collagen production in lung fibroblasts via downregulation of connective tissue growth factor [J]., 2020, 131: 110744.
[13] Liu T, Dai W J, Li C,.Baicalin alleviates silica-induced lung inflammation and fibrosis by inhibiting the Th17 response in C57BL/6 mice [J]., 2015, 78(12): 3049-3057.
[14] Huang X Y, He Y C, Chen Y F,.Baicalin attenuates bleomycin-induced pulmonary fibrosis via adenosine A2a receptor related TGF-β1-induced ERK1/2 signaling pathway [J]., 2016, 16(1): 132.
[15] Zhao H, Li C D, Li L N,.Baicalin alleviates bleomycin‑induced pulmonary fibrosis and fibroblast proliferation in rats via the PI3K/AKT signaling pathway [J]., 2020, 21(6): 2321-2334.
[16] 蔡健, 顾振纶, 蒋小岗, 等.黄芩总黄酮对博莱霉素致大鼠肺纤维化的干预作用及其机制研究 [J].中草药, 2012, 43(1): 119-124.
[17] Wei Q F, Wang X H, Zhang X Y,Therapeutic effects of quercetin on bleomycin induced pulmonary fibrosis in rats [J]., 2016, 9(2): 5161-5167.
[18] Zhang X C, Cai Y L, Zhang W,.Quercetin ameliorates pulmonary fibrosis by inhibiting SphK1/S1P signaling [J]., 2018, 96(6): 742-751.
[19] Veith C, Drent M, Bast A,.The disturbed redox-balance in pulmonary fibrosis is modulated by the plant flavonoid quercetin [J]., 2017, 336: 40-48.
[20] Boots A W, Veith C, Albrecht C,.The dietary antioxidant quercetin reduces hallmarks of bleomycin-induced lung fibrogenesis in mice [J]., 2020, 20(1): 112.
[21] Hohmann M S, Habiel D M, Coelho A L,.Quercetin enhances ligand-induced apoptosis in senescent idiopathic pulmonary fibrosis fibroblasts and reduces lung fibrosis[J]., 2019, 60(1): 28-40.
[22] Takano M, Deguchi J, Senoo S,.Suppressive effect of quercetin against bleomycin-induced epithelial-mesenchymal transition in alveolar epithelial cells [J]., 2020, 35(6): 522-526.
[23] Wang L, Jin M, Zang B X,.Inhibitory effect of safflor yellow on pulmonary fibrosis [J]., 2011, 34(4): 511-516.
[24] Jin M, Sun C Y, Pei C Q,.Effect of safflor yellow injection on inhibiting lipopolysaccharide-induced pulmonary inflammatory injury in mice [J]., 2013, 19(11): 836-843.
[25] Li H, Kan B T, Song L L,.Role of the Hippo signaling pathway in safflower yellow pigment treatment of paraquat-induced pulmonary fibrosis [J]., 2020, 48(9): 300060520905425.
[26] Turgut N H, Kara H, Elagoz S,.The protective effect of naringin against bleomycin-induced pulmonary fibrosis in Wistar rats [J]., 2016, 2016: 7601393.
[27] Chen Y, Nie Y C, Luo Y L,.Protective effects of naringin against paraquat-induced acute lung injury and pulmonary fibrosis in mice [J]., 2013, 58: 133-140.
[28] Zhang H, Liu X F, Chen S,.Tectorigenin inhibits theproliferation and enhances miR-338* expression of pulmonary fibroblasts in rats with idiopathic pulmonary fibrosis [J]., 2010, 131(1): 165-173.
[29] Ma C H, Liu J P, Qu R,.Tectorigenin inhibits the inflammation of LPS-induced acute lung injury in mice [J]., 2014, 12(11): 841-846.
[30] Wang Y P, Jing W C, Qu W Y,.Tectorigenin inhibits inflammation and pulmonary fibrosis in allergic asthma model of ovalbumin-sensitized Guinea pigs [J]., 2020, 72(7): 956-968.
[31] Agackiran Y, Gul H, Gunay E,.The efficiency of proanthocyanidin in an experimental pulmonary fibrosis model: Comparison with taurine [J]., 2012, 35(4): 1402-1410.
[32] 肖清萍, 孙坚.葛根素对大鼠肺纤维化的干预研究 [J].江西医药, 2015, 50(9): 883-886.
[33] Hu X, Huang X.Alleviation of inflammatory response of pulmonary fibrosis in acute respiratory distress syndrome by puerarin via transforming growth factor (TGF-β1) [J]., 2019, 25: 6523-6531.
[34] Zhang Y Q, Liu Y J, Mao Y F,.Resveratrol ameliorates lipopolysaccharide-induced epithelial mesenchymal transition and pulmonary fibrosis through suppression of oxidative stress and transforming growth factor-β1 signaling [J]., 2015, 34(4): 752-760.
[35] Wang J, He F, Chen L Q,.Resveratrol inhibits pulmonary fibrosis by regulating miR-21 through MAPK/ AP-1 pathways [J]., 2018, 105: 37-44.
[36] Azmoonfar R, Amini P, Yahyapour R,.Mitigation of radiation-induced pneumonitis and lung fibrosis using alpha-lipoic acid and resveratrol [J]., 2020, 19(2): 149-157.
[37] Ding S, Wang H, Wang M,.Resveratrol alleviates chronic “real-world” ambient particulate matter-induced lung inflammation and fibrosis by inhibiting NLRP3 inflammasome activation in mice [J]., 2019, 182: 109425.
[38] Pan Y, Fu H, Kong Q,.Prevention of pulmonary fibrosis with salvianolic acid a by inducing fibroblast cell cycle arrest and promoting apoptosis [J]., 2014, 155(3): 1589-1596.
[39] Liu Q, Chu H, Ma Y,.Salvianolic acid B attenuates experimental pulmonary fibrosis through inhibition of the TGF-β signaling pathway [J]., 2016, 6: 27610.
[40] Liu B, Cao B, Zhang D,.Salvianolic acid B protects against paraquat-induced pulmonary injury by mediating Nrf2/Nox4 redox balance and TGF-β1/Smad3 signaling [J]., 2016, 309: 111-120.
[41] Liu M, Xu H Y, Zhang L,.Salvianolic acid B inhibits myofibroblast transdifferentiation in experimental pulmonary fibrosis via the up-regulation of Nrf2 [J]., 2018, 495(1): 325-331.
[42] Chauhan P S, Dash D, Singh R.Intranasal curcumin inhibits pulmonary fibrosis by modulating matrix metalloproteinase-9 (MMP-9) in ovalbumin-induced chronic asthma [J]., 2017, 40(1): 248-258.
[43] Tyagi N, Singh D K, Dash D,.Curcumin modulates paraquat-induced epithelial to mesenchymal transition by regulating transforming growth factor-β (TGF-β) in A549 cells [J]., 2019, 42(4): 1441-1455.
[44] Shaikh S B, Prabhakar Bhandary Y.Effect of curcumin on IL-17A mediated pulmonary AMPK kinase/cyclooxygenase-2 expressions via activation of NF-κB in bleomycin-induced acute lung injury[J]., 2020, 85: 106676.
[45] Miao Y M, Zhang Y J, Qiao S M,.Oral administration of curcumin ameliorates pulmonary fibrosis in mice through 15d-PGJ2-mediated induction of hepatocyte growth factor in the colon [J]., 2021, 42(3): 422-435.
[46] Hu Y, Li M, Zhang M,.Inhalation treatment of idiopathic pulmonary fibrosis with curcumin large porous microparticles [J]., 2018, 551(1/2): 212-222.
[47] Gouda M M, Rex D A B, Es S P,.Proteomics analysis revealed the importance of inflammation-mediated downstream pathways and the protective role of curcumin in bleomycin-induced pulmonary fibrosis in C57BL/6 mice [J]., 2020, 19(8): 2950-2963.
[48] Wang Z, Guo Q Y, Zhang X J,.Corilagin attenuates aerosol bleomycin-induced experimental lung injury [J]., 2014, 15(6): 9762-9779.
[49] Guo S X, Fu Y, Xiong S M,.Corilagin protects the acute lung injury by ameliorating the apoptosis pathway [J]., 2017, 95: 1743-1748.
[50] Shanmugam T, Selvaraj M, Poomalai S.Epigallocatechin gallate potentially abrogates fluoride induced lung oxidative stress, inflammation via Nrf2/Keap1 signaling pathway in rats: Anand in-silico study [J]., 2016, 39: 128-139.
[51] You H, Wei L, Sun W L,.The green tea extract epigallocatechin-3-gallate inhibits irradiation-induced pulmonary fibrosis in adult rats [J]., 2014, 34(1): 92-102.
[52] Sriram N, Kalayarasan S, Manikandan R,.Epigallocatechin gallate attenuates fibroblast proliferation and excessive collagen production by effectively intervening TGF-β1 signalling [J]., 2015, 42(8): 849-859.
[53] Nikbakht J, Hemmati A A, Arzi A,.Protective effect of gallic acid against bleomycin-induced pulmonary fibrosis in rats [J]., 2015, 67(6): 1061-1067.
[54] Jin L, Piao Z H, Sun S M,.Gallic acid attenuates pulmonary fibrosis in a mouse model of transverse aortic contraction-induced heart failure [J]., 2017, 99: 74-82.
[55] Rong Y, Cao B, Liu B,.A novel Gallic acid derivative attenuates BLM-induced pulmonary fibrosis in mice [J]., 2018, 64: 183-191.
[56] Mehrzadi S, Hosseini P, Mehrabani M,.Attenuation of bleomycin-induced pulmonary fibrosis in Wistar rats by combination treatment of two natural phenolic compounds: Quercetin and Gallic acid [J]., 2020: 1-11.
[57] Yang S, Zhang M, Chen C,.Triptolide mitigates radiation-induced pulmonary fibrosis [J]., 2015, 184(5): 509-517.
[58] Chen C, Yang S M, Zhang M,.Triptolide mitigates radiation-induced pulmonary fibrosis via inhibition of axis of alveolar macrophages-NOXes-ROS-myofibroblasts [J]., 2016, 17(4): 381-389.
[59] Chen H, Chen Q, Jiang C M,.Triptolide suppresses paraquat induced idiopathic pulmonary fibrosis by inhibiting TGFB1-dependent epithelial mesenchymal transition [J]., 2018, 284: 1-9.
[60] Zhang P H, Liu J, Zong R K.Triptolide protects against TGF‑β1‑induced pulmonary fibrosis by regulating FAK/ calpain signaling [J]., 2019, 18(6): 4781-4789.
[61] Guo K N, Chen J R, Chen Z J,.Triptolide alleviates radiation-induced pulmonary fibrosis via inhibiting IKKβ stimulated LOX production [J]., 2020, 527(1): 283-288.
[62] Divya T, Dineshbabu V, Soumyakrishnan S,.Celastrol enhances Nrf2 mediated antioxidant enzymes and exhibits anti-fibrotic effect through regulation of collagen production against bleomycin-induced pulmonary fibrosis [J]., 2016, 246: 52-62.
[63] Divya T, Sureshkumar A, Sudhandiran G.Autophagy induction by celastrol augments protection against bleomycin- induced experimental pulmonary fibrosis in rats: Role of adaptor protein p62/SQSTM1 [J]., 2017, 45: 47-61.
[64] Divya T, Velavan B, Sudhandiran G.Regulation of transforming growth factor-β/smad-mediated epithelial-mesenchymal transition by celastrol provides protection against bleomycin-induced pulmonary fibrosis [J]., 2018, 123(2): 122-129.
[65] Wang C, Song X, Li Y,.Low-dose paclitaxel ameliorates pulmonary fibrosis by suppressing TGF-β1/ Smad3 pathway via miR-140 upregulation [J]., 2013, 8(8): e70725.
[66] Zhou Y, Zhu W P, Cai X J,.Atomized paclitaxel liposome inhalation treatment of bleomycin-induced pulmonary fibrosis in rats [J]., 2016, 15(2): gmr.15027309.
[67] Ostoros G, Pretz A, Fillinger J,.Fatal pulmonary fibrosis induced by paclitaxel: A case report and review of the literature [J]., 2006, 16(S1): 391-393.
[68] 彭艳梅, 崔慧娟, 刘戴维, 等.白蛋白结合型紫杉醇致肺间质纤维化死亡1例报告 [J].中国新药杂志, 2016, 25(10): 1197-1200.
[69] Gao L L, Tang H Y, He H Y,.Glycyrrhizic acid alleviates bleomycin-induced pulmonary fibrosis in rats [J]., 2015, 6: 215.
[70] 李祎, 李鑫, 李琦, 等.甘草酸对博莱霉素诱导的实验性肺纤维化的干预作用 [J].中国病理生理杂志, 2017, 33(3): 528-533.
[71] 李俸敏, 王火, 曹波, 等.雾化吸入甘草酸减轻博莱霉素所致小鼠肺纤维化的机制研究 [J].中国现代医学杂志, 2018, 28(13): 1-8.
[72] Karkale S, Khurana A, Saifi M A,.Andrographolide ameliorates silica induced pulmonary fibrosis [J]., 2018, 62: 191-202.
[73] Li J P, Feng M X, Sun R T,.Andrographolide ameliorates bleomycin-induced pulmonary fibrosis by suppressing cell proliferation and myofibroblast differentiation of fibroblasts via the TGF-β1-mediated Smad-dependent and -independent pathways [J]., 2020, 321: 103-113.
[74] 黄艳, 刘娟, 杨雅茹, 等.枇杷叶三萜酸对博来霉素致大鼠肺纤维化的干预作用 [J].中国药理学通报, 2011, 27(5): 642-646.
[75] 杨雅茹, 黄艳, 李俊, 等.枇杷叶三萜酸对TGF-β1刺激的人胚肺成纤维细胞转分化及ERK通路的影响 [J].中国药理学通报, 2011, 27(3): 341-346.
[76] Ji Y, Wang T, Wei Z F,.Paeoniflorin, the main active constituent ofroots, attenuates bleomycin-induced pulmonary fibrosis in mice by suppressing the synthesis of type I collagen [J]., 2013, 149(3): 825-832.
[77] Ji Y, Dou Y N, Zhao Q W,.Paeoniflorin suppresses TGF-β mediated epithelial-mesenchymal transition in pulmonary fibrosis through a Smad-dependent pathway [J]., 2016, 37(6): 794-804.
[78] Yang D X, Qiu J, Zhou H H,.Dihydroartemisinin alleviates oxidative stress in bleomycin-induced pulmonary fibrosis [J]., 2018, 205: 176-183.
[79] Cho I H, Choi Y J, Gong J H,.Astragalin inhibits autophagy-associated airway epithelial fibrosis [J]., 2015, 16: 51.
[80] Zhan H Q, Huang F, Ma W Z,.Protective effect of ginsenoside Rg1on bleomycin-induced pulmonary fibrosis in rats: Involvement of caveolin-1 and TGF-β1 signal pathway [J]., 2016, 39(8): 1284-1292.
[81] 刘琴, 蔡斌, 王伟, 等.桔梗皂苷-D对大鼠肺纤维化的干预作用及部分机制研究 [J].中华中医药学刊, 2012, 30(9): 2057-2059.
[82] 孙金玲, 郑金旭, 史小东, 等.柴胡皂苷D通过调控TGF-β1/Smads信号通路抑制人胚肺成纤维细胞增殖和胶原蛋白产生 [J].细胞与分子免疫学杂志, 2019, 35(3): 256-261.
[83] 濮荔, 郑金旭.咖啡酸苯乙酯联合柴胡皂苷d抗小鼠肺纤维化的作用及机制 [J].江苏大学学报: 医学版, 2016, 26(1): 21-25.
[84] Zhao L B, Wang X M, Chang Q,.Neferine, a bisbenzylisoquinline alkaloid attenuates bleomycin-induced pulmonary fibrosis [J]., 2010, 627(1/2/3): 304-312.
[85] Niu C H, Wang Y, Liu J D,.Protective effects of neferine on amiodarone-induced pulmonary fibrosis in mice [J]., 2013, 714(1/2/3): 112-119.
[86] Yu J, Che J J, Liu L,.Tetrahydropalmatine attenuates irradiation induced lung injuries in rats [J]., 2016, 153: 74-81.
[87] Yu J, Zhao L, Liu L,.Tetrahydropalmatine protects rat pulmonary endothelial cells from irradiation-induced apoptosis by inhibiting oxidative stress and the calcium sensing receptor/phospholipase C-γ1 pathway [J]., 2016, 50(6): 611-626.
[88] Li Z H.Oxymatrine attenuates bleomycin-induced pulmonary fibrosis in mice via the inhibition of inducible nitric oxide synthase expression and the TGF-β/Smad signaling pathway [J]., 2012, 29(5): 815-822.
[89] Wang W, Pei X K, Xu M X,.The protective effect of sodium ferulate and oxymatrine combination on paraquat-induced lung injury [J]., 2015, 14(2): 573-583.
[90] Wu H, Li Y, Wang Y,.Tanshinone IIAattenuates bleomycin-induced pulmonary fibrosis via modulating angiotensin-converting enzyme 2/ angiotensin-(1-7) axis in rats [J]., 2014, 11(6): 578-586.
[91] Tang H, He H, Ji H,.Tanshinone IIAameliorates bleomycin-induced pulmonary fibrosis and inhibits transforming growth factor-β-dependent epithelial to mesenchymal transition [J]., 2015, 197(1): 167-175.
[92] He H Y, Tang H Y, Gao L L,.Tanshinone IIAattenuates bleomycin-induced pulmonary fibrosis in rats [J]., 2015, 11(6): 4190-4196.
[93] An L, Peng L Y, Sun N Y,.Tanshinone IIAactivates nuclear factor-erythroid 2-related factor 2 to restrain pulmonary fibrosis via regulation of redox homeostasis and glutaminolysis [J]., 2019, 30(15): 1831-1848.
[94] Feng F F, Li N N, Cheng P,.Tanshinone IIAattenuates silica-induced pulmonary fibrosis via inhibition of TGF-β1-Smad signaling pathway [J]., 2020, 121: 109586.
[95] Zhu Z, Li Q, Xu C,.Sodium tanshinone IIAsulfonate attenuates silica-induced pulmonary fibrosis in rats via activation of the Nrf2 and thioredoxin system [J]., 2020, 80: 103461.
[96] Jiang L, Wang J, Ju J,.Salvianolic acid B and sodium tanshinone IIAsulfonate prevent pulmonary fibrosis through anti-inflammatory and anti-fibrotic process [J]., 2020, 883: 173352.
[97] 李玉花, 许先荣, 潘庆, 等.大黄素对肺纤维化大鼠TGF-β1及Smad3/7信号通路的影响 [J].中华中医药学刊, 2010, 28(2): 346-347.
[98] Tian S L, Yang Y, Liu X L,.Emodin attenuates bleomycin-induced pulmonary fibrosis via anti-inflammatory and anti-oxidative activities in rats [J]., 2018, 24: 1-10.
[99] Qu Y B, Zhang G H, Ji Y X,.Protective role of gambogic acid in experimental pulmonary fibrosisand[J]., 2016, 23(4): 350-358.
[100]Hao Y, Liu Y.Osthole alleviates bleomycin-induced pulmonary fibrosis via modulating angiotensin-converting enzyme 2/angiotensin-(1-7) axis and decreasing inflammation responses in rats [J]., 2016, 39(4): 457-465.
[101]Feng H T, Lu J J, Wang Y T,.Osthole inhibited TGF β-induced epithelial-mesenchymal transition (EMT) by suppressing NF-κB mediated Snail activation in lung cancer A549 cells [J]., 2017, 11(5/6): 464-475.
[102]Zhang X F, Huang H, Chang H J,.Magnolol reduces bleomycin-induced rodent lung fibrosis [J]., 2015, 8(9): 15450-15457.
[103]莫斯喻, 钟淇滨, 蔡肇栩, 等.厚朴酚对LPS致炎小鼠抗炎效应的初步研究 [J].海南医学院学报, 2019, 25(5): 335-338.
[104]赵华, 艾亮, 齐芳迎.叶黄素对博来霉素所致的小鼠肺纤维化治疗作用及其对小鼠氧化应激水平影响的研究 [J].安徽医药, 2016, 20(12): 2234-2237.
[105]Tang H Y, Gao L L, Mao J W,.Salidroside protects against bleomycin-induced pulmonary fibrosis: Activation of Nrf2-antioxidant signaling, and inhibition of NF-κB and TGF-β1/Smad-2/-3 pathways [J]., 2016, 21(2): 239-249.
[106]黄献欢, 黄维, 高兴华.红景天苷抑制大鼠肺纤维化机制研究[J].临床和实验医学杂志, 2018, 17(4): 343-345.
[107]曾玉兰, 冷凡.大蒜素对肺纤维化大鼠肺组织α-SMA和TGF-β1表达的影响 [J].中国现代医学杂志, 2011, 21(15): 1814-1818.
[108]曾玉兰, 冷凡.大蒜素对肺纤维化大鼠MMP-2和TIMP-2表达的影响 [J].中国医院药学杂志, 2012, 32(4): 265-268.
[109]臧明月, 韩玉生, 侯志涛, 等.麦门冬汤对肺纤维化大鼠TGF-β1、Smad3和Smad7蛋白表达的影响 [J].齐齐哈尔医学院学报, 2017, 38(24): 2856-2857.
[110]赵晨宇, 祝勇, 周济谱, 等.养阴益气合剂对博来霉素所致肺纤维化大鼠的影响 [J].中国中医药信息杂志, 2015, 22(9): 63-67.
[111]Xu L, Li L C, Zhao P,.Total polysaccharide of Yupingfeng protects against bleomycin-induced pulmonary fibrosis via inhibiting transforming growth factor-β1-mediated type I collagen abnormal deposition in rats [J]., 2014, 66(12): 1786-1795.
[112]Li L, Li D, Xu L,.Total extract of Yupingfeng attenuates bleomycin-induced pulmonary fibrosis in rats [J]., 2015, 22(1): 111-119.
[113]Cui W, Li L, Li D,.Total glycosides of Yupingfeng protects against bleomycin-induced pulmonary fibrosis in rats associated with reduced high mobility group box 1 activation and epithelial-mesenchymal transition [J]., 2015, 64(12): 953-961.
[114]王祺, 于雪峰, 齐越, 等.血府逐瘀汤干预肺纤维化大鼠作用机制研究 [J].实用药物与临床, 2019, 22(6): 580-584.
[115]黄霞, 刘惠霞, 刘超, 等.血府逐瘀汤对肺间质纤维化动物氧化应激及细胞外基质代谢的干预作用 [J].北京中医药大学学报, 2012, 35(11): 752-756.
[116]何小飞, 谢汝佳, 杨勤.丹芍化纤对肺纤维化大鼠肺内结缔组织生长因子表达的影响 [J].黔南民族医专学报, 2012, 25(1): 5-8.
[117]何小飞, 吴艳琦, 杨勤.丹芍化纤胶囊对肺纤维化大鼠TGF-β1及Smad3/7表达的影响 [J].华西药学杂志, 2012, 27(4): 410-412.
[118]何小飞, 杨勤, 谢汝佳, 等.丹芍化纤对大鼠肺纤维化模型肺组织匀浆中SOD活性和MDA含量的影响 [J].黔南民族医专学报, 2010, 23(3): 161-164,170.
[119]王英田, 王琴, 刘世青, 等.化瘀理肺方对肺纤维化大鼠治疗作用的研究 [J].中华中医药学刊, 2010, 28(9): 1908-1911.
[120]李飞, 刘世青, 黄晓日, 等.化瘀理肺方对大鼠肺纤维化形成的干预作用及对Smad7表达的影响 [J].中国老年学杂志, 2010, 30(12): 1685-1687.
[121]毕建伟.化瘀理肺方对大鼠肺纤维化的保护作用研究 [D].济南: 山东大学, 2010.
[122]Gao J, Huang Y, Li P,.Antifibrosis effects of total glucosides of Danggui-Buxue-Tang in a rat model of bleomycin-induced pulmonary fibrosis [J]., 2011, 136(1): 21-26.
[123]Gao J, Feng L J, Huang Y,.Total glucosides of Danggui Buxue Tang attenuates bleomycin-induced pulmonary fibrosis via inhibition of extracellular matrix remodelling [J]., 2012, 64(6): 811-820.
[124]李术钗, 杨宁线, 夏忠玉, 等.当归补血汤总苷联合水蛭治疗大鼠肺纤维化 [J].中成药, 2017, 39(11): 2243-2248.
[125]Zhao P, Zhou W C, Li D L,.Total glucosides of Danggui buxue Tang attenuate BLM-induced pulmonary fibrosis via regulating oxidative stress by inhibiting NOX4 [J]., 2015, 2015: 645814.
[126]徐康, 许惠琴, 范欣生, 等.人参平肺方对二氧化硅所致大鼠肺纤维化的作用及机制探讨 [J].南京中医药大学学报, 2017, 33(1): 49-53.
[127]Wang X, Li X, Wang L N,.Buyang Huanwu decoction ameliorates bleomycin-induced pulmonary fibrosis in rats via downregulation of related protein and gene expression [J]., 2018, 2018: 9185485.
[128]冯娜, 李侠, 宋占帅, 等.补阳还五汤对矽肺大鼠肺组织Smad3、Smad7蛋白质表达的影响 [J].预防医学论坛, 2018, 24(8): 566-569.
[129]张蓉, 宋占帅, 邹建芳.补阳还五汤对矽肺大鼠肺纤维化的影响及机制 [J].山东医药, 2019, 59(5): 9-12.
[130]杨颖溪, 柴立民, 吴甜甜, 等.补肾益肺消癥方对特发性肺纤维化大鼠Caspase-12信号通路关键分子基因和蛋白表达的影响 [J].北京中医药大学学报, 2016, 39(7): 575-579.
[131]吴甜甜, 柴立民, 杨颖溪, 等.补肾益肺消癥方干预肺纤维化大鼠JNK凋亡信号通路关键分子的表达调控内质网应激的作用机制 [J].现代中西医结合杂志, 2016, 25(19): 2053-2056.
[132]柴立民, 刘涓, 王珍, 等.补肾益肺消癥方干预肺纤维化大鼠TGF-β信号通路的作用机制 [J].中国中医基础医学杂志, 2013, 19(9): 1022-1024.
[133]史颖.参麦开肺散治疗肺纤维化的作用机制研究 [D].唐山: 河北联合大学, 2014.
[134]伍婷, 楚海燕, 史颖, 等.参麦开肺散对降低肺纤维化小鼠胶原生成的影响 [J].风湿病与关节炎, 2014, 3(6): 19-22.
[135]支开叶, 康永, 倪艳, 等.肺纤方干预博莱霉素致肺纤维化大鼠的实验研究 [J].中国实验方剂学杂志, 2012, 18(20): 212-216.
[136]赵兰才, 何福金, 董小霞, 等.三参保肺颗粒对慢阻肺合并肺纤维化大鼠肺组织Ⅰ、Ⅲ型胶原及转化生长因子β1表达的影响 [J].世界中西医结合杂志, 2010, 5(4): 305-307.
[137]杨丽, 吕晓东, 刘妍彤, 等.参龙煎剂干预肺纤维化大鼠血清IFN-γ、IL-4表达水平影响的实验研究 [J].中华中医药学刊, 2017, 35(6): 1427-1430.
[138]郭海, 吉福志, 魏凯峰, 等.养肺活血方对平阳霉素所致肺纤维化大鼠肺部炎症的影响 [J].中国实验方剂学杂志, 2012, 18(21): 179-184.
[139]杨珺超, 宋康, 鲁建锋, 等.补肺汤对肺纤维化大鼠肺组织TGF-β1表达影响的研究 [J].中国中医药科技, 2010, 17(4): 291-292.
[140]张弘, 夏永良, 杨珺超, 等.补肺汤对肺纤维化大鼠肺组织MMP-9、TIMP-1蛋白表达影响 [J].中华中医药学刊, 2011, 29(12): 2673-2679.
[141]安方玉, 颜春鲁, 刘永琦, 等.泻肺汤对肺纤维化大鼠TGF-β1/Smads信号转导通路的干预研究 [J].中华中医药杂志, 2018, 33(6): 2641-2645.
[142]安方玉, 刘永琦, 骆亚莉, 等.泻肺汤对肺纤维化大鼠肺组织及血清自由基代谢的影响 [J].中成药, 2016, 38(3): 665-668.
[143]宋启兰, 王燕青, 王宁.十枣汤对肺纤维化大鼠血清TNF-α和TGF-β1浓度的影响 [J].中国中医药现代远程教育, 2014, 12(8): 157-159.
[144]梅晓雷.润肺汤对肺癌患者放射性肺炎及放射性肺纤维化的影响 [J].中医学报, 2014, 29(2): 177-179.
[145]田晟, 曹文富, 张永越, 等.益气化瘀化痰方对肺纤维化大鼠的干预作用及其机制 [J].中国应用生理学杂志, 2019, 35(2): 101-106,144,1.
[146]张秀, 胡静, 覃惠, 等.宣肺化瘀方对肺纤维化大鼠肺组织TGF-β1/Smad表达的影响 [J].中草药, 2018, 49(14): 3326-3333.
[147]周剑.固本平喘汤对慢阻肺合并肺纤维化大鼠细胞外基质影响的研究 [D].武汉: 湖北中医药大学, 2010.
[148]殷彬, 周兆山, 胡海波, 等.小青龙汤、射干麻黄汤及其合方对哮喘模型大鼠血清IL-5及IL-13的影响 [J].山东中医杂志, 2011, 30(5): 337-339.
[149]胡少丹, 仕丽, 孙峰, 等.助阳补肺除痹颗粒对肺纤维化大鼠肺组织超氧化物歧化酶活性、丙二醛含量影响的研究 [J].陕西中医, 2019, 40(6): 683-686.
[150]符策富.基于“Notch/Jagged”信号通路助阳补肺除痹颗粒对肺纤维化大鼠的保护作用及机制研究 [D].长春: 长春中医药大学, 2019.
[151]张永胜, 冯一中, 曹志飞, 等.虫草复方对博莱霉素致大鼠肺纤维化的作用及其机制 [J].中草药, 2011, 42(9): 1766-1772.
[152]马林纳, 王瑞, 苗明三.基于数据挖掘的治疗肺纤维化中药用药规律分析 [J].中草药, 2020, 51(6): 1406-1411.
[153]周颖, 陈明, 柴秀娟, 等.紫杉醇脂质体雾化吸入对大鼠肺纤维化的作用研究 [J].中国现代应用药学, 2019, 36(17): 2149-2153.
Research progress on traditional Chinese medicine against treating pulmonary fibrosis
DING Da-li1, SHEN Xue-bin1, 2, YAO Jia-hui1, YU Li-zhen1, 2, ZHOU Meng-juan1, NIAN Si-hui1, 2
1.School of Pharmacy, Wannan Medical College, Wuhu 241002, China 2.Institute of Modern Chinese Medicine, Wannan Medical College, Wuhu 241002, China
Pulmonary fibrosis is a chronic progressive pulmonary interstitial disease that is caused by a variety of factors and eventually leads to alterations in the normal lung tissue structure of patients.Up to now, glucocorticoids and immunosuppressants are the main drugsin treatment of pulmonary fibrosis, however, they have unavoidable side effects.In recent years, there are more and more research focusing on pulmonary fibrosis and a further understanding has been gradually delineated in these days, which inspires the exploration and application of traditional Chinese medicine as therapeutic agents in treatment of pulmonary fibrosis.Traditional Chinese medicines and their effective components could downregulate the expression of pro-inflammatory factors, regulate the redox balance, induce the apoptosis of lung fibroblasts and block the pathopoiesis of fibrosis through various signaling pathways including transforming growth factor-β1 (TGF-β1)/Smad, phosphatidylinositol 3-kinase (PI3K)/protein kinase B (PKB/Akt), nuclear factor-erythroid 2-related factor-2(Nrf2)/glutathione (GSH), exhibiting therapeutic effect on pulmonary fibrosis and could effectively attenuate the symptoms and progression of fibrosis.Research progress on traditional Chinese medicine against treating pulmonary fibrosis were summarized in this paper to provide a reference for further study of the underlying mechanisms of traditional Chinese medicine against pulmonary fibrosis and discovery of effective compounds.
traditional Chinese medicine; pulmonary fibrosis; flavonoids; phenols; terpenoids; saponins; alkaloids; Chinese herbal compound
R285
A
0253 - 2670(2021)22 - 7006 - 19
10.7501/j.issn.0253-2670.2021.22.028
2021-04-15
安徽高校自然科学研究重点项目(KJ2017A258);安徽省科技厅重点研究与开发计划项目(201904a0702106);安徽省药学卓越人才教育培养计划项目(2019zyrc062)
丁大力,硕士研究生,研究方向为天然药物药理。Tel: 17729916458 E-mail: ding17729916458@163.com
通信作者:年四辉,教授,硕士生导师,博士,研究方向为天然药物药理、中药活性成分与质量控制。Tel: (0553)3932129 E-mail: niansihui@126.com
[责任编辑 崔艳丽]
