盐酸丙美卡因滴眼液处方工艺研究
2021-11-20文强徐小彬
文强,徐小彬
1.江西珍视明药业有限公司,江西 抚州 344000;2.江西省药品检查员中心赣北药品检查所,江西 上饶 334100
盐酸丙美卡因滴眼液为眼科手术及眼科检查的表面麻醉用药,原研生产企业为美国Allergan 公司。本论文中研究处方参照美国Allergan 公司研制生产的商品名为OPHTHETIC®的盐酸丙美卡因滴眼液的说明书。本论文中规格参照美国Allergan 公司研制生产的商品名为OPHTHETIC®的盐酸丙美卡因滴眼液和美国 Alcon 公司研制生产的商品名为ALCAINE®的盐酸丙美卡因滴眼液。
1 仪器与试药
1.1 仪器
岛津LC-10ATVP 泵,岛津SPD-10AVP 检测器,TL-9900 色谱数据工作站,ST3100 酸度计,MS205DU 电子天平,OM815 微量冰点渗透压仪,LDZH-100KBS 立式蒸汽压力灭菌器,NDJ-1 旋转式黏度计,S312 数显恒速搅拌器,SC-1513 数控超级恒温槽,RXZ 型智能人工气候箱。
1.2 试剂试药
盐酸丙美卡因(安徽省庆云医药化工,批号181101,药用级别,含量98.6%),磷酸二氢钾(分析纯,北京益利精细化学品公司),庚烷磺酸钠(色谱纯进口),三乙胺(色谱纯,进口),甲醇(色谱纯,北京益利精细化学品公司),苯扎氯铵(泰柯棕化公司,批号180502,药用级别),甘油(浙江遂昌惠康药业,批号181003,药用级别),氯化钠(江苏省勤奋药业,批号180503,药用级别),氢氧化钠(成都华邑药用辅料制造有限公司,批号180501,药用级别)。
2 处方工艺依据
2.1 规格的制定
本品的规格参照美国Allergan 公司研制生产的商品名为OPHTHETIC®的盐酸丙美卡因滴眼液和美国Alcon 公司研制生产的商品名为ALCAINE®的盐酸丙美卡因滴眼液。OPHTHETIC®和ALCAINE®的规格均为每15 mL 含75 mg 盐酸丙美卡因,故确定本品的规格为每15 mL 含75 mg 盐酸丙美卡因。
2.2 处方工艺的筛选与确定
美国Allergan 公司研制生产的商品名为OPHTHETIC®的盐酸丙美卡因滴眼液的说明书中指出其制剂处方组成中辅料有苯扎氯铵、甘油、氯化钠、盐酸溶液/氢氧化钠溶液和水。其中,苯扎氯铵作为抑菌剂[1],甘油作为增稠剂[2],氯化钠作为等渗剂,盐酸溶液/氢氧化钠溶液起到调节溶液pH的作用[3],水为溶剂。参照OPHTHETIC®的盐酸丙美卡因滴眼液的处方组成,并结合理论渗透压的计算[4],分别设计处方如下,见表1。
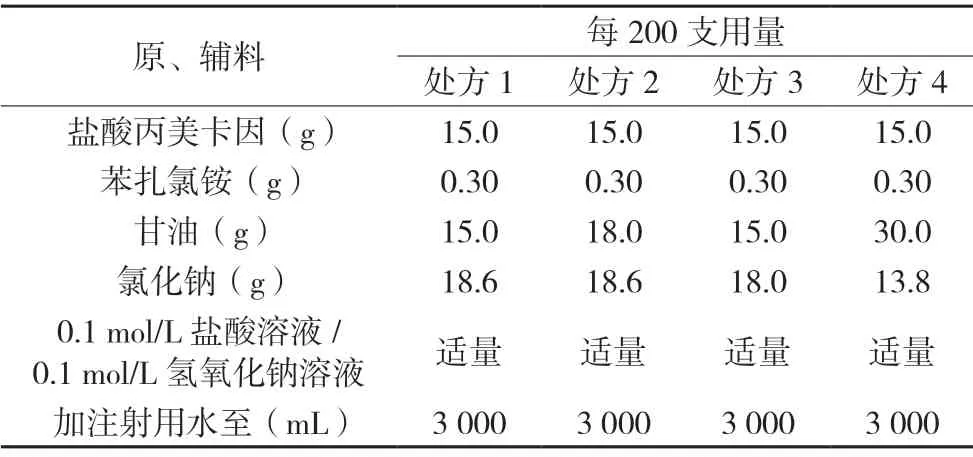
表1 盐酸丙美卡因滴眼液处方筛选[5]
初步工艺:称取处方量的原辅料于适量的注射用水中,搅拌至完全溶解,用0.1 mol/L 盐酸溶液或0.1 mol/L 氢氧化钠溶液调节溶液pH,定容。
2.2.1 理论渗透压计算和实际渗透压的检测 根据毫渗透压摩尔浓度计算公式:
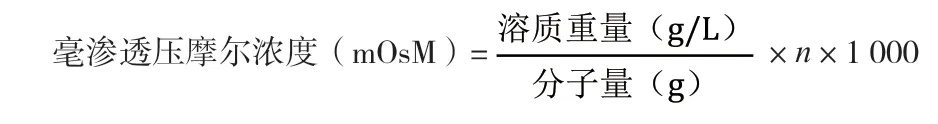
可计算上述4个处方的渗透压,渗透压计算结果见表2。
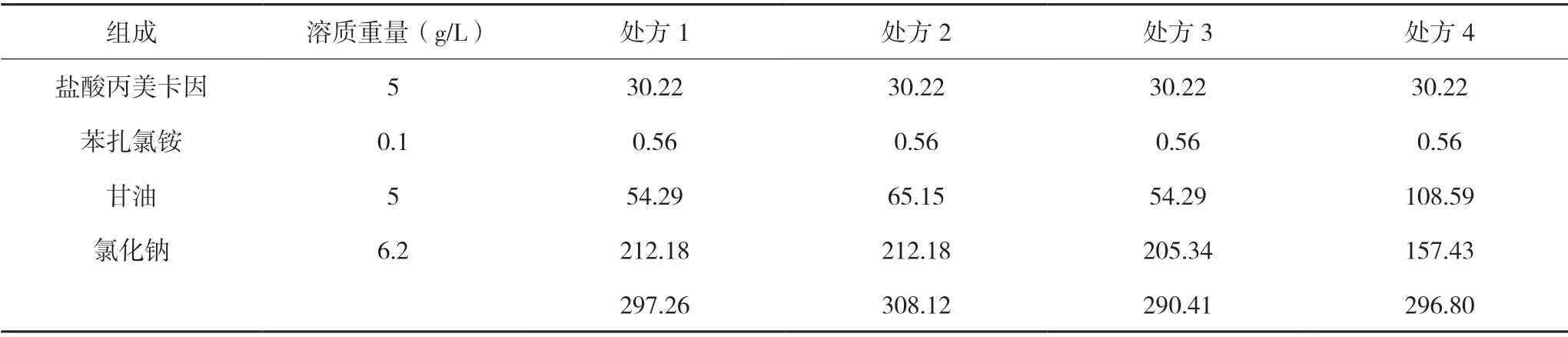
表2 处方1至处方4理论渗透压计算结果(mOsM)
由于已知正常等渗范围约为280 mOsM~310 mOsM,因此根据以上计算结果可知,4个处方的理论渗透压基本等渗,处方1 是正常渗透压的1.00 倍(血浆渗透压平均值为298 mOsM),处方2 是正常渗透压的1.03 倍,处方3 是正常渗透压的0.97 倍,处方4 是正常渗透压的1.00 倍。
根据稀溶液的依数性,冰点相同的溶液具有相同的渗透压。因此,可以通过测定样品的冰点,来考察其渗透压。样品和国外产品(ALCAINE®)的冰点测定结果见表3。
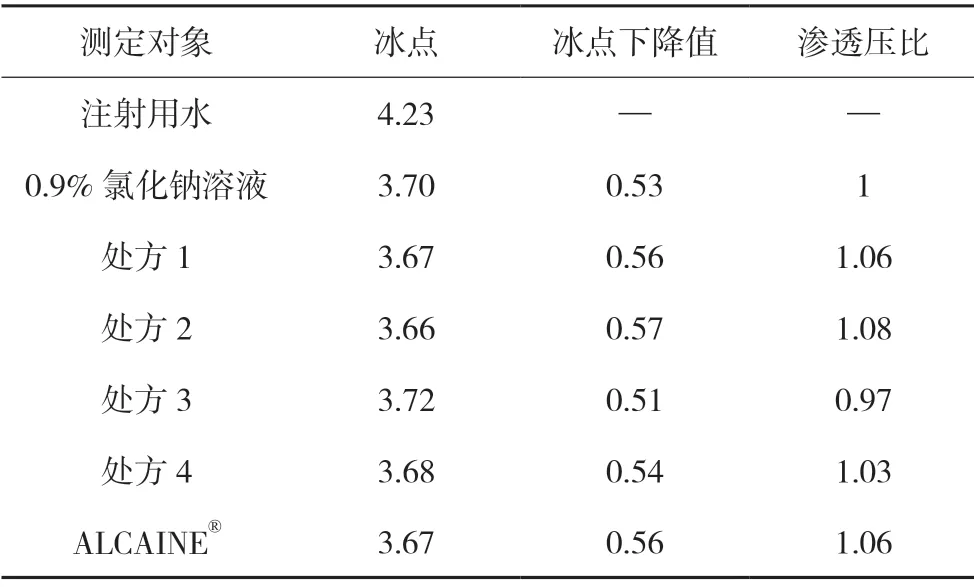
表3 冰点测定结果
由上述测定结果可知:处方1 的渗透压约为0.9%氯化钠溶液的1.06 倍,处方2 的渗透压约为0.9%氯化钠溶液的1.08 倍,处方3 的渗透压约为0.9%氯化钠溶液的0.97 倍,处方4 的渗透压约为0.9%氯化钠溶液的1.03 倍,国外产品(ALCAINE®)的渗透压约为0.9% 氯化钠溶液的1.06 倍,均满足眼球能适应的渗透压范围(相当于浓度为0.6%~1.5%的氯化钠溶液),但处方1、2 和4 的渗透压与国外产品更接近。
2.2.2 pH 的考察 测定美国Alcon 公司研制生产的商品名为ALCAINE®的盐酸丙美卡因滴眼液的pH,结果为4.95。参照测得的国外产品pH 值范围,结合滴眼剂的PH 值对主药的溶解性、稳定性及眼黏膜的影响因素[3],盐酸丙美卡因在弱酸性溶液中的溶解性和稳定性更佳,另一方面也考虑到正常人眼可耐受pH 为5~9,从而确定本品pH 约为5.0。
2.2.3 黏度的测定 取本品适量,用NDJ-1 型旋转式黏度计1 号转子60 r/min,测试温度为20 ℃±0.1 ℃,以旋转式黏度计测定[4]。样品和国外产品(ALCAINE®)的黏度测定结果见表4。

表4 黏度测定结果
根据黏度测定结果可知,处方1~处方4 的黏度和国外产品的黏度相当,但处方1、3 的黏度与国外产品的黏度更接近。
综合以上pH 考察结果、理论渗透压计算结果、实际渗透压的测定结果以及黏度的测定结果,确定处方1 为最终处方。
3 影响因素试验
参照药物稳定性试验指导原则[4],采用确定的处方和工艺制备一批样品,批号为190501,批量为500 支,进行制剂的影响因素试验,包括高温60 ℃试验、高温40 ℃试验、高温30 ℃试验和强光照射试验(4 500 lx±500 lx)。于第5 天和第10 天分别取样,进行检测。结果见表5。
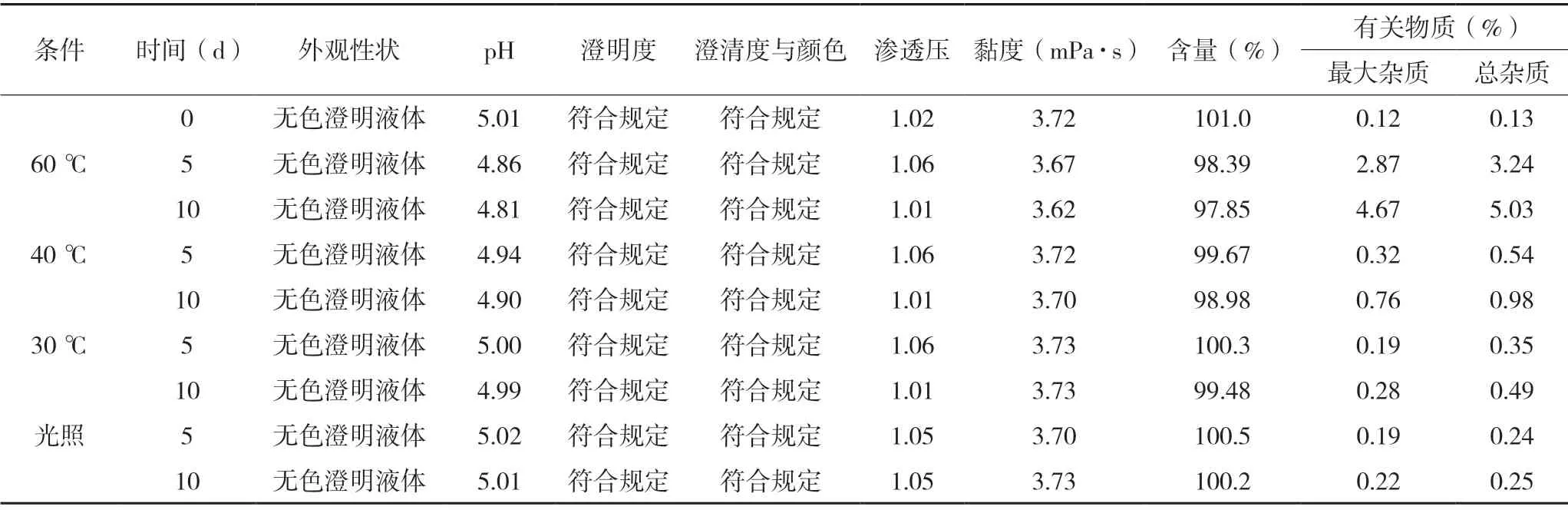
表5 盐酸丙美卡因滴眼液影响因素试验结果
结果表明:盐酸丙美卡因滴眼液在高温60 ℃条件下放置10 d 后,pH 和黏度明显降低,有关物质明显增长,含量下降,其余各项指标无明显变化,说明本品在高温60 ℃条件下不稳定;在高温40 ℃条件下放置10 d 后,pH 明显降低,有关物质明显增长,其余各项指标无明显变化,说明本品在高温40 ℃条件下不稳定;在高温30 ℃、强光照射(4 500 lx±500 lx)条件下放置10 d 后,有关物质有增长,其余各项指标无明显变化。初步确定该产品需低温避光保存。
4 低温热循环试验
为模拟本品在运输及贮存过程中可能遇到的低温、高温条件[7],对190501 样品进行低温热循环试验,内容包括三次循环,每次在2 ℃~8 ℃放置2 d,然后在40 ℃加速条件下考察2 d。结果见表6。

表6 低温热循环试验考察结果
样品经低温热循环试验后,有关物质略有增长,其余各项稳定性指标无明显变化。样品在上述反复低温、高温条件下稳定性较好。
5 制剂的安全性评价[8]
根据新(西)药审批对滴眼液的要求,评价盐酸丙美卡因滴眼液对家兔眼是否有刺激作用/腐蚀作用及其程度,为临床用药提供科学依据。采用影响因素试验样品,即批号190501 样品,每5 min 滴眼一次,每次2 滴,连续5 次给予家兔盐酸丙美卡因滴眼液滴眼,通过肉眼观察和荧光素试验,与0.9%生理盐水对照组比较无明显差异,均未见本品对角膜、虹膜和结膜产生刺激或腐蚀作用。本试验结果表明,盐酸丙美卡因滴眼液连续滴眼不引起家兔眼刺激性,也不引起角膜溃疡。临床前安全性试验结果表明,本品的安全性良好。
6 放大试验及处方工艺验证
采用确定的处方和制备工艺,进行三批放大试验,每批2 000 支,批号分别为190501、190502 和190503。按实际制备的合格成品量与理论产量计算,收率分别为86.10%,86.00%,85.70%。三批放大样品的检查结果见表7。
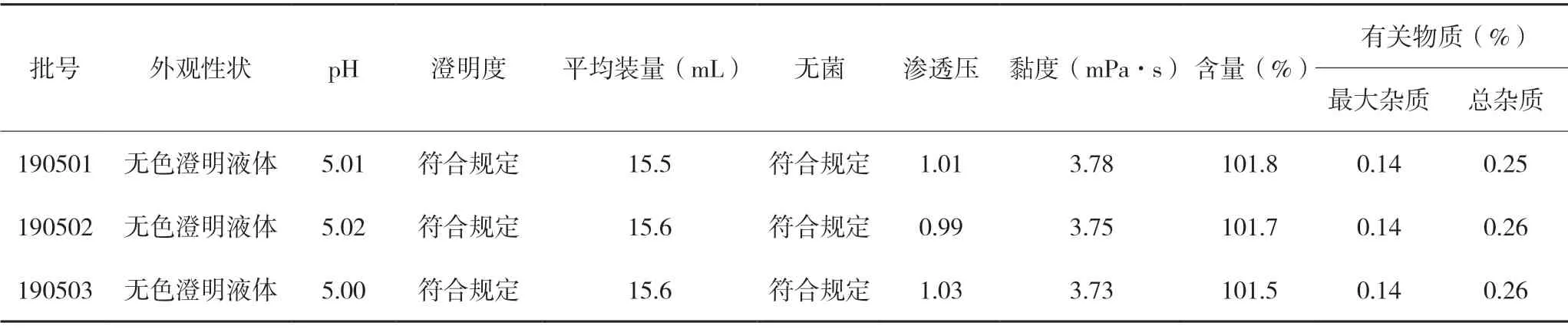
表7 三批放大样品质量检查结果
以上结果表明,三批放大样品各项检查结果均合格,平均装量均不少于标示装量的90%,且批与批之间重现性好,说明制剂的组方合理,工艺稳定,适合放大生产。
7 处方和工艺
依据上述试验最终确定盐酸丙美卡因滴眼液的处方和工艺如下。
7.1 处方
盐酸丙美卡因滴眼液,规格:15 mL:75 mg,即每15 mL 含75 mg 盐酸丙美卡因。处方如下。

7.2 制备工艺
称取处方量的氯化钠、甘油、苯扎氯铵和盐酸丙美卡因于12 000 mL(全量体积的80%)注射用水中,搅拌至完全溶解,得溶液Ⅰ。0.1 mol/L 盐酸溶液或0.1 mol/L氢氧化钠溶液调节溶液ⅠpH至5.0,得溶液Ⅱ。将溶液Ⅱ补加注射用水至15 000 mL(全量体积),搅拌均匀后,再用0.1 mol/L 盐酸或0.1 mol/L 氢氧化钠溶液调节溶液pH 至5.0,得溶液Ⅲ。溶液Ⅲ经0.22 μm 滤膜除菌过滤,得中间成品溶液。中间成品溶液经检验合格后,灌装,压塞拧盖。成品检查合格后贴标签,包装。
8 讨论
本次研究盐酸丙美卡因滴眼液的处方和工艺,主要是从滴眼剂的等渗调节、黏度选择、PH 调节、抑菌剂选择以及制剂的稳定性、安全性等各方面进行试验考查和数据分析,最终基本确定了盐酸丙美卡因滴眼液的处方和工艺,后序还需通过对样品的长期稳定性试验、加速试验和对比试验,用更完整的数据进一步确定该处方工艺的组方合理性、工艺稳定性和质量可靠性。
