代偿期乙型肝炎肝硬化湿热证患者肠道菌群特征分析*
2021-11-19胡萌翟昌明张冬卓永祥李丹田广俊
胡萌,翟昌明,张冬,卓永祥,李丹,田广俊
广东省中医院珠海医院,广东 珠海 519015
肝硬化是各种慢性肝病的重要阶段,其中乙型肝炎肝硬化是我国当前最主要的肝硬化疾病,是导致肝癌、肝移植等终末期肝病的重要危险因素[1]。肠道菌群是由细菌、真菌、原生动物、古细菌等组成的多样化生态系统,它们相互共生并寄生于人体,对维持机体正常生理状态起到重要作用[2]。众多研究表明,肠道菌群与肝脏通过肠-肝轴相互联系,乙型肝炎肝硬化患者肠道菌群发生变化,其菌群种类、比例与肝脏免疫及炎症息息相关[3-4]。
湿热首见于《素问·生气通天论》,后世医家对湿热的病因病机及治法进行了完善和丰富。湿热二邪相互裹挟,重滞黏腻,病势缠绵难解,湿热证候在我国岭南地区较常见,多与肝、胆、脾、胃、三焦关系密切[5]。虽然肠道菌群与肝硬化进展密切相关,但目前关于代偿期乙型肝炎肝硬化湿热证患者与其他证候患者粪便微生物群比较研究的报道较少。本研究初步分析了乙型肝炎肝硬化不同中医证候肠道菌群的变化特征,以期进一步揭示肝硬化湿热证的生物学基础及与肠道菌群的关系。
1 资料与方法
1.1 一般资料选取2020年1—12月广东省中医院珠海医院肝病科门诊和住院收治的代偿期乙型肝炎肝硬化湿热证患者33例、非湿热证患者49例及对照组24例为研究对象。湿热证组男20例,女13例;年龄(43.40±7.26)岁。非湿热证组男30例,女19例;年龄(41.55±8.86)岁。对照组男15例,女9例;年龄(40.52±7.84)岁。3组患者基线资料比较,差异无统计学意义(P>0.05),具有可比性。研究符合医学伦理要求并通过广东省中医院伦理委员会审核批准(BF2019-078-01),所有入选者均对研究知情同意。
1.2 诊断标准
1.2.1 西医诊断标准 符合《慢性乙型肝炎防治指南》[6]和《肝硬化诊治指南》[7]的诊断标准。
1.2.2 中医诊断标准 符合《中药新药临床研究指导原则》[8]和《肝硬化中西医结合诊疗共识》[9]的诊断标准。主症:①口干苦或口臭;②胁胀或痛;③大便黏滞秽臭或大便不爽。次症:①纳呆;②胃脘胀闷;③倦怠乏力;④皮肤巩膜黄染。舌脉:舌质红、苔黄腻、脉弦数或弦滑数。证型确定:具备主症2项和次证1或2项,参考舌脉象。
1.3 病例纳入标准年龄30~50岁;符合乙型肝炎肝硬化的中医、西医诊断标准;近1个月内未使用过抗生素、微生态调节剂等影响肠道微生态的药物;签署研究知情同意书。
1.4 病例排除标准近1个月内有使用过抗生素、微生态调节剂等影响肠道微生态的药物;近1个月内全身有除乙肝病毒之外的其他病毒、细菌、真菌感染;近1个月内有腹泻等肠道疾病的发生;合并炎症性肠病、糖尿病、非酒精性脂肪性肝病者;饮食习惯特殊者,例如素食者;合并甲型、丙型、丁型、戊型等类型肝炎及其他嗜肝病毒感染;合并自身免疫性肝病、血吸虫性肝病、肝豆状核变性等其他慢性肝病;长期服用明确肝毒性药物或酒精摄入量每周>140 g;合并心、肺、肾、血液系统及胃肠道严重原发病或精神病;患者或患者家属不同意接受研究随访。
1.5 病例剔除标准凡在入组后发现不符合试验方案者;入组后发现严重疾病者。
1.6 研究方法
1.6.1 16S rDNA测序方法 参照文献[10]方法进行测序:收集研究对象检查当日晨起的大便,冻存于-80 ℃ 冰箱,待样品收集完成后,低温(0 ℃)运送至上海中科新生命生物科技有限公司进行粪便DNA的提取及16Sr DNA检测。采用CTAB或SDS方法对样本的基因组DNA进行提取,并对DNA的纯度和浓度进行检测。根据测序区域的选择,使用带Barcode的特异引物和高保真DNA聚合酶对选定的V3-V4可变区进行PCR扩增。PCR产物用2%琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收,胶回收采用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)。参照电泳初步定量结果,对PCR扩增回收产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,按照每个样本的测序量要求,进行相应比例的混合。使用NEBNext®UltraTMDNALibraryPrepKit建库试剂盒进行文库构建。构建好的文库通过AgilentBioanalyzer2100和Qubit进行质检,文库质检合格后采用IlluminaMiseq测序平台对V3-V4可变区进行扩增和测序。
1.6.2 肠道菌群测序结果分析 参照文献[11],根据得到的原始测序数据对低质量测序数据进行过滤后,进行组装和再过滤,进行OTU聚类,并与数据库对比,进行物种注释;基于OTU和注释结果进行样品Alpha多样性、Beta多样性、肠道菌群构成差异性分析等一系列的综合性分析及处理。
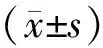
2 结果
2.1 各组患者OTU聚类和物种注释结果分析对照组、非湿热证组、湿热证组的肠道菌群物种丰富程度不同,OTU种类分别为45 174种、67 511种和 59 314 种,特有OTU种类分别为187 575种、34 621种和30 179种。代偿期乙型肝炎肝硬化患者OTU种类多于对照组,独有OTU种类也增多;湿热证组较非湿热证组的OTU种类以及每组间的独有OTU种类减少,见图1。
2.2 各组患者Alpha多样性分析Alpha多样性是对单个样本中物种多样性分析,结果显示,湿热组与非湿热组Good-coverage指数较对照组升高,且湿热组与对照组比较,差异具有统计学意义(P<0.05),表明三组间肠道菌群的群落丰富度、菌群多样性有一定差异,见图2。
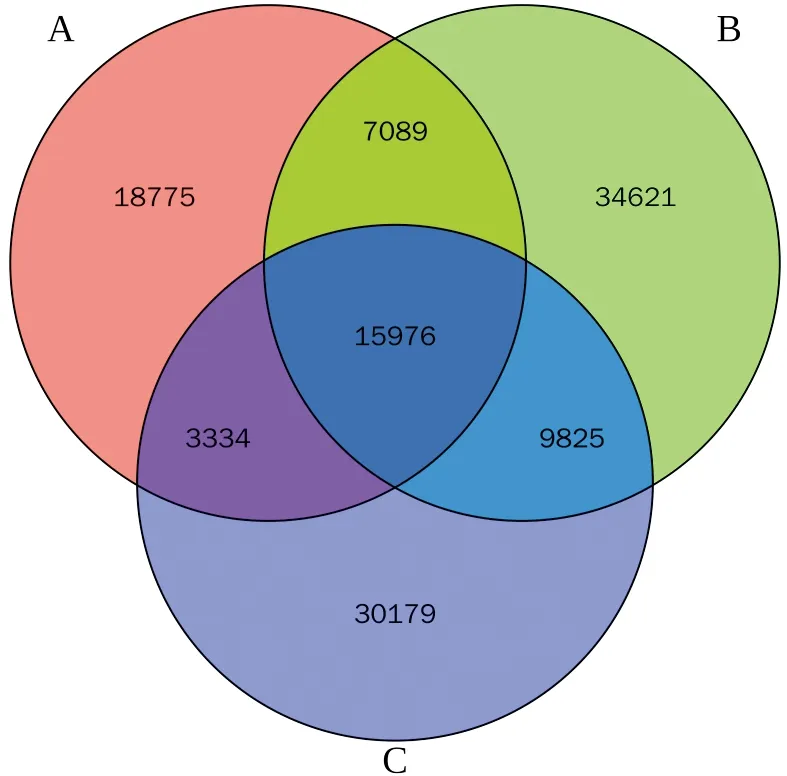
注:A:对照组;B:非湿热证组;C:湿热证组图1 各组患者OTU聚类Venn图
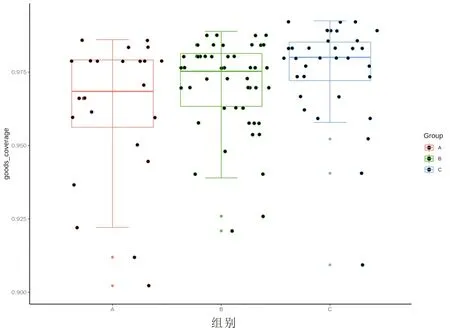
注:A:对照组;B:非湿热证组;C:湿热证组图2 各组患者Alpha多样性分析
2.3 各组患者Beta多样性分析Beta多样性分析映样本群落组成的相似性。主坐标分析(Principal Co-ordinates Analysis,PCoA)结果显示,对照组及非湿热证组组间样本坐标出现聚拢,表明二组内菌群结构相似,而湿热证组菌群结构差异性大,与其他两组比较,差异具有统计学意义(P<0.05)。表明湿热证在一定程度上改变了代偿期乙型肝炎肝硬化患者的肠道菌群,见图3。
2.4 肠道菌群构成及差异性分析
2.4.1 各组患者肠道菌群在门水平的物种组成丰度分析 在门水平中,检测出主要菌门9个,分别为:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、疣微菌门(Verrucomicrobia)、绿菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、蓝细菌门(Cyanobacteria)。其中,放线菌门相对丰度值在对照组、非湿热证组、湿热证组三组间逐渐增高,且湿热证组与其他比较,差异具有统计学意义(P<0.05);湿热证组绿菌门相对非湿热证组丰度值明显减少,差异具有统计学意义(P<0.05);湿热证组酸杆菌门相对其他两组丰度值均明显减少,差异具有统计学意义(P<0.05),见图4。
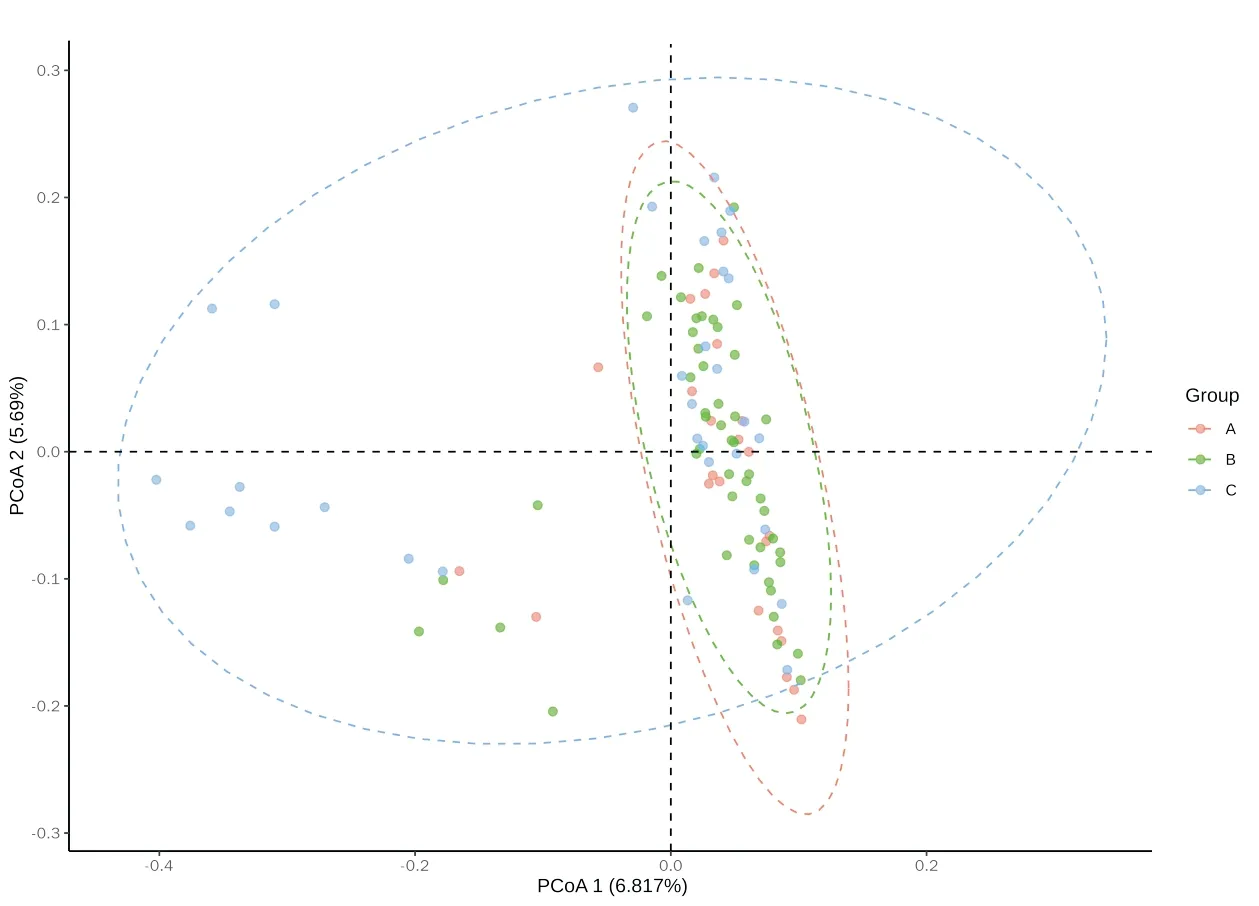
注:A:对照组;B:非湿热证组;C:湿热证组图3 各组患者Beta多样性分析
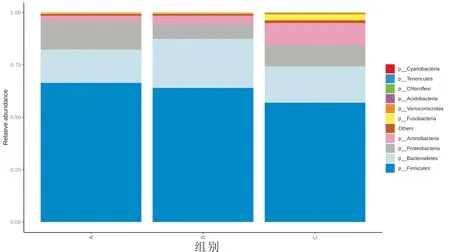
注:A:对照组;B:非湿热证组;C:湿热证组图4 各组患者肠道菌群在门水平的物种组成丰度分析
2.4.2 各组患者肠道菌群在属水平的物种组成丰度分析 在属水平中,共检测出差异性菌属9种,分别为拟杆菌属(Bacteroides)、巨单胞菌属(Megamonas)、Faecalibacterium、Escherichia-Shigella、双歧杆菌属(Bifidobacterium)、Subdoligranulum、Blautia、乳酸杆菌属(Lactobacillus)、罗斯氏菌属(Roseburia)、Agathobacter。其中,湿热证组巨单胞菌属相对其他两组丰度值均明显减少,差异具有统计学意义(P<0.05);双歧杆菌属相对丰度值在健康对照、非湿热证、湿热证3组间逐渐增高,且湿热证组与其他两组比较,差异具有统计学意义(P<0.05);湿热证组乳酸杆菌属相对其他两组丰度值增多,且非湿热组与湿热组比较,差异具有统计学意义(P<0.05),见图5。
2.4.3 各组患者肠道菌群LefSe分析 LefSe(LDA Effect Size)是一种用于发现高维生物标识和揭示基因组特征的算法,能根据分类学组成对样本按照不同的分组条件进行线型判别分析,以便找出对样本划分产生显著性差异影响的群落或物种。该分析结果提示,湿热证组的差异性菌群主要分布在乳杆菌目(Lactobacillales)、芽孢杆菌纲(Bacilli)、链球菌科(Streptococcaceae)、Alistipes、Rikenellaceae。非湿热组组的差异性菌群主要分布在普雷沃菌科(Prevotellaceae)、韦荣氏球菌属(Veillonella)、巴恩斯氏菌属(Barnesiella)、Lachnoclostridium。见图6。
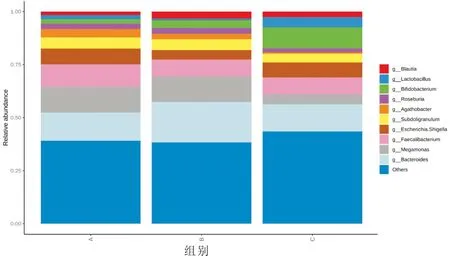
注:A:对照组;B:非湿热证组;C:湿热证组图5 各组患者肠道菌群在属水平的物种组成丰度分析
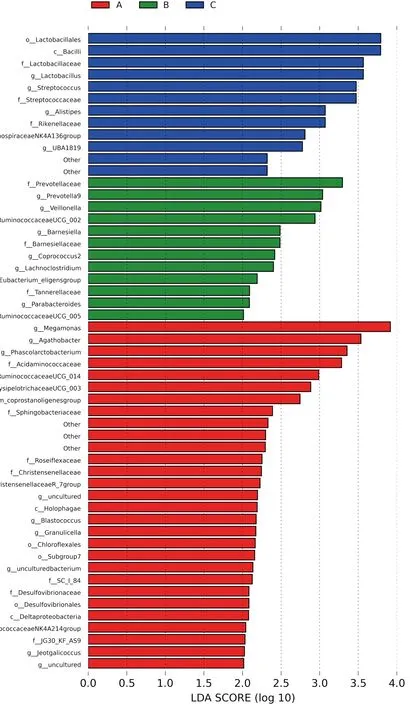
注:A:对照组;B:非湿热证组;C:湿热证组图6 各组患者肠道菌群LefSe分析
3 讨论
健康的肠道菌群和完整的肠道屏障对保持肠-肝轴的动态平衡具有非常关键的作用[12]。研究表明,肝硬化患者常存在不同程度的肠道菌群失调和免疫状态紊乱,其能促使细菌产物激活免疫系统并加重肝脏炎症反应,且与肝功能状态、Child-Pugh分级密切相关,可诱导和促进乙肝肝硬化并发症的产生[13-15]。同时,内毒素、脂肪酸和胆汁酸等与肠道菌群的相互作用和影响也会加重肠黏膜损伤,破坏肠道微生态平衡和屏障功能[16-18]。因此,乙肝肝硬化的发生发展往往与肠道菌群结构改变相互促进、互为因果。
中医学理论强调阴阳交感、对立制约、互根互用和消长平衡,注重五行相生、相克,这恰好与肠道菌群各种微生物之间彼此制约,互相依存而形成动态的生态平衡非常相似[5]。中医以“整体观念”和“辨证论治”为核心,以证候反映当前阶段疾病本质(状态)。从临床表现看,肝硬化湿热证患者常见脘腹胀满,乏力纳呆,口干苦,肛门灼热,大便黏腻不爽,或见泄泻、里急后重等,其与肠道菌群紊乱引起的消化道症状存在高度的一致性。中医学认为,肝脾气机不畅,运化失常,水湿痰饮内生,郁久则易酿生湿热,而湿热作为病理产物,蕴蒸肝胆或中焦,致使肠道内环境稳态失衡,条件致病菌异常增殖,肠道菌群代谢功能紊乱,并通过炎症反应介导加速肝脏损伤,大量临床基础研究亦证实,炎症是湿热证的重要病理物质基础[19-21]。
本研究通过对乙型肝炎肝硬化不同中医证候患者及对照组的肠道菌群结构进行对比分析发现,湿热证组肠道菌群与非湿热证组和对照组比较,无论是菌群多样性还是物种丰富程度,均有一定程度变化。湿热证与代偿期乙型肝炎肝硬化患者的某些肠道菌群的丰度变化相关,主要表现为湿热证组放线菌门、双歧杆菌属、乳酸杆菌属相对丰度值增高,绿菌门、酸杆菌门、巨单胞菌属相对其他两组丰度值均明显减少。放线菌门因其菌落呈放射状而得名,为革兰氏阳性细菌,主要能促使土壤中的动物和植物遗骸腐烂。有研究表明,放线菌门在高脂肪和动物蛋白饮食患者肠道菌群中丰度增加,且与功能性胃肠病的发病有一定相关性[22]。双歧杆菌属、乳酸杆菌属均为人体内的益生菌,具有抗感染、调节宿主免疫系统、杀灭病原体等功效。巨单胞菌属为丁酸盐产盐菌,能够发酵各种碳水化合物,是肠道能量来源的提供者,并能保护肠道黏膜,提高肠道免疫等。有研究显示,巨单胞菌在病毒性肝炎、原发性肝癌患者的粪便菌群中均会出现丰度值的减少,提示其与“肠-肝轴”调控具有一定相关性[23]。绿菌门是一类进行不产氧光合作用的细菌,有研究显示其会在肝脏损伤修复时被大量消耗[24]。目前,关于酸杆菌门的研究较少,但有报道发现其在肺纤维化、肝纤维化患者的肠道菌群中出现丰度值降低[25-26]。
综上所述,代偿期乙型肝炎肝硬化患者存在肠道菌群失调,湿热证肠道菌群物种丰富程度及多样性与非湿热证及健康对照人群存在明显差异。本研究从肠道菌群角度初步揭示代偿期乙型肝炎肝硬化湿热证中医证候的生物学基础,为阐明湿热与肠道菌群之间的关系提供了客观依据,同时为中医药有效干预肝硬化湿热证肠道菌群失调提供了新靶点和新思路。另外,基于中医证候研究的复杂性及多态性,本研究仅对湿热证患者与其他人群的肠道菌群分布特征进行了差异性分析,对非湿热证中的常见证如肝郁脾虚、肝肾阴虚等尚未分层对比,同时亦缺乏对证候、理化检查及肠道菌群之间相互关系的深入系统分析,因此还需在后续研究中进一步充实与完善。
