聚苯乙烯微塑料对东海原甲藻生长的影响
2021-11-19刘千龙罗肇河康建华孙秀武张元标
孙 炎,刘千龙,罗肇河,康建华,孙秀武,张元标,林 辉,潘 钟*
(1.自然资源部第三海洋研究所,福建 厦门 361005;2.厦门大学海洋与地球学院,福建 厦门 361102)
微塑料被定义为直径小于5 mm的塑料颗粒,海洋中的塑料垃圾会经过一系列的物理、化学或生物过程分解成为微塑料。聚苯乙烯(Polystyrene, PS)是广泛使用的热塑性塑料之一,内部化学结构稳定,不易降解,容易造成环境污染[1]。1990年后,我国对聚苯乙烯的需求大幅增加,年消费量都在10万吨以上[2]。大量塑料制品的生产和使用,使得塑料垃圾在海洋水体中不断累积,微塑料广泛存在于近岸和大洋水体、生物体和深海沉积物等环境介质中[3-6],严重威胁海洋生态系统的稳定[7]。我国东海表层海水中微塑料的平均丰度为0.31 个/m3,在世界海域中处于中等水平[8],因此,东海海域的微塑料污染问题不容忽视。
东海原甲藻(Prorocentrumdonghaiense)属于甲藻纲,原甲藻目,原甲藻科,原甲藻属。东海原甲藻生长周期短,易于实验室培养、观测,适宜东海原甲藻生长的最佳温度约为20 ℃,最佳盐度在20~40之间[9]。我国赤潮灾害频发,2018年,我国管辖海域共发现36次赤潮事件,其中大部分发生在东海[10]。东海原甲藻是我国东海海域常见的有害赤潮藻[11],该藻暴发形成赤潮后,对海洋生态的危害大且难以控制[12]。
有毒有害微藻会寄生在海洋塑料垃圾碎片上,并可通过塑料碎片在海洋环境中传播[13]。Bergami等(2017)研究表明聚苯乙烯纳米微塑料对杜氏藻(Dunaliellatertiolecta)的生长具有长期毒性[14]。Sjollema等(2016)利用脉冲振幅调制叶绿素荧光仪测定聚苯乙烯微塑料对盐生杜氏藻(Dunaliellasalina)光合作用的影响,发现高浓度(250 mg/L)、小粒径(0.05 μm)条件下的微塑料对藻的抑制作用更强[15]。Wu等(2019)研究发现聚丙烯(Polypropylene, PP)和聚氯乙烯(Polyvinylchloride, PVC)微塑料会影响蛋白核小球藻(Chlorellapyrenoidosa)的光合作用,聚丙烯或聚氯乙烯微塑料的浓度越高,蛋白核小球藻的光合作用活性越低,且聚氯乙烯的抑制效应大于聚丙烯[16]。Lagarde等(2016)对聚丙烯和莱茵衣藻(Chlamydomasreinhardtii)之间的相互作用进行了研究,微塑料浓度设置为400 mg/L、粒径设置为400~1 000 μm,发现实验第一天莱茵衣藻的生长并未受聚丙烯微塑料的影响,实验20 d后,微藻、微塑料和胞外多糖会形成密度为1.2 g/cm3的异质聚集体,该聚集体会沉降到锥形瓶底部[17]。Zhang等(2017)研究发现平均直径为1 μm的聚氯乙烯微塑料对中肋骨条藻(Skeletonemacostatum)的生长和光合作用有明显的抑制[18]。微藻作为海洋中的一种微生物,是海洋食物链底端的的生产者,是全球氧气的主要来源,对于维持水生生态系统的稳定性起着重要的作用[19],微塑料污染作为当今世界四大环境问题之一,从2004年至今不断引起科学界的关注与研究[20],本研究拟通过设计不同粒径和浓度的聚苯乙烯微塑料及在不同浓度溶解性有机质溶液(DOM)的情况下对东海原甲藻的差异化暴露实验,观察东海原甲藻的生长状况,探讨聚苯乙烯微塑料对东海原甲藻生长的影响机制,从而为微塑料和赤潮藻的复合污染带来的生态效应以及海洋生态系统的保护提供科学依据。
1 材料与方法
1.1 实验材料
东海原甲藻由自然资源部第三海洋研究所海洋生物与生态实验室藻种库提供。聚苯乙烯微球购自天津倍思乐公司,粒径为0.1 μm和1.0 μm。
设备:光学显微镜(Olympus CKX41)、消毒灭菌锅(BXM-30R,上海博讯实业有限公司医疗设备厂)、光照培养箱(GXZ-280,宁波江南仪器厂)、锥形瓶(500 mL,蜀玻)、0.5 mL藻类计数框(XKJ-05S,厦门登迅仪器设备有限公司)。
鲁哥氏液:5 g碘和10 g碘化钾溶于85 mL蒸馏水中配置而成,避光保存。
f/2培养基:天然海水过滤,煮沸灭菌,pH调节至8,盐度调节至30.0±0.1,每1 L培养基中加入1 mL 75 g/L NaNO3、1 mL 5 g/L NaH2PO4·2H2O、1 mL痕量金属溶液和0.5 mL维生素溶液。
溶解性有机质溶液:称取2.0 g溶解性有机质(Alfa Aesar)于500 mL 烧杯中,搅拌使固体完全溶解,将烧杯中的液体转移至1 000 mL容量瓶中,并用去离子水定容至容量瓶刻度标线,配置成2 000 mg/L的溶解性有机质溶液,摇匀待用。
1.2 实验方法
f/2培养基中DOM浓度测定: 采集水样储存于60 cm3经过前处理的棕色玻璃瓶中,加磷酸酸化至pH<2,在-20 ℃条件下密封保存;测定时,将样品充分解冻,然后用岛津 TOC-VCPH型总有机碳分析仪分析,相对标准偏差(CV)<2%,测得f/2培养基中的DOM含量为1 mg/L。
取500 mL f/2培养基,转移至经高压蒸汽灭菌后的锥形瓶(500 mL)中,接种生长状态良好的东海原甲藻,接种密度为3.2×105个/L,使东海原甲藻处于生长迟滞期。按表1所示加入聚苯乙烯微塑料设置0、1、2、3、4、5六个实验组,其中0号为对照组,5号中加入1 mL配置好的溶解性有机质溶液,使培养基中的DOM浓度为5 mg/L。每个实验组设置2个平行样,置于恒温培养箱中,培养条件设置为温度20 ℃,光暗比L∶D=12 h∶12 h,光照强度为90 μmol/(m2·s)。前期每2 d取样一次,中期和后期每1 d取样一次,测量藻密度。实验结束时剩余藻液的体积应大于初始藻液体积的1/2。
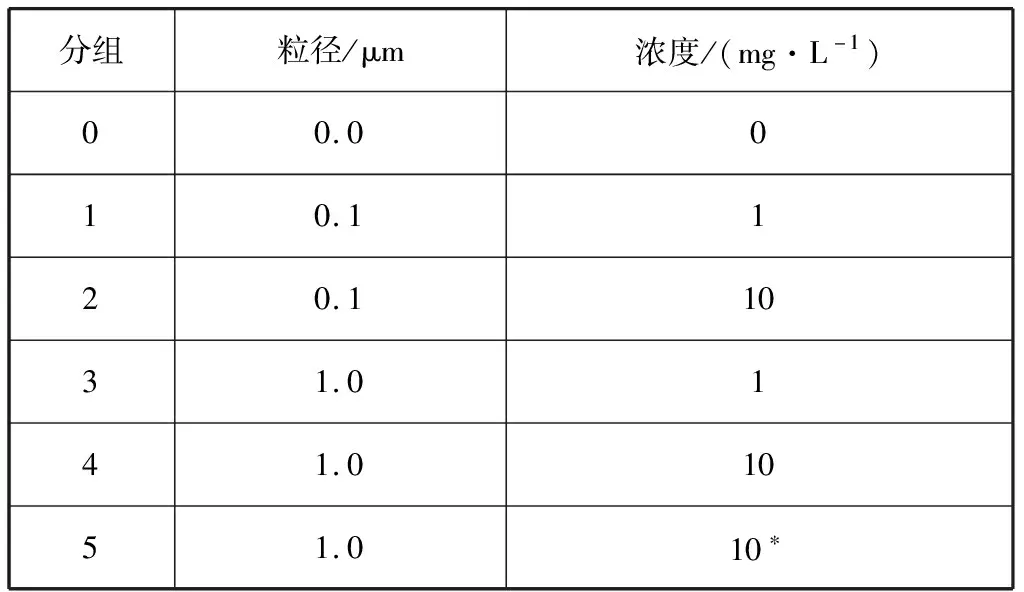
表1 微塑料暴露实验方案设置
藻密度测定:取100 μL藻液于10×10格的0.5 mL藻类计数框上,再加入300 μL鲁哥氏液固定藻,然后用光学显微镜观察计数,每个样品计数2次,取其平均值,记录细胞数量。
生长速率测定的计算公式如下。
(1)
式(1)中:C为生长速率[个/(L·d)],N2和N1分别为时间t2(d)和t1(d)时的藻细胞密度(个/L)。
采用Origin 8.0软件对数据进行分析和处理。
2 结果与讨论
东海原甲藻作为我国东部沿海常见的赤潮藻[21],在微塑料污染普遍存在的东海海域,可能与微塑料发生大概率的相互作用。广泛分布的微塑料影响藻类的生长,继而影响生态系统的稳定。本研究对东海原甲藻在聚苯乙烯微塑料差异化暴露条件下的生长状况进行了探讨,设置初始藻密度为3.2×105个/L,基于预实验结果设定藻体培养实验周期为19 d,图1显示六个实验组在微塑料暴露条件下的不同生长情况。
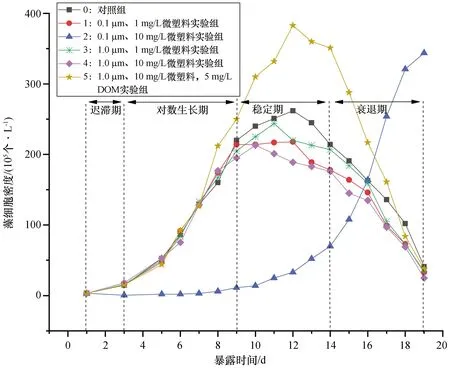
图1 东海原甲藻在不同微塑料暴露条件下的生长动力学曲线
实验组0、1、3、4体现了藻类生长的4个时期已在图1中标出:迟滞期(第1—3天)、对数生长期(第3—9天)、稳定期(第9—14天)、衰退期(第14—19天)。在迟滞期和对数生长期,4个实验对照组的藻密度差别较小,但在稳定期和衰退期呈现明显的差别,其中,实验组0(0 μm、0 mg/L)的藻密度最大,说明微塑料会抑制藻在稳定期和衰退期的生长。

在稳定期和衰退期,藻密度大小为实验组3(1.0 μm、1 mg/L)>实验组1(0.1 μm、1 mg/L),说明微塑料粒径越小,对藻的抑制作用越强。微塑料对藻的毒性强弱与其粒径大小相关,本次实验选取的微塑料粒径较小(0.1 μm和1.0 μm),而东海原甲藻细胞较大,体长可达16~22 μm[27],当微塑料和藻细胞接触时,可能会堵塞藻细胞气孔,降低养分和气体交换[28],从而抑制藻的生长。小粒径的微塑料还可能通过气孔进入藻细胞内部引起细胞机械损伤。微塑料进入藻细胞内部后,可能会引发部分细胞器的应激反应,导致细胞代谢紊乱,从而抑制藻细胞的生长。微塑料粒径越小,越易造成气孔堵塞或进入细胞内部,进而引起细胞机械损伤、降低养分和气体交换,从而对藻生长的抑制作用越强。在实验组1(0.1 μm、1 mg/L)、实验组3(1.0 μm、1 mg/L)和实验组4(1.0 μm、10 mg/L)藻生长的稳定期和衰退期中,藻生长抑制作用强弱大小为实验组4>1>3,表明在这两个时期内浓度的抑制效果强于粒径,可能的原因是聚苯乙烯微塑料的遮光效应大于细胞损伤效应。
与实验组1(0.1 μm、1 mg/L)和实验组4(1 μm、10 mg/L)相比,实验组2(0.1 μm、10 mg/L)在藻的迟滞期和对数增长期早期生长缓慢,对数增长期后期生长快且藻密度较大,实验结束后藻密度仍在增长。说明在小粒径(0.1 μm)和高浓度(10 mg/L)条件同时存在下的聚苯乙烯微塑料对东海原甲藻前期的生长影响表现为先抑制、后促进。纳米塑料在生物体内容易发生聚集,而且排出缓慢,从而在细胞和分子层面上具有明显的毒性效应[29]。0.1 μm的微塑料已经达到纳米级别,且在10 mg/L的高浓度下对东海原甲藻造成强烈的抑制效应,导致藻在生长前期就出现细胞损伤、气体交换减弱等现象,藻密度增长缓慢。东海原甲藻在其生长后期生长速率加快的原因可能如下:细胞受外因胁迫自身调节,使细胞壁增厚[30],从而有效地阻挡微塑料的入侵,避免细胞损伤;藻类的同质聚集[31],藻细胞通过形成群落而降低其细胞表面体积比,减少微塑料在其表面的吸附,从而保护藻细胞不受进一步损害。
图2显示了第1—9天内东海原甲藻的生长速率变化情况。实验组0~5的平均生长速率分别为0.53、0.53、0.15、0.52、0.51、0.55 个/(L·d)。实验组0、1、3、4在第1—9天内的生长速率均随时间的增加而减小,可能的原因是随着培养时间的增加,培养基中的N、P等营养物质被消耗而得不到补充,导致藻的生长速率降低[38]。实验组5(1.0 μm、10 mg/L,DOM浓度为5 mg/L)的平均生长速率最大,说明高浓度的溶解性有机质促进了东海原甲藻的生长,这可能由于溶解性有机质携带或分解产生氮磷无机盐[33,36]或腐殖酸吸附微塑料从而降低微塑料对藻生长的抑制[37]。实验组5在D3—D5天和D5—D7天的生长速率相同,均为0.53个/(L·d),后一时间段维持了前一时间的生长趋势,这也进一步证明了具有高浓度(DOM浓度为5 mg/L)溶解性有机质的实验组5中的营养物质较其他实验组充足,溶解性有机质携带或分解产生氮磷无机盐[33,36]为维持藻较快的生长带来了额外的营养源补充。实验组2(0.1 μm、10 mg/L)的初始生长速率最小,为-1.04 个/(L·d),说明实验开始时其藻生长受到微塑料的强烈抑制,这也充分表明了微塑料颗粒的低粒径效应明显强于高粒径颗粒;在D7—D9天,实验组2的生长速率最大,为0.65 个/(L·d),显著大于其他实验组,藻表现出明显的增长趋势,表明0.1 μm、10 mg/L的聚苯乙烯微塑料对东海原甲藻第1—9天内生长趋势的表现为先抑制、后促进。
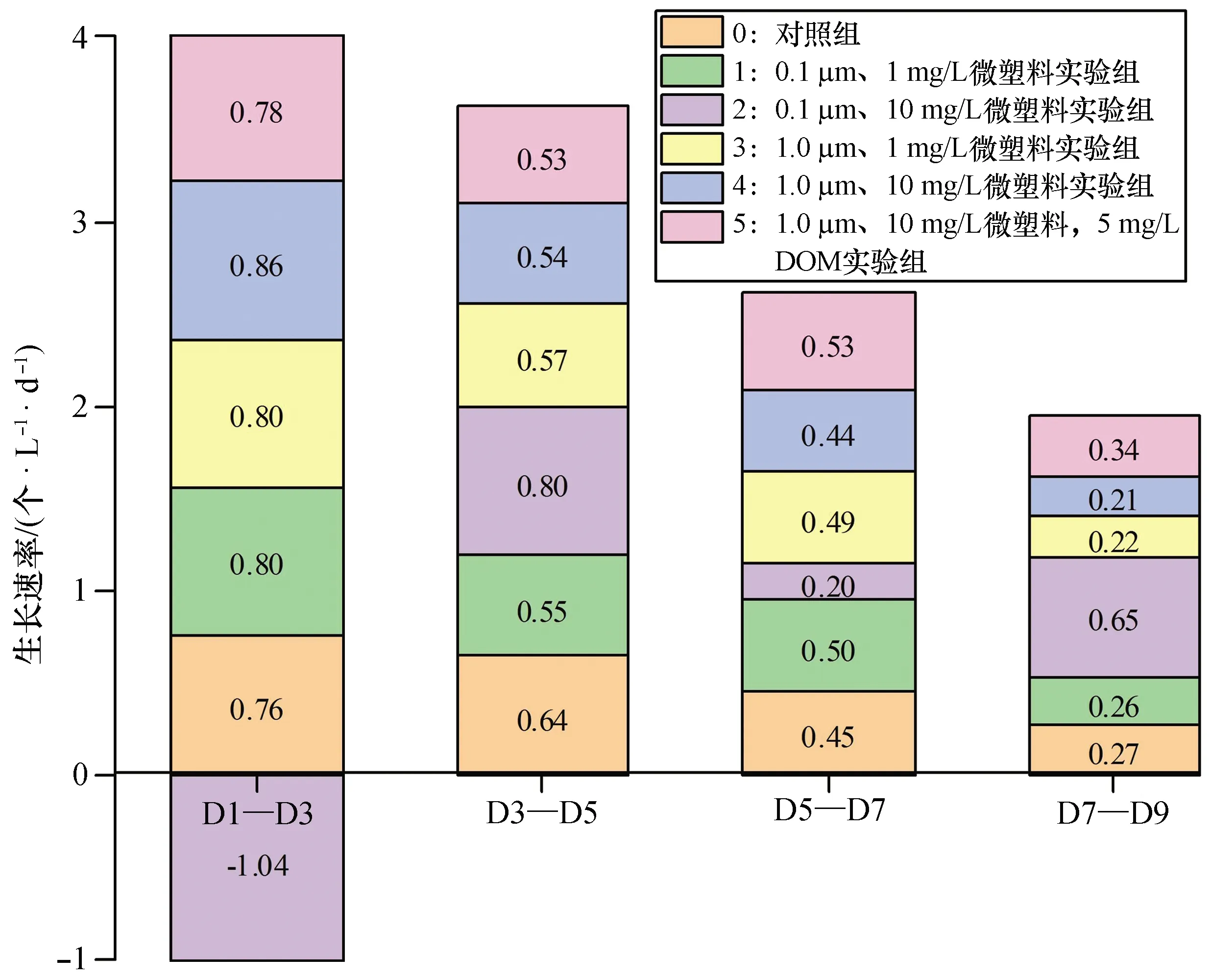
图2 各实验组中藻的生长速率变化
3 结论
本研究通过聚苯乙烯微塑料差异化暴露实验,观察了东海原甲藻的生长情况,测量了藻密度和生长速率的变化,获得如下结论:
(1)DOM的加入促进了东海原甲藻的生长,在小粒径(0.1 μm)和高浓度(10 mg/L)条件同时存在下的聚苯乙烯微塑料对东海原甲藻前期的生长影响表现为先抑制、后促进。
(2)聚苯乙烯微塑料会抑制东海原甲藻在稳定期和衰退期的生长,微塑料粒径越小、浓度越高抑制作用越强。
(3)后续研究可进一步从更多层面测定微藻的生长状况,比如测定藻细胞的实际光合效率、观察培养基中N和P的变化、对藻细胞进行测定透射电子显微镜(TEM)切片分析从而在细胞器层面解释毒性机理等,获取更多有代表性的数据,为全面了解微塑料对东海原甲藻的生态生理效应提供理论支撑。
