泰来草WOX转录因子的筛选与结构分析
2021-11-19陈石泉吴钟解蔡泽富
沈 捷,陈石泉,吴钟解,蔡泽富*
(1.海南热带海洋学院 热带海洋生物资源利用与保护教育部重点实验室,海南 三亚 572022;2.海南省海洋与渔业科学院,海南 海口 571126)
同源异型盒(Homeobox,HB)是一类高度保守的转录因子[1],因含有同源异型结构域(Homeodomain,HD)而得名,在真核生物个体发育及细胞分化中发挥关键调控作用。典型的同源异型结构域是由约60个氨基酸组成,能够与特异性的DNA序列结合,它的标志就是含有螺旋-环-螺旋-转角-螺旋(Helix-loop-helix-turn-helix)的结构和12个保守的氨基酸(RQLYIVWFNRRK)[2-4]。
WOX(WUSCHEL-related Homeobox)转录因子家族是HB超家族中的一员,是植物特有的一类转录因子。与典型的同源异型结构域相比,WOX转录因子家族的同源异型结构域多出了5个氨基酸[WUSCHEL(WUS)多出6个氨基酸][4],对模式植物拟南芥(Arabidopsisthaliana)中WOX转录因子家族进行系统进化树分析,可分为3个进化分支:远古进化支包括WOX10、WOX13、WOX14;WUS进化支包含WUS和WOX1-7;而WOX8、WOX9、WOX11和WOX12则是处于两者之间的中间进化支[5]。结构上,WUS进化分支的WOX蛋白除了含有典型的HD结构域外,其下游还包括WUS-box结构域,该结构域与调控干细胞稳定性和花器官发育等过程密切相关[6]。一些家族成员在HD和WUS-box之间还存在连续的酸性氨基酸序列,这段酸性氨基酸序列可能与转录激活相关。一些家族成员如WUS蛋白的羧基端有一个乙烯响应因子(Ethylene Response Factor,ERF)相关的结构域,这个结构域与转录抑制相关。
WOX家族成员众多,在拟南芥中,WOX家族的15个成员分别具有调控干细胞多能性、侧生器官的发育、花器官的形成和胚发育等生物学功能[5-15]。WOX转录因子广泛存在于各种植物之中,水稻全基因组中共有13个WOX转录因子[16];玉米全基因组中共预测有21个WOX转录因子[16-17];在棉花、杨树、高粱和茄子等植物中也有关于WOX基因的报道[16,18-20]。陆地生物中,WOX基因的鉴定与功能研究非常多,但是相对于海洋植物而言,目前对WOX基因的研究还比较少,仅在单细胞绿藻中发现WOX基因家族[21],其他海洋植物并未有报道。
海草床的生态功能与服务价值重大,作为海岸带天然生态屏障,在红树林与珊瑚礁生态系统之间起着承上启下的纽带作用,能促进海洋主要元素循环,净化水质并稳固海床,可提供全球每年1.9万亿美元的经济价值[21-25]。自1980以来,全球范围内海草床面积正以110 km2/a的速度减少[22,26-27],中国海草床退化也较严重[21,28]。泰来草(Thalassiahemprichii)是热带海草主要优势种,属于水鳖科泰来草属(Thalassia),主要分布在东南亚、台湾南部和海南的文昌、琼海、陵水、三亚、三沙等[29],被列入新加坡濒危植物红色名录“极度濒危”。海草资源的保护与恢复离不开种苗的补充,因此,研究泰来草重要生理功能的分子调控机制对海草生态学、生物地理和遗传多样性具有重要意义。本研究通过筛选泰来草WOX基因,通过分析其基因结构与进化关系,探索WOX基因在泰来草中潜在的生理功能和根茎发育的分子调控机制,为深入利用分子生物学手段进行种苗繁育调控提供理论基础。
1 材料与方法
1.1 数据来源
用于泰来草WOX基因筛选的数据来源于本实验室对泰来草转录组的测序结果,样品采集自海南陵水新村港与黎安港海草特别保护区,为结构完整、生长健壮的泰来草叶片。利用BGISEQ-500测序平台,共获得了6.47 GB的数据,通过denove组装,并利用KEGG、Gene Oncology(GO)、NR、NT、SwissProt、Protein families(Pfam)、EuKaryotic Orthologous Groups(KOG)7个数据库对测序结果进行注释,获得了32 097个Unigenes(该成果论文另行发表,GeneBank登录号:SRR10438616)。
1.2 生物信息学分析
利用ORF finder预测泰来草WOX基因CDS(Coding DNA Sequence);利用在线软件SMART(http://smart.embl-heidelberg.de/)对蛋白质结构进行分析;利用EXPASY(https://web.expasy.org/protparam/)对蛋白的分子量、等电点等进行预测;利用泰来草的WOX基因序列在数据库(https://blast.ncbi.nlm.nih.gov/)中进行检索和同源性对比;利用Clustal W软件(http://www.ebi.ac.uk/Tools/msa/clustalw2/)进行蛋白序列的多重联配分析;利用MEGA X软件(http://www.megasoftware.net/)的最大似然法(Maximum Likelihood, ML)构建系统发育树[Bootstrap:1 000, Substitution Model: Jones-Taylor-Thormton(JTT)Modle, Tree Inferebce Options: Nearest-Neighbor-Interchange(NNI)]。
2 结果与讨论
2.1 泰来草WOX基因的获得与结构分析
根据本实验室对泰来草转录组的测序结果,仅发现一个WUSCHEL同源基因,该基因长834 bp,通过ORF Finder预测获得了一个597 bp的全长CDS序列,编码198个氨基酸,分子量为21 967.43,pI值为5.34,信号肽分析表明,N端包含29个氨基酸的信号肽[MHPAVFLSLPDLRCSLLLLVTWVFTPVTT,http://www.cbs.dtu.dk/services/SignalP/,图1(a)]。
利用SMART软件分析蛋白结构域,结果显示包含典型的Homeobox结构域(29—97),对其全长CDS序列进行结构预测,结果表明这个典型的结构域是参与发育过程中关键转录调控的DNA结合因子[图1(b)]。

图1 泰来草WOX转录因子结构分析
利用SWISS-MODEL(https://swissmodel.expasy.org/)同源建模的方法对其进行三级结构的预测。结果显示,本地建模质量评估(Local Quality Estimate)值为0.3~0.8[图2(a)],全局模型质量评估(GMQE)值为0.19,定性模型质量分析(QMEAN)值为-1.00[(图2(b)],HOX domain建模同源性为30.77%,结果比较可靠。从结果可以看出,该蛋白具有Helix-loop-helix-turn-helix结构[图2(c)],这与其他植物中WOX基因的三维建模结果一致。
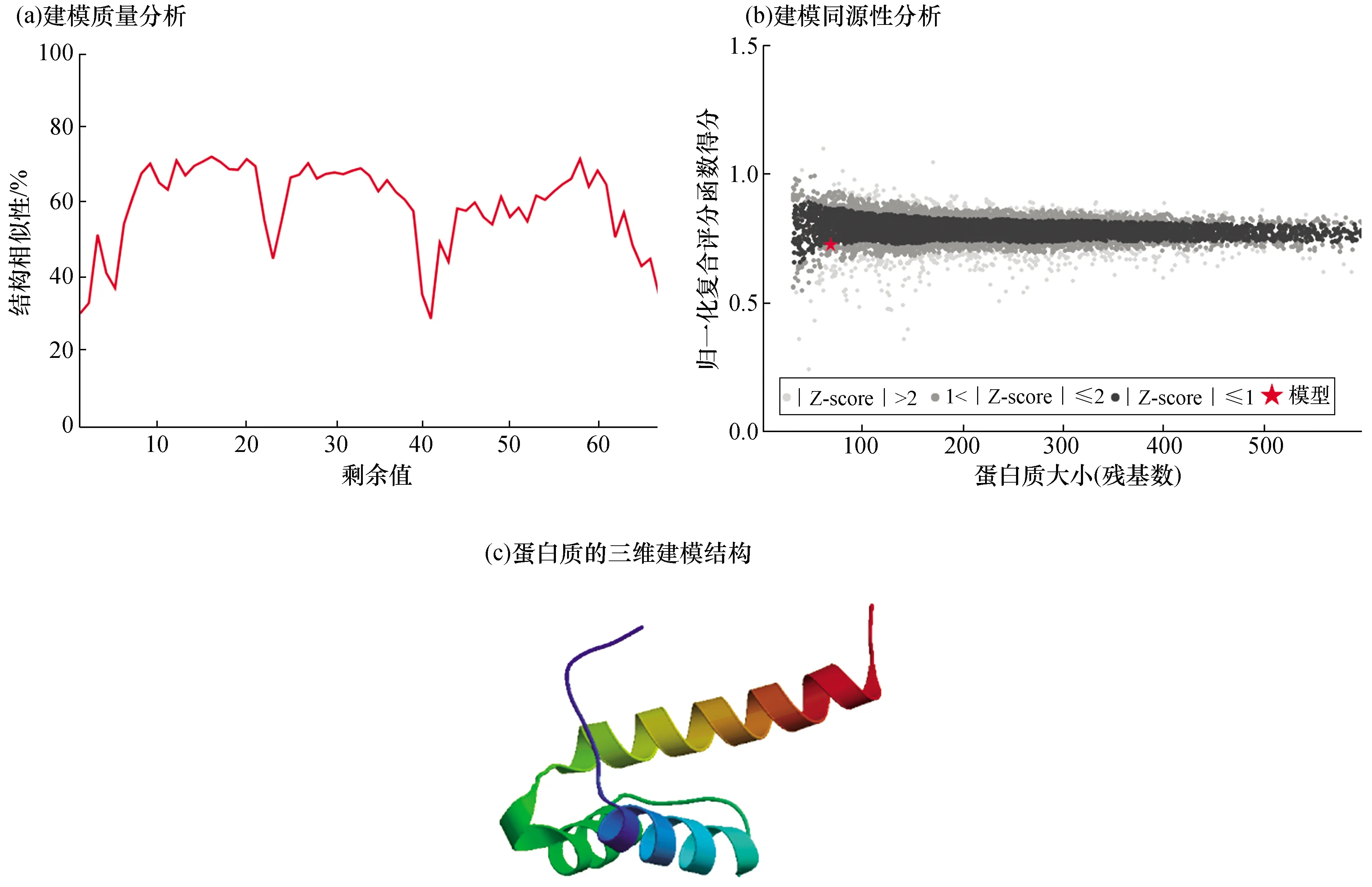
图2 泰来草WOX转录因子蛋白质结构建模分析
2.2 同源比对及进化树分析
将泰来草的WOX基因序列与NCBI的数据库中已公布的其他物种的WOX基因进行blast比对,获得了99条相似序列,其中一致性最高为67.39%,最低为38.50%,其相似结果主要集中在豆科植物中,仅发现一种水生植物——莲(Nelumbonucifera)的WOX基因,此外还有葫芦科、锦葵科、棕榈科以及蝶形花科和一些藤本植物。从中筛选了序列一致性最高的8条序列进行蛋白的多重联配分析(图3)。结果显示,在这8种植物中,均具有明显的Homeobox结构域,但是泰来草与这些植物相比,N-端明显的缺失了一段,这可能与陆地植物和海洋植物的进化关系有关。

图3 泰来草WOX转录因子与其他8种植物的WOX8转录因子的多重联配分析
对NCBI数据库中所能获得的植物WOX蛋白序列进行筛选,选择了93条处于中间进化支的典型序列(表1),与泰来草的WOX蛋白序列进行对比分析,并利用MEGA X中的最大似然法(ML)构建了系统发育树(图4)。从结果可以看出,虽然WOX8和WOX13在序列上具有很大的相似性,但泰来草的WOX转录因子与其他物种的WOX8聚集在一起,故将本研究中获得的泰来草WOX基因注释为ThalassiatestudinumWUSCHEL-relatedHomeobox8(ThWOX8)。有意思的是,泰来草与陆地棉和海岛棉的WOX蛋白聚集在一个分支之上,并且与其他的豆科等物种具有显著的分离。
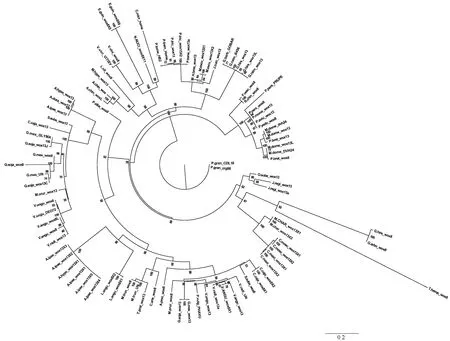
图4 泰来草WOX基因蛋白与其他93种植物WOX基因蛋白的进化树分析

表1 用于进化树分析的93条蛋白序列信息
2.3 讨论
WOX转录因子几乎存在于植物的每一个器官之中,在各器官分裂旺盛的细胞群中显著表达,参与调控植物干细胞的稳定、器官形成、胚的形成关键发育等过程。为了长期维持植物细胞自我更新和分化之间的平衡,需要将动态信号转换为空间和时间上精确且稳定的基因表达状态,WOX转录因子通过变应性控制生长素信号传导和响应途径,调节靶基因座的组蛋白乙酰化而起作用,触发植物生长素的局部分化,同时维持干细胞在整个生命周期中的生存,以保持植物全周期状态下的生长和发育[30]。
本研究根据前期转录组测序的结果,通过对7个数据库的筛选仅获得了1个WOX基因,这可能是用于转录组测序的样品根茎叶结构不完整造成的。序列比对和进化树构建结果存在差异,这可能是由于不同算法造成的。结合前期转录组测序的结果综合考虑,我们认为泰来草与豆科和莲科的亲缘关系较为接近。这是海洋植物泰来草中发现的第一个WOX转录因子,由于缺乏其它海洋高等植物的WOX8的同源基因,我们尚不清楚其他海洋植物是否具有同样的类似基因。
从单细胞绿藻到绿色开花植物,亲缘关系相差巨大,但都含有WOX基因,说明这是一类较为古老的基因。基因家族数量的扩增往往在进化发育过程中起着重要的作用,包括新结构起源、形态的多样化以及复制后新功能的产生和亚功能的分化[31-33]。系统进化研究的结果也表明,在单细胞绿藻和陆地植物发生分化之前,他们的共同祖先就已经含有至少一个远古支起源的WOX基因,随后各物种的远古支WOX基因独立进化,进而扩增分化出中间支和WUS支[34]。我们在泰来草中发现的ThWOX8是属于中间支的一个重要基因。在拟南芥中,AtWOX8在胚胎基部区域表达,与WUS支的WOX2基因协同作用,参与调控拟南芥受精卵发育成胚的过程,促进胚根发育形成根分生组织[7,14,35]。此外在胚发育过程中,STPL/WOX8通过调控CUPSHAPEDCOTYLEDON(CUC)基因的表达促进子叶叶缘的发育[36]。水稻DWT1是拟南芥AtWOX8/9的同源基因,具有影响水稻节间细胞分生和伸长的作用,同时调控水稻主杆和分蘖生长的一致性[37]。在裸子植物挪威云杉(Piceaabies)中,PaWOX2和PaWOX8/9在受精卵和体胚发育早期高度表达[38],表明这一机制在被子植物和裸子植物中具有保守性[39]。这些研究结果表明,WOX8参与了体细胞胚特别是基部(根端)的发育,为我们进一步分析ThWOX8基因在泰来草根发育过程中发挥的作用及其调控机制奠定基础。
海草作为一种重要的潮间带植物,是重要的海洋初级生产者,能够为一些海洋生物提供丰富的食物和栖息场所,同时对维持近海生态平衡具有至关重要的作用。近年来海草种群的衰退现象严重,对海草床的生态修复成为研究热点。但生境恢复法、种子法、移植法等海草床修复方法都不够理想[40-42],缺乏组织培养等有效手段进行大量的人工繁育。目前,我们正在进行ThWOX8基因过表达载体构建和转化拟南芥的实验,旨在深入分析ThWOX8基因在泰来草发育过程中所发挥的作用。了解泰来草的分子生物学特性、基因表达信息,进一步挖掘与根茎叶生长相关的关键基因,尤其是与体细胞胚胎发生、定殖相关的基因及其分子机理,可以为泰来草分子育种与扩繁提供有益的思路。
3 结论
本研究利用泰来草转录组数据,筛选到一个WOX基因(命名为ThWOX8),该基因全长597 bp,编码198个氨基酸,其中具有典型的Homeobox结构域。同源比较分析和系统进化树分析结果表明:泰来草ThWOX8与豆科植物和莲的亲缘关系较为接近。关于ThWOX8在调控泰来草胚胎发育过程中的具体生理功能及机理尚需进一步研究。
