不同状态红树和盐沼植物样品的脂肪酸组成比较研究
2021-11-19谢丽梅吴志强陈顺洋陈光程
谢丽梅, 吴志强, 陈 彬, 陈顺洋, 陈光程*
(1.自然资源部第三海洋研究所,福建 厦门361005; 2.中国海洋大学海洋生命学院,山东 青岛 266003; 3.福建省海洋生态保护与修复重点实验室,福建 厦门 361005)
作为滨海湿地生态系统的初级生产者,湿地植物为生态系统内和其毗邻区域的生物提供食物来源和栖息繁衍场所,并构成复杂的食物链和食物网关系[1]。脂肪酸作为细胞膜脂的主要成分,又是机体重要的能源物质,是植物必不可少的成分[2]。植物脂肪酸随着食物链传递到消费者体内,对动物的生长发育和繁殖具有重大意义[3],通过对比物种脂肪酸的组成,可以确定物种间的营养关系,指示食物网的结构组成[4]。
目前我国对滨海湿地植物脂肪酸的报道较少,多集中在某一植物物种或者常见物种的脂肪酸组分的研究[5]。红树和盐沼植物是我国南方河口常见的湿地植物类型,它们通常具有相似的生态位,可同时分布在河口的一些岸段[6],因此都可能构成湿地底栖动物的食物来源。本研究分析了九龙江口红树植物秋茄(Kandeliaobovata)和桐花树(Aegicerascorniculatum),以及盐沼植物互花米草(Spartinaalterniflora)和短叶茳芏(Cyperusmalaccensis)这4种湿地植物成熟、衰老和腐烂植物样品中的脂肪酸组成,以期为了解湿地植物在维系底栖食物网的重要性提供参考。
1 材料与方法
1.1 样品采集与前处理
植物样品采集于福建省龙海市浮宫镇草埔头村沿岸(24°23′28.82″N, 117°54′32.50″E)。采集红树植物叶片和盐沼植物地上部分,因为它们分别代表这两类植物输出的有机碳的形式。随机摘取秋茄、桐花树的新鲜成熟叶片,摇晃树干获取凋落的叶片,收集林地地表腐烂的叶片。同时,随机采集互花米草、短叶茳芏的成熟和衰老的(死亡枯黄)地上部分生物量,收集地面腐烂的茎秆等样品。每种类型的植物分别采集4份重复样品。样品运回实验室后用蒸馏水洗净,于-40 ℃冷冻干燥后研磨成粉,待测。
1.2 脂肪酸提取
脂肪酸的提取参考崔莹(2012)的方法[7],称取50 mg样品于15 mL具盖玻璃试管中,加入6 mL二氯甲烷∶甲醇混合溶液(体积比为2∶1)于80 ℃条件下水浴加热2 h。水浴结束后迅速冷却至室温,将试管中的液体转移到25 mL空试管中,60 ℃水浴蒸干,再向试管中加入4 mL盐酸∶甲醇混合溶液(体积比为1∶3),于60 ℃条件下水浴4 h后将试管迅速冷却。再加入1 mL正己烷溶液,涡旋混匀后静置分层,必要时可加入蒸馏水助分层,重复提取两次。将正己烷层转移至样品瓶中,用氮气吹干浓缩,再加入正己烷定容至1 mL,待测。
1.3 脂肪酸测定
利用气相色谱仪(GC7890A)测定脂肪酸的组成和含量,自动进样器每次注入分析样品量为1 μL。所用色谱柱为极性毛细管柱(HP-88, 长60 m×直径0.25 mm×膜厚0.2 μm),进样口温度为250 ℃,火焰检测器温度为300 ℃,分流比为10∶1。气相色谱运行时的升温程序是:初始温度100 ℃,维持3 min,然后以10 ℃/min的速度升温到210 ℃,维持1 min,然后以1.5 ℃/min的速度升到240 ℃,保持3 min;氮气为载气,流速为3 mL/min。定性使用的脂肪酸甲酯标准为37种脂肪酸甲酯混标、二十六烷酸甲酯、二十八烷酸甲酯(No.47885,No.52203,No.74701,Sepulco.)与三十烷酸甲酯(No.T0812,Tokyo Kasei Kogyo Co.,Ltd)。
1.4 数据处理
本研究中脂肪酸的表达写为CA:BnXt/CA:BnXc,A表示脂肪酸碳链的碳数,B表示双键的数量,X表示第一个双键离甲基端的碳数,t表示反式脂肪酸,c表示顺式脂肪酸。采用峰面积归一化法,得到各脂肪酸成分的相对百分含量。基于样品的脂肪酸组成,采用聚类分析对样品进行分组,再用相似性分析(ANOSIM)和相似性百分比分析(SIMPER)检验植物样品处理组之间的相似性,同一物种不同状态样品中脂肪酸组成的差异用主成分分析(PCA)和SIMPER分析(Primer 6);用单因素方差分析比较不同样品脂肪酸含量的差异(SPSS 23.0)。
2 结果与讨论
2.1 样品脂肪酸的组成
在12种植物样品中共检测出20种脂肪酸(表1、2),其中月桂酸(C12:0)、肉豆蔻酸(C14:0)、棕榈酸(C16:0)、十七酸(C17:0)、硬脂酸(C18:0)、油酸(C18:1n9)、亚油酸(C18:2n6)、花生酸(C20:0)和二十碳烯酸(C20:1n9)等9种脂肪酸在所有样品中均被检测到。样品的偶数碳原子脂肪酸含量均高于96%。样品中检测到13种饱和脂肪酸(SFA),含量最高的均为C16:0(21.76%~39.55%),其次是C18:0(4.98%~29.88%)。样品中检测到不饱和脂肪酸(UFA)7种,其中单不饱和脂肪酸(MUFA)4种,主要包括C18:1n9(2.04%~12.90%)和C20:1n9(1.64%~40.45%);多不饱和脂肪酸(PUFA)3种,包括C18:2n6、C18:3n6和C20:4n6,其中含量最高的为C18:2n6(8.25%~24.69%)。UFA/SFA值在4种植物的新鲜成熟样品中最高,衰老样品次之,腐烂样品则最低。
4种植物在叶片衰老和分解过程中饱和脂肪酸含量增加,盐沼植物的单不饱和脂肪酸含量在衰老过程中显著降低(p<0.05),互花米草的多不饱和脂肪酸含量在衰老过程中显著降低(p<0.05,图1)。C20:1n9含量在除秋茄外的3种植物叶片衰老过程中显著降低,C18:0在盐沼植物叶片衰老过程中含量增加(表1、2)。
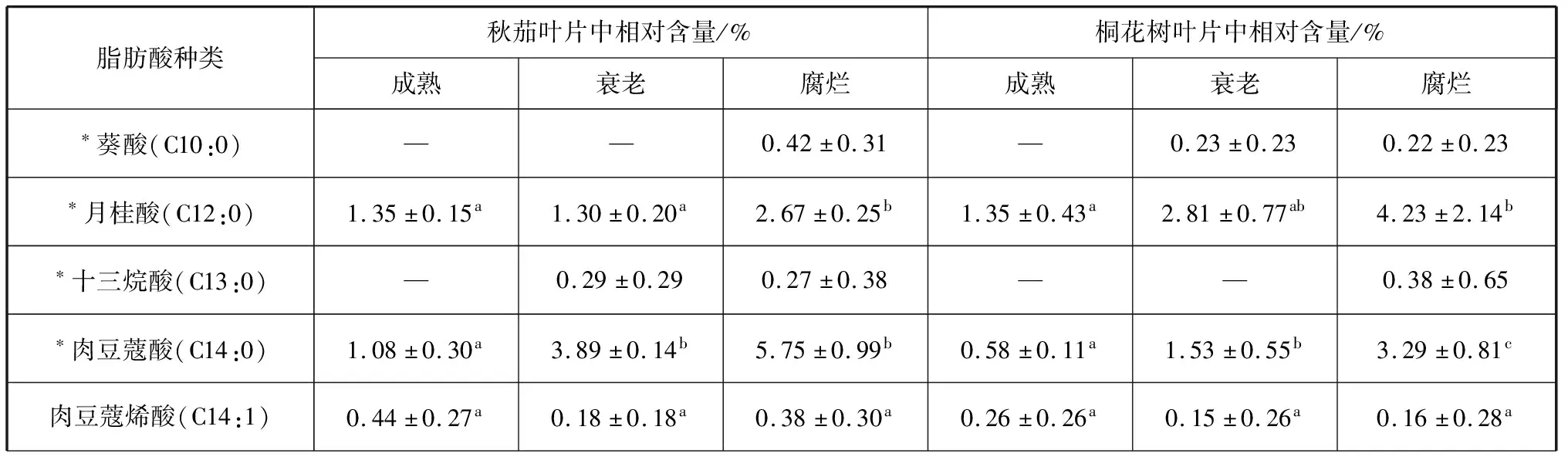
表1 红树植物叶片的脂肪酸组成及相对含量
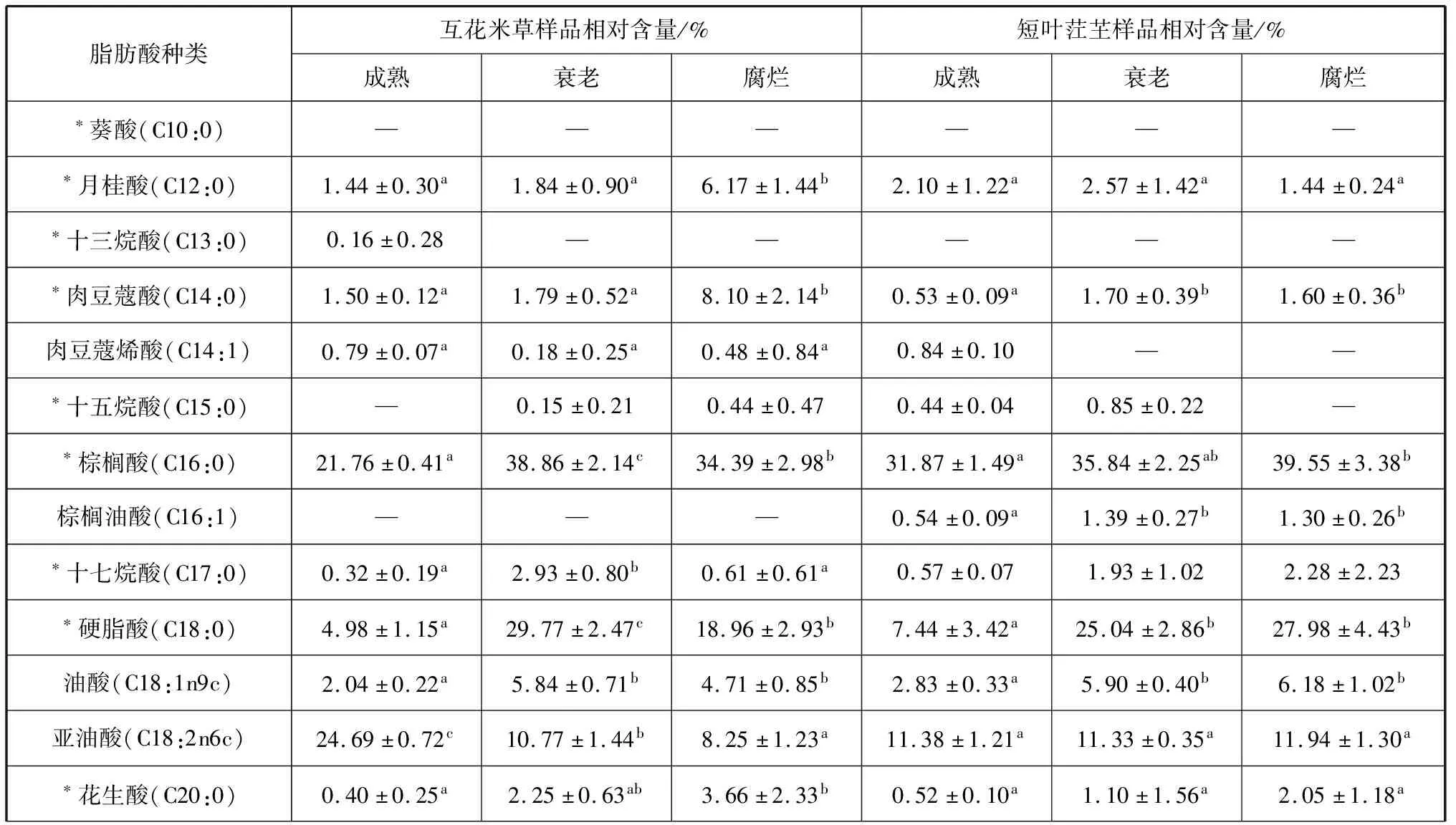
表2 盐沼植物样品的脂肪酸组成及相对含量

图1 不同植物样品脂肪酸的组成
2.2 样品脂肪酸组成的差异
聚类分析将植物样品脂肪酸组成在80%相似水平下分成3组,其中6种红树样品为第1组,两种盐沼植物成熟样品为第2组,两种盐沼植物的衰老样品和腐烂样品同为第3组(图2)。基于聚类分析分组情况的One-way Anosim分析结果表明,红树样品组(第1组)和第2、3组之间均存在显著差异(R=0.99,p=0.036;R=0.996,p=0.005),两组盐沼样品间脂肪酸组成差异不显著。SIMPER分析结果表明第1组和第2、3组的组间差异贡献最大的脂肪酸是C30:0,第1组的6种红树样品均检测出C30:0,盐沼植物样品均未检出。

图2 基于样品脂肪酸组成的聚类分析结果
PCA分析结果显示,在4种植物样品脂肪酸的组成上,不同状态的样品分处在不同的组(图3)。基于不同状态样品的PCA分析结果进行SIMPER分析,结果表明,红树植物成熟样品和衰老、腐烂样品间差异贡献最大的是C20:1n9,盐沼植物成熟样品和衰老、腐烂样品间差异贡献最大的是C20:1n9和C18:0。
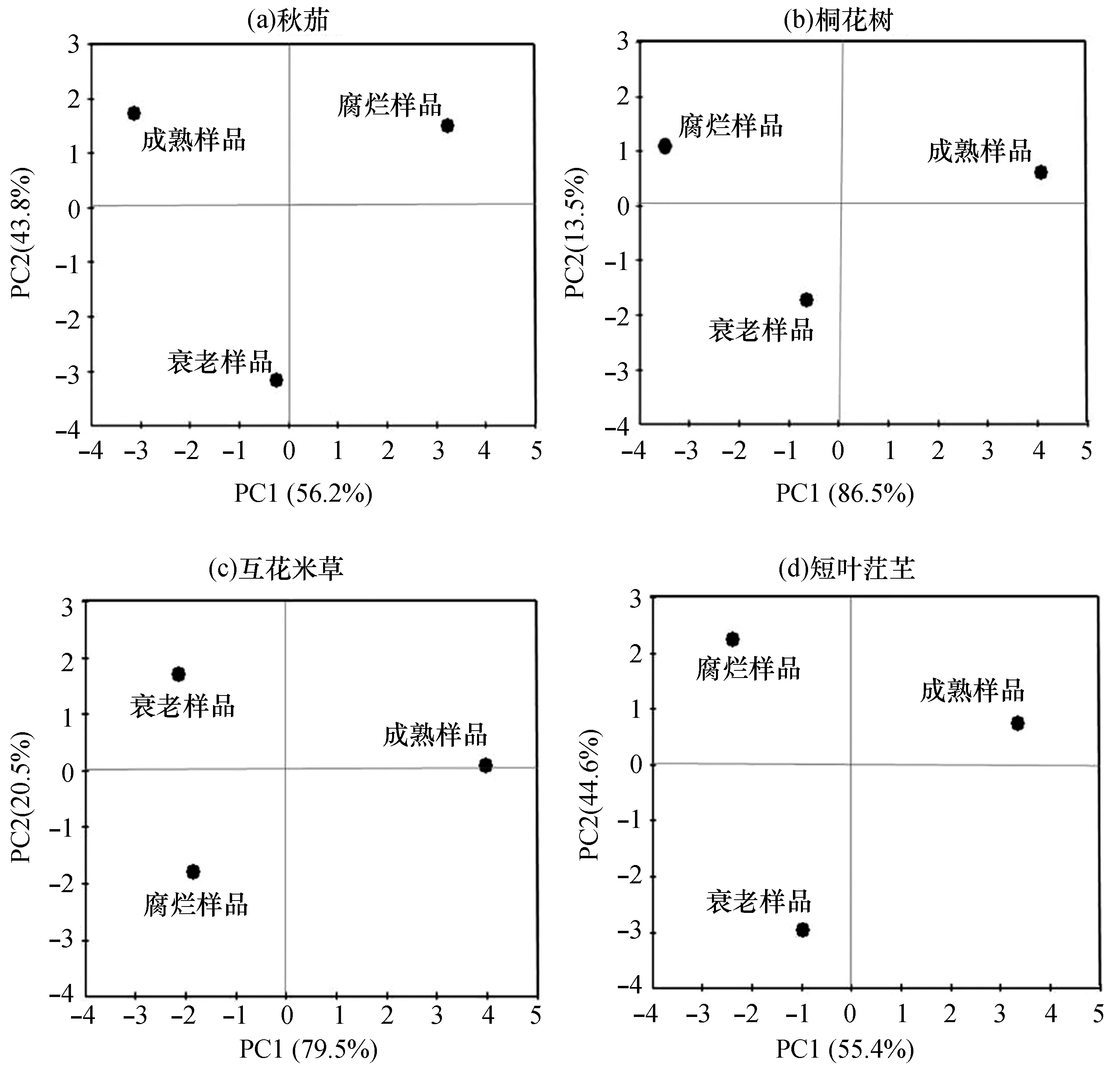
图3 基于样品脂肪酸组成的PCA分析结果
2.3 讨论
本研究在样品中共检测出20种脂肪酸,奇数碳原子含量较低,含量较高的为C16:0、C18:0、C18:1n9、C18:2n6和C20:1n9。C16:0和C18:2n6已被证实通常是红树和盐沼植物叶片中的主要脂肪酸[5, 8-9]。4种植物成熟样品中的UFA含量均高于SFA,其中互花米草成熟叶片UFA/SFA最高。两种红树成熟叶片的UFA/SFA值(1.20和1.46)与卢昌义等(1997)在九龙江口的报道相近[10],盐沼植物的UFA/SFA值也落在前人报道的区间内[11-12]。本研究也发现,红树和盐沼植物样品中的UFA/SFA值在衰老和腐烂样品中低于成熟样品,脂肪酸的组成以SFA为主。C16:0在叶片衰老和腐烂过程中相对含量有所增加,是4种植物腐烂叶片中含量最高的脂肪酸,这有可能是其他脂肪酸含量减少导致的[9]。
由于不同生物对脂肪酸的合成和改造能力存在差异,某些脂肪酸只能由特定的生物合成,且脂肪酸在生物代谢中具有保守性,因此脂肪酸被认为是一种合适的生物标志物,已经被广泛用于水生动物食物来源的研究[13-14]。此前的研究已经筛选出了一些特征脂肪酸用于示踪食物网中有机质的传递,例如C20:5n3被认为是硅藻的特征脂肪酸,甲藻含有较高的C22:6n3和C18:4n3[15]。碳链长度大于24的长链脂肪酸,如C26:0、C28:0和C30:0则是红树植物的特征脂肪酸,在一些河口湿地底栖动物食源和食物网的研究中被用来示踪红树植物的贡献[13-14]。本研究中C30:0在6种红树叶片中被检出(3.37%~7.47%),但样品中未检出C26:0和C28:0。前人的研究表明红树植物的特征脂肪酸组成存在明显的种间差异和地区差异,其长链脂肪酸的组成和含量存在很大的不确定性,在一些物种中可能存在两种及以上的长链脂肪酸,因此在利用特征脂肪酸进行食源和食物网研究时需测定该研究区域内红树的脂肪酸组成[16]。本研究中两种盐沼植物样品中检测到的脂肪酸在红树样品中也存在,说明盐沼植物无特征脂肪酸,与之前的研究相符[12]。因此,在河口地区,当红树植物和盐沼植物共存时,单独使用脂肪酸示踪法无法直接证实这两类植物是否都构成了底栖动物的食物来源,需要结合其它方法,如胃含物法、稳定同位素法[16]等全面分析底栖动物的食物来源及贡献。
本研究结果表明不同状态的叶片脂肪酸组成存在明显差异(图3)。在植物的衰老过程中,植物体内的膜脂过氧化作用加剧,不饱和脂肪酸含量降低,膜脂的脂肪酸饱和程度逐渐增高[17]。这与本研究的结果总体相似。衰老的植物样品相比新鲜成熟样品,所检测到的20种脂肪酸中,仅有C20:1n9在4种植物之间表现出相同的变化规律,其含量在衰老的样品中出现明显的下降。但两种盐沼植物的C20:1n9含量则下降更快,在衰老的样品的脂肪酸中所占比例未超过3%,与腐烂叶片的含量也相似;相应的,它们的C18:0比例则出现明显的增加。Huynh等(2007)认为动物体内C20:1n9的水平可以反映出它们的食物来源[18],但在本研究中盐沼和红树植物的C20:1n9在腐烂过程中发生明显变化,因此利用C20:1n9的水平是否可以准确指示滨海湿地植物对底栖动物食源的贡献还需要验证。
本研究发现腐烂样品中USF/SFA的比值低于新鲜成熟叶和衰老叶片,这可能是因为植物在分解过程不饱和脂肪酸首先被利用[19]。红树叶片分解过程中,长链的脂肪酸能够保持稳定的水平,多不饱和脂肪酸也不被降解[8]。尽管之前的研究表明叶片腐烂过程中C16:0的水平会出现明显的下降[8, 20],可从~70%下降到~20%,但是本研究未发现红树和盐沼植物样品中C16:0受到腐烂过程的影响,腐烂样品中的C16:0均维持在>30%的水平。Rajendran等(2000)的研究[9]中,红树植物叶片腐烂过程中C16:0的水平的变化量也远低于Mfilinge等(2003)的研究[8],或者未发生变化。这可能是这些研究中衰老的样品中脂肪酸含量的组成差异造成的。考虑到同一物种的脂肪酸在不同地区存在差异以及植物物种之间的差异[5, 21],我们认为今后的研究中还需要进一步探究植物凋落物在分解过程脂肪酸的变化过程及机制。
包括C18:2n6和C18:3n3在内的必需脂肪酸[22],在海洋动物的生长、膜运输和代谢调节过程中起着重要的作用[23]。底栖动物在摄食消化红树植物凋落物中主要是利用其中的必需脂肪酸[24]。红树林中植食性的蟹类,如相手蟹科动物通常对腐烂的叶片具有较强的摄食偏好,这是因为在红树叶片腐烂过程中微生物的作用使叶片的氮含量增加、碳氮比相应降低,可以提供更好的营养比[25]。尽管九龙江口褶痕相手蟹(Sesarmaplicata)对秋茄和桐花树的腐烂叶片的摄食偏好强于新鲜和衰老叶片[26],本研究未发现红树腐烂叶片中的必需脂肪酸含量高于其他两种状态样品,饱和脂肪酸含量甚至升高,而互花米草的腐烂样品中的水平则远低于成熟样品。Mfilinge等也发现秋茄叶片在腐烂过程中必需脂肪酸含量未出现增加的现象[8]。因此,为维持其正常生长,湿地中的底栖动物通常需要通过其它的食物来源,如其他底栖动物或底栖藻类,来补充所需的营养[25]。
3 结论
本研究通过对比较九龙江口红树和盐沼植物不同状态下样品中的脂肪酸组成,发现4种植物新鲜成熟叶片中不饱和脂肪酸比例高于饱和脂肪酸,但它们衰老和腐烂叶片中饱和脂肪酸比例升高。红树和盐沼植物脂肪酸组成存在显著差异,红树具有特征脂肪酸C30:0,盐沼植物未发现有特征脂肪酸。但腐烂过程中,脂肪酸组成的变化特征因物种和植被类型而异,植物凋落物在分解过程中脂肪酸的变化过程及机制还需要进行深入讨论。本研究也表明,与其他两种状态相比,腐烂的植物样品中脂肪酸的营养品质,尤其是必需脂肪酸比例并未得到改善,因此今后还需要进一步结合湿地底栖动物的食源分析、脂肪酸的利用效率、生长和生理等研究讨论湿地植物对底栖动物的维持作用。
