鲤mstn 基因RNA 干涉载体构建与检测分析
2021-11-19闫学春栾培贤何立川
闫学春,栾培贤,何立川
(中国水产科学研究院黑龙江水产研究所,淡水鱼类育种国家地方联合工程实验室,淡水水产生物技术与遗传育种重点实验室,黑龙江 哈尔滨 150070)
mstn(Myostatin,肌肉生长抑制素)基因是动物肌肉生长发育的负调控基因,敲除或抑制其表达,可使动物的肌肉快速大量增长。动物肌肉发育不仅依靠激素调节,某些组织特异性效应因子也影响肌肉的发育。肌肉生长抑制素是目前所知最强的肌肉生长抑制因子,它通过抑制成肌细胞的增殖而发挥作用[1,2]。Myostatin 抑制肌肉生长发育的功能在“比利时蓝牛”和“彼德蒙特牛”中得到了验证,他们是2个经过长期遗传选育得到的双肌牛品种。“比利时蓝牛”具有十分强壮的骨骼肌,其骨骼肌数量是其他品种牛的4 倍;而在“彼德蒙特牛”中检测到2 个点突变,导致Myostatin 功能全部或几乎全部丧失[3-5]。以上研究结果表明,肉牛的“双肌”现象是由于在骨骼肌细胞中缺少Myostatin 蛋白抑制作用的缘故。自Mcpherron 等发现小鼠mstn 基因以来[6],相继克隆了真鲷(Pagrosomus major)[7]、牙鲆(Paralichthys olivaceus)[8]、松江鲈(Trachidermus fasciatus)[9]、淇河鲫(Carassius auratus)[10]、加州鲈(Micropterus salmoides)[11](Elopichthys bambusa)[12]、草鱼(Ctenopharyngodon idella)[13]、鳜(Siniperca chuatsi)[19]、斑鳜(S.scherzeri)[14]、鲤(Cyprinus carpio)[15]、斑马鱼(Danio rerio)[16]、虹鳟(Oncorhynchus mykiss)[17]、大西洋鲑(Salmo salar)[18]和莫桑比克罗非鱼(Oreochromis mossambicus)[20]等鱼的mstn 基因,说明鱼类中mstn 基因分布广泛,且都参与了肌肉的生长和发育调控。
RNA 干扰(RNA interference,RNAi)是由小片段siRNA(Small interfering RNA)介导的诱导同源mRNA 降解,从而导致基因表达抑制的现象[21]。siRNA是RNA 干涉的中间产物,在靶序列的识别上具有高度特异性,只降解与其序列互补配对的mRNA[22]。本研究以鲤mstn mRNA 为靶序列,筛选有效抑制鲤Myostation 基因的siRNA 分子,构建siRNA 质粒pzu6p-siMSTN,目的是将该质粒转到鲤细胞内,让转录产物形成发夹结构,发挥抑制鲤mstn 基因表达或阻断与该基因相关的信号转导途径。而具有发夹结构的双链RNA 能够增加阻断基因的表达时间[ 23 ]。
1 材料与方法
1.1 实验鱼
实验用受精卵取自黑龙江水产研究所呼兰实验场性成熟的鲤亲鱼。转基因鲤的饲养管理、样品处理和检测程序等均与对照组相同。
1.2 转基因供体质粒pzu6p-siMSTN 构建
在鲤mstn 基因的CDS 区(GenBank:GQ214770.1)上,通过金斯瑞公司的设计软件设计了一条含有颈环结构的干涉片段(含有BamH Ⅰ和Mlu Ⅰ酶切位点),长度为70 bp。合成的干涉片段构建在puc57载体上,为puc57-siMSTN。
用限制性内切酶Ase Ⅰ和Mlu Ⅰ双酶切PEGFP-C1 质粒载体,切除质粒上的CMV 启动子、egfp 表达区域和sv40 终止子,获得3 100 bp 的框架结构,获得带有Ase Ⅰ和Mlu Ⅰ粘性末端的启动子片段。通过T4 DNA 连接酶连接。获得质粒pzu6p-siRNA。
用限制性内切酶BamH Ⅰ和Mlu Ⅰ分别双酶切puc57-siMSTN 和pzu6p-siRNA,经T4 连接酶连接,并转入top 10 感受态细胞中,挑取阳性克隆,测序验证获得pzu6p-siMSTN(鲤U6 启动子干涉载体)转基因供体质粒(图1)。
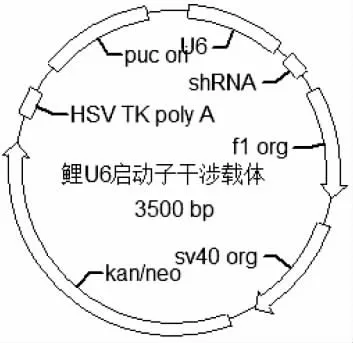
图1 鲤U6 启动子干涉载体图谱Fig.1 The transgenic donor plasmid of U6 promoter for common carp Cyprinus carpio
1.3 转基因供体质粒DNA 的提取
采用碱法裂解法提取转基因供体质粒。提取单个菌落接种到含有卡娜霉素的LB 培养基中,37℃强烈震荡培养过夜,离心,向沉淀物中依次加入50 mmol/L 葡萄糖、10 mmol/L 乙二胺四乙酸二钠、25 mmol/L 三羟甲基氨基甲烷、溶菌酶4 mg/mL、0.2 mol/L 氢氧化钠、1%十二烷基硫酸钠、和醋酸钾等溶液;离心,向上清液中加入等体积酚/氯仿,混合,离心,向上清液中加入2 倍体积无水乙醇沉淀,再用70%乙醇清洗,离心,加RNA 酶和TE 溶解沉淀,-20℃保存备用。
1.4 外源基因导入
在6 月繁殖季节,采用脑垂体和类似物的混合物人工催产,分别采集鲤卵子和精液,放入4℃冰箱中备用。每次注射时,取少量的卵子和精液授精,让受精卵分散粘附在培养皿上,用国产可三维移动的显微操作仪,在受精卵分裂之前进行外源基因的导入,每个细胞注射转基因供体质粒(pzu6p-siMSTN)1 nL,供体质粒的注射剂量为40 pg,对照鲤注射生理盐水。注射后的受精卵放在23~24℃水簇箱中孵化。
1.5 转基因鲤总DNA 提取
裂解液为蛋白酶K(200 μg/mL),十二烷基肌氨酸钠(0.5%),乙二胺四乙酸二钠(200 mmol/L,pH8.0)。幼鱼整体匀浆,加入100 μL 裂解液,55℃消化,用酚、氯仿、异戊醇混合液,抽提3 次,无水乙醇沉淀,自然干燥后溶解于TE 中,4℃冰箱保存备用。
1.6 外源基因整合率的检测
根据鲤MSTN 干涉载体序列设计引物。上游引物:CTGCGATTAATTCTTTAGCCTCCGAGAG;下游引物:GCAAAGGCGGTGCGGGAT。
引物由上海生物工程有限公司合成。以鲤转基因供体质粒pzu6p-siMSTN 为阳性对照,以对照鲤为阴性对照,进行PCR 分析。PCR 反应条件:94℃预变性3 min,93℃30 s,58℃30 s,72℃30 s,38 个循环,72℃延伸5 min。PCR 反应总体积为25 μL,反应程序在PE9700 上进行。扩增产物用1.2%的琼脂糖凝胶电泳,goldview 染色,GDS8000(UVP 公司)凝胶成像系统拍摄,回收转基因阳性鲤中的目标条带,进行测序验证。
2 结果与分析
2.1 转基因供体质粒的构建
通过将真核表达载体PEGFP-C1 的启动子进行改造,得到斑马鱼U6 启动子的质粒pzu6p-siRNA。然后将干涉片段siMSTN 与载体相连接,得到pzu6p-siMSTN(鲤MSTN 干涉载体)。
2.2 鲤mstn 外源基因的转基因效果
共进行了5 批鲤受精卵的转基因注射,共注射受精卵1 225 粒,孵出后存活720 尾,转基因显微注射平均存活率为58.6%,注射生理盐水的对照组的存活率为92%(表1)。
2.3 PCR 检测
对50 尾转基因鱼个体的基因组DNA 进行扩增,扩增片段大小在400 bp 左右(图2)。将与供体片段一致的基因片段切下,对其中5 尾样品的阳性扩增产物进行回收、克隆和测序验证,测序结果如图3 所示。由图3 可知,鲤外源基因成功插入鲤基因组中,转基因鲤外源基因的平均整合率为36.2%(表1)。
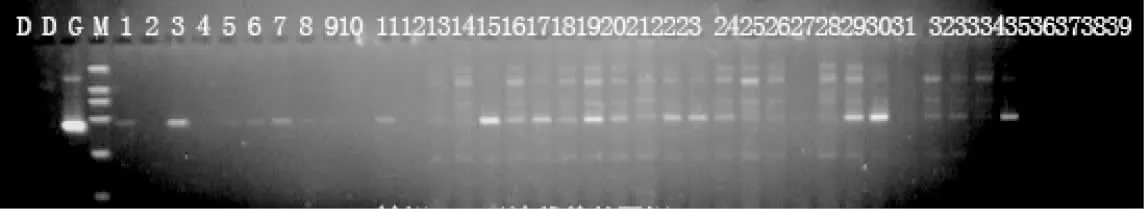
图2 转鲤mstn 基因鲤的PCR 检测分析Fig.2 The detection results of PCR for transgenic carp

图3 转mstn 基因鲤片段序列与供体质粒基因序列比对Fig.3 Sequence alignment of mstn gene between transgenic common carp and donor plasmid of mstn gene
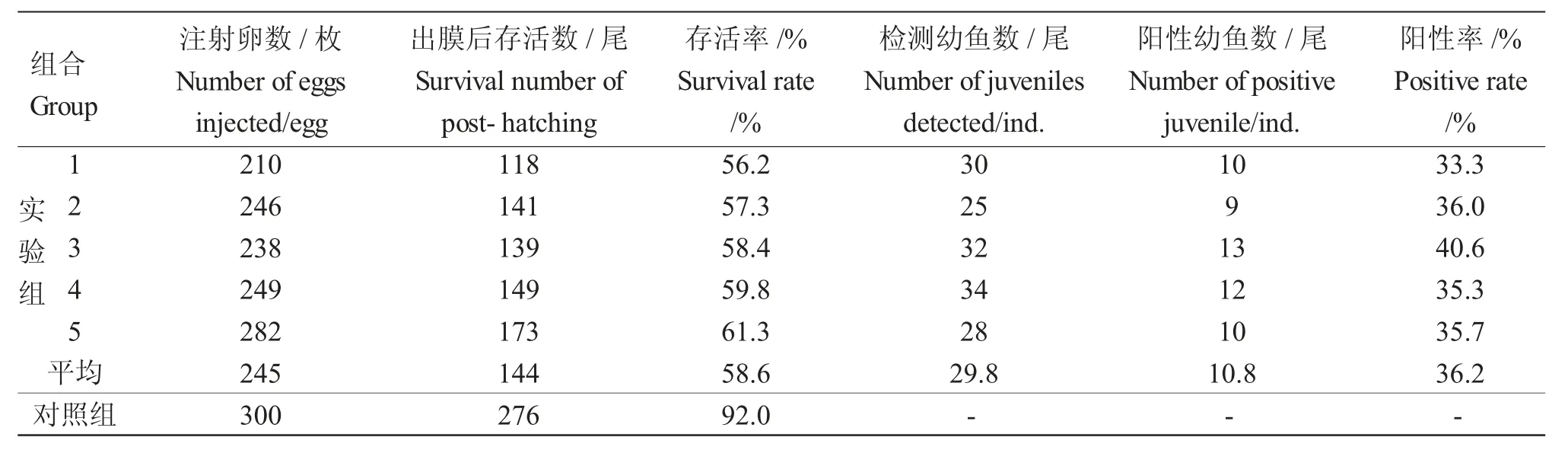
表1 转mstn 基因鲤幼鱼存活率和阳性率检测Tab.1 Survival and transgenic positive rates in common carp juveniles via microinjection with mstn gene
3 讨论
不同物种之间存在种属差异,要想启动不同基因的表达需要种属较为特异的启动子启动基因的转录。据文献报道[24],干涉片段的表达用U6 启动子或者H1 启动子能有效表达干涉片段,为了实现mstn 基因在鲤体内沉默,使用鲤U6 启动子最为理想。但鲤的U6 启动子序列未知,所以本文选用了种属差异较近的斑马鱼U6 启动子,它具有明确的起始和终止序列,在细胞中可以表达很多小分子RNA。siRNA 表达载体依赖U6 启动子,可控制一段45~50 nt 的发夹结构RNA(small hairpin RNA,shRNA)在鲤细胞中的表达,而shRNA 在鲤细胞内可以自动被加工成为siRNA,引发目标基因的沉默或其表达受到抑制。如刘萱等[25]利用人H1 启动子构建了哺乳动物细胞siRNA(small interference RNA,小干扰RNA)表达质粒pBS/HIPS。该质粒约有19 bp 的siRNA 转录产物,能够在细胞内自主合成,对细胞内源性目标RNA 起到了特异性抑制作用。Sui 等[26]利用U6 启动子构建了可操纵的siRNA表达载体,该载体质粒成功抑制了多种外源和内源基因的表达。说明利用U6 启动子引导产生siRNA的质粒载体,可在体内直接转录产生siRNA,抑制mstn 基因的表达,可达到较高的RNAi 效应。本研究主要是针对鲤myostatin 基因序列,构建以斑马鱼U6 为启动子的鲤myostatin 基因的RNA 干扰质粒载体pzu6p-siMSTN(鲤MSTN 干涉载体)。通过酶切和测序验证载体构建正确性。为了能确定鲤myostatin 双链RNA 是否能够插入鲤基因组中,用人工合成的鲤MSTN 干涉载体通过显微注射技术将pzu6p-siMSTN 基因导入野鲤受精卵内,获得了一批转基因鲤,PCR 检测和测序验证表明,外源供体基因成功插入鲤基因组中,转基因鲤外源基因的整合率平均为36.2%。
随着鲤基因组测序的完成,生物学研究从单个基因进入到基因组时代,利用siRNA 介导的RNA干扰手段,或者结合转基因技术,将有望成为探索鱼类特定基因的功能、疾病致病机理及其防治的新途径。Acosta 等[27]利用显微注射技术,将具有siRNA的mstn 基因质粒导入斑马鱼体内,使其MSTN 蛋白的表达受抑制,最终获得了体形巨大的斑马鱼。Thomas 等[28]体外合成的具有发卡RNA 表达载体质粒,利用显微注射技术导入到大鼠内,使大鼠的纤维大小增加34%,肌肉重量增加10%。在鱼类育种中,虽然分子辅助育种技术和基因敲除技术(反义核苷酸技术、基因打靶技术等)较传统的数量遗传育种有较多的优点,但研究过程中投入大,群体大,耗时、效率低等缺点也有待解决。RNA 干扰技术已成为解决这些问题的重要手段。与其他方法相比,RNA 干扰技术在基因功能研究具有简单易行、试验周期短、成本低、可进行高通量基因功能分析及具有高度特异性等许多优点。为了解除mstn 基因对肌肉细胞的抑制作用,本研究利用RNA 干扰技术干扰mstn mRNA 的表达,来提高养殖鱼类肌肉含量,改善肉质性状,促进养殖鱼类生长。
综上所述,RNA 干扰技术能达到基因敲除的结果,是研究这些基因功能的良好工具。RNA 干扰技术在充满挑战的后基因时代将有广阔的应用前景,它将会在水产动物,尤其是在鱼类研究中带来一次新的技术革命。研究结果表明,这种阻碍肌肉生长抑制素的方法将有助于鲤肌肉再生能力的增强,为获得具有特殊功能的转基因鲤提供了新的手段,也进一步证实了转鲤mstn 基因RNA 干扰质粒技术是可行的育种技术之一[29]。
