2株降解菌对棉田土壤中敌草隆的降解效果评价
2021-11-18钱灿灿王浩东张嘉宇魏姿涵吴彩兰杨德松
钱灿灿,王浩东,张嘉宇,魏姿涵,吴彩兰,杨德松
(石河子大学 农学院/新疆绿洲农业病虫害治理与植保资源利用重点实验室,新疆 石河子 832000)
【研究意义】敌草隆(diuron)是一种高效低毒广谱的取代脲类除草剂,化学名3-(3,4-二氯苯基)-1,1-二甲基脲[1],主要通过抑制植物和藻类的光合作用达到除草目的[2],可由植物的根部或叶片吸收,能有效防治1 年生种子繁殖的单子叶、双子叶、禾本科和莎草科等杂草[3]。敌草隆在我国主要用于甘蔗田的前期除草,还可用于玉米、花生、水稻、棉花、温带树木和果树等除草[3-8]。其具有高效性、用量少、残效期长、杀草谱广的特点,通常以复配的形式作为棉花脱叶剂在新疆棉田广泛使用,但随着药剂用量的持续增加、效能不断提高的同时,对土壤造成了严重的危害,已远远超出环境的自然清洁能力,因此,敌草隆残留修复开始广泛受到关注[9]。生物修复是一种十分经济环保的技术,它旨在运用生物体的活动代谢来降低污染环境中有害物质的含量,并且可以使被污染的环境部分或全部变为其最初始状态的一个过程[10-11]。在环境中对有机污染物的传统处理方式主要包括:化学法、焚烧法或掩埋等,这些处理方法虽然快速但容易造成环境的二次污染,因此,以微生物降解为主的自然降解成为在环境中对有机污染物清除的首选,且生物修复具有无二次污染、降解彻底、广谱和速效等优点[12]。【前人研究进展】许双燕等[13]首次发现甲基菌属菌株具有降解红霉素的能力,这为生物降解养殖废弃物与环境中的抗生素提供了一种新的微生物资源。Hu 等[14]发现一株从蟋蟀中分离出来的LCB8T菌株能有效降解草甘膦、辛硫磷、毒死蜱、顺式氯菊酯等农药。陈锐等[15]从土壤中筛选出一株微生物菌株SSCL-3,经鉴定该菌为米曲霉Aspergillusoryzae,该菌株能解决菊酯类农药土壤残留问题。【本研究切入点】现国外关于降解菌修复农药污染的研究较多,但目前国内针对敌草隆造成的残留问题,筛选出降解菌进行治理的报道很少,已经报道的菌种资源也非常有限,能否在新疆广大植棉区使用尚未明确。【拟解决的关键问题】因此,本研究利用前期筛选获得的高效菌株,采用室内盆栽试验来验证菌株对土壤中残留敌草隆的降解情况以及对土壤的修复效果,利用生物法对其降解效果进行评价,为土壤中敌草隆残留的生物修复提供理论支撑。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株和植物 菌株SL-1 芬氏纤维微细菌Cellulosimicrobium funkei和SL-6 木糖氧化无色杆菌Achromobacter xylosoxidans,为本实验室前期从连续施用10 年以上敌草隆的新疆第八师生产建设兵团采集的棉田土壤中分离获得。其中菌株SL-1 能在敌草隆浓度200 mg/L,5%的接菌量,温度30 ℃,pH 7,不接外加碳源时降解效率最佳,于第5 天(120 h)时,菌株SL-1 对敌草隆的降解率高至90.8%;菌株SL-6 能在敌草隆浓度200 mg/L,15%的接菌量,温度30 ℃,pH 8,不接外加碳源时降解效率最佳,在第5 天(120 h)时,菌株SL-6 对敌草隆降解率高达93.1%。
1.1.2 供试药剂 敌草隆原药;敌草隆标准品(质量分数98.8%)购于Dr.Ehrenstorfer 公司;乙腈(色谱纯);氯化钠;氨水。
1.1.3 供试培养基 A.无机盐培养基:MgSO4·7 H2O 0.2 g,KH2PO40.5 g,(NH4)2SO41 g,NaCl 0.5 g,K2HPO41.5 g,蒸馏水1 000 mL,pH 7.0~7.2。B.牛肉膏蛋白胨培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,蒸馏水1 000 mL,pH 7.0~7.2。C.富集培养基:在无机盐培养基中添加所需含量的敌草隆。D.LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL。固体培养基均在以上培养基中加入18 g/L 琼脂粉末。
1.1.4 供试土壤 试验所用土壤采自石河子大学试验站。土壤类型为壤土,pH 8.40;有机质15.5 g/kg;碱解氮61.34 mg/kg;有效磷30.5 mg/kg;速效钾462 mg/kg。取土深度0~25 cm,除去土壤中的草根、石块等杂物,过2 mm筛,于160 ℃干热灭菌3 h后使用。
1.1.5 供试仪器 高效液相色谱仪(waters e2695 separations module)、涡旋振荡器、精确电子分析天平、高速台式离心机、超声波清洗器、烘箱、震荡仪、紫外分光光度计、生化培养箱。
1.2 试验方法
1.2.1 降解菌的制备 将供试菌株SL-1 和SL-6 形态清晰且无污染的单菌落接种于LB 液体培养基中,然后在30 ℃、180 r/min 摇床培养24~48 h至溶液浑浊,7 500 r/min 高速离心5 min,倒掉上清液,沉淀菌体收集后用等量无机盐培养基洗涤,制备细胞悬浮液。用分光光度计检测菌悬液的OD 值,并将OD600调至0.5,后采用稀释平板法测定菌液的细胞浓度,菌株SL-1 细胞浓度约为4.5×109cfu/mL;SL-6 细胞浓度约为5.6×109cfu/mL。
1.2.2 土壤中敌草隆含量的测定 土样采集后风干并碾碎过2 mm筛备用。精确称量10.0 g土壤样品至50 mL离心管内,分别添加2 mL 3%氨水和8 mL乙腈,涡旋震荡提取10 min。再加入4 g NaCl盐析促使水相和有机相分离,继续涡旋震荡2 min,在4 000 r/min下高速离心5 min。收集上层液体1 mL过0.22 μm有机滤膜,高效液相色谱检测。
色谱条件:色谱柱5.0 μm×4.6 mm×250 mm;流动相V(甲醇)∶V(水)=60∶40;流速1.0 mL/min;柱温35 ℃;测定波长254 nm;进样量20 μL。
1.2.3 土壤中敌草隆降解试验 称量100 g 供试土壤(灭菌)于花盆中,并加入敌草隆,使土壤中敌草隆的含量分别为100,200,500,1 000 mg/kg,敌草隆与土壤均匀混合后,按10%的接种量分别添加SL-1 及SL-6菌悬液,使土壤中的菌体含量约为0.5×109cfu/g,随后向土壤中加水,使得土壤中的含水量达到田间最大持水量的60%。将花盆置于30 ℃的恒温箱中进行黑暗处理,分别于0,3,6,9,12,15 d 后取土,检测土壤中敌草隆的残留量,每个处理重复3次,且设置空白对照。
1.2.4 土壤中敌草隆降解影响因素试验(1)接种量。称量100 g供试土壤于花盆中,添加敌草隆,使土壤中敌草隆的浓度达到500 mg/kg,敌草隆与土壤均匀混合后,分别以5%、10%、15%、20%的接种量分别加入SL-1 和SL-6 的菌悬液,使土壤中菌体含量分别达到0.25×109,0.5×109,0.75×109,1.0×109cfu/g,向土壤中加水,使土壤中的含水量达到田间最大持水量的60%。待土壤处理结束后,将花盆置于30 ℃的恒温箱进行黑暗处理,15 d后取样并检测土壤中敌草隆的残留量。
(2)初始浓度。称量100 g 供试土壤置于花盆中,添加敌草隆,使土壤中敌草隆的浓度分别为100,200,500,1 000 mg/kg,敌草隆与土壤均匀混合后,按10%的接种量分别加入SL-1及SL-6菌悬液,使土壤中的菌体含量约为0.5×109cfu/g,随后向土壤中加水,使土壤中的含水量达到田间最大持水量的60%。将花盆置于30 ℃的恒温箱进行黑暗处理,15 d后取样并检测土壤中敌草隆的残留量。
(3)湿度。称量100 g 供试土壤加入花盆中,添加敌草隆,使土壤中敌草隆的含量为500 mg/kg,敌草隆与土壤均匀混合后,按10%的接种量分别加入SL-1 及SL-6 菌悬液,使土壤中的菌体含量约为0.5×109cfu/g,随后向土中加水,使土壤中的含水量达到20%、40%、60%、80%。将花盆置于30 ℃的恒温箱进行黑暗处理,15 d后取样并检测土壤中敌草隆的残留量。
(4)温度。称量100 g 供试土壤加入花盆中,添加敌草隆,使土壤中敌草隆的含量为500 mg/kg,敌草隆与土壤均匀混合后,按10%的接种量分别加入SL-1 及SL-6 菌悬液,使土壤中的菌体含量约为0.5×109cfu/g,随后向土壤中加水,使得土壤中的含水量达到田间最大持水量的60%。将花盆分别放置在25,30,35 ℃的恒温箱进行黑暗处理,15 d后取样并检测土壤中敌草隆的残留量。
1.2.5 生物法验证菌株SL-1 和SL-6 的降解效果 本试验采用生物法验证降解菌SL-1 和SL-6 在土壤中对敌草隆的降解效果。设置以下4 个处理(表1)。4 组试验均设置重复且在30 ℃的培养箱中黑暗处理15 d,后向每盆土壤中播种棉花种子10 粒(棉花种子提前进行12 h 浸种),观测其出苗率,且于接种后的21 d 对其鲜质量、干质量、根长等生理指标进行测量统计,观测植株生长情况,并对其降解效果进行评价分析。

表1 生物法验证菌株对敌草隆降解效果的4个处理Tab.1 Four treatments to verify the degradation effect of diquat by biological method
1.3 数据统计与分析
试验结果均采用SPSS 22.0 与Excel 2016 统计软件进行数据方差分析及多重比较,本试验所显示的结果均为3次重复测定的平均值。

式(1)、(2)中,N:降解率;NX:相对降解率;CX:15 d后土壤中敌草隆的检出含量(mg/kg);C0:土壤中敌草隆初始施用含量(mg/kg);CCK:15 d后未接种菌株的对照处理土样之中敌草隆的检出含量(mg/kg)。
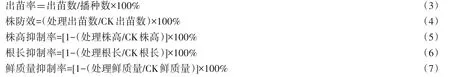
2 结果与分析
2.1 菌株SL-1和SL-6对土壤中敌草隆降解效果评价
如图1所示,对于敌草隆初始浓度100 mg/kg的处理组,药后15 d,菌株SL-1和SL-6处理后土样中敌草隆的含量从100 mg/kg分别降至36.6 mg/kg和22.7 mg/kg,降解率分别为63.4%和77.3%,相对于不接菌的自然降解率45.4%分别提高了18个百分点和31.9个百分点;对于敌草隆初始浓度200 mg/kg的处理组,药后15 d,菌株SL-1和SL-6处理后的土壤,敌草隆浓度从200 mg/kg分别降至78.9 mg/kg和68.6 mg/kg,降解率分别为60.5%和65.6%,相比于不接菌的自然降解率33.7%分别提高了26.8个百分点和31.9个百分点;对于敌草隆初始浓度500 mg/kg的处理组,药后15 d,菌株SL-1和SL-6处理后的土壤,敌草隆的浓度从500 mg/kg分别降至230.5 mg/kg和191.0 mg/kg,降解率分别为53.9%和61.8%,相对于不接菌的自然降解率34.5%分别提高了19.4个百分点和27.3个百分点;敌草隆初始含量1 000 mg/kg的处理组,药后15 d,菌株SL-1和SL-6处理后的土壤,敌草隆的浓度从1 000 mg/kg分别降至490.8 mg/kg和429.0 mg/kg,降解率分别为51.0%和57.1%,相对于不接菌的自然降解率37.2%分别提高了13.8个百分点和19.9个百分点。

图1 敌草隆的降解动态图Fig.1 The degradation dynamic of diuron
结果表明,菌株SL-1和SL-6较不接菌的土壤有较好的降解效果,且菌株SL-6的降解效果略优于菌株SL-1;对比4组处理发现,随着土壤中敌草隆含量的增高,菌株对敌草隆的降解率变低,菌株对敌草隆含量100 mg/kg的土壤降解效果最佳,降解率高达63.4%和77.3%,而对敌草隆含量1 000 mg/kg的土壤降解效果最慢,降解率仅为51.0%和57.1%,由此说明,土样中高含量的敌草隆可能会对菌株的活性产生抑制,从而使降解效率降低。
敌草隆在土壤中的消解动态(表2)均符合一级动力学方程Ct=C0ekt。敌草隆含量100,200,500,1 000 mg/kg 的CK 土壤样品中,不接菌时敌草隆的消解动力学方程为:Ct=94.185 e-0.039t、Ct=196.68 e-0.028t、Ct=504.85 e-0.027t、Ct=1 009.7 e-0.025t;其半衰期分别为17.77,24.75,25.67,27.72 d;当接入SL-1菌株时,敌草隆含量100,200,500,1 000 mg/kg的土壤样品中,敌草隆的消解动力学方程为:Ct=92.518 e-0.07t、Ct=185.3 e-0.059t、Ct=493.01e-0.053t、Ct=965.66e-0.05t;其半衰期分别低至9.9,11.75,13.08,13.86 d;当接入SL-6 菌株时,敌草隆含量100,200,500,1 000 mg/kg 的土壤样品中,敌草隆的消解动力学方程为:Ct=90.792 e-0.097t、Ct=176.87 e-0.066t、Ct=481.72e-0.064t、Ct=952.56e-0.056t;其半衰期分别低至7.14,10.5,10.83,12.38 d。综上结果得出,随着土壤中敌草隆含量的增加,其半衰期逐渐延长;且接菌后的土壤敌草隆的半衰期较不接菌明显缩短,其中菌株SL-6的半衰期稍短于菌株SL-1。
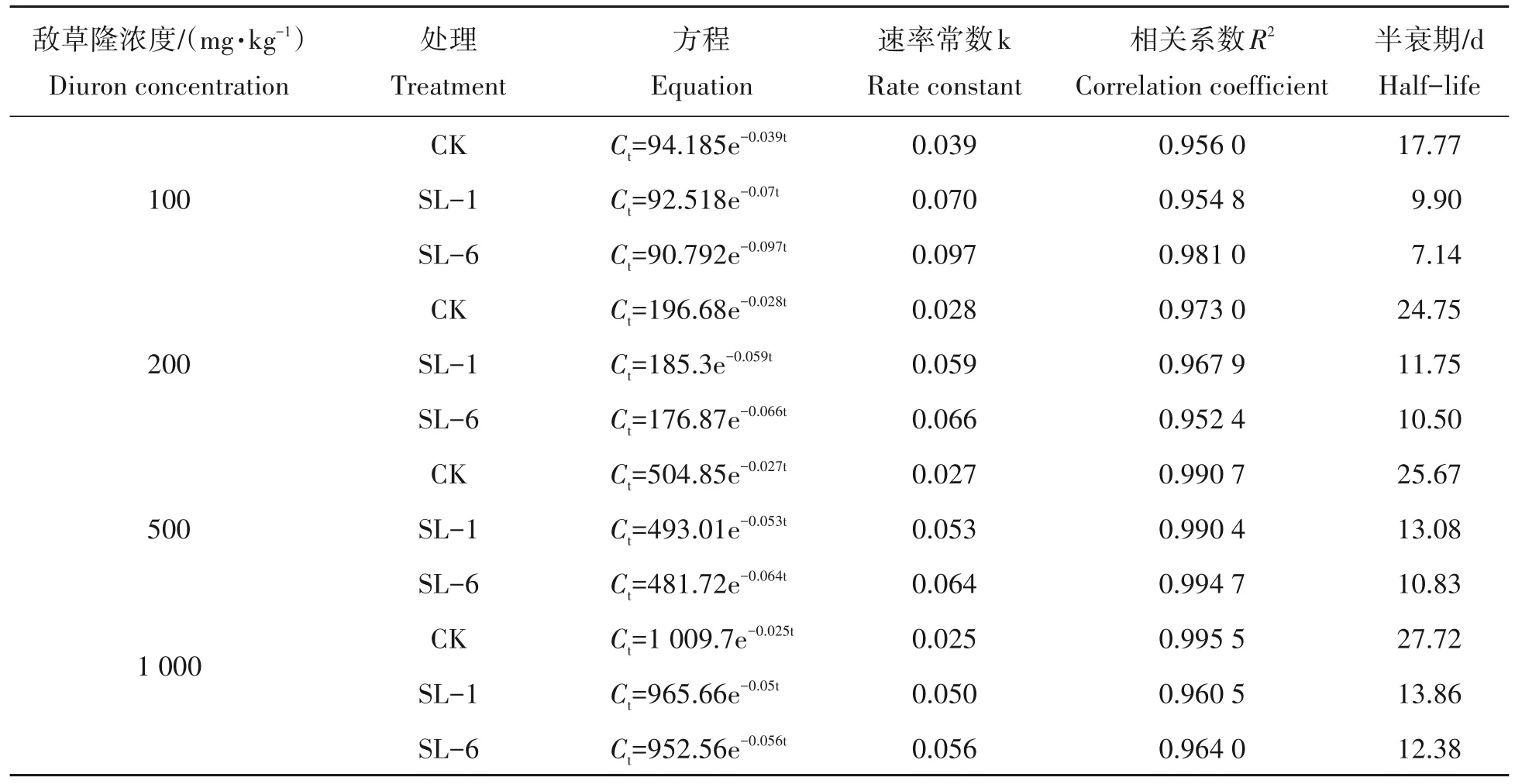
表2 敌草隆的消解动力学方程以及相关参数Tab.2 Kinetic equation of digestion and related parameters of diuron
2.2 接菌量对土壤中敌草隆降解的影响
使中敌草隆的含量达到500 mg/kg,土样中含水量达到60%,分别以0%、5%、10%、15%、20%(V∶m)的接种量接入两菌株。如图2,15 d 后敌草隆在土壤中的降解率有明显的差异,不接菌时敌草隆的自然降解率明显比接菌后低。菌株SL-1 处理的土壤,当接菌量为10%时,降解率最高为63.8%,较不接菌的36.8%增加了27 个百分点;SL-6 处理的土壤中,其不同接菌量对敌草隆的降解有显著的影响,当接菌量为15%时,降解效果最好,降解率高达79.9%,明显高于其它接菌量,且较不接菌时36.8%的降解率增加了43.1个百分点。
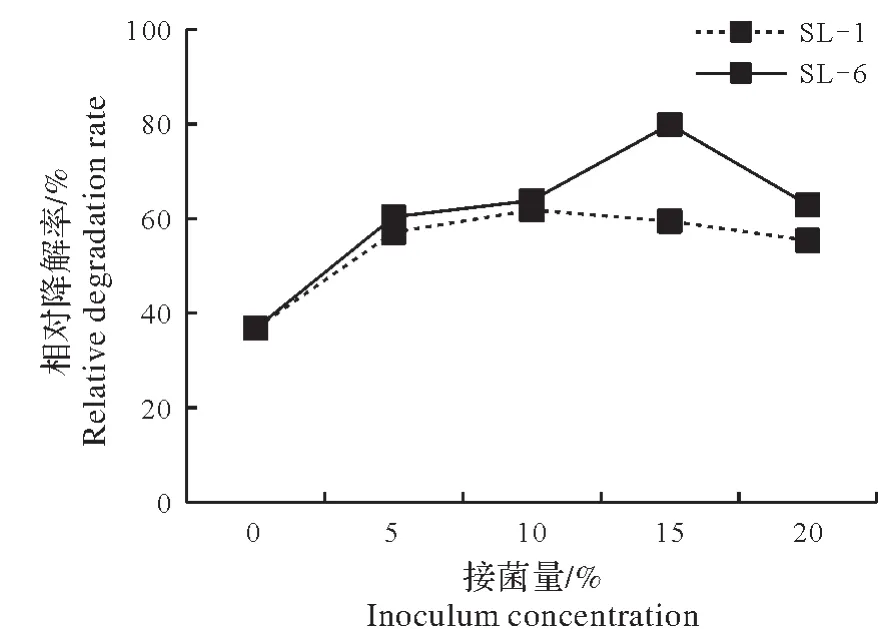
图2 接菌量对土壤中敌草隆降解的影响Fig.2 Effect of bacterial exposure on the degradation of diuron in soil
由结果可知,当菌株SL-1 的接菌量为10%时,其降解率最高;当接入菌株SL-6 时,不同接菌量的降解率出现先增高后降低的趋势,接菌量15%时降解率最高,不接菌时敌草隆的自然降解率明显低于接菌后的降解率。
2.3 药剂初始浓度对土壤中敌草隆降解的影响
将土壤中敌草隆的含量控制在100,200,500,1 000 mg/kg,土壤含水量达到60%,以10%接菌量接入菌株,15 d 后SL-1、SL-6 及CK 的降解率均随着敌草隆含量的增高呈降低趋势(图3);其中SL-6 的降解率优于SL-1,接菌后的降解率优于不接菌;敌草隆浓度控制在100 mg/kg时,两株菌株对药剂降解率最高分别为63.5%、77.3%,较不接菌的自然降解率45.4%分别提高了18.1个百分点和31.9个百分点。
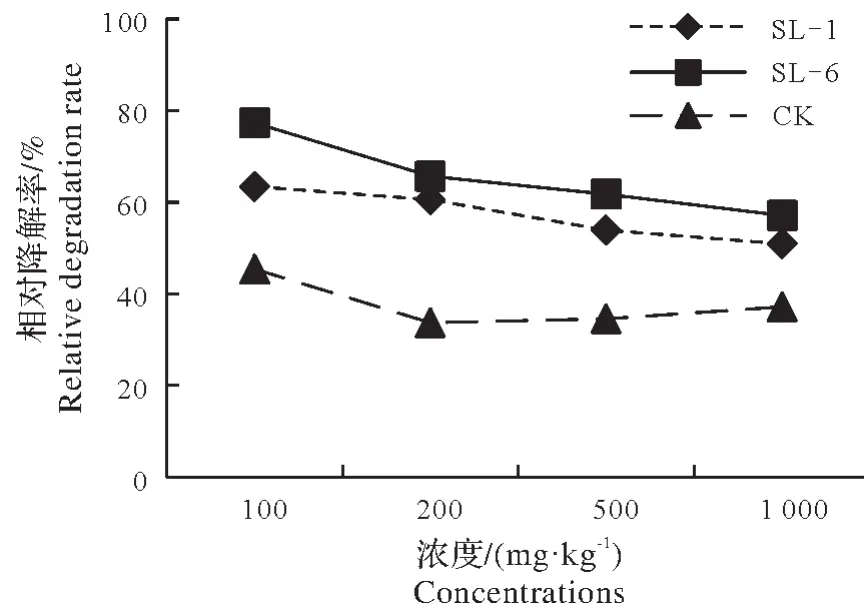
图3 敌草隆初始浓度对土壤中敌草隆降解的影响Fig.3 Effect of initial concentration of fungicides on degradation of diuron in soil
因此,由结果可知,控制土壤中敌草隆含量为100 mg/kg时,自然降解率低于接菌后,且在3个处理中由于土样中敌草隆含量的增加,降解率随之降低。
2.4 土壤湿度对土壤中敌草隆降解的影响
使土壤中敌草隆浓度达到500 mg/kg,以10%的接菌量接入菌株SL-1 和SL-6,随后向土样中加水,使土壤中的含水量达到20%、40%、60%、80%(V∶m)。由图4 可知,15 d 后菌株SL-1、SL-6 及CK 的降解率均随着土壤含水量的增高而增高;当含水量最低为200 g/kg 时,CK 及接菌后的降解率分别为15.6%、35.5%、39.4%;而当含水量升至800 g/kg时,CK及接菌后的降解率分别高达46.9%、69.3%、74.9%。
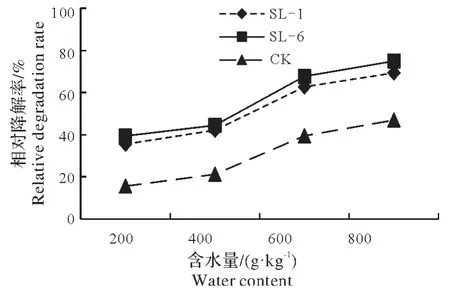
图4 土壤湿度对土壤中敌草隆降解的影响Fig.4 Effect of moisture on degradation of diuron in soil
因此,由结果可知,土壤湿度对敌草隆的降解有显著的影响,土壤高含水量对菌株降解敌草隆有促进作用。
2.5 培养温度对土壤中敌草隆降解的影响
将土壤中敌草隆浓度达到500 mg/kg,以10%的接菌量接入菌株SL-1 及SL-6,使土壤含水量达到60%,将其分别置于25,30,35 ℃的恒温培养箱黑暗处理15 d。处理组的降解率分别为42.4%、60.6%、43.2%和46.5%、65.4%、52.8%(图5)。温度为30 ℃时,两株菌株的降解率最高,较CK 分别增加了20.4个百分点和25.3个百分点;且温度过高或过低均会对菌株的活性产生影响,导致降解速率变慢。
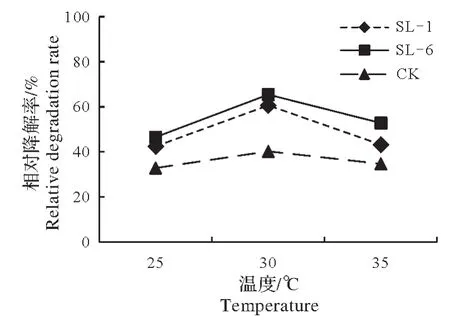
图5 培养温度对土壤中敌草隆降解的影响Fig.5 Effect of culture temperature on degradation of diuron in soil
2.6 菌株SL-1和SL-6处理敌草隆残留土壤对棉花的影响
试验结果显示,2 种菌株均能对含敌草隆土壤有较好的修复能力,也能一定程度上缓解施药对植株造成的药害。下列4组处理中,清水对照以及菌株处理后的棉苗长势较好,而敌草隆处理的棉苗出苗率较低,且植株矮小,后期棉苗出现萎蔫。经菌株SL-1 和SL-6 处理过的土壤中棉苗的药害现象有所缓解(图6)。

图6 不同处理下棉苗生长情况Fig.6 Growth of cotton seedlings under different treatments
对土壤进行敌草隆处理,15 d 后播种,仅用敌草隆处理的土壤,棉花出苗率较低,仅为50%;而经菌株处理后的棉花出苗率分别提高至63.3%和70%。对培养21 d后的棉苗鲜质量、干质量、株高、根长、须根数等进行测量,数据结果均表明CK棉苗长势最好,其次是经菌株处理的施药土壤中的棉苗,且均明显优于仅施药处理组(表3)。敌草隆处理的棉苗鲜质量为0.65 g,经菌株SL-1和SL-6处理后,其鲜质量抑制率分别降低了36.2 个百分点和40.41 个百分点;敌草隆处理的棉苗株高为6.53 cm,其株高抑制率为62.96%,而经菌株SL-1 和SL-6 处理后,其株高抑制率分别降低了37.55 个百分点和38.12 个百分点;敌草隆处理的棉苗根长为3.88 cm,须根数为14.67,其根长抑制率为58.85%,经SL-1 和SL-6 处理后,其根长抑制率分别降低了27.78个百分点和26.51个百分点;且须根数增至24和22.67。

表3 菌株SL-1和SL-6处理敌草隆残留土壤对棉花的影响Tab.3 Effects of bacterial strains SL-1 and SL-6 on cotton treated with the residual soil of tamarind
3 结论与讨论
本研究对菌株SL-1 和菌株SL-6 的降解条件进行了评价。菌株SL-1 和SL-6 较不接菌的土壤来说有较好的降解效果,且菌株SL-6 的降解效果略优于菌株SL-1。对比4 组处理发现,由于土壤中敌草隆含量的增高,其菌株对敌草隆的降解率会随之变低,敌草隆含量最低(100 mg/kg)的土壤降解效果最快,降解率高达63.4%和77.3%,而菌株在敌草隆含量最高(1 000 mg/kg)的土壤中降解效果最慢,降解率仅为51.0%和57.1%,可以表明,土样中高含量的敌草隆会对菌株的活性有抑制,从而降低降解率。由土样中敌草隆消解的动力学方程可以看出,SL-1和SL-6处理后,土样中4个含量的敌草隆由于含量的增多,半衰期也逐渐变长;且菌株SL-1 较不接菌的半衰期分别缩短了45.5%、52.5%、49.0%、50.0%,菌株SL-6较不接菌的半衰期分别缩短了59.8%、57.6%、57.8%、53.3%。其次,菌株在土样中的降解情况受接种量、药剂初始浓度、湿度、温度等原因的影响,因此本试验对菌株在土样中的降解程度进行了优化。菌株SL-1在土壤中敌草隆含量100 mg/kg、接菌量10%、土壤含水达到80%、30 ℃时,降解效果最好;SL-6在土壤中敌草隆含量100 mg/kg、接菌量15%、土壤含水达到80%、30 ℃时,降解效果最好;最后,采用室内盆栽法验证菌株的安全性,菌株SL-1 和SL-6 均能对含药土壤有较好的修复能力,也能降低敌草隆对植株的损伤,对棉苗鲜质量、干质量、株高、根长、须根数等进行测量,结果显示对照组棉苗长势最好,其次是菌株处理的施药土壤中棉苗,均明显优于仅施药处理组。因此可知,菌株SL-1 和SL-6 在一定程度上可以降低土壤中敌草隆的含量。
敌草隆具有低挥发性和高土壤-有机化合物分配系数,易吸附于土壤颗粒,造成土壤中敌草隆的大量蓄积,如果土壤中有机质含量较低,敌草隆会在土壤深处浸出,造成地下水污染。土壤对敌草隆残留自然降解缓慢,其在土壤中的蓄积可对土壤中非靶标生物造成威胁。其在土壤中的环境行为主要有5种:生物降解、土壤吸附、光催化降解、土壤淋溶迁移和水解,其中生物降解已被证明是现阶段一种有效的修复工具,也是当前自然环境中降解敌草隆的主要方法。目前国外已有很多关于敌草隆生物降解的研究,主要集中在筛选、分离、鉴定和降解特性等方面[16-18],大多数菌群来自土壤微生物。但土壤中的微生物易受到多种因素影响,包括温度、湿度、含水量及自身因素等[3,19]。微生物生长有一个合适pH 值范围,土壤中过高或过低pH值对微生物的酶活性和蛋白质活性都有一定的抑制作用,造成微生物降解效率降低[20]。杨孟然[2]试验结果表明,土壤含水量会影响降解菌制剂的降解,含水量越高,制剂对敌草隆的降解效果越好。因此,可对土壤pH值的变化、含水量的变化及不同土壤类型对降解菌降解特性进行研究,确定降解菌使用的最佳条件,为实际应用提供理论依据。
本研究结果显示当土壤中敌草隆含量最低(100 mg/kg),自然降解率及接菌后的降解率均最高,且由于土壤中敌草隆含量的增加,其降解率随之变低。有研究表明,土壤中富集农药含量过高对菌株的降解会产生影响,是由于农药浓度过高会抑制菌体的生长和繁殖,如磺酰脲类除草剂在水溶液中浓度过高会对细菌的乙酰合成酶活性产生抑制,从而降低菌株的活性[21]。金博文等[22]在筛选、分离及鉴定玉米赤霉烯酮降解菌时研究发现,菌株对ZEN 降解能力的强弱与温度及pH 等因素密切相关。金雷等[23]研究结果表明咪唑乙烟酸的降解速率与接菌量呈正相关,且降解率随含水量的增加而降低。通常状况下,土壤中含水量越高,其通气状况愈差[24]。本试验结果恰相反,可能是因为当土壤含水量加大,有利于除草剂在土壤中的扩散和除草剂的解吸附[25-27],从而菌株接触到敌草隆的机会越大。由于土壤环境复杂,存在多种残留农药,因此可以对菌株SL-1和SL-6的降解谱进行深入研究,扩大其应用范围。
