高通量测序分析根结线虫对马铃薯根际土壤真菌群落多样性的影响
2021-11-15张丽芳李艳琼蔡建高秀徐晴芳刘威良杨卫星胡海林
张丽芳 李艳琼 蔡建 高秀 徐晴芳 刘威良 杨卫星 胡海林
摘要:【目的】分析根结线虫对马铃薯根际土壤真菌群落多样性的影响。【方法】通过高通量测序技术、土壤性质测定及生物信息学技术分析感染根结线虫马铃薯和健康马铃薯根际土壤真菌群落多样性差异。【结果】从6个土壤样品中共获得3界12门34纲77目171科332属526种的土壤真菌。对物种多样性指数分析后,发现感染根结线虫马铃薯病株与健康马铃薯植株的根际土壤真菌群落多样性和土壤性质均存在显著性差异。对6个样品进行物种组成分析后,在门水平中,感病植株根际土壤真菌Basidiomycota丰度较健康植株根际土壤真菌丰度高,Ascomycota丰度低于健康植株根际土壤;在科水平中,病株根际土壤丰度较高的菌群有Nectriaceae和Trimorphomycetaceae;在属水平中,健康植株根际土壤丰度较高的菌群为镰刀菌属Fusarium、被孢霉属Mortierella和未知分类毛壳菌科属unclassified_f_Chaetomiaceae。【结论】感染根结线虫的马铃薯与健康马铃薯根际土壤真菌群落丰度在门、科和属水平上均存在差异,为进一步研究马铃薯根结线虫的发生和防治提供了新的思路。
关键词:根结线虫;马铃薯根际土壤;土壤性质;高通量测序;真菌多样性
中图分类号:S154;S 532
文獻标志码:A
文章编号:1008-03 84(2021)08-0936-06
High-Throughput Sequencing on Fungal Diversity in Potato Rhizosphere Soil
Infested by Root-knot Nematodes
ZHANG Lifang 1, LI Yanqiong 2, CAI Jian 1. GAO Xiu 1, XU Qingfang 1. LIU Weiliang 1, YANG Weixing 1, HU Hailin 3*
(I. Yunnan Engineering Research Center of Fruit Wine, Qujing Normal University, Qujing, Yunnan 65501I, China; 2. Collegeof Agronomy and Life Sciences, Kunming University Kunming, Yunnan 6502 14. China; 3. College of Mathematics andStatistics, Qujing Normal University Qujing, Yunnan 65501I. China )
Abstract: 【Objective】Diversity of the thizosphere soil fungal community in potato field as affected by the presence of root-knot nematodes was investigated using high-throughput sequencing technique. 【Methods】The properties and bioinformaticsof thizosphere soils surrounding healthy and infested potato plants were compared to analyze the possible effects of differentialfungal community on the occurrence and control of the disease. 【Results】There were 526 fungi species belonging t0 332genera. 171 families. 77 0rders. 34 classes, 12 phyla, and 3 kingdoms identified from the 6 field specimens. Significantlydifferentiations on the fungal community diversity and properties of the thizosphere soils on the healthy and infested potato lotswere found. In the infected areas, Basidiomycota was the more abundant phylum, but Ascomycota less, than on the healthy lots.At family level. Nectriaceae and Trimorphomycetaceae were more abundantly found in the soil of diseased plants, while atgenus level, Fusarium. Mortierella, and some unclassified Chaetomiaceae more richly in the soil of healthy plants.【Conclusion】Significant differences in the abundance of fungi in the thizosphere soils of potatoes infested by the root-knotnematodes and the healthy counterparts were found at phylum, family, and genus levels. The information would aid furtherstudy on the occurrence and control of potato root-knot nematodes.
Key words: Root-knot nematodes; potato thizosphere soils; soil properties; high throughout sequencing technology; fungidiversity
0 引言
【研究意义】马铃薯Solanum tuberosum L隶属茄科茄属,是世界上第四大粮食作物,是云南省三大粮食作物之一,据云南省农业农村厅统计数据显示,截至2018年底,云南省马铃薯种植面积达5.628×10s hm2,产量(折粮)209.2万t,云南省马铃薯种植面积、总产量均居全国第3位,同时也是根结线虫的主要寄主之一。【前人研究进展】近年来,微生物多样性指标作为重要的土壤健康指标受到广泛的关注,而马铃薯根结线虫的侵染主要从根部开始侵染,同时促使根际土壤中的菌群更容易感染植株。据报道,国内外马铃薯寄生性线虫至少有24属68种,其中一些种类严重危害马铃薯的生产,我国已报道的马铃薯寄生线虫有16属44种,大多数是垫刃属、滑刃属等,马铃薯根结线虫属垫刃目线虫病害。在这些植物病原线虫中,马铃薯根结线虫Meloidogyne spp.占损失的50%以上[1-3]。根结线虫在土壤中受许多微生物影响,线虫寄生真菌被认为是自然条件下控制线虫的主要因子之一[4-7],所以推测感染根结线虫的马铃薯和健康马铃薯根际微环境土壤间存在差异。每棵植株所处的土壤成分、施肥情况和健康状态等微环境都会有细微的差别.都能灵敏地反映在其根际土壤微生物群落结构上,而表现出一种植物根际土壤微生物群落结构的多样性,就其丰度而言,数量在300~55 000[8-12]。然而,马铃薯植株健康状态变化与根际土壤微生物群落结构息息相关,土壤微生物菌群对调节植株根际微环境起到很大作用。利用传统的方法获得的微生物仅占环境微生物的0.1%~1.0%[13],无法全面反映环境微生物群落的真实状况。近年来,随着新一代测序技术的快速发展,利用Illumina Mi Seq高通量测序技术,现代生物信息学手段,可获得庞大的数据信息,该技术具有高通量、价格低、运行周期短的优势,已被广泛应用于微生物群落结构研究[14-17]。【本研究切入点】利用Illumina Mi Seq高通量测序技术探讨感染根结线虫的马铃薯和健康马铃薯根际微环境土壤间真菌群落差异有待深入研究。【拟解决的关键问题】本研究利用Illumina MiSeq测序技术对云南省曲靖市马龙县马铃薯生产基地健康马铃薯和感染根结线虫的马铃薯根际土壤真菌群落进行测序分析,探索其根际土壤真菌群落结构差异及其影响因素,为感染根结线虫的马铃薯根际土壤微环境改善,病害防治提供理论依据。
1材料与方法
1.1土壤样品采集地概况
试验地位于云南省曲靖市马龙县月望乡范家新屯马铃薯种植区,经度103°63',緯度25°33',海拔2090.00 m,属低纬度高原季风气候,年平均气温13.6℃,年均降水量1001.8 mm,每年平均日照1985h以上,县城年均气温13.4℃,每年无霜期24ld。冬无严寒,夏无酷暑,日照较长,热量不足,雨量充沛,但干冷同期,雨热同季,干湿分明,降水集中。各采样田的气候条件、栽培管理措施和水肥用量基本一致。土壤类型为砖红壤。
1.2土壤样品采集方法
在6块试验田中,按照5点采样法采集20 cm深的土壤样品,去除石块和大颗粒杂质,抖落根际土壤,进行混装后带回实验室,用20目的筛子过筛,处理组和对照组分别标记为MLE1,MLE2,MLE3,MLCKI,MLCK2,MLCK3.每个处理4个重复,分装至无菌离心管中,1份用于土壤性质测定,另外3份密封后立即放入-80℃冰箱,用于DNA提取。
1.3土壤性质测定
土壤pH采用pH酸度计测定,有机质(SOM)含量采用重铬酸钾氧化容量法测定,速效氮( AN)含量采用碱解扩散法测定,速效磷(AP)含量以NH4F_HC1溶液提取后采用紫外可见分光光度计测定,速效钾( AK)含量采用1.0 mol.L-l乙酸铵浸提后以火焰光度计测定。
1.4高通量测序分析
土壤样品送至美吉生物医药科技(上海)有限公司进行DNA提取和高通量测序。扩增引物为ITSIF(5'-CTTGGTCATTTAGAGGAAGTAA-3').ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')扩±曾片段长度为300 bp[18]。
1.5数据处理与分析
将PCR产物用QuantiFluorrM_ST蓝色荧光定量系统(Promega公司)进行检测定量,按照相应比例的混合后进行Miseq文库构建、拼接质控、OTU聚类、数据分析与信息挖掘。土壤性质和真菌群落多样性均采用SPSS17.0进行分析。
2结果与分析
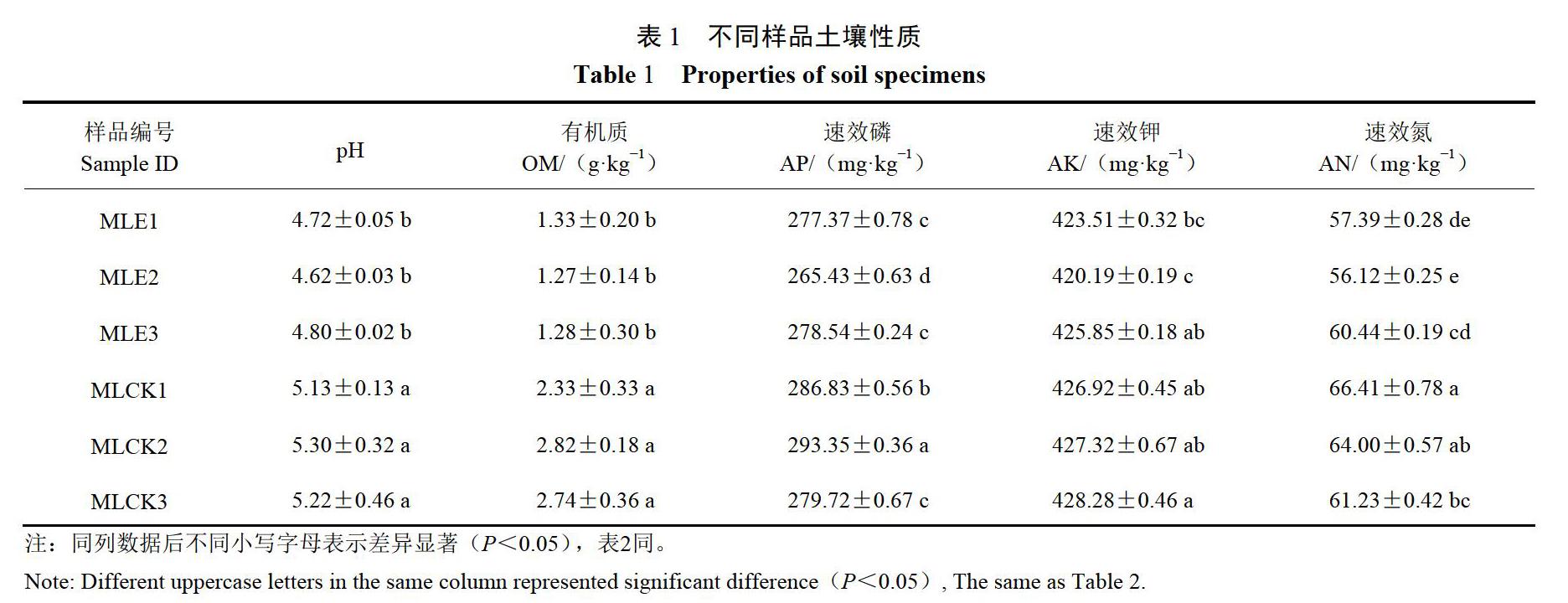
2.1不同样品土壤性质分析
由表1可知,6种样品根际土壤pH均偏酸性,其中,健康马铃薯根际土壤pH稍偏高,感染根结线虫的马铃薯根际土壤pH酸性略强,二者间存在差异显著性(P<0.05)。土壤有机质含量( OM)、速效磷( AP)、速效钾(AK)和速效氮(AN)均存在差异显著性(P<0.05),总体而言,以上4种物质含量在健康马铃薯根际土壤中含量略高。
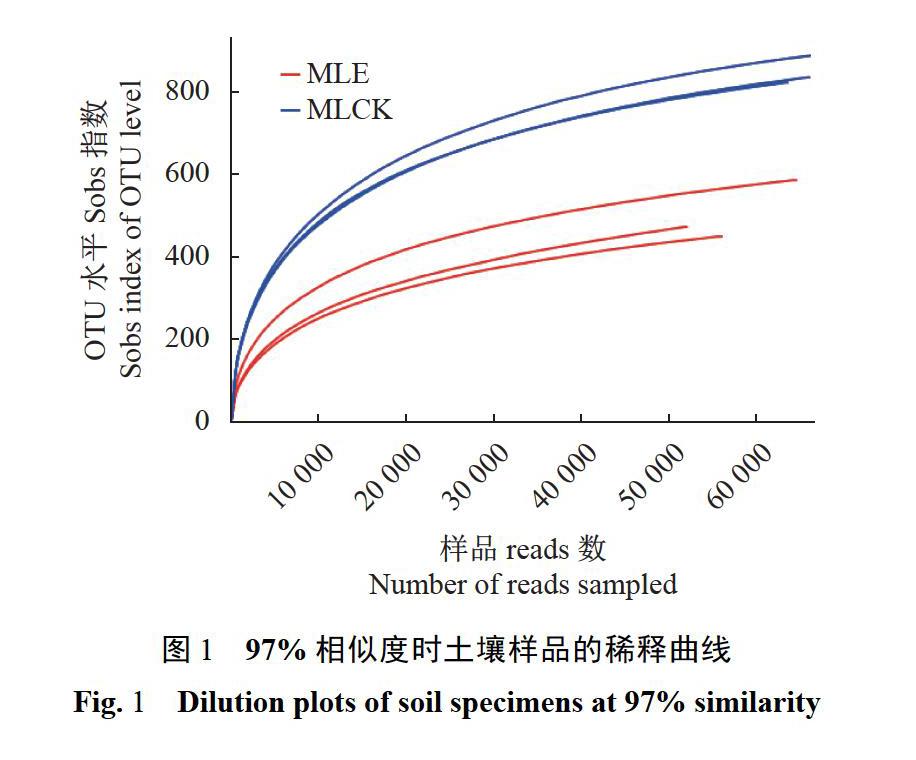
2.2样品稀释曲线分析
由图1可知,样品的稀释曲线呈平稳趋势发展,未达到饱和。可见,虽然取样、测试数据均存在科学性,样品信息存在较高的客观土壤环境真菌群落构成置信度,可客观体现土壤样本各自真菌群落,但也存在未发现部分少量微生物的可能性,说明测序结果可以反映样品当中的绝大多数真菌信息。
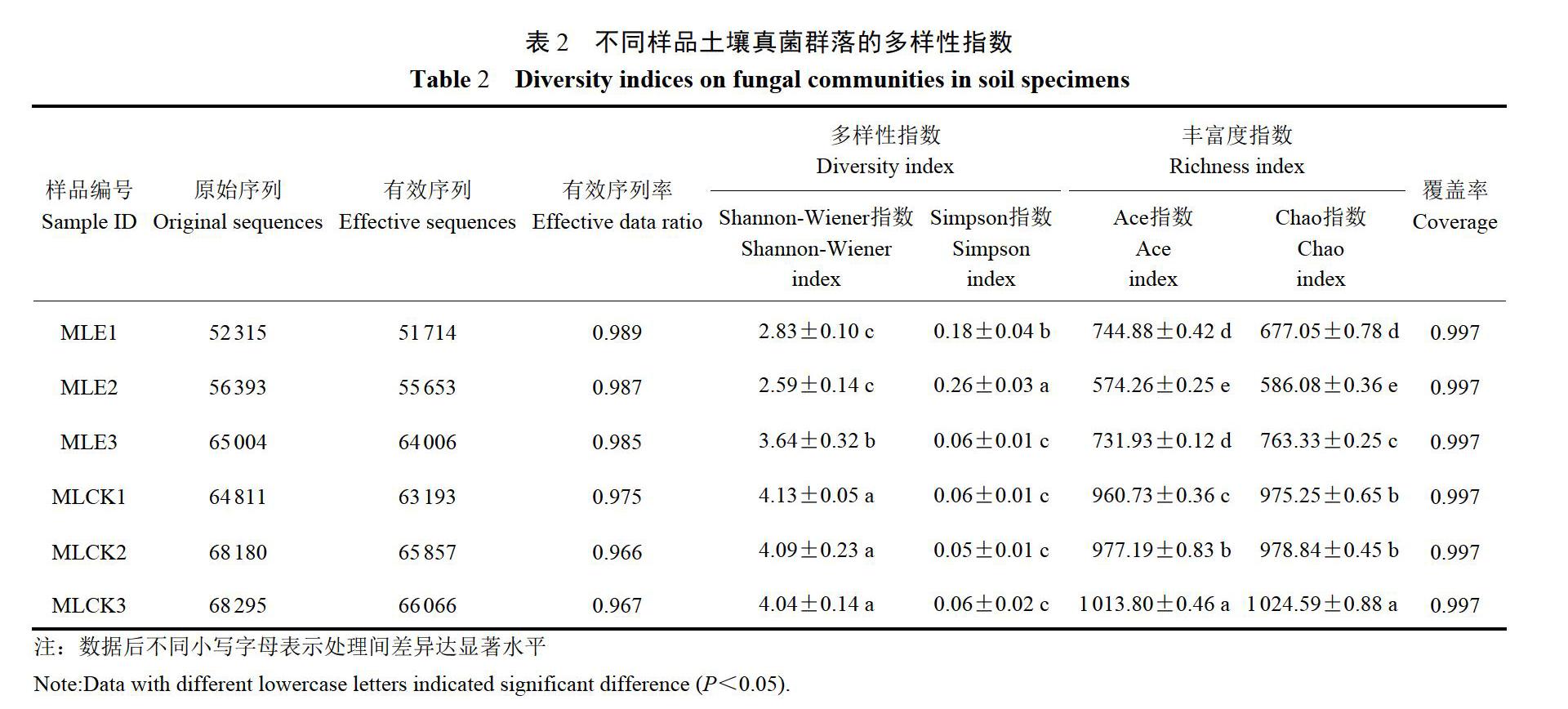
2.3测序序列统计及多样性指数分析
根据测序获得的原始序列和有效序列分析可知(表2),所有序列经质控分析得到的有效序列占比均在96%以上,说明原始序列利用率较高,绝大部分都可用作后续数据分析。各土壤真菌多样性指数覆盖率均为99.7%,说明测序数据合理真实,测序数据基本涵盖了马铃薯根际土壤中的真菌类群,能体现马铃薯根际土壤真实环境中真菌特征。通过SPSS统计软件分析,感染根结线虫马铃薯根际土壤真菌群落的Shannon-Wiener指数为2.59~4.19,Simpson指数为0.05~0.26,Ace指数为574.26~1013.8,Chao指数为586.14~1025.57,其中,感染根结线虫马铃薯根际土壤真菌菌落的多样性指数和丰富度指数与健康马铃薯根际土壤真菌群落均存在显著性差异。从多样性指数可看出,健康马铃薯根际土壤Shannon指数大于感染根结线虫马铃薯根际土壤,而Simpson指数恰好相反,说明健康马铃薯根际土壤真菌群落多样性更高。由Chao指数和Ace指数可看出,健康马铃薯根际土壤真菌群落丰富度均高于处理组,说明健康马铃薯根际土壤真菌群落丰富度高于处理组。
2.4物种组成分析
2.4.1物种组成Venn图分析 由图2可直观比较出两大组样品中OTU数目组成情况,两组样品中共有OTU数548个,占全部OTU的2g%,MLE组特有OTU数为189,占全部OTU的10%;MLCK组OTU数594,占全部OTU的32%,由此看出两大组样品中真菌分布差异明显。
2.4.2土壤真菌群落组成 6个土壤样品测序共获得3界12门34纲77目171科332属526种的土壤真菌。
2.4.3真菌在门水平上比较 对MLEI、MLE2、MLE3、MLCKI、MLCK2、MLCK3共6个样品中的真菌群落分别求和后,对6个样品做柱状图分析,结果如图3所示,6个样品丰富度相似,6个样品中丰度占优势的菌门均为担子菌门Basidiomycota,子囊菌门Ascomycota和球囊菌门 Mortierellomycota, 而MLCK1、MLCK2和MLCK3中子囊菌门Ascomycota和球囊菌门Mortierellomycota略高于另外3个样品。
2.4.4真菌在科水平上比较 如图4所示,6个样品在科水平上存在差异,MLCKI、MLCK2和MLCK3中真菌菌群丰富度高于另外3个样品,MLE1、MLE2和MLE3中丰度较高的菌群有赤壳科Nectriaceae、Trimorphomycetaceae、被孢霉科Mortierellaceae、 毛壳菌科Chaetomiaceae和裸囊菌科Gymnoascaceae,而MLCKI、MLCK2和MLCK3中丰度较高的菌群有赤壳科Nectriaceae、被孢霉科Mortierellaceae和毛壳菌科Chaetomiaceae。
2.4.5真菌在属水平上比较 如图5所示,6个样品中主要菌群为沙蜥属Saitozyma、镰刀菌属Fusarium、被孢霉属Mortierella、未知分类毛壳菌科属unclassifiedf_Chaetomiaceae和赤霉菌属Gibberella,在MLEI、MLE2和MLE3中丰度较高的菌属为Saitozyma,而Fusarium和Mortierella次之。在MLCK1、MLCK2和MLCK3中丰度较高的菌属为Fusarium、Mortierella和unclassified_f_ Chaetomiaceae.
3讨论与结论
本研究采用高通量测序技术分析了感染根结线虫马铃薯根际土壤真菌多样性及其群落组成,结果表明,从物种组成韦恩图可看出,健康植株根际土壤的OTU數量较感病植株根际土壤多,在门水平中,感病植株根际土壤真菌Basidiomycota丰度较健康植株根际土壤高,Ascomycota丰度低于健康植株根际土壤;在科水平中,病株根际中丰度较高的菌群有Nectriaceae和Trimorphomycetaceae; 在属水平中,健康植株根际土壤中丰度较高的菌群为Fusarium、Mortierella、unclassified_f_Chaetomiaceae和Plectosphaerella。健康植株根际土壤真菌群落Ascomycota高的原因可能是Ascomycota都是寄生或腐生,部分感病植株根系腐烂,根际分泌物大量减少甚至无分泌物,造成Ascomycota赖以寄生的根际营养成分下降,所以感病植株根际土壤中Ascomycota丰度降低;相反,感病植株根际土壤中Basidiomycota丰度高的原因是由于病根腐烂过程中,与植株具有共生关系的担子菌门Basidiomycota势必紧急动员,通过与植物形成共生菌根来抵御或弥补根结线虫感染对植株的伤害[19-20],所以表现出其丰度显著提高。在科水平中,Nectriaceae丰度高的原因可能是Nectriaceae是一种导致植株形成丛枝菌根并致使根际腐烂的致病菌,所以丰度偏高,与Nonaka等研究[6.21]相符。本研究中感染根结线虫的马铃薯根际土壤真菌群落的Ace指数、Chao指数和Shannon-wienner指数趋势相同,而与pH相反;Simpson指数与有机质、速效氮、速效磷及速效钾含量变化相反,说明土壤真菌丰度和多样性与土壤养分含量密切相关,下一步将进一步明确其相关性,通过各种手段改善土壤pH和理化性质等因素改变土壤真菌群落结构来控制根结线虫病害的扩展和蔓延。
参考文献:
[1]MARKS R BRODIE B Potato cVst nematodes. biology. distributionand control [J]. Potato Cyst Nematodes Biology Distribution andControl. 1998.5 (2):79-86
[2]徐春玲,陈淳,周春娜,等马铃薯根际3种植物线虫种类记述[J]华仁南农业大学学报,2012,33 (2):167-170
xu C L CHEN C,ZHOU C N,et al Description of Three NewRecorded Species of Plant Parasitic Neinatodes Extracted fromRhizosphere of Potato inChina [J]. Journal of South China。Agricultural University,2012,33 (2):167-170 (in Chinese)
[3]OKA Y,KOLTAI H,BAR-EYAL M et al New strategies for thecontrol of plant-parasitic Nematodes[J]Pest Monagement Science.2000. 56 (11):983-988
[4]DACKMAN c NORDBRING-HERTZ B Fungal parasites of thecereal cvst nematode Heterodera avenae in southern Sweden[J]Journal of Nematology. 1985. 17(1):50-55
[5] KHAN T A,SAXENA s K Effect of root-dip treatment with culturefiltrates of soil fungi on multiplication of Meloidogyne javanica andyield of tomato [J] Test ofAgrochemical and Cultivars. 1997(18):50-51
[6]TOJU H. TANABE A s,SATO H Network hubs in root-associatedfunmgal metacommunities [J].Microbiome. 2018.6(1):116
[7]杨树军,雷丽萍,祝明亮,等烟草根结线虫生物防治方法应用研究[J]西南农业学报,2004. 17( Sl):151-154
YANG S J,LEI L P,ZHU M L,et al Screening of the parasiticalfungi of root knot nematode in tobacco [J]. Southwestern ChinaJournal of Agricultural Sciences. 2004. 17(Sl): 151-154 (inChinese)
[8]MENDES R,KRUIJT M. DE BRUIJN I, et al Deciphering thethizosphere microbiome for disease-suppressive bacteria [J] Science.2011. 332( 6033) 1097-1100
[9]UROZ s, BUEEE M. MURAT c,et al Pyrosequencing reveals acontrasted bacterial diversitv between oak thizosphere and surroundingsoil [J] Eny Microbiol Rep. 2010.2(2):281-288
[IO]WEINERT N. PICENO Y. DING G c,et al PhyloChip hybridizationuncovered an enonuous bacterial diversity in the thizosphere ofdifferent potato cultivars: Many common and few cultivar-dependenttaxa[J] FEMS Microbiology Ecology, 201l,75(3)497-506
[II] PIRES A c c,CLEARY D F R,ALMEIDA A. et al Denaturinggradient gel electrophoresis and barcoded pyrosequencing revealumprecedented archaeal diversitv iii mangrove sediinent andthizosphere samples [J] Applied and Environmental Microbiology.2012. 78(16) 5520-5528
[12] BULGARELLI D. ROTT M. SCHLAEPPI K. et al Revealingstructure and assembly cues for Arabidopsis root-inhabiting bacterialmicrobiota [J] Nature. 2012. 488( 7409):91-95
[13]樓骏,柳勇,李延,等高通量测序技术在上壤微生物多样性研究中的研究进展[J]中国农学通报,2014. 30( 15):256260
LOU J, LIU Y. LI Y. et al Review of High-throughput sequencingtechniques in studies of soil inicrobial diveisity [J]. Chinese AgriculturalScience Bulletin. 2014. 30( 15) 256260.( in Chinese)
[14]董艳辉,于宇风,温鑫,等基于高通量测序的藜麦连作根际上壤微生物多样性研究[J].华北农学报,2019. 34 (2):205-211
DONG Y H,YU Y F,WEN X. et al Studies on diversity ofthizosphere microorgamsin in quinoa continuous cropping Soil byHigh Throughput Sequencing [J]. Acta Agriadture Boreali-Sinica.2019. 34(2): 205-211 (in Chinese)
[15]张骏达,李素艳,孙向阳,等基于高通量测序技术的小同年代公园绿地上壤细菌多样性[J]微生物学通报,2019. 46(1):6574
ZHANG J D. LI S Y. SUN X Y. et al Analysis of soil bacterialdiversity in urban parks with different ages by high throughputsequencing [J]. Microbiology China. 2019. 46(1):6574.( inChinese)
[16]汪娅婷,付丽娜,姬广海,等基于高通量测序技术研究云南玉米根际微生物群落多样性[J].江西农业大学学报,2019.41 (3):491-500
WANG Y T,FU L N,儿G H. et al A study of the microbialcommunitv diversity of com thizosphere in Yunnan province based onHigh-Throughput Sequencing Technique [J]. Acto .4griculturaeUniversitatis Jiangxiensis. 2019. 41(3) 491-500.( in Chinese)
[17]王艳云,郭笃发小同植物类型下土壤真菌群落研究[J]基因组学与应用生物学,2017. 36 (2):696-701
WANG Y Y. GUO D F Study on Soil Fungal Community underDifferent Plant Types[J]. Genomics and Applied Biology. 2017.36 (2): 696-701 (in Chinese)
[18] ADAMS R I,MILETTO M. TAYLOR J W. et al Dispersal inmicrobes: fungi in indoor air are doininated bv outdoor air and showdispersal limitation at short distances [J]. The ISME Journal. 2013.7 (7):1262-1273
[19] LAURENT P,VOIBLET c,TAGU D. et al_A novel class ofectoinvcorrhiza-regulated cell wall polpeptides in Pisolithustinctorius [J]. Mol Plant Microbe. 1999. 12(10) 862-871
[20] HELGASON T, FITTER A H Natural selection and the evolutionaryecology of the arbuscular mvconhizal fungi (Phylum Glomeromycota)[J] Journal ofExperimentol Botany. 2009. 60(9):2465-2480
[21] NONAKA K. KANETA T,OMURA s, et al_Mariannaeamacrochlamydospora,a new hyphomycete (Nectriaceae) from soil inthe Bonin Islands. Japan [J].Mycoscience. 2015. 56(1):2933
(責任编辑:林海清)
收稿日期:2021-0308初稿;2021-06-19修改稿
作者简介:张丽芳( 1987-),女,博士,讲师,研究方向:植物病理(E-mail: 752859175@qq.com)
*通信作者:胡海林( 1986-),男,硕士,助教,研究方向:马铃薯病害(E-mail: 243902676@qq.com)
基金项目:云南省科技计划计划青年项目(2018FD080):曲靖师范学院青年项目(2019QN002)
