木质纤维素分解复合菌系的分解特性与细菌组成多样性分析
2017-10-27何水清艾士奇王建豪
何水清 艾士奇 王建豪
摘要:利用木质纤维素分解复合菌系BYND-8对稻秆进行生物处理,研究其分解特性及其細菌组成多样性,为应用微生物方法处理木质纤维素类资源提供理论依据。通过测定复合菌系在分解稻秆的过程中木质纤维素各成分含量的变化,同时测定分解过程中培养基pH值的变化趋势,研究其分解特性。运用高通量测序技术对复合菌系rRNA基因的V3-V4区进行测序,分析其细菌组成多样性。结果表明,复合菌系BYND-8具有较高的木质纤维素分解能力,对培养基的pH值具有自我调节能力;在纲、目、科3个分类水平上,分别将复合菌系中的细菌分成了73个纲、132个目和226个科,复合菌系中细菌在科的分类水平上比较丰富,其中相对量较高、占优势的细菌为紫单胞菌科(Porphyromonadaceae,1873%)、柄杆菌科(Caulobacteraceae,1203%)和理研菌科(Rikenellaceae,1196%)。木质纤维素分解复合菌系BYND-8具有较高的细菌组成多样性。
关键词:木质纤维素;分解;复合菌系;高通量测序;多样性分析;木质纤维素分解机理
中图分类号: Q9399;S182文献标志码:
文章编号:1002-1302(2017)16-0241-06
收稿日期:2016-09-20
基金项目:黑龙江省大学生创新创业训练计划(编号:20141022311);国家科技支撑计划(编号:2015BAD21B04、2016YFD0800602);黑龙江农垦总局科技攻关项目(编号:HNK125B-11-06A、HNK125B-11-11A、JCTG17-04)。
作者简介:何水清(1994—),男,江西宁都人,主要从事农业废弃物资源化利用与环境微生物分子生态学的研究。E-mail:616022790@qqcom。
通信作者:王伟东,博士,教授,主要从事农业废弃物资源化利用与环境微生物分子生态学的研究。E-mail:wwdcyy@126com。
为了减少化石燃料的过度开采而带来的环境污染,木质纤维素这一重要的生物质资源越来越受到重视。中国是一个农业大国,每年作物秸秆产量约8亿t,其中含有大量的木质纤维素资源。这些秸秆中约有30%没有得到资源化利用,大部分被就地焚烧,不仅造成了资源的浪费,而且引起了严重的环境污染。近年来,秸秆等木质纤维素类废弃物资源化利用越来越受到政府和科研工作者的重视,其中高效、环保、廉价的生物处理法被日益采用[3]。崔宗均等从堆肥样品中富集筛选、驯化得到1组可高效稳定分解木质纤维素的复合菌系MC1[4-5];赵听等得到了能分解小麦秸秆的复合菌群FWD1,小麦秸秆的分解率达到7692%;刘长莉筛选驯化出复合菌系NSC-7,稻秆的分解率达447%。同样也有分解木质纤维素的单菌与复合菌系分解能力比较的研究报道,张晓伦等从垃圾堆腐物中分离得到了3株具有较强纤维素分解能力的真菌,发现由2种不同菌株组成的混合菌系比任何单一菌株的纤维素分解能力强,CMC酶活性是单一菌株的15倍[8];陈耀宁等将1株黄孢原毛平革菌和1株歧皱青霉混合培养,发现木质纤维素的分解率较单一菌株大大提高[9];温雪等将2株具有较强木质纤维素分解能力的菌株与2株无分解能力的菌株进行组合,发现组合菌群的纤维素分解能力较单独的菌株分解能力稳定而高效[10]。Kato 等通过对复合系MC1中关键菌株的重新组合发现其纤维素的分解能力高于单一菌株[11]。单一菌株对木质纤维素的分解能力远不及多种菌株协同作用[12-13]。因此,利用微生物复合菌系各菌株之间的协同作用来高效稳定地分解木质纤维素并分析其分解机理具有重要意义。
本研究以实验室构建的中温木质纤维素分解复合菌系BYND-8为研究对象,运用高通量测序技术分析其细菌组成多样性,为复合菌系分解木质纤维素的机理奠定基础。
1材料与方法
11培养条件
纤维素蛋白胨培养基(PCS):蛋白胨50 g,NaCl 50 g,CaCO3 20 g,酵母粉10 g,木质纤维素(稻秆)50 g,蒸馏水1 L,pH自然,1×105 Pa灭菌15 min,按培养基体积的10%接种,30 ℃静止培养。
稻秆预处理方法:将稻秆剪切成5 cm的小段,用1%的NaOH溶液浸泡24 h,然后用自来水冲洗稻秆,再用盐酸(1 mol/L)浸泡,之后用自来水冲洗并浸泡12 h,至pH值为70左右,105 ℃烘干至恒重备用。
12复合菌系的筛选
把旺盛产沼气的培养液10 mL接种到装有90 mL PCS培养基的三角瓶内,提前放入滤纸条作为分解的外观指标,将05 g经预处理的稻秆作为碳源,30 ℃静止培养。当滤纸条完全分解、稻秆软化时,按体积10%的接种量接种到同样的培养基中传代培养。在继代培养过程中,留下分解能力强的培养物,淘汰失去分解能力的培养物。如果培养物分解能力下降,则把不同的培养物相互组配,继续传代培养。保留分解能力高效且稳定的培养物,用作后续研究。
13复合菌系中稻秆及其木质素、纤维素、半纤维素分解率的变化
取三角瓶,将10 g稻秆加入90 mL PCS培养基中,按体积比接种10%的复合菌系,30 ℃静止培养。将培养0、1、2、3、4、5、6、7 d的稻秆分别取出,每天取3瓶,5 000 r/min离心,弃上清,为消除菌体用硝酸和盐酸的混合溶液冲洗稻秆,离心,用清水冲洗,离心,105 ℃烘干至恒重后称质量,计算每瓶稻秆的失重量和分解率[14],最后计算平均值。烘干后的稻秆经粉碎过筛后用于测定木质素、纤维素和半纤维素的含量。在纤维素分析仪(美国ANKOM220)上,用改良的范式洗涤法测定木质素、纤维素和半纤维素的含量[15],计算分解率。
14复合菌系pH值的动态变化
141复合菌系pH值的变化
100 mL三角瓶內分装 90 mL PCS培养基,按体积比接种10%的复合菌系,30 ℃静止培养。每天按时取3瓶复合菌系,用pH计(日本HORIBA)测定其pH值,连续测定10 d。
142不同的起始pH值对复合菌系培养基pH值的影响
将PCS培养液的初始pH值分别调至4、5、6、7、8、9、10,按体积比接种10%的复合菌系,30 ℃静止培养。每天按时取3瓶复合菌系,用pH计(日本HORIBA)测定其pH值,连续测定 7 d。
15复合菌系的高通量测序
151获取测序样品
取稻秆分解能力旺盛阶段(接种培养5 d)的液态培养物和稻秆表面的微生物。
培养基中微生物的获取方法:取适量培养基 12 000 r/min 离心10 min可得到菌体。
稻秆表面微生物的获取方法:取适量复合菌系处理5 d的稻秆,加入适量PBS缓冲液,150~200 r/min振荡30~60 min,超声5 min,再150~200 r/min振荡30~60 min。取上清液加入到50 mL离心管中,120 00 r/min离心10 min得菌体。
将所得培养基中的微生物和稻秆表面的微生物混合备用。
152提取总DNA
取适量所得的菌体,用氯化苄法提取其总DNA[16]。所提取的总DNA要保证浓度大于10 ng/μL,总量超过500 ng,D260 nm/280 nm在18~22之间。琼脂糖凝胶电泳主带清晰。
15316s rDNA基因V3-V4区PCR扩增及测序
提取样品总DNA后,根据细菌V3-V4区设计得到引物,合并引物接头,进行PCR扩增,对其产物进行纯化、定量及均一化,最后形成测序文库。对构建好的文库进行质检,质检合格的文库用Illumina MiSeq PE300进行测序。
154细菌多样性数据分析
对序列进行聚类,将相似性超过97%的序列划分到同一个OTU(operational taxonomic units)。按众数原则对序列进行物种注释。统计样品在各个分类水平上的构成,用饼图进行可视化。对统计样品中在纲、目、科分类水平上的菌群作聚类,用相同颜色表示该分类水平所含的OTU序列丰度的相对高低。
2结果与分析
21复合菌系中稻秆及其木质素、纤维素、半纤维素分解率的变化
经过连续的传代培养,已构建出具有高效稳定分解木质纤维素能力的复合菌系BYND-8。经前期的试验验证,复合菌系经传代培养和保存后,菌种组成和功能都已达到稳定。在复合菌系培养过程中,可明显观察到滤纸分解,稻秆软化成细丝状。
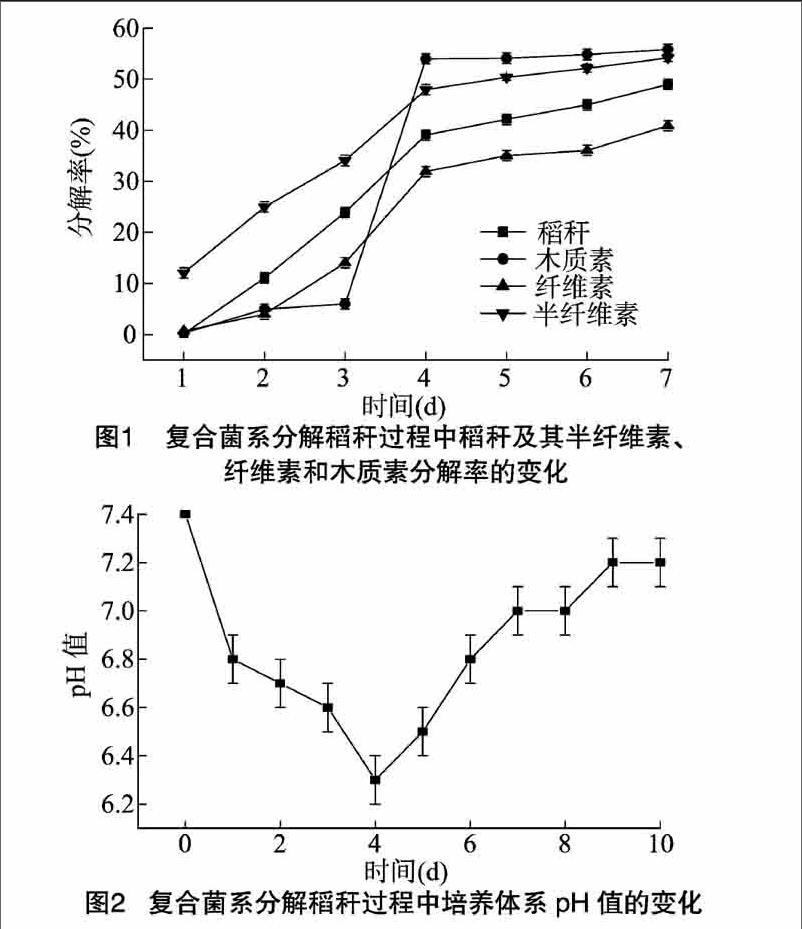
稻秆和稻秆中木质素、纤维素、半纤维素的分解率的变化结果如图1所示。在培养的前4 d秸秆被旺盛分解,4 d后分解能力减弱基本不再分解。在培养4 d时分解率达到最高值,稻秆和稻秆中木质素、纤维素、半纤维素的分解率分别为392%、540%、317%、480%。稻秆经过复合菌系处理7 d后,稻秆和稻秆中木质素、纤维素、半纤维素的分解率分别为490%、555%、407%、536%。
22复合菌系培养体系pH值的动态变化
221复合菌系分解稻秆过程中培养体系pH值的变化
由图2可知,在培养的前4 d,培养基的pH值呈下降趋势,到培养4 d时,pH值降到最低,从起始的74降到63。从培养5 d开始,培养基的pH值开始回升,到培养7 d时,培养基的pH值回升到70左右,并保持相对稳定状态,一直到培养 10 d,培养基的pH值保持在72左右,与培养基的起始pH值相差不大。
222不同的起始pH值条件下复合菌系培养基pH值的变化
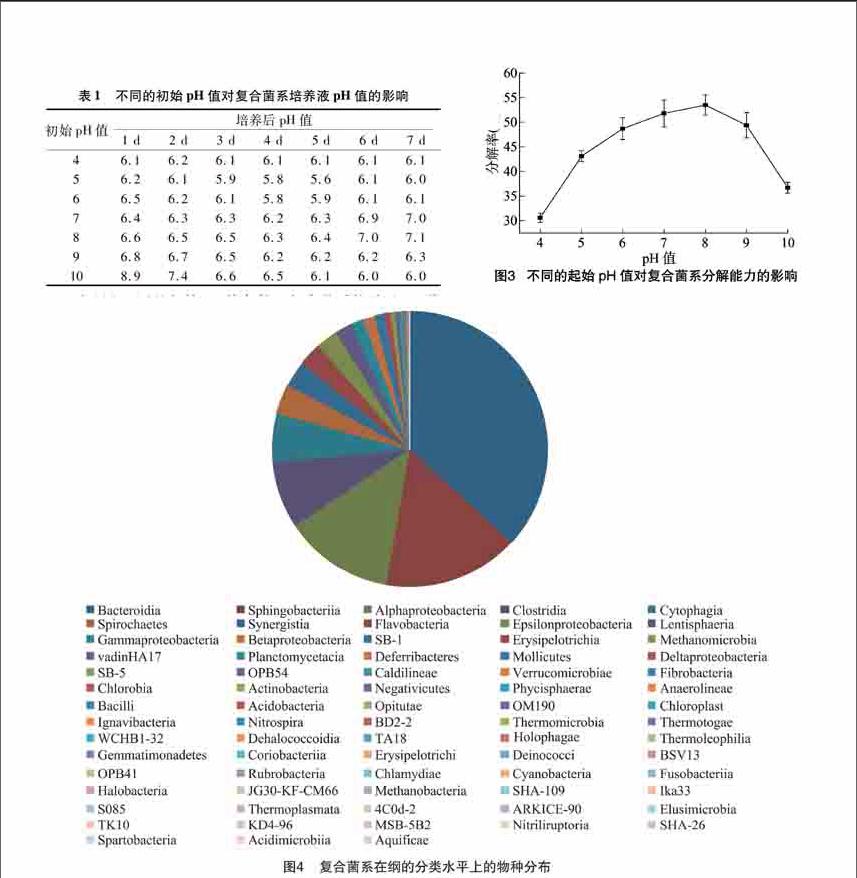
由表1可知,当培养基的初始pH值为4时,接种复合菌系1 d后培养基的pH值上升至61,直至接种7 d时,培养基的pH值一直保持在61左右。当培养基的初始pH值为5和6时,接种复合菌系1 d后培养基的pH值分别上升至62和65,分别在培养5、4 d时pH值达到最低值,但是到培养 6 d 时培养基的pH值回升到61并保持相对稳定。当培养基的初始pH值为7和8时,接种复合菌系1 d后培养基的pH值明显下降,到培养4 d时培养基的pH值达到最低值,分别为62、63,到接种后6 d,培养基的pH值回升到70左右并保持相对稳定状态。当培养基的初始pH值为9和10时,接种复合菌系1 d后培养基的pH值呈现明显下降,且一直维持这一下降趋势,到接种后7 d时,培养基的pH值分别达到63、60左右。
在研究不同的起始pH值条件下复合菌系培养基pH值变化的同时,对不同的起始pH值条件下稻秆的分解率进行了试验。由图3可知,当pH值在40~100范围内时,稻秆都会发生分解,但是复合菌系对稻秆的分解程度各不相同。当pH值为80时,稻秆的分解率最高,可达到535%;其次是[CM(25]当pH值为70时,稻秆的分解率为518%;当pH值为4和100时,稻秆的分解率则明显下降。
综合以上结果可知,在培养基的起始pH值为4~10时,复合菌系的pH值随着稻秆的分解而自动调节,最终的pH值都保持在6~7之间,接近中性。在木质纤维素分解的旺盛时期,培养基的pH值均可降到最低值。当木质纤维素分解完成后,培养基的pH值均可自动回升。当培养基的初始pH值为4~10时,稻秆呈现不同的分解状态,分解率各不相同,而适宜复合菌系分解稻秆的初始pH值接近中性,培养基过酸过碱都不适宜复合菌系分解稻秆。
23复合菌系的细菌组成多样性
对复合菌系进行16s rDNA扩增子高通量测序,将复合菌系在微生物的纲、目、科3个分类水平给出分类。复合菌系在微生物分类单元纲的水平上的物种相对丰度统计结果如图4所示。
复合菌系的细菌组成在纲的水平上包含73个纲的细菌,其物种相对丰度高于100%的可分类菌纲共有13个,包括拟杆菌纲(Bacteroidia)、鞘脂杆菌纲(Sphingobacteriia)、α-变形菌纲(Alphaproteobacteria)、梭菌纲(Clostridia)、纤维黏网菌纲(Cytophagia)、螺旋体纲(Spirochaetes)、互养菌纲(Synergistia)、黄杆菌纲(Flavobacteria)、ε-变形菌纲(Epsilonproteobacteria)、黏胶球形菌纲(Lentisphaeria)、γ-变形菌纲(Gammaproteobacteria)、β-变形菌纲(Betaproteobacteria)和未培养细菌,其物种相对丰度分别为3675%、1600%、1284%、789%、581%、344%、307%、277%、253%、195%、148%、141%、107%。
复合菌系在微生物分类单元目的水平上的物种相对丰度统计结果如图5所示。
复合菌系的细菌组成在目的水平上包含132个目的细菌,其物种相对丰度高于100%的可分类菌目共有9个,包括拟杆菌目(Bacteroidales)、鞘脂杆菌目(Sphingobacteriales)、柄杆菌目(Caulobacterales)、梭菌目(Clostridiales)、嗜纤维菌目(Cytophagales)、螺旋体目(Spirochaetales)、Synergistales、黄杆菌目(Flavobacteriales)、弯曲菌目(Campylobacterales),其物种相对丰度分别为3816%、1661%、1197%、818%、602%、357%、319%、287%、263%。
复合菌系在微生物分类单元科的水平上的物种相对丰度统计结果如图6所示。
对复合菌系进行高通量测序后发现细菌的组成在科的水平上比较丰富。复合菌系的细菌组成在科的水平上包含226个科的细菌,其物种相对丰度高于100%的可分类菌科共有14个,包括紫单胞菌科(Porphyromonadaceae)、柄杆菌科(Caulobacteraceae)、理研菌科(Rikenellaceae)、海滑菌科(Marinilabiaceae)、嗜纤维菌科(Cytophagaceae)、瘤胃菌科(Ruminococcaceae)、互养菌科(Synergistaceae)、弯曲菌科(Campylobacteraceae)、螺旋体科(Spirochaetaceae)、黄杆菌科(Flavobacteriaceae)、Christensenellaceae和3个未培养的细菌,其物种相对丰度分别为1873%、1203%、1196%、733%、603%、371%、323%、266%、258%、219%、123%,3个未培养的细菌相对丰度共占了1628%。复合菌系中相对丰度低于1%的可分类菌科共有212个,由于这些细菌在复合菌系中的相对丰度极小,共占复合菌系的1205%。
3讨论
利用限制性培养技术从产沼气旺盛的沼液中筛选具有分解木质纤维素分解能力的复合菌系BYND-8,用稻秆的分解率作为指标,培养7 d后,稻秆及稻秆中木质素、纤维素和半纤[CM(25]维素的分解率分别为490%、555%、407%、536%。虽[CM)]
然与已报道的复合菌系相比其木质纤维素能力相对较低[2,4,7,11,14],但BYND-8与它们的筛选样品来源不同,是从沼气发酵体系中筛选得到,沼气发酵体系是厌氧环境,在此也证明不同的培养条件对于纤维素分解能力影响较大。该复合菌系可能应用于将来的以稻秆为原料的沼气发酵的预处理。
通过复合菌系在分解稻秆过程中pH值变化趋势、调节培养基的不同起始pH值复合菌系对稻秆的分解率来看,复合菌系可以自我调节培养环境的pH值,这充分体现了该复合菌系较纯培养菌株分解木质纤维素的优势所在。崔宗均等构建的木质纤维素分解复合菌系的pH值随着培养时间先下降后升高最后趋于稳定并与初始pH值较一致[4,17],这与本研究的结果相吻合。复合菌系培养体系的pH值对于木质纤维素的分解具有明显的影响。
不同菌株协同作用可高效稳定地分解木质纤维素,宋亚彬曾通过传统的平板分离法和变性梯度凝胶电泳法分析了复合菌系的菌种组成多样性,她发现复合菌系的微生物组成主要分为肠杆菌科(Enterobacteriaceae)、产碱杆菌科(Alcaligenaceae)、黄单胞菌科(Xanthomonadaceae)、芽孢杆菌科(Bacillaceae)和一个未知的菌科[18]。但是通過对复合菌系进行16S rDNA扩增子高通量测序,分析复合菌系的细菌组成及多样性,发现高通量测序技术与传统的分子生物学手段相比,更加全面、准确,它将复合菌系在科的分类水平上分成226个科的细菌,远远高于传统的多样性分析方法。而且通过高通量测序分析可知,肠杆菌科、产碱杆菌科、黄单胞菌科、芽孢杆菌科的相对丰度分别为011%、086%、006%、0008%,远低于高通量测序得到的优势菌株。说明传统的分析方法存在一定的局限性,不能表征复合菌系涵盖的全部微生物。而高通量测序可以揭示不同种类的细菌在木质纤维素分解过程中的功能,分析不同菌种之间存在的协同关系。通过对复合菌系进行高通量测序,可以得到复合菌系中相对量较高的占优势的菌株,进而可以揭示分解木质纤维素的功能菌。紫单胞菌科属于拟杆菌门,适宜在中温厌氧条件下生长,能发酵多种单糖和二糖,产生有机酸,如丙酸、乙酸和少量丁酸等[19],曾在石油烃污染土壤及肥育猪后肠分离得到,参与了烃类的厌氧降解及纤维降解[20-21]。苏增建等从石油污染土壤样品中得到以石油烃为唯一生长碳源的细菌菌株,研究了其石油降解能力,结果表明柄杆菌具有一定的石油降解能力[22],推测柄杆菌在复合菌系中起到分解木质纤维素中长链烷烃的作用。高凤芹对驯化后的瘤胃液和传统的沼液进行高通量测序分析,结果表明瘤胃液的细菌主要分布在瘤胃球菌科、理研菌科等,而沼液中含量大于8%的细菌群落只有理研菌科和瘤胃球菌科,发挥了高效降解纤维素和甲烷生成的功能[23]。而本研究复合菌系正是从产沼气旺盛的沼液中富集筛选得到,理研菌科与瘤胃菌科同样起到分解木质纤维素的作用。瘤胃菌科适合厌氧生长,部分细菌可氢化不饱和脂肪酸,有的能分解芳香族化合物、肉桂酸和巴豆酸酯[24]。嗜纤维菌科能溶解植物纤维及水解纤维素[25]。黄杆菌科专性需氧。螺旋体科也具有专一性降解半纤维素的作用[26]。互养菌科的细菌属于厌氧发酵菌,可以利用有机酸发酵产生乙酸,利于菌系的对烃的降解[27]。在对复合菌系中优势菌株的分析后发现,分解木质纤维素的细菌在分解木质纤维素时,产生了大量的有机酸,由于有机酸的积累导致复合菌系在分解木质纤维素旺盛时期pH值降到最低。在这些优势菌中既有好氧细菌又有厌氧细菌,而起木质纤维素分解作用的主要都是厌氧细菌,好氧细菌的存在是将整个体系创造成无氧环境,进而厌氧纤维素分解细菌发挥作用。正是由于复合菌系具有较高的微生物组成多样性,才使得复合菌系具有较高的分解木质纤维素的能力。
4结论
木质纤维素分解复合菌系BYND-8具有高效稳定的分解能力,初始培养基接近中性时其分解效果最好。复合菌系BYND-8中细菌在科的分类水平上相对量较高,占优势的细菌为紫单胞菌科(Porphyromonadaceae)、柄杆菌科(Caulobacteraceae)和理研菌科(Rikenellaceae),主要参与木质纤维素的分解。本研究为进一步研究复合菌系协同分解木质纤维素的机理奠定理论基础。
参考文献:
Jnsson L J,Martin C Pretreatment of lignocellulose:formation of inhibitory by-products and strategies for minimizing their effects[J] Bioresource Technology,2016,199:103-112
温博婷,袁旭峰,华彬彬,等 纤维素分解菌系WSD-5常温产酶高温糖化小麦秸秆研究[J] 中国农业大学学报,2014,19(2):36-42
[3]Venkatesh C,Pradeep V An overview of key pretreatment processes employed for bioconversion of lignocellulosic biomass into biofuels and value added products[J] Biotech,2013,3(5):415-431
[4]崔宗均,李美丹,朴哲,等 一组高效稳定纤维素分解菌复合系MC1的筛选及功能[J] 环境科学,2002,23(3):36-39
[5]Guo P,Wang X F,Zhu W B,et al Degradation of corn stalk by the composite microbial system of MC1[J] Journal of Environmental Sciences,2008,20(1):109-114
[6]赵听,张凯煜,谷洁,等 复合菌群FWD1的木质纤维素降解特性及其微生物多样性研究[J] 农业环境科学学报,2015,34(8):1582-1588
[7]刘长莉 木质纤维素分解复合菌群NSC-7菌种组成及种间协作机理[D] 哈尔滨:东北林业大学,2008
[8]张晓伦,刘旭,饶泽昌 高效纤维素分解菌混合培养及其降解能力[J] 南昌大学学报:理科版,2005,29(5):500-502
[9]陈耀宁,曾光明,喻曼,等 与黄孢原毛平革菌协同降解稻草的混合菌筛选[J] 中国环境科学,2007,27(2):189-193
[10]温雪,付博锐,王彦杰,等 纤维素分解复合菌系WSC-9中厌氧细菌的分离[J] 东北农业大学学报,2013,44(2):47-52
[11]Kato S,Haruta S,Cui Z J,et al Stable coexistence of five bacterial strains as a cellulose degrading community[J] Applied and Environmental Microbiology,2005,71(11):7099-7106
[12]Yan L,Gao Y M,Wang Y J,et al Diversity of a mesophilic lignocellulolytic microbial consortium which is useful for enhancement of biogas production[J] Bioresource Technology,2012,111(5):49-54
[13]Wang W D,Yan L,Cui Z J,et al Characterization of a microbial consortium capable of degrading lignocellulose[J] Bioresource Technology,2011,102(19):9321-9324
[14]王伟东,崔宗均,牛俊玲,等 一组木质纤维素分解菌复合系的筛选及培养条件对分解活性的影响[J] 中国农业大学学报,2004,9(5):7-11,44
[15]何江,毛忠贵,张庆华,等 高效木薯渣分解复合菌群RXS的构建及其发酵特性研究[J] 环境科学,2012,33(3):1020-1027
[16]Zhu H,Qu F,Zhu L H Isolation of genomic DNAs from plants,fungi and bacteria using benzyl chloride[J] Nucleic Acids Research,1993,21(22):5279-5280
[17]王伟东,王小芬,刘长莉,等 木质纤维素分解菌复合系WSC-6分解稻秆过程中的产物及pH动态[J] 环境科学,2008,29(1):219-224
[18]宋亚彬 中温木质纤维素降解复合菌系及其对沼气产量的影响[D] 大庆:黑龙江八一农垦大学,2009
[19]王学华,黄俊,宋吟玲,等 高效水解酸化UASB活性污泥的菌群结构分析[J] 环境科学学報,2014,34(11):2779-2784
[20]张文静 烃类厌氧降解过程中互营细菌的分布特征和系统发育研究[D] 北京:中国农业科学院,2011
[21]冯平 肥育猪对不同类型纤维消化适应性及其后肠发酵与微生物菌群变化研究[D] 北京:中国农业科学院,2013
[22]苏增建,李敏,邝春兰 热带地区石油污染土壤中降解菌的筛选[J] 安全与环境学报,2008,8(1):86-88
[23]高凤芹 柳枝稷发酵产甲烷过程中纤维素降解机制及微生物多样性变化[D] 北京:中国农业大学,2015
[24]王继文,王立志,闫天海,等 山羊瘤胃与粪便微生物多样性[J] 动物营养学报,2015,27(8):2559-2571
[25]布坎南,吉本斯 伯杰细菌鉴定手册[M] 8版北京:科学出版社,1984:116-117
[26]张翔飞 活性干酵母对肉牛瘤胃发酵、纤维降解及微生物菌群的影响[D] 雅安:四川农业大学,2014
[27]周蕾 厌氧烃降解产甲垸菌系的组成及其代谢产物的特征[D] 上海:华东理工大学,2012
