UPLC-MS/MS法检测禾谷镰刀菌中6-磷酸海藻糖和海藻糖的色谱柱选择
2021-11-14吴琴燕梁红芳张文文温小林朱建飞徐超庄义庆
吴琴燕 梁红芳 张文文 温小林 朱建飞 徐超 庄义庆


摘要: 選择6-磷酸海藻糖(T6P)和海藻糖(Tre)在超高效液相色谱UPLC分离中的最佳色谱柱。对T6P和Tre在C 18 柱、Kinetex Hilic柱、T3柱、LunaNH2柱、Cogent diamond Hydride 柱和BEH Amide 柱6种色谱柱中的色谱行为进行对比研究。结果表明,T6P和Tre在LunaNH2柱和T3柱中分离效果较好,分别建立LunaNH2柱和T3柱的UPLC-MS/MS检测方法,其检出限分别为 1.25~ 5.10 μg/L 和 12.75~ 15.62 μg/L ,定量限分别为 3.75~ 15.60 μg/L 和 38.25~ 52.03 μg/L ,回收率分别为 71.5%~ 85.7%和 82.8%~ 95.6%,相对标准差分别为 3.8%~ 8.5%和 2.7%~ 3.3%,LunaNH2柱的灵敏度高,T3色谱柱的回收率高、稳定性好。2种色谱柱均满足禾谷镰刀菌中T6P和Tre同时检测的要求。
关键词: 超高效液相色谱-串联质谱; 禾谷镰刀菌; 6-磷酸海藻糖; 海藻糖; 色谱柱
中图分类号: O657.63 文献标识码: A 文章编号: 1000-4440(2021)05-1299-06
Selection of chromatographic column for trehalose-6-phosphate and trehalose detection in Fusarium graminearum by UPLC-MS/MS
WU Qin-yan 1 , LIANG Hong-fang 1 , ZHANG Wen-wen 2 , WEN Xiao-lin 1 , ZHU Jian-fei 1 , XU Chao 1 , ZHUANG Yi-qing 1,3
(1.Central Laboratory of Zhenjiang Institute of Agricultural Sciences in Hill Area of Jiangsu Province, Jurong 212009,China; 2.Zhenjiang Agricultural and Rural Bureau, Zhenjiang 212400, China; 3.Central laboratory of Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: The best chromatographic column of trehalose-6-phosphate (T6P) and trehalose (Tre) in ultra-high performonce liquid chromatography(UPLC) separation was selected. The chromatographic behaviors of T6P and Tre in six kinds of chromatographic columns (C 18 column, Kinetex HILIC column, T3 column, LunaNH2 column, Cogent diamond hydride column and BEH Amide column) were compared. The results showed that Amino column and T3 column were suitable for the detection of T6P and Tre according to the chromatographic retention effect. UPLC-MS/MS methods for T6P and Tre in Fusarium graminearum were established based on LunaNH2 column and T3 column, respectively. The detection limits of LunaNH2 column and T3 column were 1.25-5.10 μg/L and 12.75- 15.62 μg/L , the limits of quantification were 3.75-15.60 μg/L and 38.25-52.03 μg/L , the recoveries were 71.5%-85.7% and 82.8%-95.6%, the relative standard deviations( RSD ) were 3.8%-8.5% and 2.7%-3.3%, respectively. The method established by LunaNH2 column has high sensitivity, and the method established by T3 column has high recovery rate and good stability. LunaNH2 column and T3 column can be used for the simultaneous detection of T6P and Tre in Fusarium graminearum.
Key words: ultra-high performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS); Fusarium graminearum ; trehalose-6-phosphate; trehalose; chromatographic column
禾谷镰刀菌( Fusarium graminearum )是小麦、玉米等农作物中最常见的病原菌 [1-5] ,该菌致病,不仅导致农作物产量下降,同时产生呕吐毒素,严重影响农产品的品质和安全性 [6-8] 。海藻糖(Trehalose,Tre)的生物合成途径对真菌的致病力有至关重要的作用,据报道,禾谷镰刀菌中敲除海藻糖合成途径的相关基因,禾谷镰刀菌将丧失海藻糖合成能力,继而无法产生孢子,呕吐毒素合成能力下降86% [9-10] 。6-磷酸海藻糖(Trehalose-6-phosphate,T6P)是Tre生物合成的中间体,是植物和真菌中必不可少的信号代谢物 [11-14] ,对禾谷镰刀菌中T6P和Tre进行定量检测,可以为禾谷镰刀菌生长和海藻糖合成途径研究提供支撑。
Tre属于糖类化合物,有较为成熟的检测方法。T6P属于酸性强糖,在微生物中含量极低,目前主要采用气质联用(GC-MS) [10] 和液质联用(LC-MS) [15-16] 2种方法检测,GC-MS需要衍生反应,前处理复杂,检测时间长,LC-MS检测时间短,样品前处理简单,但主要采用单级杆质谱扫描,母离子定性和定量检测,假阳性概率较大 [17] 。另外,由于T6P具有强酸性质,为强极性难保留和难分离的化合物,需采用亲水模式分离,对色谱柱要求较高,据报道Dionex IonPac AS11-HC column (250.0 mm× 2.0 mm,9.0 μm) [16] 、SIELC Primesep SB column (4.6 mm× 150.0 mm,5.0 μm) [17] 、Waters Acquity BEH amide column (3.0 mm× 100.0 mm,1.7 μm) [15] 、 ZIC-HILIC HPLC column (2.1 mm× 150.0 mm,3.5 μm) [18] 和AQUITY UPLC BEH C18 (2.1 mm× 50.0 mm,1.7 μm) [19] 均可用于检测磷酸糖,除Waters Acquity BEH amide column可以达到较大的分离度,具有较好的分离效果,其他色谱柱均不同程度存在分离度低、色谱响应值低、色谱峰拖尾、色谱柱使用寿命短等问题。本研究根据T6P的强极性亲水性质,重新对色谱柱进行筛查,选择合适的色谱柱,并建立同时检测禾谷镰刀菌中的T6P和Tre的UPLC-MS/MS方法。
1 材料和方法
1.1 仪器与试剂
Agilent 1290 型UPLC系统,ABsciex 4500质谱检测器,电子天平(XP105DR 型,赛多利斯科学仪器有限公司产品),AWL-020I-P型超纯水系统(艾科浦仪器有限公司产品),KQ-250E 型超声波清洗器(昆山禾创超声仪器有限公司产品),H2050R型医用离心机(湖南湘仪实验室仪器开发有限公司产品),DW-86L828J型超低温冰箱(海尔生物医疗股份有限公司产品),涡旋混匀器(江苏海门其林贝尔仪器有限公司产品)。
甲醇和乙腈(色谱纯,美国默克公司产品),乙酸铵( 纯度≥ 98%,德国CNW 公司产品)。T6P和Tre购自sigma-aldrich贸易有限公司,质谱用水为屈臣氏蒸馏水。
1.2 分析条件
色谱柱: Agilent C18色谱柱 (50.0 mm× 2.1 mm,1.7 μm)、Phenomenex,Kinetex Hilic 色譜柱 (100.0 mm× 2.1 mm,1.7 μm)、Waters Acquity UPLC HSS T3 Column (100.0 mm× 3.0 mm,1.7 μm)、Phenomenex lunaNH2 100(100.0 mm× 2.0 mm,3.0 μm)、Cogent diamond Hydride 色谱柱 (150.0 mm× 2.1 mm,2.2 μm )和ACQUITY UPLC BEH Amide (2.1 mm× 100.0 mm,1.7 μm),柱温40 ℃,进样体积1 μl,流动相、洗脱梯度和流速根据色谱柱特性确定。
离子源:电喷雾离子源;扫描方式:负离子切换扫描;检测方式:质谱多反应监测(MRM);气帘气压力:40 kPa;电喷雾电压: -4 500 kPa ;离子源温度:550 ℃;雾化气压力:65 kPa;加热辅助气压力:65 kPa;驻留时间: 40 ms。其他优化的质谱条件见表1。
1.3 样品制备
将供试PH-1禾谷镰刀菌(由江苏省农业科学院食品质量安全检测研究所提供)置于绿豆汤液体培养基中,在28 ℃、140 r/min 条件下培养7 d,过滤去除菌丝后,离心浓缩成为1 ml 1× 10 5 个的孢子液备用。将孢子液接种于马铃薯液体培养基中,每瓶接种1 ml,28 ℃、140 r/min 震荡培养7 d后,过滤取菌丝,采用去离子水清洗3次后,烘干, -20 ℃ 储存待测。
准确称取菌丝样品0.04 g于15 ml离心管中,加入4 ml去离子水,浸泡1 h后,采用高速匀浆机(上海沪析实业有限公司产品)匀浆,加入4 ml甲醇后, -80 ℃ 冷冻,用超声波清洗机(南京先欧仪器制造有限公司产品)超声解冻破壁30 min,离心,取上清液,待测。
1.4 测定指标
1.4.1 线性范围 Waters Acquity UPLC HSS T3色谱柱检测时,T6P的质量浓度为31.25 μg/L 、62.50 μg/L 、125.00 μg/L 、250.00 μg/L 、500.00 μg/L 、 1 000.00 μg/L ,Tre的质量浓度为3.9 μg/L 、7.8 μg/L 、15.6 μg/L 、31.3 μg/L 、62.5 μg/L 、125.0 μg/L 、250.0 μg/L ;Phenomenex lunaNH2柱检测时,T6P和Tre的质量浓度均为3.9 μg/L 、7.8 μg/L 、15.6 μg/L 、31.3 μg/L 、62.5 μg/L 、125.0 μg/L 、250.0 μg/L ,按照优化后的色谱条件,对每个点重复测定3次。以质量浓度为横坐标,以峰面积为纵坐标,绘制标准曲线,以标准曲线的第一个和最后一个点的质量浓度作为线性范围。
1.4.2 检出限与定量限 考虑仪器的背景噪音,采用基线噪音分析方法,取标准曲线最低质量浓度试样测出的信号与噪声信号进行比较,将信噪比 3∶ 1时相应的质量浓度确定为检出限,将信噪比 10∶ 1时相应的质量浓度确定为定量限 [20] 。
1.4.3 准确度与精密度 分别在试样中加入T6P和Tre的标准工作液,在重复性测定条件下对每个添加质量浓度测定6次,计算回收率和相对标准偏差( RSD )。回收 率=( 实际浓 度- 试样原始浓 度)/ 标样浓 度× 100%。
2 结果与分析
2.1 T6P色谱柱的筛选
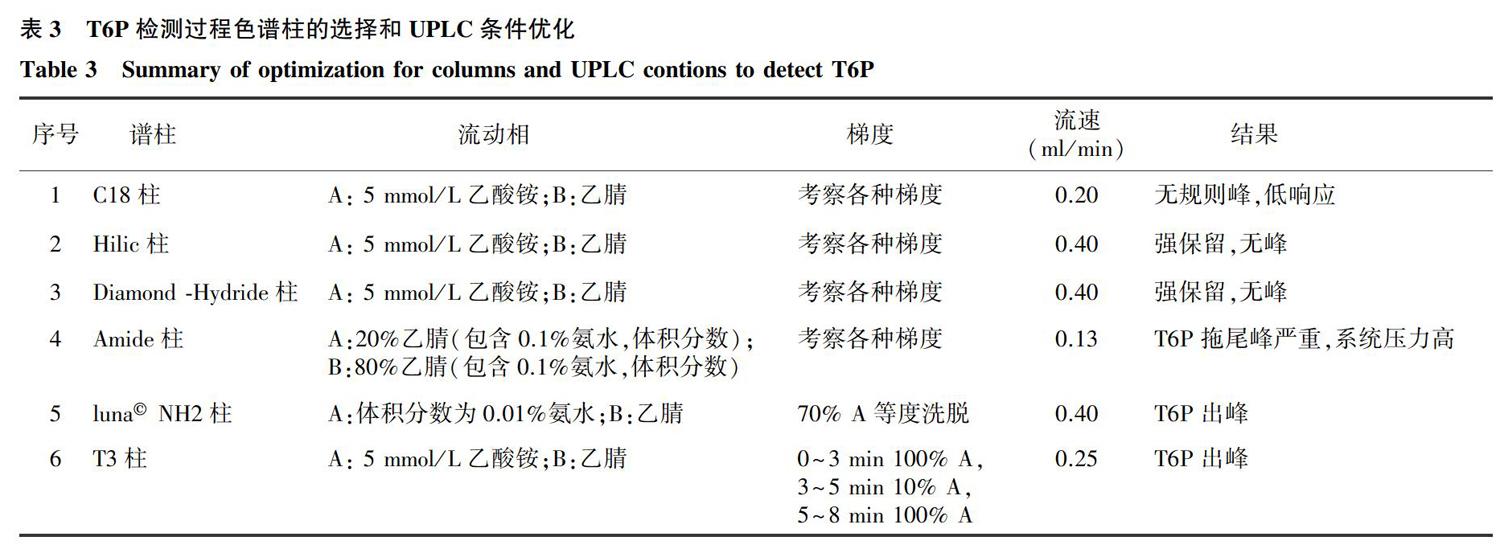
T6P具有亲水性,为强酸性糖,极性较强。色谱柱需同时适合检测糖类和强极性物质。未经过衍生分离糖类的常用色谱柱有氨基柱和酰胺柱,这些类型的色谱柱稳定性、寿命以及分离重现性等方面性能均不佳 [21-22] ;Phenomenex,Kinetex Hilic柱采用强极性材料作为固定相,能对极性物质产生氢键、静电作用,表现出较强的保留特性,适合极性和亲水化合物的检测 [23] ;Cogent diamond Hydride 亲水柱适合糖类、有机酸等高级化合物,是MicroSolv公司推荐的专用磷酸糖分离色谱柱。Agilent C18柱为疏水反向色谱柱,极性较强的样品保留较弱,但蒋卫杰等 [19] 利用C18柱实现了T6P的色谱分离;Waters Acquity UPLC HSS T3色谱柱采用三官能团键合和封端技术,可以耐受100%水相,对极性化合物有良好的保留。本研究考虑到T6P的亲水性质,并参考文献 [15]~[19] ,筛选出如表2所示的6种不同类型的色谱柱进行T6P的测定。
根据表2中色谱柱不同的分离机理,选择适合T6P分离的色谱柱的流動相和检测条件,比较T6P在6种色谱柱上的保留情况,如表3所示,采用Hilic柱和Diamond -Hydride柱时,T6P未出峰,说明磷酸糖极性太强,在Hilic和Diamond -Hydride色谱柱上出现强保留,这2种色谱柱不适合T6P的检测。 Amide柱检测柱压大,T6P的色谱峰严重拖尾,色谱柱使用200个样品后,T6P出现强保留,该色谱柱无法继续用于检测T6P,磷酸基团对Amide柱损耗较大。C18柱的T6P保留较弱,T6P在2 min左右无规则流出,与检测原理相符,疏水反向色谱柱不适合极性物质分离。LunaNH2柱和T3柱,T6P的保留效果较好,50 μg/L 的T6P通过LunaNH2柱检测响应强度约为 3.5× 10 4 cps,而1 000 μg/L 的T6P利用T3柱检测时响应值只有 1× 10 4 cps,T6P利用T3色谱柱检测响应强度远低于LunaNH2柱(图1);Tre利用LunaNH2柱和T3柱这2种色谱柱检测时,响应值无显著差异(图2)。
2.2 色谱质谱中流动相的优化
质谱检测过程中水相含量高,不利于液滴雾化和脱溶剂化,通常需要降低流速,增加脱溶剂化气流和温度,来获得较好的离子化效率。本研究中,在脱溶剂化气流和温度较高的情况下,T3柱采用了100%的水相影响了T6P的离子化效率,是其检测响应强度远低于LunaNH2柱的主要原因,降低流速使T6P色谱峰拖尾严重,因此考虑在流动相中添加氨水,可以适当的增强离子化效率。本研究使用0.01%氨水为水相,发现T6P的响应提高了10倍 (图3),但是其响应值仍远低于LunaNH2柱。T3色谱柱的pH适应范围为 2~ 8,水相中加入0.01%氨水后,pH值接近8,靠近T3柱的极限值,但其使用寿命仍远长于LunaNH2柱。LunaNH2柱的氨基容易流失,造成柱效下降, 1根色谱柱检测磷酸糖平均寿命为 200~ 300个样品,T3柱使用寿命长,响应值较低,因此需综合考虑检测成本、样品中T6P的含量,选择合适的色谱柱进行测定。
2.3 线性范围与检出限
如表4所示,T6P和Tre通过LunaNH2柱时,在 4.25~ 250.00 μg/L 的线性范围内呈现良好的线性关系,通过T3柱时在 31.25~ 1 000.00 μg/L 的范围内呈现良好的线性关系;另外,通过LunaNH2柱的检出限为 1.25~ 5.10 μg/L ,远低于T3柱( 12.75~ 15.63 μg/L );LunaNH2柱的定量限为 3.75~ 15.60 μg/L ,也低于T3柱( 38.25~ 52.03 μg/L ),LunaNH2柱的灵敏度高于T3柱,2种色谱柱的决定系数均在0.99以上,均符合实际分析的要求。
2.4 回收率和精密度
準确称取禾谷镰刀菌40 mg,添加一定质量浓度的标准品溶液后,每个质量浓度4次重复,计算该方法的回收率和相对标准差,结果 (表5) 表明,利用LunaNH2和T3 2种色谱柱,在3个加标水平下,T6P的回收率分别为 71.5%~ 85.7%和 83.7%~ 95.6%,相对标准差为 3.8%~ 6.2%和 2.7%~ 3.3%;Tre的回收率分别为 72.4%~ 82.3%和 82.8%~ 84.8%,相对标准差为 4.5%~ 8.5%和 2.8%~ 3.2%;与LunaNH2柱相比, T3柱的回收率高,相对标准差低,说明T3柱的稳定性优于LunaNH2柱。利用LunaNH2和T3 2种色谱柱检测出禾谷镰刀菌pH-1中T6P含量分别为52.6 μg/g 和60.5 μg/g ,Tre含量为4.4 mg/g 和5.4 mg/g ,2种色谱柱检测禾谷镰刀菌pH-1中T6P和Tre含量无显著差异,均可用于检测禾谷镰刀菌pH-1中T6P和Tre含量。
3 结 论
本研究根据T6P的亲水性和强极性特点,对6种不同类型色谱柱进行筛查,确定了Luna NH2柱和T3柱同时适合T6P和Tre 2种化合物UPLC-MS/MS检测,分别建立利用2种色谱柱同时检测禾谷镰刀菌中T6P和Tre的方法,发现Luna NH2柱的灵敏度高,T3柱的回收率高、稳定性好。利用2种色谱柱检测出禾谷镰刀菌pH-1中T6P含量分别为52.6 μg/g 和60.5 μg/g ,Tre含量分别为4.4 mg/g 和5.4 mg/g ,均差异不显著。该方法也可以被借鉴于其他真菌的相关研究和应用中。
致谢: 感谢江苏省农业科学院中心实验室杨丹主任对样品检测提供的帮助!
参考文献:
[1] 蔡静平,刘新影,翟焕趁. 禾谷镰刀菌DON毒素生物合成调控研究进展[J]. 河南工业大学学报(自然科学版), 2016, 37(1):114-119.
[2] 程 亮,管军军,常晓娇. 隐蔽型脱氧雪腐镰刀菌烯醇的研究进展[J].粮油食品科技, 2012, 20(6):61-64.
[3] 张 升,张 伟,王 丽,等. 氨基酸态氮对禾谷镰刀菌生长及DON毒素产生的影响[J].江苏农业学报,2020,36(6):1403-1410.
[4] 曹 坤,管 明,陈 康,等. 一株拮抗禾谷镰刀菌和降解呕吐毒素解淀粉芽孢杆菌的筛选及在饲料贮存中的应用[J]. 江苏农业科学,2019,47 (8):179-183,190.
[5] 王芝涵,王春伟,高海馨,等. 引起玉米穗腐病的禾谷镰刀菌LAMP快速检测方法的建立[J]. 江苏农业学报,2019,35(3): 581-585.
[6] 封 薇,刘太国,张 敏,等. 脱氧雪腐镰刀菌烯醇(DON)在小麦籽粒中的积累分析[J]. 植物病理学报, 2012, 42(1):25-31.
[7] 李瑞园,刘红河,康 莉. HPLC-MS/MS法同时测定粮食中脱氧雪腐镰刀菌烯醇及其衍生物[J]. 分析测试学报, 2014(6):660-665.
[8] CUI L, SELVARAJ J N, XING F, et al. A minor survey of deoxynivalenol in Fusarium infected wheat from Yangtze-Huaihe river basin region in China[J]. Food Control, 2013, 30(2):469-473.
[9] 宋修仕. 禾谷镰刀菌细胞壁形成相关基因及其 RNAi 片段功能鉴定[D].南京:南京农业大学,2015.
[10] SONG X S, LI H P, ZHANG J B, et al. Trehalose 6-phosphate phosphatase is required for development, virulence and mycotoxin biosynthesis apart from trehalose biosynthesis in Fusarium graminearum[J]. Fungal Genetics & Biology, 2014, 63:24-41.
[11] PAUL M J, PRIMAVESI L F,DEVERAJ J, et al. Trehalose metabolism and signaling[J]. Annual Review of Plant Biology,2008, 59(1):417-441.
[12] 张 雯,王宇斐,郭延平. 高等植物6-磷酸海藻糖信号调控研究进展[J]. 植物生理学报, 2016, 52 (4):394-400.
[13] 陈素丽,彭 瑜,周 华,等. 植物海藻糖代谢及海藻糖-6-磷酸信号研究进展[J]. 植物生理学报, 2014, 50(3):233-242.
[14] SHAN S, MIN H, LIU T, et al. Structural insight into dephosphorylation by trehalose 6-phosphate phosphatase (OtsB2) from Mycobacterium tuberculosis[J]. The FASEB Journal, 2016, 30(12):3989.
[15] TORANO J S, DELATTE T L, SCHLUEPMANN H , et al. Determination of trehalose-6-phosphate in Arabidopsis thalianaseedlings by hydrophilic-interaction liquid chromatography-mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2012, 403(5):1353-1360.
[16] DELATTE T L, SCHLUEPMANN M H J, SOMSEN G W, et al. Determination of trehalose-6-phosphate in Arabidopsis thalianaseedlings by anion exchange chromatography–mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2009 (389):12-17.
[17] GRIFFTHS C A, SAGAR R, GENG Y, et al. Chemical intervention in plant sugar signalling increases yield and resilience[J]. Nature, 2016, 540(7634):574-578.
[18] MATA A T, JORGE T F, FERREIRA J, et al. Analysis of low abundant trehalose-6-phosphate and related metabolites in Medicago truncatula by hydrophilic interaction liquid chromatography-triple quadrupole mass spectrometry[J]. Journal of Chromatography A, 2016, 1477:30-38.
[19] 蔣卫杰,李 强,余宏军. 番茄中海藻糖-6-磷酸含量的超高效液相色谱串联质谱检测方法:CN109900833A [P]. 2019-06-18.
[20] 中国质检总局和中国国家标准委员会.合格评定化学分析方法确认和验证指南:GB/T 27417-2017 [S]. 北京:中国标准出版社,2017.
[21] 李亚丽,逄世峰,王玉方,等. 单糖及寡糖定量分析方法综述[J]. 食品工业科技,2016,37(14):363-367.
[22] 尹大芳,孙晓杰,郭莹莹,等. 单糖定性定量的色谱分析方法的研究进展[J]. 食品工业科技, 2020, 41(24):321-329.
[23] 解 楠,黄雨晴,郑国建.亲水作用色谱法测定食品中5种糖[J].理化检验(化学分册), 2020, 56(12):1303-1306.
(责任编辑:陈海霞)
