干扰lncRNA SBF2-AS1通过靶向调控miR-582-5p表达抑制乳腺癌MCF-7细胞的增殖、迁移和侵袭*
2021-11-13张平弟吴永丰
张平弟,宣 佶,吴永丰
(1.东南大学附属中大医院江北院区,南京 210000;2.南京中医药大学,南京 210000)
乳腺癌是女性肿瘤中死亡率较高的恶性肿瘤,随着分子生物学和基因组学的发展以及精准医学的出现,分子靶向药物治疗成为乳腺癌的一种新型治疗方法[1]。靶向治疗的关键之一在于潜在治疗靶点的筛选,研究发现,非编码RNA(ncRNA)与乳腺癌的发生发展密切相关,可作为乳腺癌的潜在治疗靶点[2]。长链非编码核糖核酸(long non-coding Ribonucleic Acid,lncRNA)和微小RNA(microRNA,miRNA)均属于非编码RNA,与乳腺癌的发生发展、转移和预后相关,且lncRNAs 可与miRNA、信使RNA(messenger RNA,mRNA)或蛋白相互作用来调节相关基因的表达,从而影响乳腺癌的进展[3]。SBF2 反 义RNA1(SBF2 antisense RNA 1,SBF2-AS1)是一种新的lncRNA,SET结合因子2(set binding factor 2,SBF2)的反义RNA1,干扰SBF2-AS1可抑制宫颈癌细胞的增殖[4]。远处转移和复发是乳腺癌患者死亡的重要原因之一,而miRNA的异常表达与乳腺癌的转移及血管形成等密切相关[5]。生物学软件预测发现,SBF2-AS1 与miR-582-5p 有结合位点。研究报道,miR-582-5p可抑制骨肉瘤细胞的生长和侵袭[6],但miR-582-5p 对乳腺癌细胞的影响尚不清楚。本研究旨在研究lncRNA SBF2-AS1 对乳腺癌细胞恶性生物学行为的影响及其机制,现将结果报道如下。
1 材料与方法
1.1 材料 乳腺癌细胞MCF-7、SK-BR-3、MDAMB-231和正常乳腺细胞MCF10A购自中国科学院上海细胞库;RPMI-1640 培养基购自美国Gibco 公司;Trizol 试剂、荧光定量试剂盒购自日本TaKaRa公司;双荧光素酶报告基因检测试剂盒购自武汉纯度生物科技有限公司;Transwell 小室、基质胶购于美国BD 公司;MTT 试剂盒、RIPA 蛋白裂解液购自上海碧云天生物技术有限公司。
1.2 细胞培养与分组 乳腺癌细胞MCF-7、SKBR-3、MDA-MB-231 和正常乳腺细胞MCF10A 用RPMI-1640 培养基常规培养;取对数生长期乳腺癌细胞MCF-7,分别将miR-582-5p模拟物及阴性对照(NC)、SBF2-AS1 干扰表达载体(siRNA)及阴性对照转染至MCF-7细胞,记为miR-582-5p组、miR-NC组、si-SBF2-AS1 组、si-NC 组;将SBF2-AS1 干扰表达载体分别与miR-582-5p 抑制剂及阴性对照共转染至MCF-7 细胞,记为si-SBF2-AS1+miR-582-5p组、si-SBF2-AS1+anti-miR-NC组。
1.3 实时荧光定量PCR(qPCR)检测miR-582-5p和SBF2-AS1 表达水平 收集各组细胞,提取其总RNA,反转录成cDNA 后按试剂盒使用说明配制反应体系,进行PCR扩增,相对表达量采用2-△△Ct法计算。
1.4 Western blotting 检测蛋白的表达 提取各组细胞总蛋白,定量后进行SDS-PAGE,转膜、封闭液封闭,分别加入一抗(1∶1 000)4 ℃冰箱孵育过夜;加入二抗(1∶2 000)室温孵育2 h,曝光显影,定影,分析蛋白条带吸光度。
1.5 MTT检测细胞增殖 各组细胞分别培养24 h、48 h、72 h,加入MTT 溶液,孵育4 h,加入二甲基亚砜,反应10 min,酶标仪检测490 nm处吸光度(OD)值。
1.6 Transwell 检测细胞迁移和侵袭 各组MCF-7细胞消化后用无血清培养液饥饿12 h;迁移实验:取200 μL MCF-7细胞悬液于Transwell上室,常规培养24 h后用0.1%结晶紫染色液染色10 min,显微镜下随机选取5 个视野拍照并计数。侵袭实验:Transwell上室加入基质胶,其余同迁移实验。
1.7 双荧光素酶报告基因实验 构建含有miR-582-5p结合位点的SBF2-AS1野生型和突变型荧光素酶表达载体,将其分别与miR-NC 或miR-582-5p共转染至MCF-7细胞,按试剂盒说明检测细胞荧光素酶活性。
将si-NC、si-SBF2-AS1、pcDNA、pcDNA-SBF2-AS1 分别转染至MCF-7,用qPCR 检测miR-582-5p表达水平。
1.8 统计学方法 采用SPSS 20.00 统计软件对数据进行统计分析。计量资料以均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 lncRNA SBF2-AS1 和miR-582-5p 在乳腺癌细胞和正常乳腺细胞中的表达 与正常乳腺细胞MCF10A相比,乳腺癌细胞MCF-7、SK-BR-3、MDAMB-231 中SBF2-AS1 的表达水平显著升高(均P<0.05);而miR-582-5p的表达水平显著下降(P<0.05),见图1。
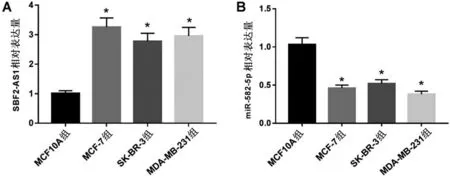
图1 SBF2-AS1和miR-582-5p在乳腺癌细胞和正常乳腺细胞中的表达
2.2 干扰SBF2-AS1 表达对MCF-7 细胞活性的影响 与si-NC组相比,si-SBF2-AS1组MCF-7细胞中SBF2-AS1 的表达水平显著降低(P<0.05),Cyclin D1表达水平显著降低,p21、p27的表达水平显著升高,MCF-7细胞活性显著降低(P<0.05),见图2、表1。

图2 干扰SBF2-AS1表达对MCF-7细胞活性的影响
表1 干扰SBF2-AS1表达对MCF-7细胞活性的影响,n=9
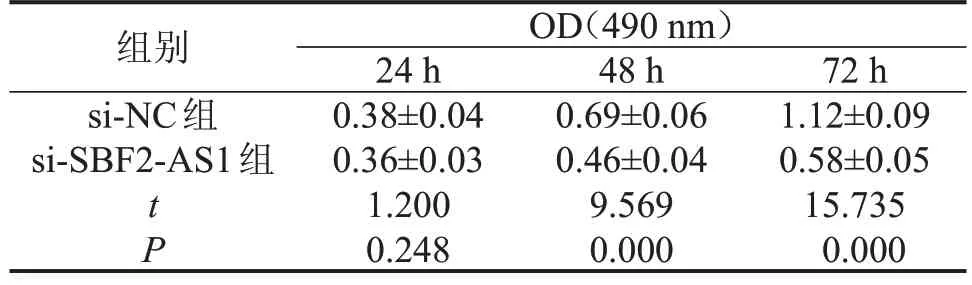
表1 干扰SBF2-AS1表达对MCF-7细胞活性的影响,n=9
2.3 干扰SBF2-AS1表达对MCF-7细胞迁移、侵袭数目的影响 与si-NC组相比,si-SBF2-AS1组MCF-7细胞中MMP-2、MMP-9、MMP-14 蛋白的表达水平显著降低,MCF-7细胞中迁移和侵袭数量显著降低(均P<0.05),见表2,图3。
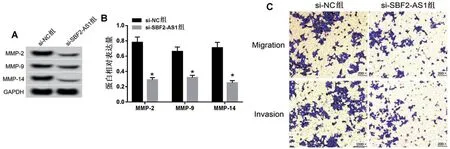
图3 干扰SBF2-AS1表达对MCF-7细胞迁移、侵袭数目的影响
表2 干扰SBF2-AS1 表达对MCF-7 细胞迁移、侵袭数目的影响,n=9
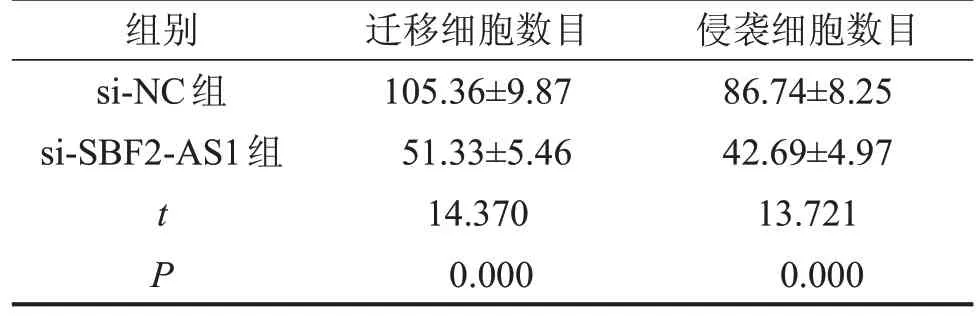
表2 干扰SBF2-AS1 表达对MCF-7 细胞迁移、侵袭数目的影响,n=9
2.4 miR-582-5p 过表达对MCF-7 细胞增殖、迁移和侵袭的影响 与miR-NC 组相比,miR-582-5p 组Cyclin D1、MMP-2、MMP-9蛋白的表达水平显著降低,p21的表达水平显著升高,MCF-7细胞活性显著降低,MCF-7 细胞中迁移和侵袭数量显著降低(均P<0.05),见图4,表3。
表3 miR-582-5p过表达对MCF-7细胞活性、迁移和侵袭的影响,n=9

表3 miR-582-5p过表达对MCF-7细胞活性、迁移和侵袭的影响,n=9
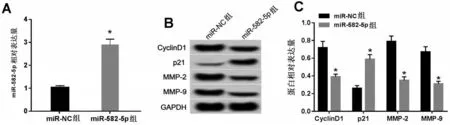
图4 miR-582-5p过表达对miR-582-5p及相关蛋白表达的影响
2.5 lncRNA SBF2-AS1 靶向调控miR-582-5p 的表达 TargetScan 预测显示,SBF2-AS1 与miR-582-5p有结合位点,见图5。WT-SBF2-AS1 与miR-582-5p共转染后MCF-7 细胞荧光素酶活性显著降低(P<0.05),见表4。pcDNA-SBF2-AS1 组miR-582-5p 的表达水平显著低于pcDNA 组(P<0.05);si-SBF2-AS1 组miR-582-5p 的表达水平显著高于si-NC 组(均P<0.05),见图6。
表4 miR-582-5p 与WT-SBF2-AS1 或MUT-SBF2-AS1 共 转染后的细胞荧光素酶活性,n=9

表4 miR-582-5p 与WT-SBF2-AS1 或MUT-SBF2-AS1 共 转染后的细胞荧光素酶活性,n=9

图5 SBF2-AS1的序列中含有与miR-582-5p互补的核苷酸序列

图6 过表达或干扰SBF2-AS1后miR-582-5p的表达
2.6 抑制miR-582-5p 表达逆转了干扰SBF2-AS1表达对MCF-7细胞增殖、迁移和侵袭的作用 与si-SBF2-AS1+anti-miR-NC组相比,si-SBF2-AS1+antimiR-582-5p组Cyclin D1、MMP-2、MMP-9蛋白的表达水平显著升高,p21的表达水平显著降低,MCF-7细胞活性显著升高,MCF-7细胞迁移和侵袭数量显著升高(均P<0.05),见图7、表5。
表5 抑制miR-582-5p表达逆转了干扰SBF2-AS1表达对MCF-7细胞增殖、迁移和侵袭的作用,n=9
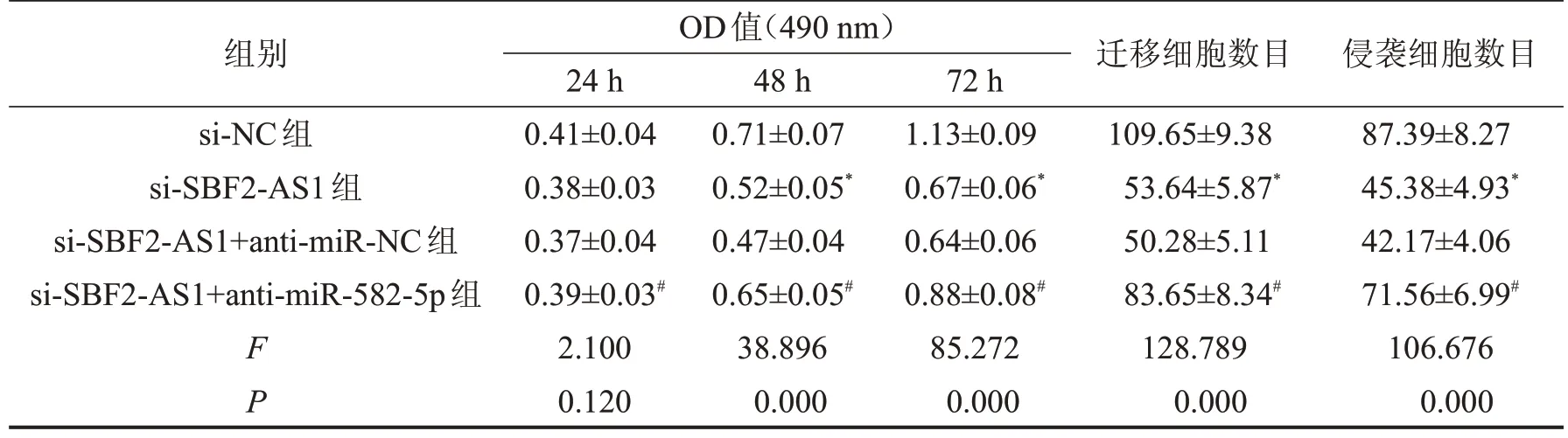
表5 抑制miR-582-5p表达逆转了干扰SBF2-AS1表达对MCF-7细胞增殖、迁移和侵袭的作用,n=9
与si-NC组比较,*P<0.05;与si-SBF2-AS1+anti-miR-NC组比较,#P<0.05。
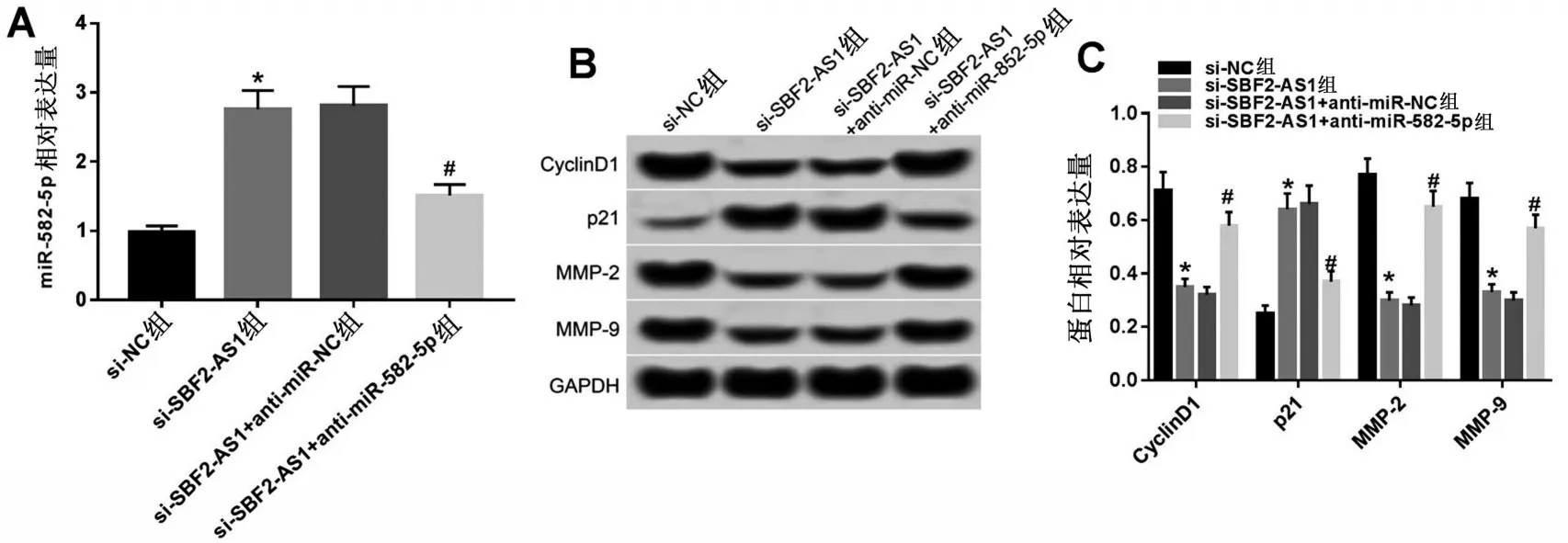
图7 抑制miR-582-5p表达逆转了干扰SBF2-AS1表达对MCF-7细胞增殖、迁移和侵袭相关蛋白表达的作用
3 讨论
癌细胞从原发肿瘤扩散并扩散到身体的远处部位是转移性癌症患者死亡的主要原因,研究乳腺癌的分子机制,以期为进一步研发有效的靶向治疗药物奠定基础[7]。研究发现,lncRNA 和miRNA 均参与调控乳腺癌的进展,可作为其治疗的靶点[8-9]。研究报道,沉默SBF2-AS1 可抑制食管鳞状细胞癌细胞的增殖和侵袭[10]。SBF2-AS1 在肝细胞癌组织中显著上调表达,敲除SBF2-AS1 通过调节miR-140-5p/TGFBR1 抑制肝癌细胞增殖、迁移和侵袭[11]。下调SBF2-AS1 表达抑制非小细胞肺癌细胞的增殖和转移[12]。以上研究表明,SBF2-AS1在多种肿瘤中起促癌作用,下调SBF2-AS1 具有抑制肿瘤进展的作用。而SBF2-AS1在乳腺癌中的作用及其对乳腺癌细胞的影响尚不清楚。本实验先检测了不同乳腺癌细胞系中SBF2-AS1 的表达水平,结果发现,SBF2-AS1在乳腺癌细胞系中均高表达,且在MCF-7细胞中表达水平最高,故后续实验均采用此细胞(P<0.05)。本实验进一步干扰SBF2-AS1 表达后,MCF-7 细胞活性显著降低,MCF-7 细胞中迁移和侵袭数量显著降低(均P<0.05),说明干扰SBF2-AS1 表达可抑制乳腺癌细胞MCF-7 增殖、迁移和侵袭。提示SBF2-AS1在乳腺癌中也起促癌作用,下调其表达可抑制乳腺癌的进展。
研究发现,miR-582-5p 参与多种癌症的进展,如上调miR-582-5p抑制膀胱癌细胞增殖、侵袭和迁移及促进细胞凋亡[13];过表达miR-582-5p 通过下调NOTCH1 抑制非小细胞肺癌细胞的生长和侵袭[14]。此外,miR-582-5p在子宫内膜癌、胃癌中低表达,上调miR-582-5p表达通过靶向AKT3来抑制人子宫内膜癌、胃癌细胞的增殖,促进细胞凋亡[15-16]。miR-582-5p 还通过靶向Rab27a 抑制人结肠直肠癌细胞增殖、细胞周期进展和侵袭[17]。以上研究表明,miR-582-5p在多种肿瘤中起抑癌作用,可抑制多种肿瘤细胞的恶性生物学行为。本实验检测了不同乳腺癌细胞系中miR-582-5p 的表达水平,结果发现,miR-582-5p在乳腺癌细胞系中同样低表达,且过表达miR-582-5p后,MCF-7细胞活性显著降低,MCF-7细胞迁移和侵袭数量显著降低(均P<0.05),说明过表达miR-582-5p可抑制乳腺癌MCF-7细胞增殖、迁移和侵袭。提示miR-582-5p 在乳腺癌中发挥抑癌基因作用,与在其他癌症中的作用相似。此外,本实验还发现,SBF2-AS1 可靶向调控miR-582-5p的表达,而抑制miR-582-5p 表达可部分逆转干扰SBF2-AS1 表达对乳腺癌MCF-7 细胞增殖、迁移和侵袭的抑制作用(均P<0.05)。以上结果提示,SBF2-AS1可能通过调控miR-582-5p影响乳腺癌进展。
综上所述,干扰lncRNA SBF2-AS1可通过调控miR-582-5 抑制乳腺癌MCF-7 细胞的增殖、迁移和侵袭。
