高粱GRAS基因家族全基因组鉴定及其对烯效唑的响应
2021-11-10杨溥原梁红凯殷丛培崔江慧常金华
杨溥原,梁红凯,殷丛培,崔江慧,常金华
(河北农业大学 农学院, 河北 保定 071001)
高粱(Sorghum bicolorL.)是我国五大粮食作物之一,广泛应用于酿造、畜牧、制糖等多个产业。随着农业结构调整,高粱地位愈发重要。近年来复杂多变的气候条件,对高粱产量和品质造成较大影响[1]。有研究表明烯效唑通过调节植株内源激素平衡,使植物的生理特性、形态指标产生变化,从而达到调节植株生长和改善植株生理特性,减轻植株在逆境胁迫下受损害的目的[2]。GRAS转录因子是植物生长发育中不可或缺的一类蛋白,利用生物信息学技术对高粱GRAS家族基因进行分析,旨在探索高粱GRAS基因功能,并挖掘与激素调节相关的GRAS基因,探索其在植物生长调控中的作用。GRAS转录因子最先鉴定出的3个家族成员分别是 Gibberellic acid insensitive(GAI),Repressor of GA1(RGA)和 Scarecrow(SCR)[3],从而定义了GRAS转录因子。一般来说,GRAS蛋白C末端含有多个高度保守的基序,即为GRAS结构域,而特异性主要表现在可变的N末端,不同的N端基序可使该类蛋白与不同靶蛋白结合,即增加了基因功能的多样性[4-5]。自2004年第一个GRAS家族鉴定以来[6],玉米(Zea maysL.)、小麦(Triticum aestivumL.)、大豆(Glycine maxL.)以及棉花(Gossypium hirsutumL.)等约300种作物中分别鉴定出GRAS蛋白[7-10]。不同物种之间,GRAS亚族分类不同,如早期拟南芥(Arabidopsis thaliana)、水稻和玉米的GRAS蛋白可根据结构差异分为8个亚家族[4],即DELLA、SCR、LS、PAT1、HAM、SCL3、SHR和LISCL亚家族,后来随着基因组学研究的深入,GRAS家族又被分为10~16个亚族[11-12]。不同的亚族参与的生理生化反应各不相同,如DELLA是赤霉素(GA)信号通路的负调控因子,当接收到细胞外GA信号时会在细胞核降解,并传递出GA正常的信号维持植株正常发育,DELLA突变体则表现为因GA不敏感性导致植株矮小[13];SCL3位于GA信号转导通路下游,对GA其正向调节作用,维持植物体内赤霉素平衡,与DELLA蛋白互为拮抗作用[14];LS和HAM蛋白被证实在多个物种中参与分生组织形成;SCR与SHR蛋白可正向调控根系生长,但当SCR与SHR蛋白正常代谢时,叶片生长受到抑制[15];PATI光信号转导通路中重要的一环,拟南芥AtPAT1被证实对光敏色素A信号传导起正向调节作用[16];LISCL亚族在植物响应逆境胁迫时发挥重要作用且会参加生长素反应中不定根形成的过程[17]。因此,GRAS蛋白可以广泛参与激素信号转导、分生组织发育及胁迫应答等多种生理反应。目前,本研究对高粱全基因组进行GRAS家族鉴定,对其理化性质、进化关系、基因结构等进行分析;以烯效唑处理下的高粱转录组数据,筛选出部分差异表达基因,并利用qRT-PCR分析差异基因的表达模式,鉴定该家族中潜在响应激素调节的基因。
1 材料与方法
1.1 材料准备及转录组测序
本试验所用高粱材料为‘红1号’,于2019年种植在河北农业大学育种中心,待高粱长到七叶期时,对其喷施浓度为1.1 g/L的烯效唑,分别于处理后0、3、7和14 d取旗叶,每组处理连续取3株,样品迅速放置于-80℃冰箱。利用TRNzol法提取高粱总RNA,用Nandorop One超微量分光光度计测定浓度和质量(OD260/280),高质量样品RNA用于构建文库并进行Illumina测序,获得转录组数据,后续分析基于此转录组数据。
1.2 高粱GRAS基因家族鉴定及分类
为挖掘鉴定高粱GRAS蛋白,本研究于Ensembl Plants网 站(http://plants.ensembl.org/index.html)下载高粱全基因组数据;pfam数据库(http://pfam.xfam.org/)下载GRAS隐马克夫模型[18],并利用Linux版本的HMMER软件进行鉴定,E值设置小于10-5,去除冗余的序列,初步得到高粱GRAS蛋白序列[19];利用pfam-search(http://pfam.xfam.org/search#tabview=tab1)与Smart(http://smart.embl.de/)对GRAS蛋白序列进行验证,最终保留含有GRAS结构域的蛋白。
1.3 理化性质分析及染色体定位
利用ExPASy-ProParam网站(https://web.expasy.org/protparam/)对高粱GRAS蛋白的氨基酸数、分子量和等电点进行预测。提取高粱GRAS基因的位置,通过Mapchart高粱GRAS基因在染色体上的分布情况可视化。
1.4 系统发育树构建、保守结构域及基因结构分析
参照上述方法鉴定出拟南芥和谷子(Setaria italica)的GRAS蛋白,将3个物种的GRAS蛋白序列使用MEGA7.0的Muscle进行多序列比对,选择邻接法(Neighbor-Joining),Bootstrap method设置为1 000,构建系统发育树[20],并根据GRAS基因结构进行亚家族分类。利用在线网站MEME(http://meme-suite.org) 及 GSDS2.0(http://gsds.gao-lab.org/)对高粱GRAS基因进行保守结构域及基因结构预测。
1.5 共线性分析
利用Blast对高粱全基因组数据进行比对,McscanX软件对其进行共线性分析及筛选同源基因,通过Circos软件绘制共线性关系图谱[21];利用相同方法处理拟南芥和谷子的全基因组数据,通过McscanX软件将高粱与拟南芥和谷子之间的同源关系可视化。
1.6 顺式作用元件分析
截取高粱GRAS基因上游启动子的1 500 bp序列,提交至在线网站Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),筛选与植物生长发育、激素代谢和胁迫应答相关的元件进行分析。
1.7 高粱GRAS基因注释
将高粱GRAS基因提交至GO数据库(http://geneontology.org/)进行BP、MF、CC注释分类;利用KEGG(https://www.kegg.jp/)对GRAS蛋白参与的pathway通路进行注释[22]。
1.8 基因表达分析及荧光实时定量
采用 FPKM(Fragments per kilobase million)法计算烯效唑处理下高粱转录组测序文库各基因表达量,利用Tbtools绘制不同时期GRAS基因表达热图。
利用转录组同批RNA,选取高粱glactin作为内参基因,利用Primer 5.0设计引物(表1),反转录后进行荧光实时定量(qRT-PCR, Quantitative Realtime PCR),采用2-△△Ct法计算相对表达量,每组处理样品设置3次生物学重复和3次技术重复。

表1 实时荧光定量所用引物序列Table 1 Primer sequences used for qRT-PCR
1.9 数据分析
利用SPSS25对荧光实时定量结果进行方差分析,采用邓肯方法进行多重比较。
2 结果与分析
2.1 高粱GRAS基因家族鉴定与理化性质分析
利用GRAS的隐马克夫模型从高粱全基因组序列中鉴定出80个GRAS转录因子,通过ExPASy-ProParam在线网站预测其理化性质。如表2所示,80个高粱GRAS转录因子氨基酸数为295~967个,分子量大小为31 529.21~107 470.03 kD;等电点介于4.82~9.05之间,平均等电点为6.01,其中91.25%为酸性蛋白;不稳定系数介于34.19~63.88,根据Sarikaya等人的研究[23],不稳定系数高于40为不稳定蛋白,即高粱GRAS蛋白中96.25%为不稳定蛋白;脂肪系数介于60.62~97.14;平均亲水性为-0.264,其中95%为亲水性蛋白,由此可知高粱GRAS家族成员内的理化性质也存在一定差异。图1为高粱GRAS基因染色体定位图,由图所示,除7号染色体外,80个GRAS基因全部定位于高粱9条染色体上,且全部定位到染色体两端;其中5号染色体GRAS基因最多(25个),10号染色体GRAS基因最少,仅3个。
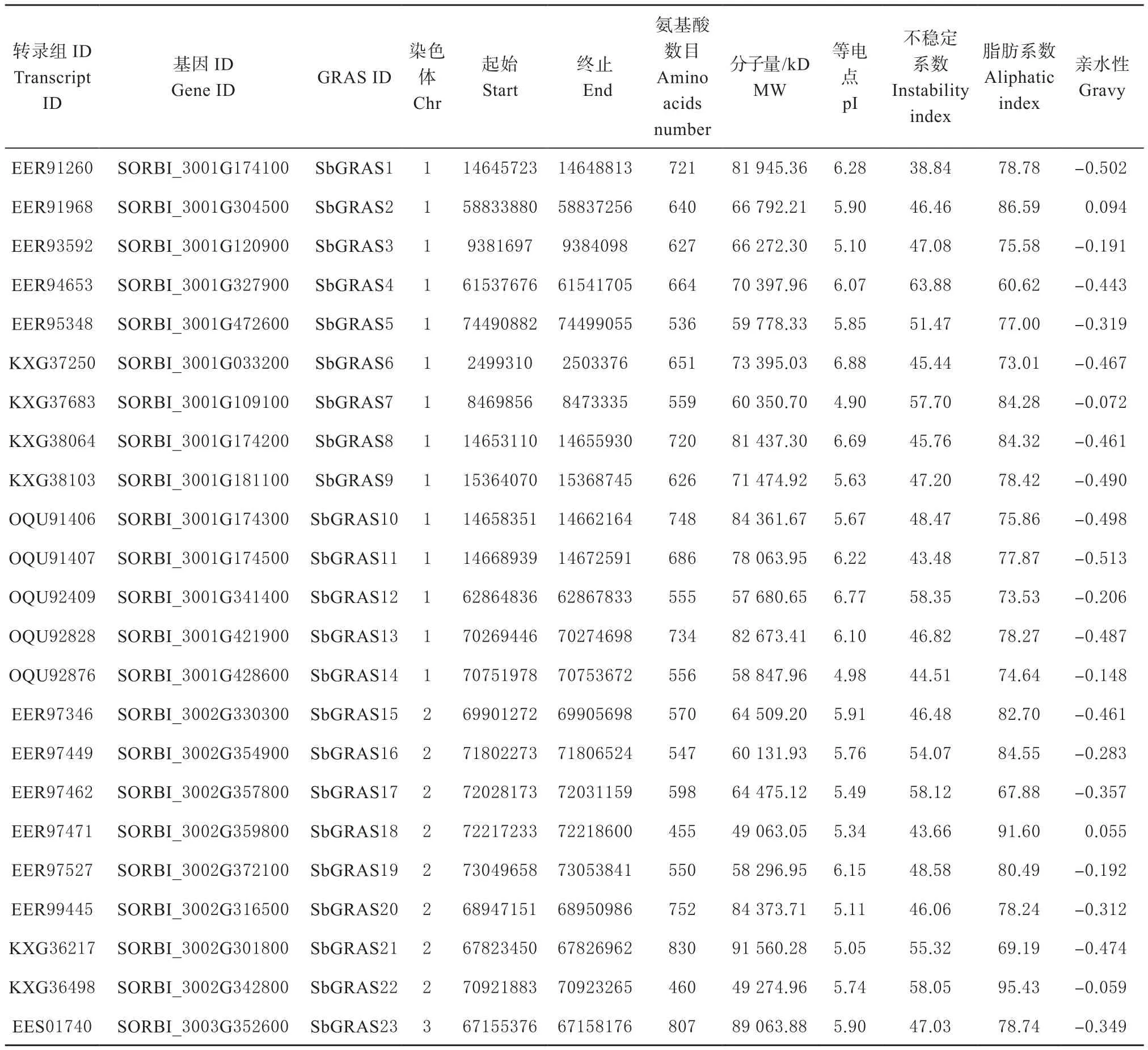
表2 高粱GRAS基因一级结构及理化性质分析Table 2 Analysis of primary structure and physicochemical property of GRAS genes in sorghum

续表:

续表:
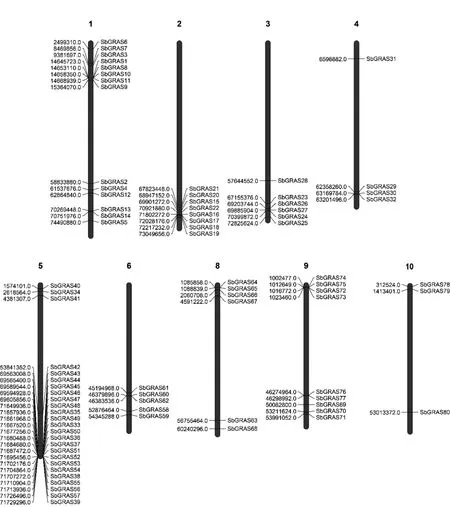
图1 高粱GRAS家族基因染色体定位图Fig.1 Chromosomal mapping of sorghum GRAS family genes
2.2 GRAS基因家族系统进化分析
利用MEGA7.0将筛选得到的高粱(80个)、拟南芥(34个)、谷子(56个)的GRAS蛋白序列构建系统发育树。根据亲缘关系远近,170个GRAS蛋白序列可划分为8个亚家族,分别为HAM、LS、SCR、DELLA、SCL3、SHR、PAT1和LISCL。其中LS、SCR和DELLA亚族高粱GRAS成员最少,仅4个;SHR和PAT1亚族成员各7个;HAM亚族成员9个;LISCL是高粱GRAS家族中最大的亚家族,与玉米相似[5],成员达38个,占全部高粱GRAS家族的47.5%。
2.3 保守结构域与基因结构分析
通过MEME和GSDS在线网站对高粱80个GRAS家族成员进行分析,利用TBtools将GRAS基因的保守结构域和基因结构可视化(图3)。如图所示,利用MEME在高粱GRAS基因预测了20个Motif,80个GRAS基因之间包含的Motif种类及数量具有一定差异,但同一亚族之间具有相似的保守结构域,说明相同亚族之间可能具有相似的功能。某些亚族中还具备特定的Motif,如LISCL亚族相对于其他亚族,C端有特定的4个motif,即motif10、motif13、motif16和motif19,这与前人研究相似,且除SbGRAS43和SbGRAS53外,其余基因N端都具有1个特定保守结构域(Motif5)等。通过基因结构分析可以看出,所有高粱GRAS基因都含有1~5个编码区(CDS);22个基因无非编码区(UTR),占全部高粱GRAS基因的27.5%;24个基因分别有1~4个内含子,其余GRAS基因无内含子;相同亚族内的基因大多具有相似的基因结构,SbGRAS53和SbGRAS54与其他GRAS基因具有明显不同的基因结构,推测其在进化过程中曾发生变异。
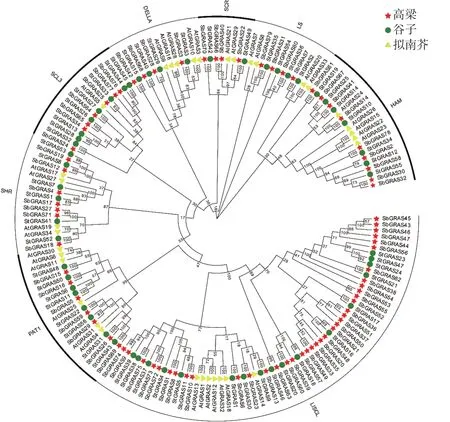
图2 GRAS基因家族系统发育树Fig.2 Phylogenetic trees of GRAS gene family
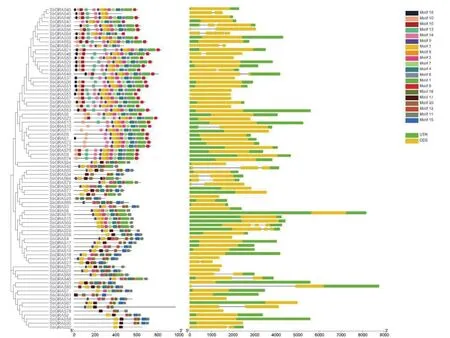
图3 高粱GRAS基因家族保守结构域及基因结构Fig.3 Conserved components and gene structure of GRAS gene family in sorghum
2.4 共线性分析
基因复制对物种基因组进化、扩张及功能分化有重要意义[24]。通过对高粱GRAS基因绘制共线性图谱(图4),结果显示高粱11个GRAS基因存在6对共线性关系,无串联重复基因,其中SHR、PAT1、SCL3和HAM亚族各一对同源基因,SCR亚族存在2对同源基因。5号和8号染色体中存在3对同源基因,2个同源基因位于9号染色体,其余3个分别位于1号、2号与3号染色体。对高粱、拟南芥和谷子构建物种间GRAS共线性图谱(图5),由图可知,高粱与拟南芥存在7对共线性关系,与谷子存在46对共线性关系。因此,GRAS基因存在早于单子叶植物与双子叶植物的分化时间。
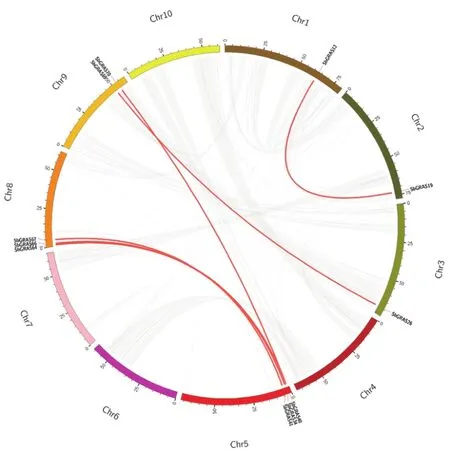
图4 高粱GRAS基因家族共线性分析Fig.4 Collinearity analysis of sorghum GRAS gene family

图5 高粱与拟南芥、谷子GRAS基因家族共线性分析Fig.5 Collinearity analysis of GRAS gene family in sorghum with Arabidopsis and foxtail millet
2.5 顺式作用元件
利用在线网站Plant CARE预测高粱GRAS基因上游 1 500 bp启动子的顺式作用元件[25],筛选出与生长发育、激素调节及逆境胁迫应答相关的顺式作用元件进行分析。如图6所示,搜索出大量与生长发育相关的元件,如光响应元件与种子特异性调节元件等、与激素调节相关的有ABA响应元件、GA响应元件及IAA响应元件等、与逆境胁迫相关的包括抗氧化逆境胁迫元件、生物及非生物胁迫应答元件、防御胁迫响应元件,以及与盐、干旱、低温胁迫相关的一系列顺式作用元件。67个GRAS基因含有不同的激素相关响应元件,其中34个基因存在GA响应元件;77个GRAS基因存在响应不同胁迫应答的相关元件;23个GRAS基因存在与种子特异性调节相关的元件;全部GRAS基因均含有光响应相关元件。因此,推测高粱GRAS基因可能广泛参与植物生长发育过程中的多种生理生化反应。
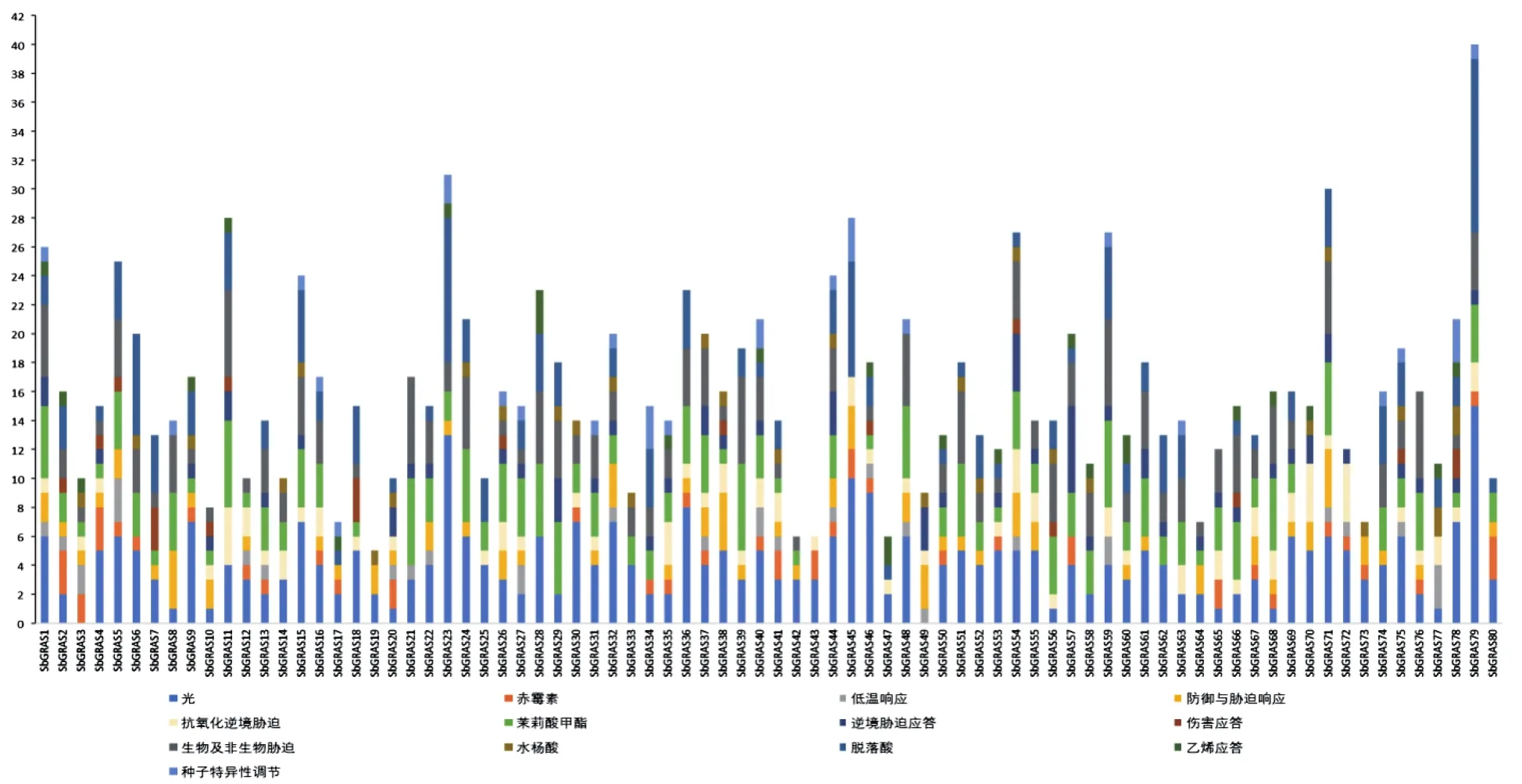
图6 高粱GRAS基因家族顺式作用元件Fig.6 Cis-acting elements of sorghum GRAS gene family
2.6 高粱GRAS家族成员GO与KEGG分析
对高粱GRAS基因进行GO分析(图7),80个GRAS基因全部得到Biological process(BP)、Cellular component(CC)及Molecular function(MF)注释,发现GRAS基因参与20种生物过程(BP),其中全部基因均参与调控种子休眠过程;细胞成分(CC)全部为细胞核;注释到3种分子功能(MF),其中全部基因均注释到DNA结合转录因子活性与特异性DNA结合中。通过KEGG注释高粱GRAS基因参与的代谢通路,发现大部分基因均参与植物激素信号转导(K14494)与核糖体生物合成(K14777)途径。
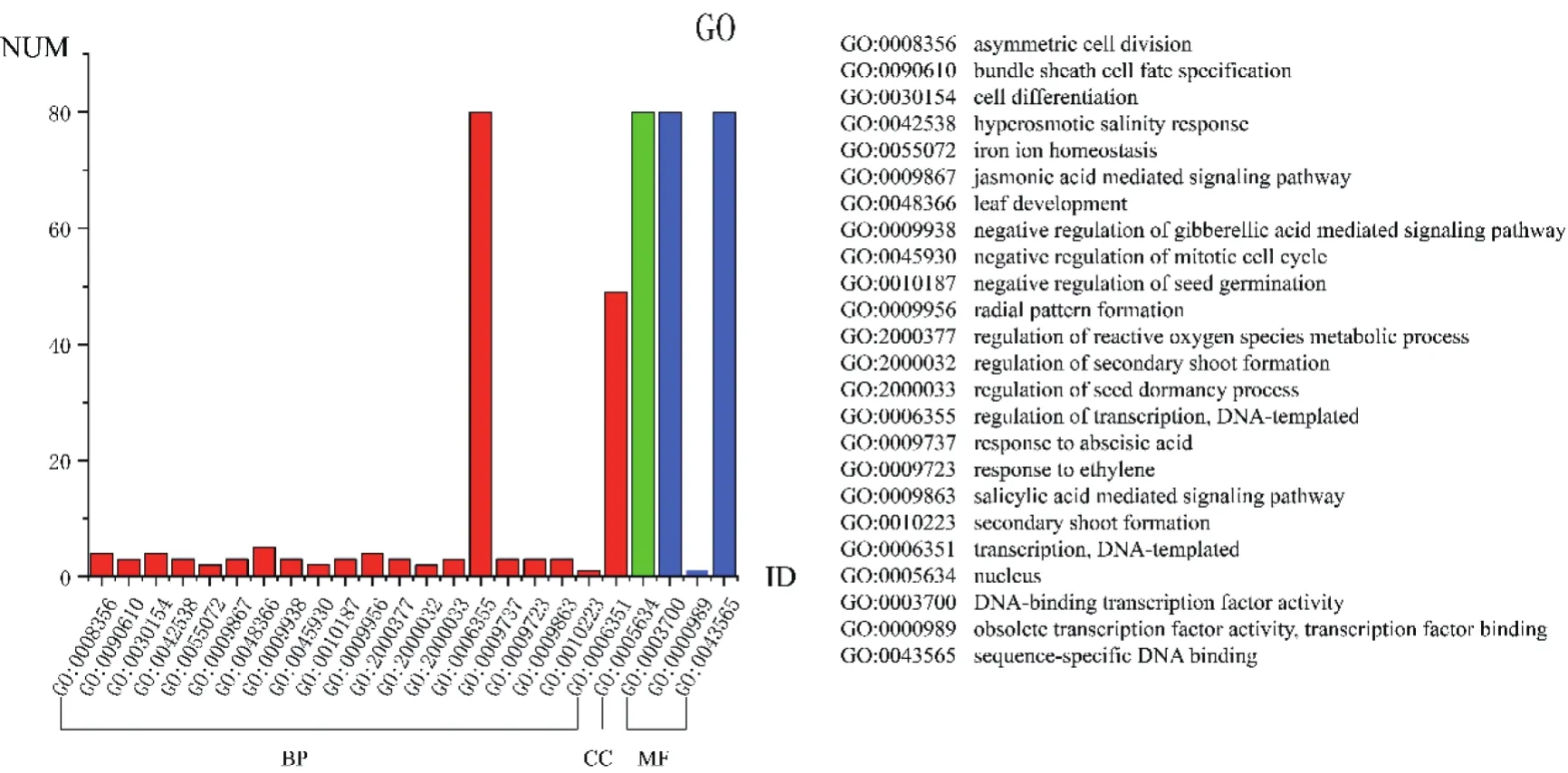
图7 高粱GRAS基因GO注释信息Fig.7 The GO annotations of sorghum GRAS genes
2.7 高粱GRAS基因对烯效唑调控的响应
本研究以外源生长调节剂烯效唑处理7叶期高粱幼苗,并设置对照组(CK)和处理组(T),分别于处理后0、3、7和14 d取新生展开第一片叶,进行转录组测序分析,经过滤分析得到32 423个表达基因,其中66个GRAS基因有所表达。
基于此转录组数据绘制高粱GRAS基因表达热图(图7),分析GRAS基因在不同时期的表达量变化规律。根据聚类情况,可将66个GRAS基因分为5类,Ⅰ中GRAS在对照和处理下表达量变化趋势基本一致,大多基因的表达量均先降低,在7 d时显著升高,随后降低,但对照组和处理组的表达量之间无显著差异;Ⅱ中表达趋势大多呈现先升高,在3 d时达到顶峰,之后表达量下降,对照组和处理组之间的表达趋势相同,且无显著差异,推测在烯效唑处理下该类基因无明显作用;Ⅲ中GRAS基因最多,且大多基因均呈现表达量持续升高的趋势,其中SbGRAS7、SbGRAS15、SbGRAS16及SbGRAS29在烯效唑处理下14 d表达量显著高于对照组14 d表达量;Ⅳ中各基因在处理和对照下表达趋势一致,均呈现先升高后降低最后再升高的趋势,其中仅SbGRAS44在7 d时表达量显著降低,但CK7与T7之间无显著差异;Ⅴ中基因表达量大多表现出先降低,在14 d时有升高的趋势,但各个时期间的表达量变化不显著,且对照组与处理组间的表达量变化差异不显著。
为进一步验证烯效唑处理下高粱GRAS基因表达模式,挑选了8个表达量较高且差异显著的GRAS基因,进行qRT-PCR分析(图9)。由于该8个基因在3 d时的表达量与0 d时相比基本无变化,所以仅对其在0、7、14 d 3个时期进行qRT-PCR。结果显示,6个基因表达趋势与转录组数据基本吻合,其中5个基因的表达量存在显著差异。SbGRAS2与SbGRAS13呈现先升高后降低的趋势,且在烯效唑处理7 d时达到显著;SbGRAS7与SbGRAS15表达量持续升高,14 d时处理组表达量显著高于对照组;SbGRAS58表达量也表现出持续升高的趋势,但7 d和14 d时处理组表达量显著低于对照组。
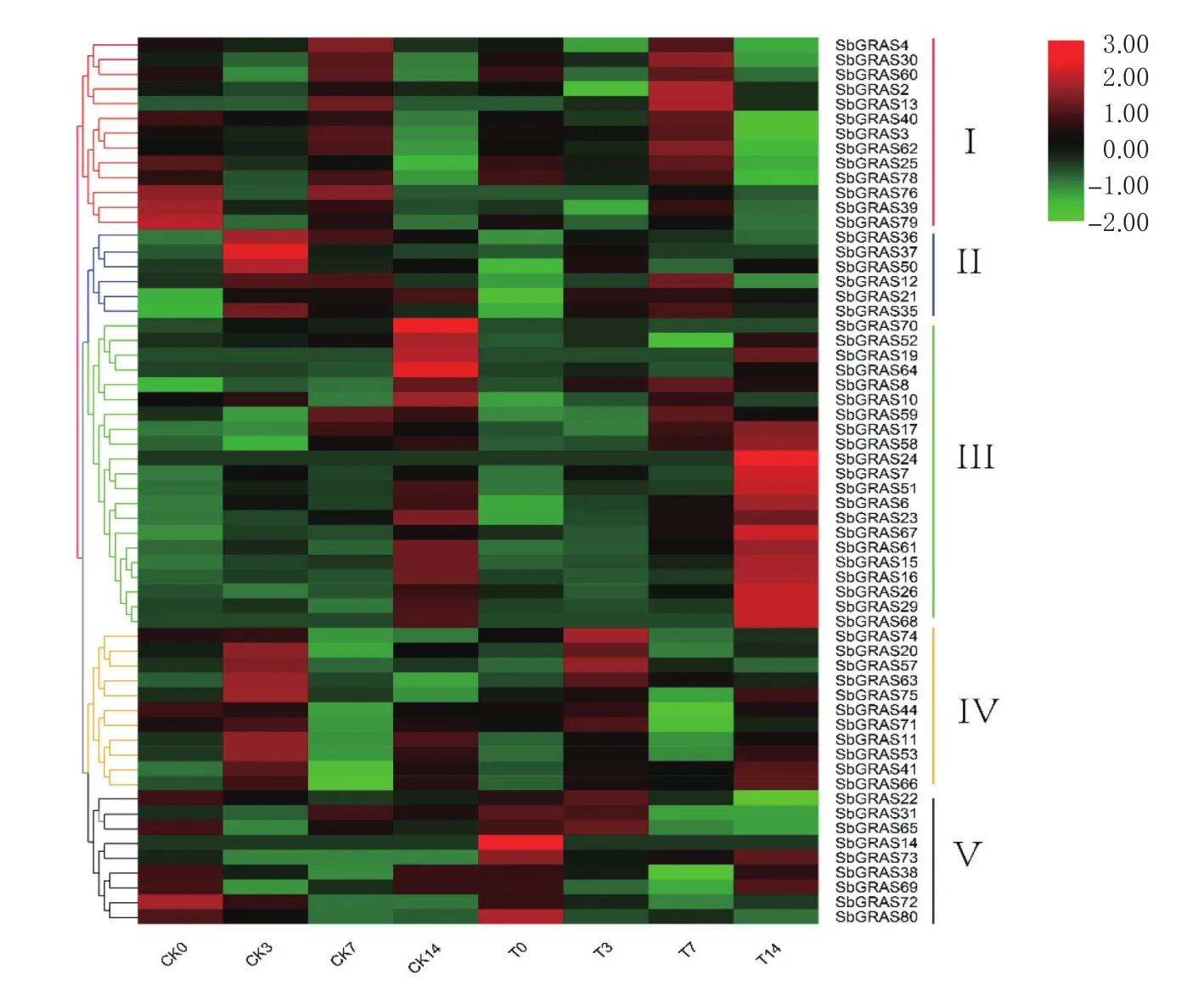
图8 高粱GRAS基因在烯效唑处理下的表达模式Fig.8 The expression pattern of sorghum GRAS genes under uniconazole treatment

图9 烯效唑处理下高粱GRAS基因的表达水平Fig.9 Expression level of sorghum GRAS genes under Uniconazole treatment
3 讨论
GRAS转录因子广泛存在于植物体中,参与植物生长发育中的多个代谢途径。2009年高粱全基因组序列公布,为高粱基因功能挖掘提供理论基础。本研究基于烯效唑处理下不同时期高粱转录组数据,结合生物信息学鉴定高粱GRAS基因,并通过qRT-PCR验证功能。
本研究从高粱全基因组序列中鉴定出80个GRAS转录因子,与玉米(86个)相差不多,且同样可以分为8个亚族。通过系统发育树,根据亲缘关系远近,预测相同亚族间临近分枝的蛋白功能可能相似,如AtGAI与AtRGA1的研究较为透彻[8],他们可以参与GA信号转导,抑制植株的生长与开花,而与其同源性较高的SbGRAS3和StGRAS3也可能存在类似功能;不同亚族之间结构差异较大,如motif5、motif10和motif19仅存在于LISCL亚族中,推测这些保守结构域导致LISCL亚族具有特异性功能;相同亚族之间结构相似,可能在基因功能方面存在一定相似性[26],但在基因进化过程可能存在一定变异,如SbGRAS53和SbGRAS54与LISCL亚族其他基因的保守结构域极为相似,但基因结构存在明显不同,这种变异可能使基因功能发生改变,对基因进化及功能分化有重要意义。相较于拟南芥,高粱与谷子的同源性更高,可以根据谷子GRAS基因预测高粱中同源基因的功能。通过对高粱GRAS基因染色体定位,发现16个GRAS基因聚集在5号染色体末端极小的一段区域内,且都属于LISCL亚族,因此可以推测这段局域可能发生过小规模基因复制事件,前人研究表明,玉米GRAS家族也曾发生类似事件[5]。70%的高粱GRAS转录因子的内含子丢失,此现象在F-box与SAUR等大型基因家族中也经常发生,真核生物将出现此现象的原因归结于无内含子基因复制、无内含子基因逆转录以及水平基因转移。此外,在进化过程中高粱GRAS转录因子存在6对直系同源基因,这些基因的理化性质、基因结构和基因表达均极其相似。
根据GO和KEGG注释,发现高粱GRAS基因全部注释到种子休眠调控,并且大多参与激素信号转导通路。赤霉素是植物体内最重要的激素之一,对植物生长、种子萌发以及提高产量有重要意义,烯效唑是赤霉素合成抑制剂,对赤霉素起负向调控作用[27]。前人多项研究表明,GRAS转录因子可以参与赤霉素代谢通路[28],影响植株正常发育,如拟南芥中AtGAI可以参与并影响GA代谢通路[9];DELLA与SCL3蛋白对SHR/SCR复合体的调控作用,揭示了GRAS转录因子保持植物体内赤霉素稳态的代谢过程,从而维持根系正常生长发育[29]。
基因的表达模式在一定程度上决定着基因功能,GRAS基因家族功能十分广泛,除上述与激素调节相关外,水稻LISCL亚族的OsGRAS23转录因子可以受到一些应激反应基因诱导,正向调控水稻抗旱性[30];逆境下抗霉素A与L-半胱氨酸等通过诱导LISCL亚族NtGRAS1上调表达,进而增加细胞内活性氧含量,参与胁迫应答[31],水稻GRAS家族基因D26可以通过参与调控油菜素内酯代谢途径,进而调控水稻分蘖生成[32]。结合转录组数据,80个高粱GRAS基因根据表达变化可以分为5组,其中III组GRAS基因最多,部分基因的表达量变化差异十分显著,如SbGRAS15在14 d时基因表达量明显上调,且处理组表达量显著高于对照组,说明该基因可能参与激素调控网络。挑选出8个具有显著差异的高粱GRAS基因进一步通过q-PCR验证,结果发现存在4个上调基因和1个下调基因,说明这些GRAS基因可能在高粱烯效唑的处理下发挥某种作用,这些基因在对外源生长调节剂的响应机制有待进一步研究。
