聚乙二醇修饰木犀草素脂质体的制备及其理化性质
2021-11-05刘淼高悦李康帆何维维李靖原王婷钱卫东
刘淼,高悦,李康帆,何维维,李靖原,王婷,钱卫东
(陕西科技大学食品与生物工程学院,陕西西安 710021)
木犀草素(3’,4’,5,7-四羟基黄酮)是一种类黄酮多酚类化合物,广泛存在于水果、蔬菜和中草药中。现有研究表明木犀草素具有抗肿瘤[1]、抗氧化[2]、抗炎[3]、保护神经系统[4]和抗菌[5]等活性。值得注意的是,木犀草素作为拓扑异构酶抑制剂,也是一种潜在的可用于治疗肿瘤的天然活性成分。然而,木犀草素属于脂溶性药物,存在水溶性差和生物利用度低等问题,这对其临床应用产生了一定的限制。因此,改善木犀草素成药性缺陷是提高其临床应用的重要前提之一。
脂质体是一种特殊的囊泡,由一个或多个封闭的壳或片层组成,由磷脂双层组成,磷脂是两亲性的,其基本特征是在同一分子上有一个亲脂的尾部和亲水性的头部[6]。脂质体大小从几十纳米到几百微米,这主要取决于所用的制备方法。脂质体制备方法有薄膜分散法[7]、硫酸铵梯度法[8]、冷冻干燥法[9]等,其中薄膜分散法制备的脂溶性药物脂质体的包封率高,硫酸铵梯度法对两亲性药物脂质体的包封率高、渗漏小,而冷冻干燥法主要用于包裹蛋白质、多肽等在水溶液中不稳定的物质。脂质体以其血液循环时间长,生物相容性好,生物利用度好和肿瘤特异性高等优点,备受人们关注。
聚乙二醇是一种高亲水性聚合物,能在脂质体表面形成一层水化膜,可阻碍血浆成分与脂质体表面的吸附,从而降低网状内皮系统对脂质体的摄取,使脂质体在体循环中作用时间延长,有利于延长药物的作用时间。鉴于聚乙二醇及其衍生物可提高药物载体的稳定性[10],研究人员通过对脂质体的表面修饰,将聚乙二醇运用于基于脂质体的药物传递系统的制备研究中[11],但对聚乙二醇木犀草素脂质体修饰的报道较少。为此,本文利用薄膜分散法制备聚乙二醇修饰木犀草素脂质体,同时应用Box-Behnken结合响应面方法优化脂质体处方,以包封率、粒径大小、电位等为评价指标,分析聚乙二醇修饰木犀草素脂质体的最佳制备工艺。
1 材料与方法
1.1 材料
1.1.1 试剂
木犀草素(CAS:491-70-3,HPLC纯度≥98%)、氯仿、甲醇、蛋黄卵磷脂、胆固醇、磷脂酰乙醇胺-聚乙二醇2000(DSPE-PEG2000)、胃蛋白酶、胰蛋白酶、果胶酶、氯化钠、磷酸二氢钠和氢氧化钠。
1.1.2 主要设备
电热恒温水浴锅、紫外-可见分光光度计、旋转蒸发仪、电子分析天平、超声波细胞破碎仪、纳米粒度及ZETA电位分析仪、透射电子显微镜、pH计。
1.2 方法
1.2.1 木犀草素检测标准曲线的绘制
采用全波长扫描仪分析0.1 mg/mL木犀草素乙醇溶液和空白聚乙二醇修饰脂质体的吸光度,明确木犀草素的最大吸收波长。分别配制0.05、0.1、0.15、0.2、0.25 mg/mL的木犀草素乙醇溶液,采用紫外分光光度计测定吸光值,绘制线性回归方程,所制得的回归方程及相关系数为y=9.378x+0.0027,R2=0.995。
1.2.2 聚乙二醇修饰木犀草素脂质体的制备
采用薄膜分散法制备木犀草素脂质体[12],按一定比例称取蛋黄卵磷脂、胆固醇和木犀草素,溶解于氯仿:甲醇=2:1(V/V)中,置于旋转蒸发仪中旋转,待薄膜形成后加入15 mL纯净水充分摇匀,置于水浴锅中继续水化1 h后进行超声处理,获得木犀草素脂质体溶液。接着加入等体积不同质量分数DSPEPEG2000的水溶液,再涡旋使之均匀混合后4 ℃静置1 h,即得聚乙二醇修饰木犀草素脂质体[13]。
1.2.3 聚乙二醇修饰木犀草素脂质体包封率的测定
采用超滤离心法[14]分析聚乙二醇修饰木犀草素脂质体包封率,取3 mL脂质体置于超滤离心管中,离心(5000 r/min)10 min,取400 μL过滤所得的溶液测定吸光值,计算游离木犀草素的含量。另取400 μL脂质体,加入无水甲醇涡旋10 min进行破乳,测定吸光值,计算聚乙二醇修饰木犀草素脂质体的包封率。计算公式如下:
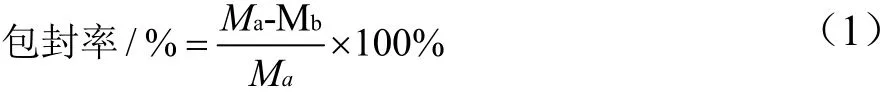
式中:
Ma——木犀草素总浓度,mg/mL;
Mb——游离的木犀草素浓度,mg/mL。
1.2.4 聚乙二醇修饰木犀草素脂质体制备的单因素实验
研究不同膜材(蛋黄卵磷脂:胆固醇)质量比(4:1、6:1、8:1、10:1、12:1)、脂药(蛋黄卵磷脂与木犀草素)质量比(8:1、16:1、24:1、32:1)、超声时间(10 min、15 min、20 min、25 min、30 min)、水化温度(30 ℃、40 ℃、50 ℃、60 ℃)和DSPE-PEG2000的质量分数(2%、3%、4%、5%、6%)对包封率的影响。依次选出膜材比,药脂比,超声时间,水化温度和DSPE-PEG2000的质量分数对聚乙二醇修饰木犀草素脂质体包封率的影响,筛选出合适的三因素进行进一步分析。
1.2.5 聚乙二醇修饰木犀草素脂质体制备的响应面实验
在单因素试验结果的基础上,采Design-Expert试验设计方法,表1为响应面实验因素水平编码表,以膜材比、脂药比、DSPE-PEG2000的质量分数为三因素,将各个因素的低水平、中水平、高水平分别用-1、0、1标记。以包封率为响应值,进行响应面实验设计。
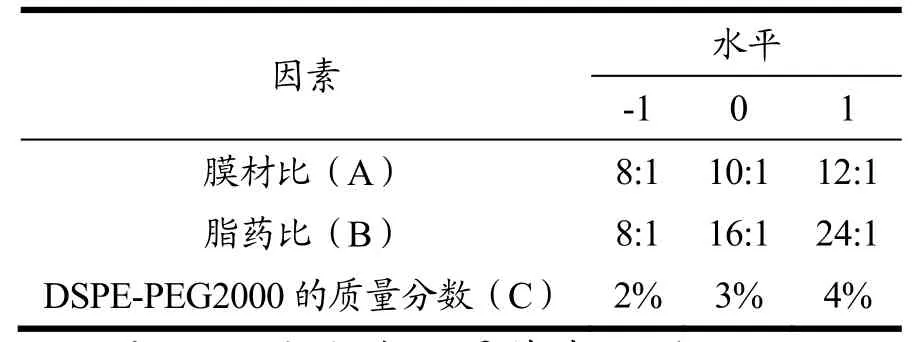
表1 响应面实验因素水平表Table 1 Response surface experimental factor level table
1.2.6 聚乙二醇修饰木犀草素脂质体的粒径分布、电位
采用纳米粒度及ZETA电位仪在室温下进行平均粒径和电位(ζ)测定,每个样品平行测定三次。
1.2.7 聚乙二醇修饰木犀草素脂质体的形态分析
为了观察聚乙二醇修饰木犀草素脂质体的形态,将所制得的聚乙二醇修饰木犀草素脂质体进行光学分析,然后再用透射电镜分析外貌特征。取木犀草素脂质体样品在水中稀释,将20 μL稀释样品滴加在150目铜网上,静置10 min。然后用磷钨酸负染色液(2%)的覆盖网格2 min,自然干燥,用透射电镜对样品进行分析[15]。
1.2.8 聚乙二醇修饰木犀草素脂质体在体外模拟液中的释放实验[16]
在100 mL胃液、小肠液和结肠液中分别加入25 mL聚乙二醇修饰木犀草素脂质体溶液,置于100 r/min,温度为37 ℃的摇床中,每隔一定时间段取样分析,取样时段为0 h、0.5 h、1 h、2 h、3 h、4 h、5 h、6 h、7 h、8 h、9 h、10 h,分别取出1 mL释放介质,同时加入等温等体积的对应模拟液,实验重复三次。用紫外分光光度计测定木犀草素的含量,计算累积释放率。计算公式如下:
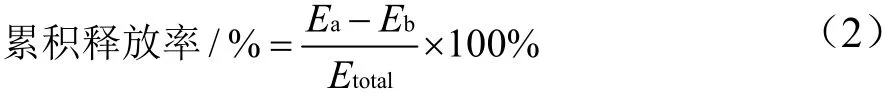
式中:
Ea——时间a时测定的游离木犀草素含量,mg;
Eb——反应刚开始时测定游离木犀草素的含量,mg;
Etotal——包封的木犀草素总量,mg。
1.2.9 数据统计分析
实验重复三次,实验数据用origin 2017软件分析并作图,数据以平均值±标准差(SD)表示。
2 结果与讨论
2.1 木犀草素含量分析
从图1可知,木犀草素的最大吸收波长在370 nm处,而空白聚乙二醇修饰脂质体在370 nm处无最大吸收,因而选择370 nm作为木犀草素的检测波长。
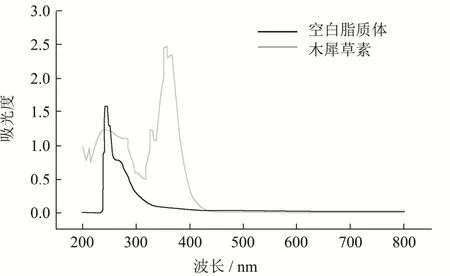
图1 木犀草素的全波长扫描Fig.1 The full wave scanning of luteolin
2.2 单因素实验
2.2.1 膜材比对聚乙二醇修饰木犀草素脂质体包封率的影响
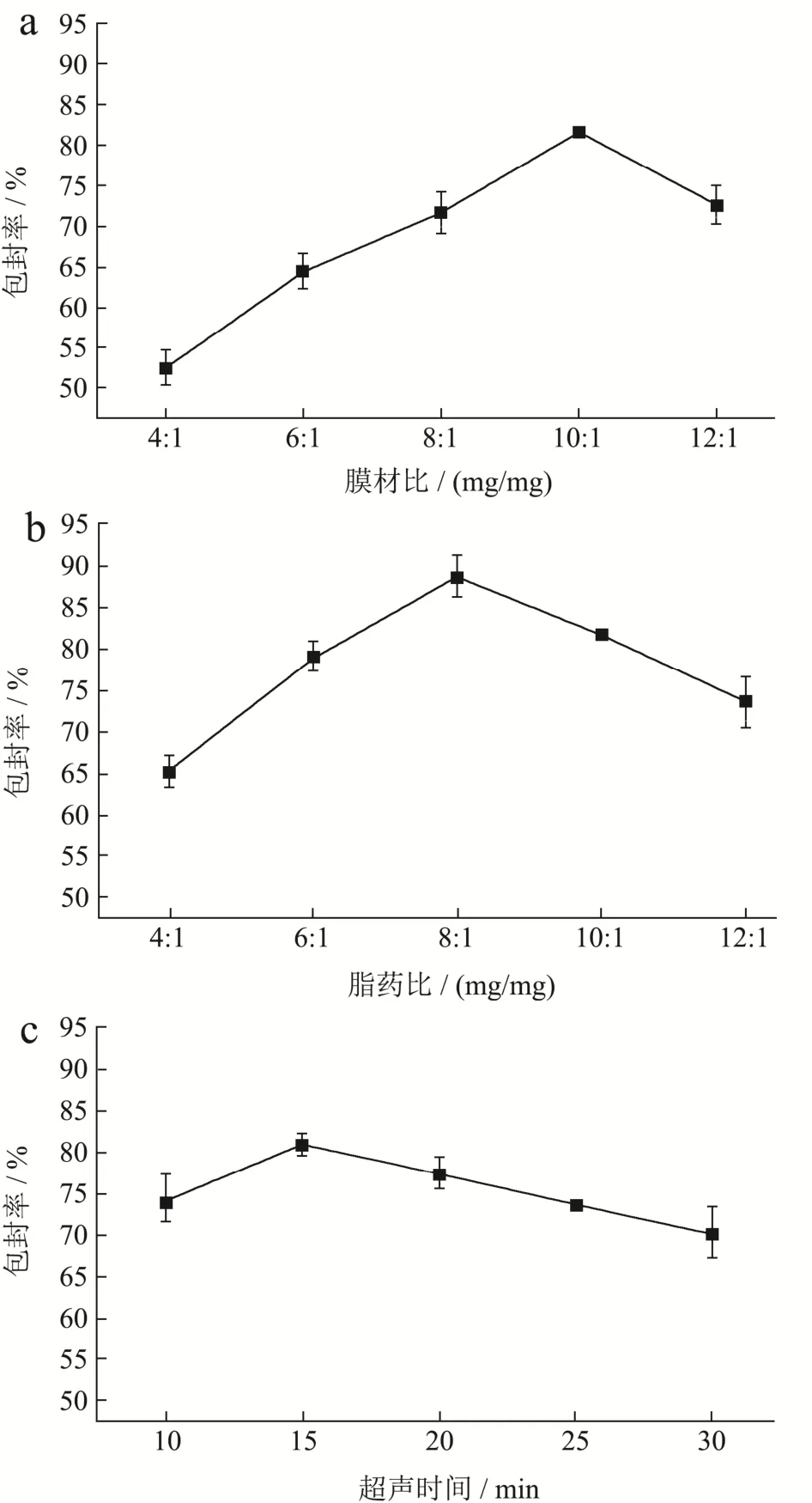
胆固醇与磷脂是共同构成脂质体的基础物质,胆固醇具有调节膜流动性的作用。结果如图2a所示,随着磷脂与胆固醇质量比从4:1增加到12:1时,聚乙二醇修饰木犀草素脂质体的平均包封率从52.56%增大到81.43%,随后减小至72.6%,这可能是由于起初胆固醇的相对含量过高,增加脂膜刚性,分子间排列紧密,木犀草素难以进入磷脂双分子层中,但是随着膜材比的增加,使得胆固醇的相对含量降低,包封率增加,在10:1时达到最大。但是,随着胆固醇的相对量继续降低到一定程度时,蛋黄卵磷脂的相对量过多,水化过程困难,蛋黄卵磷脂聚集,导致包封率下降,这与之前的报道基本一致[17]。
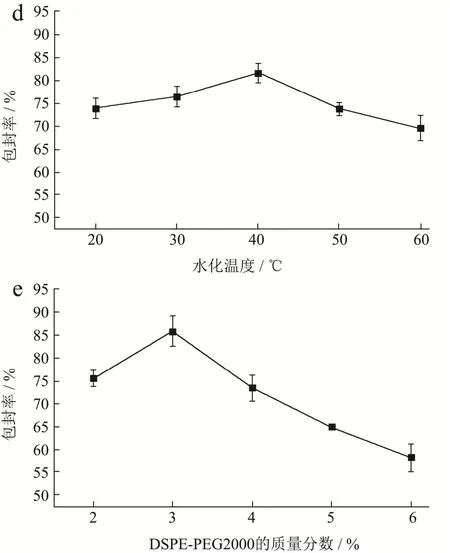
图2 单因素对聚乙二醇修饰木犀草素脂质体包封率的影响Fig.2 Effect of single factor on the entrapment efficiency of luteolin liposome modified by polyethylene glycol
2.2.2 脂药比对聚乙二醇修饰木犀草素脂质体包封率的影响
结果如图2b所示,木犀草素相对加入量太多,可能超过了脂质体能包封的最大量,导致难以形成脂质膜;而木犀草素相对加入量太少,则造成蛋黄卵磷脂利用度不高[18]。因此随着脂药比的4:1增加到32:1时,包封率先增大到88%随后减小到73.56%,当脂药比为16:1时包封率最大。
2.2.3 超声时间对聚乙二醇修饰木犀草素脂质体包封率的影响
适宜的超声时间有利于脂质体的形成,但超声时间过长会使部分脂质体破裂从而降低包封率[19]。结果如图2c所示,脂质体的,包封率随着超声时间的增大而增大,当超声时间为15 min时,包封率达到最大即为80.86%。
2.2.4 水化温度对聚乙二醇修饰木犀草素脂质体包封率的影响
本文所用的磷脂为天然蛋黄卵磷脂,温度过高会加速蛋黄卵磷脂的氧化,使得脂质体膜出现降解,导致药物流出,引起包封率下降[20],所以水化温度不能太高。结果如图2d所示,水化温度在40 ℃时,包封率较高,为81.66%。
2.2.5 DSPE-PEG2000的质量分数对聚乙二醇修饰木犀草素脂质体包封率的影响
研究报道若DSPE-PEG2000使用量过大,将不利于其进入脂质体的磷脂双分子层中[21]。结果如图2e所示,DSPE-PEG2000的质量分数从2%增加到6%时,脂质体平均包封率依次为75.46%、85.80%、73.30%、64.77%、51.33%,呈先升高后降低现象。
2.3 利用响应曲面方法优化聚乙二醇修饰木犀草素脂质体制备工艺
使用Design-Expert设计软件进行三因素三水平实验设计,三因素为膜材比、脂药比和DSPEPEG2000的质量分数。响应面实验设计方案与结果如表2所示。

表2 Box-Behnken试验设计方案与结果Table 2 Design and results of Box-Behnken
2.3.1 数据处理
使用Design-Expert分析表3和表4,对响应面结果进行二次回归拟合,其方程包封率(Y)=88.74-0.72×A-1.17×B-3.08×C-2.5×A×B-1.75×A×C+3.25×B×C-16.89×A2-14.07×B2-9.42×C2(R2=0.98,F=45.17,失拟度检验F=0.31,p=0.82)。
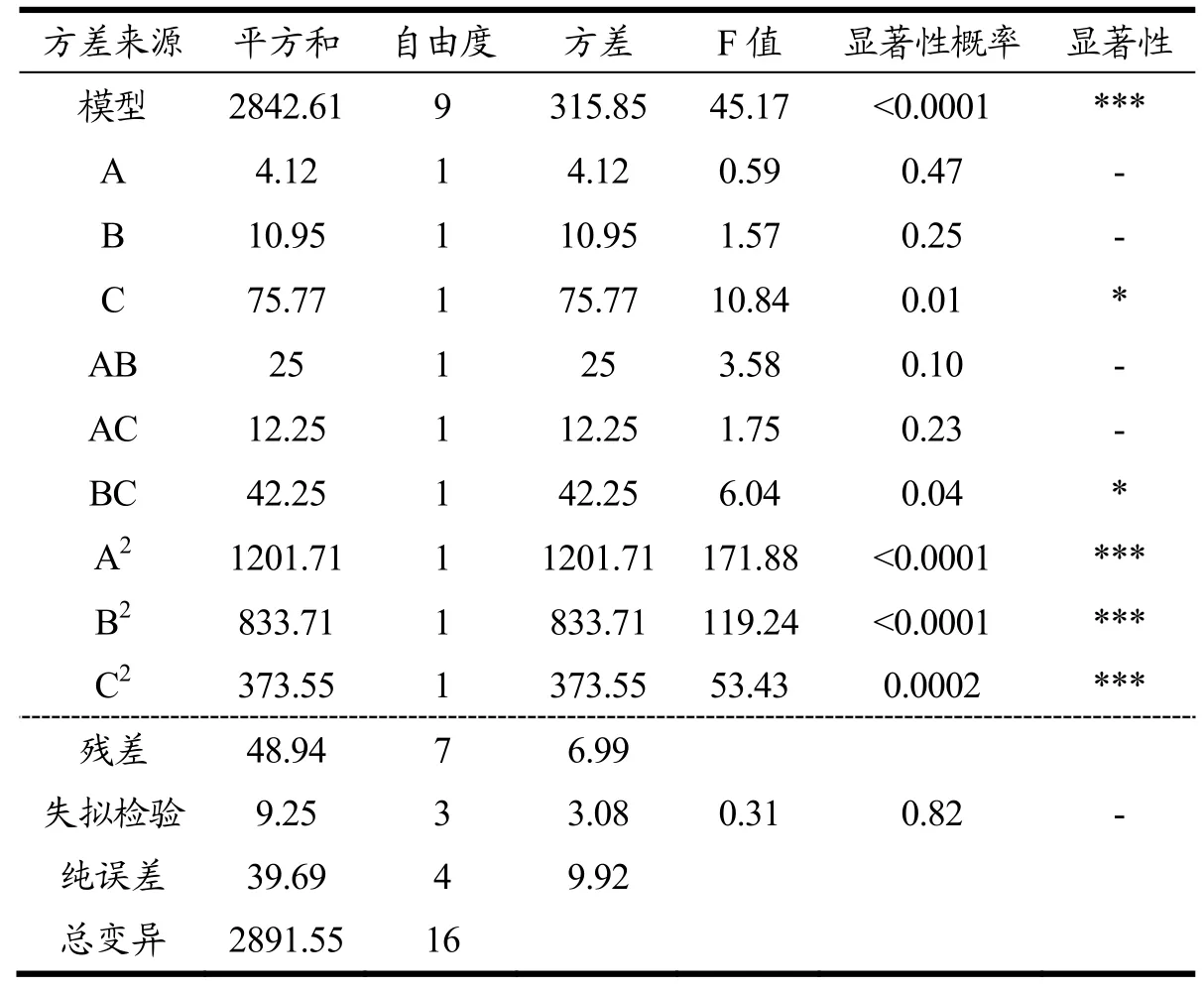
表3 回归模型方差分析表Table 3 Analysis of variance of regression model
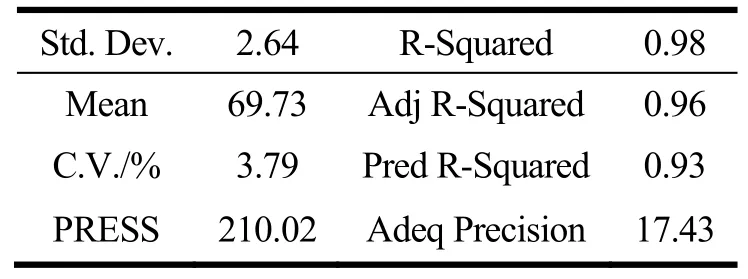
表4 回归方程误差统计分析表Table 4 Statistical table of regression equation error
由二次方程结果可知拟合模型F值高,p<0.001,说明实验模型显著和较高的拟合度,失拟项F值为0.31,值较小且p=0.82>0.05,表明失拟项不显著,表明拟合模型结果好,符合实验的要求,可用于分析实验结果。二次回归方程的系数R2=0.98>0.95,变异系数CV=3.79%<10%,证明变异性差,实际值与预计值之间存在较高的相关性,能够准确的预测实际情况。因此Box-Behnken设计的模型可用于聚乙二醇修饰木犀草素脂质体的制备工艺分析和预测。
2.3.2 各因素的交互作用对脂质体壁材粒径的影响
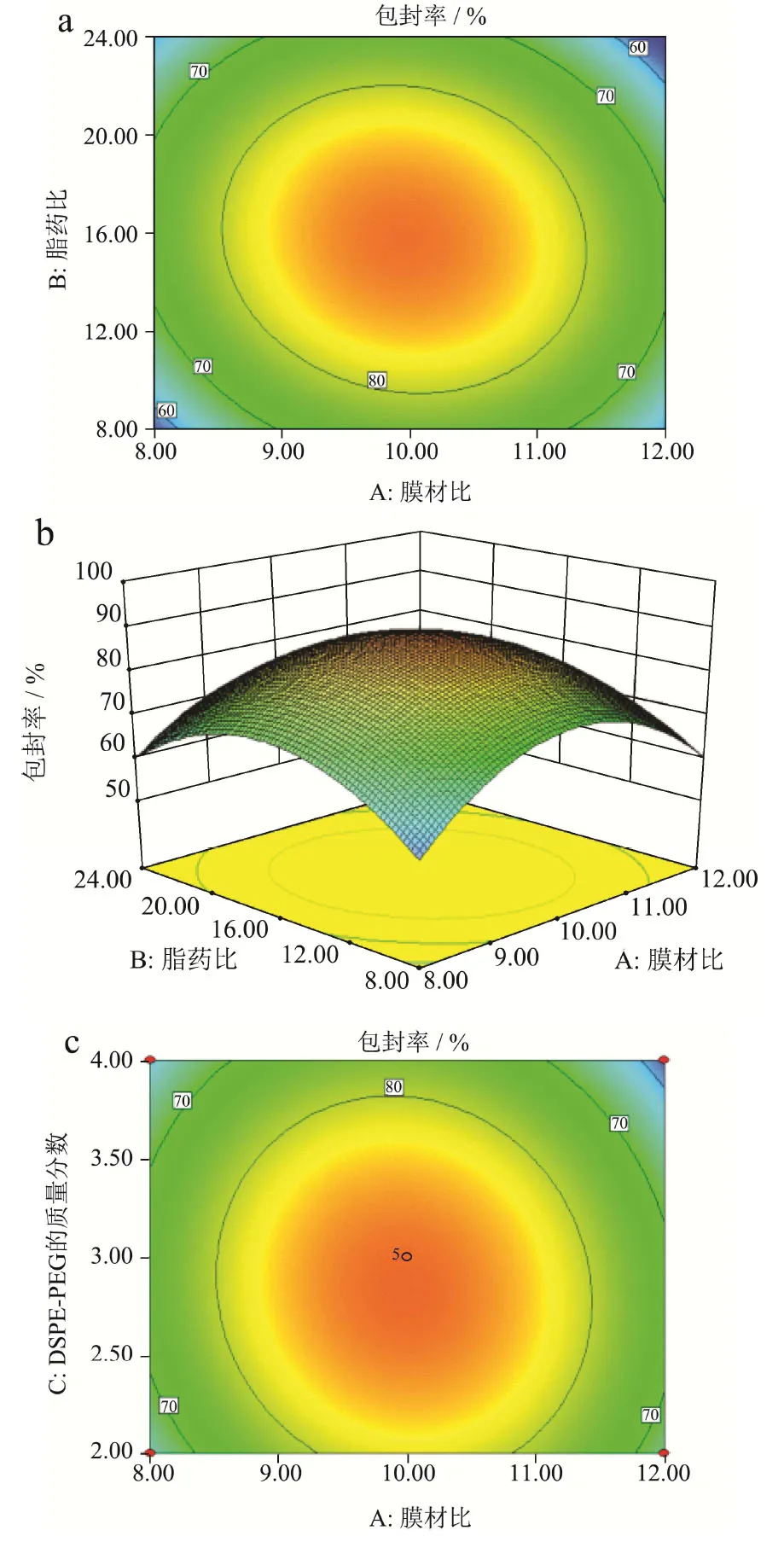
Design-Expert分析可知,3个因素中DSPE-PEG 2000的质量分数对包封率的影响最大,其次是脂药比和膜材比。三因素之间均存在一定的交互作用,其中DSPE-PEG2000的质量分数和脂药比的交互作用最为显著(F=6.04)。为探讨三因素之间交互作用对木犀草素脂质体包封率的影响,根据二次回归方程的拟合结果,将膜材比,脂药比和DSPE-PEG2000的质量分数中的一个因素固定,以获得另外两个因素对脂质体包封率的影响。
从图3可以看出,三个响应曲面图坡度都较陡峭,其中固定DSPE-PEG2000的质量分数,膜材比和脂药比交互的响应曲面图最陡峭,表明这三因素对脂质体包封率的影响均有明显的影响,但膜材比和脂药比对脂质体包封率的影响最大。综合表3结果可知,膜材比和脂药比、膜材比和DSPE-PEG2000的质量分数,两两之间交互作用不显著(p>0.05),而脂药比和DSPE-PEG2000的质量分数之间具有显著的交互作用(p<0.05)。
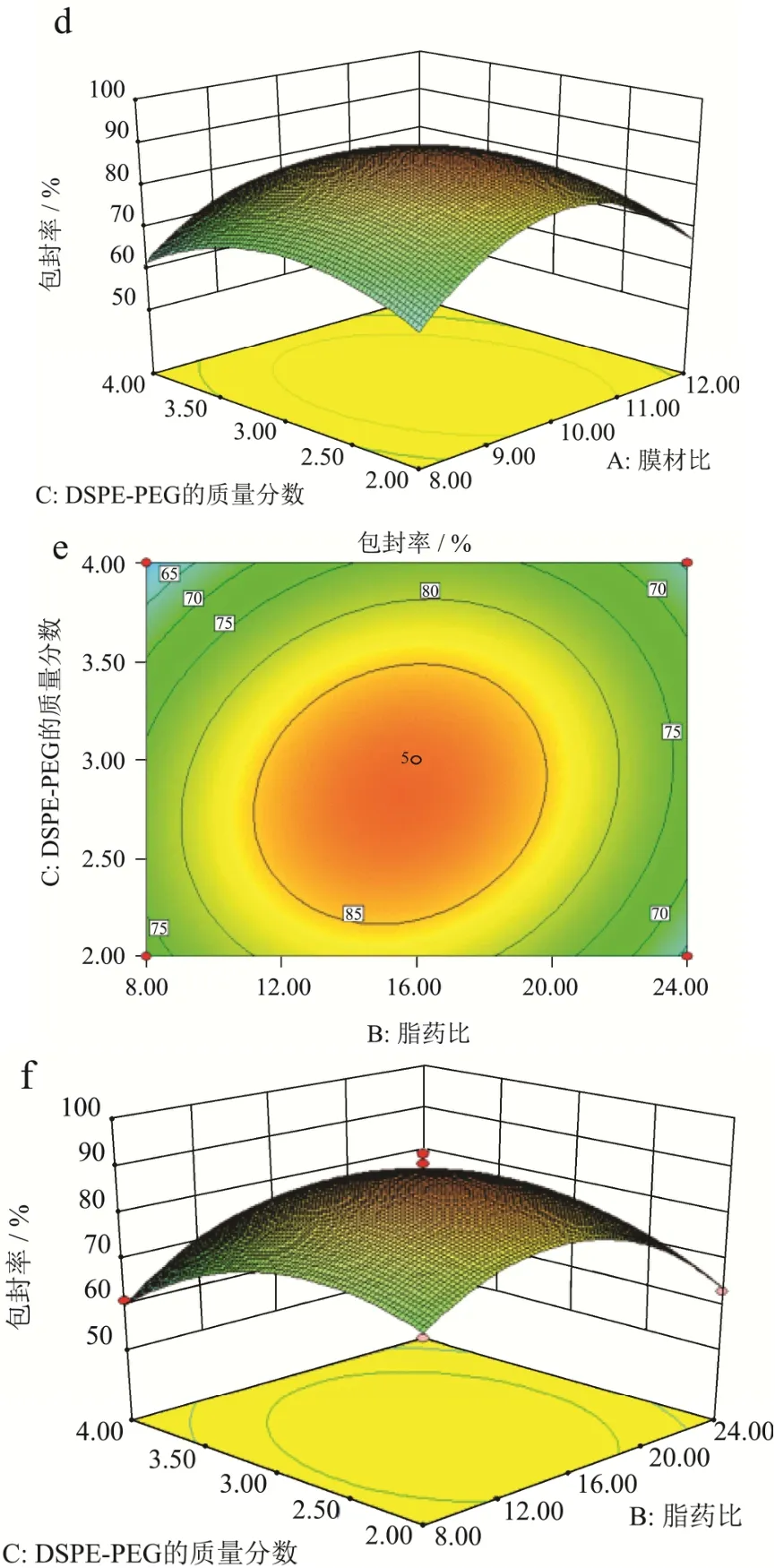
图3 脂质体制备工艺交互作用曲面Fig.3 Response surface analysis of interaction between liposomes preparation parameter
2.3.3 最佳制备工艺参数的确定
利用软件进行优化,聚乙二醇修饰木犀草素脂质体最佳制备参数为:在保持其它工艺条件不变的情况下,当膜材比为10:1,脂药比为16:1,DSPE-PEG2000的质量分数为3%,超声时间15 min和水化温度40 ℃时,所制备的聚乙二醇修饰木犀草素脂质体,其平均包封率为86.30%,表明木犀草素脂质体最佳制备工艺的可行性较好。
2.4 聚乙二醇修饰木犀草素脂质体粒径及电位
取一定量聚乙二醇修饰木犀草素脂质体溶液,用去离子水稀释一定倍数后,利用纳米粒度及ZETA电位仪测定粒径和Zeta电位。结果如图4a所示,脂质体平均粒径为134.1 nm,且大多数分布在80~200 nm。曹大振等[22]研究以大豆卵磷脂、胆固醇为膜材,用薄膜-超声分散法制备了表没食子儿茶素没食子酸酯脂质体,制备的脂质体的平均粒径为132.74 nm,与本研究所制备的脂质体粒径相当。脂质体多分散指数(PDI)为0.14,PDI与脂质体的稳定性紧密相关,当PDI值≥1.0,脂质体均一性较差,而PDI值≤0.30,表明60%以上的脂质体粒径大小相当[23],均一性较好,符合要求。Zeta电位是评价脂质体分散稳定性的重要参数,如图4b所示,本文所制备的脂质体电位为-14.07 mV,为带负电的脂质体,而Zeta电位是评价脂质体制剂分散稳定性的重要参数,Zeta电位不仅可表征粒子的表面电荷,而且可用于分析粒子间排斥力,可以预测分散体的稳定性,理论上电荷脂质体带负电荷越多其越稳定。朱顺耀等[24]采用改良逆相乙醇注入法制备唾液酸修饰的绿原酸脂质体,其Zeta电位为-25.3 mV。此外,研究发现DSPE-PEG2000也可以增加脂质体的空间位阻,使脂质体更加稳定[15]。
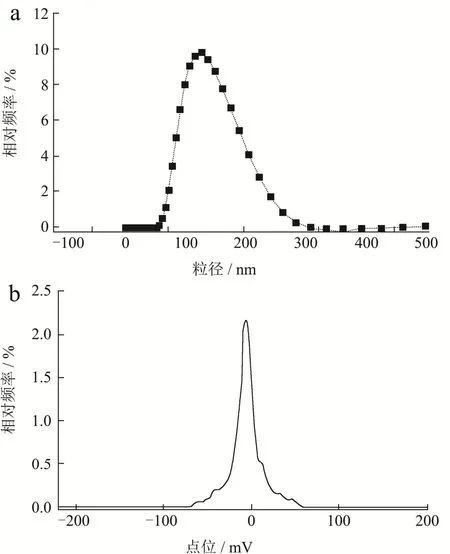
图4 聚乙二醇修饰木犀草素脂质体粒径分布及Zeta电位图Fig.4 Distribution of particle size and Zeta potential of luteolin liposome modified by polyethylene glycol
2.5 聚乙二醇修饰木犀草素脂质体的形貌
如图5,聚乙二醇修饰木犀草素脂质体呈均一透明,具有蓝色乳光的胶体形态(图5a),且在激光照射下能产生丁达尔效应(图5b),表明制备的脂质体状态较好。用磷钨酸负染于透射电镜下观察木犀草素脂质体和聚乙二醇修饰木犀草素脂质体形态(图5b),观察到木犀草素脂质体(图5c)和聚乙二醇修饰木犀草素脂质体(图5d)外观比较圆整,多数为球形,且大小较为均一,少数形状不规则。
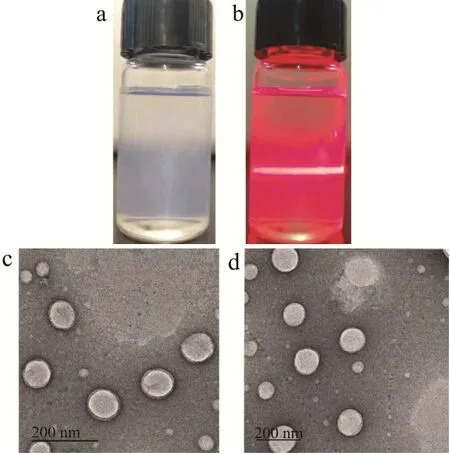
图5 木犀草素脂质体形貌特征Fig.5 Morphology of luteolin liposome
2.6 聚乙二醇修饰木犀草素脂质体在体外不同模拟液的释放曲线
以取样时间为横坐标,以木犀草素累积释放率为纵坐标,结果如图6所示,聚乙二醇修饰木犀草素脂质体在胃、小肠和结肠模拟液中累积释放量分别为39.08%、43.67%和71.71%。
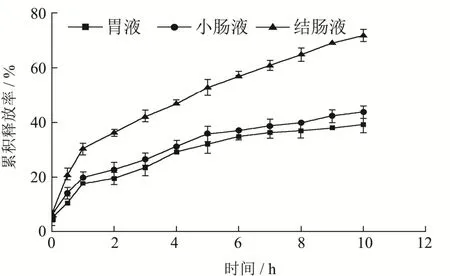
图6 聚乙二醇修饰木犀草素脂质体在不同模拟液中的释放曲线Fig.6 Release kinetics of luteolin liposome modified by polyethylene glycol in different simulated medium
3 结论
木犀草素具有多种药理作用,但水溶性差,因此将其制备成脂质体不仅可提高溶解度,而且可增加生物利用度。本文以木犀草素包封率为评价指标,结果表明水化温度和超声时间对脂质体包封率的影响较小,进而应用响应面方法优化蛋黄卵磷脂和DSPE-PEG2000含量,获得制备工艺参数,构建聚乙二醇修饰木犀草素的脂质体。经优化后所制备的聚乙二醇修饰木犀草素脂质体平均粒径为134.1 nm,Zeta电位为-14.07 mV,平均包封率为86.30%,且体外缓释性良好。
