原发性胆汁性胆管炎动物模型的研究进展
2021-11-04徐雅菲赵志斌廉哲雄
徐雅菲, 赵志斌, 廉哲雄
1 华南理工大学 医学院, 广州 510006; 2 广东省人民医院, 广州 510000
原发性胆汁性胆管炎(PBC)是一种由免疫系统对肝内中小胆管上皮细胞特异性攻击引起的自身免疫性肝病,多发于中老年女性,其发病原因和机制尚不清楚。通常患者血清学特征包括高滴度的抗线粒体抗体(AMA),高水平的ALT、ALP和高水平的促炎性细胞因子,如IFNγ、TNFα等。肝脏组织学特征包括门静脉区淋巴细胞浸润,早期的胆管周围肉芽肿形成、肝门静脉区嗜酸性粒细胞浸润和选择性中小胆管破坏(也称为非化脓性破坏性胆管炎),晚期可发展为纤维化,最终可能进展为肝硬化甚至肝癌,但病情严重程度和时间进展在患者之间差异很大[1]。其中AMA是PBC高度疾病特异性的血清指标,90%~95%的PBC患者可测到AMA阳性,对于PBC的诊断有非常重要的意义,然而AMA滴度与PBC疾病严重程度无关,其在PBC疾病发展中的作用尚不清楚[2]。为了加深对PBC疾病本身的认识,同时帮助临床医师在探究PBC疾病机制和寻找新疗法的研究中更科学、合理地选择工具,本文讨论了多种PBC动物模型的建模原理和疾病特征。
1 基因编辑小鼠
基因编辑小鼠通过基因编辑技术对特定目标基因进行修饰,引起免疫调节缺陷,使其自发产生类似于PBC的自身免疫反应,常用的基因编辑PBC小鼠模型研究进展如下。
1.1 TGFβ Ⅱ型受体(dominant-negative transforming growth factor-β receptor type Ⅱ, dnTGFβRⅡ)小鼠 dnTGFβRⅡ小鼠在CD4启动子的控制下,过表达显性失活dnTGFβRⅡ,通过干扰TGFβ和TGFβ Ⅰ、Ⅱ型受体组成的功能信号复合体的组装,特异地阻断T淋巴细胞中的TGFβ信号通路[3]。
该模型模拟了人类PBC疾病早期的关键临床特征,在PBC免疫学发病机制研究中得到广泛应用。血清学上,dnTGFβRⅡ小鼠自发产生AMA。22~24周龄时,分别有100%、95%和68%的小鼠血清显示抗PDC-E2、OGDC-E2和BCOADC-E2抗体阳性。组织病理学上,肝脏门静脉区有中度至重度淋巴细胞浸润,主要为CD4+和CD8+T淋巴细胞,也可见B淋巴细胞、NK细胞、单核/巨噬细胞,并且其浸润程度与胆道破坏相关。此外,小鼠血清中IFNγ、TNFα、IL-6和IL-12p40水平升高,这也与人类PBC血清细胞因子谱相似。进一步过继转输实验结果提示,CD8+T淋巴细胞是导致dnTGFβRⅡ小鼠PBC样症状的关键效应细胞,而CD4+T淋巴细胞主要与小鼠并发的结肠炎相关[3]。
最新的研究[4]表明,雌性dnTGFβRⅡ小鼠肝脏中出现更严重的淋巴细胞浸润,具有更高水平的炎症因子。该小鼠模型的缺点是门静脉区未见明显的嗜酸性粒细胞浸润和肉芽肿[5]。另外,小鼠模型中未见循环IgM的持续升高,而是出现IgA水平升高[3]。该小鼠主要的并发症是3~4月龄出现严重的炎症性肠病,其胃、十二指肠、胰腺和肾脏中也观察到轻度单个核细胞浸润[3]。
1.2 腺嘌呤尿嘧啶富集元件(adenylate uridylate-rich element, ARE)-Del-/-小鼠 ARE-Del-/-小鼠,通过缺失IFNγ基因3′端非翻译区的ARE而导致IFNγ的慢性持续表达[6]。
ARE-Del-/-小鼠发病具有明显的性别倾向性,雌性不仅发病率高于雄性,且疾病严重程度更高。雌性8~10周龄的ARE-Del-/-小鼠血清中可检测到高滴度的抗PDC-E2、BCOADC-E2和OGDC-E2的AMA;相比之下,8~10周龄的雄性小鼠仅可检测到抗PDC-E2抗体,并且随年龄增长而消退,在20周龄时3个表位的AMA均不能检测到。肝脏病变方面,20周龄的雌性小鼠显示有中度至重度的门静脉淋巴细胞浸润,而雄性小鼠仅有轻度至中度浸润。此外,雌性小鼠的门静脉和小叶炎症、小胆管破坏和肉芽肿形成更为严重,部分可见轻度纤维化,而在雄性小鼠中纤维化程度较低或检测不到。20周龄的雌性ARE-Del-/-小鼠总胆汁酸上调,其AST和ALT水平均显著升高。促炎细胞因子方面,雌性小鼠血清中IFNγ和TNFα水平也更高。此外,过继转输实验表明CD4+T淋巴细胞是导致肝门静脉炎症的主要致病细胞[7]。
肝脏RNA测序显示,雌性小鼠比雄性更富集1型和2型IFN信号及淋巴细胞介导的免疫反应相关基因,这可能是ARE-Del-/-小鼠表现出雌性倾向的原因[7]。该模型与临床PBC不同的是检测不到ALP,且肝纤维化程度较轻。由于ARE-Del-/-小鼠在4个月大时产生抗DNA抗体并表现出肾小球肾炎的特征,它也被作为系统性红斑狼疮的动物模型[6]。
1.3 NOD.c3c4小鼠 NOD.c3c4小鼠是非肥胖型糖尿病(non obesity diabetic, NOD)模型的同源小鼠,在3号和4号染色体上插入B6/B10品系来源的胰岛素依赖性糖尿病抗性等位基因[8]。
NOD.c3c4小鼠在9~10周龄时,有56%自发产生抗PDC-E2的自身抗体,但随着年龄的增长AMA水平下降。值得注意的是,部分小鼠抗PDC-E2自身抗体呈阴性,但可见明显的组织学性自身免疫性胆道疾病。病理上,胆道上皮细胞受累区域有CD4+、CD8+T淋巴细胞和pDCA1+树突状细胞等浸润,可见破坏性胆管炎。部分小鼠还显示出其他与人类PBC类似的症状,包括嗜酸性粒细胞浸润、上皮样肉芽肿样病变和早期肝纤维化。该小鼠的CD4+T淋巴细胞和CD8+T淋巴细胞单独均可以致病,说明T淋巴细胞在疾病过程中的关键作用[8]。
该模型最大的缺点是自身免疫的初始攻击位置与临床不同。临床上PBC发病起于免疫系统对肝内中小胆管的攻击,而NOD.c3c4小鼠的初始损伤是由发生在胆总管界面的免疫反应引起的。随着疾病的进展,NOD.c3c4小鼠的病理从胆总管扩散到肝内胆管,并表现出胆总管炎症扩张和囊性病变。20~30周龄的NOD.c3c4小鼠中发现明显的肝脏胆道多囊病[8]。另外,该模型检测不到ALP,血清中IgM和IgA均升高,AMA发生率较低等原因限制了NOD.c3c4小鼠在研究中的应用。
1.4 Scurfy小鼠 Scurfy小鼠由于Foxp3基因突变引起Foxp3蛋白的缺失,导致Foxp3+Treg细胞完全消失,从而打破肝脏免疫耐受[9]。
3~4周龄的Scurfy小鼠血清均可检测到高滴度的IgG、IgA和IgM型抗PDC-E2自身抗体。此外,小鼠肝实质和大部分肝门静脉区域都有中度到重度的淋巴细胞浸润,且与胆管损伤密切相关。该小鼠肝脏部分汇管区的胆管消失,在肝实质中观察到不同程度的炎症坏死变化,并可见中性粒细胞、嗜酸性粒细胞浸润。小叶间胆管被炎性细胞包围,并呈退行性改变。该小鼠模型胆管损伤主要由CD8+T淋巴细胞介导[9]。另外,Scurfy小鼠血清中炎症因子TNFα、IFNγ、IL-6、IL-12p40和IL-18水平显著升高[10]。
Scurfy小鼠的局限性是免疫耐受打破严重,自发全身性的自身免疫性疾病,且寿命只有4周左右,不利于对PBC发病过程及进展机制的探究[10]。
1.5 IL-2Rα (CD25)-/-小鼠 IL-2Rα/CD25可以转导淋巴细胞增殖的信号,并且是Treg细胞增殖、发育和活化的关键因子[11]。
IL-2Rα-/-小鼠血清均可检测到IgG和IgA型的抗PDC-E2自身抗体。血清中细胞因子IFNγ、TNFα、IL-2和IL-12p40水平升高[12]。病理上,肝门静脉区有中度淋巴细胞浸润,导致胆管破坏。其浸润淋巴细胞主要是CD4+和CD8+T淋巴细胞,CD8+T淋巴细胞占优势并从门静脉区进入肝实质区域。此外,IL-2Rα-/-小鼠肝脏还有轻度界面肝炎,肝小叶可见少量CD4+或CD8+T淋巴细胞,少数情况下中央静脉附近有明显浸润。
IL-2Rα-/-小鼠肝脏病理与人类PBC不同的是,没有肉芽肿或嗜酸性粒细胞浸润[12]。与缺乏IL-2R其他成分的小鼠一样,该小鼠模型会发生严重贫血、淋巴组织增生性自身免疫性疾病和溃疡性结肠炎样疾病[13],然而与人类结肠炎相关的肝胆疾病是原发性硬化性胆管炎(PSC),而不是PBC。在IL-2Rα-/-小鼠模型中,CD4+T淋巴细胞的缺失可抑制其结肠炎症,而CD8+T淋巴细胞的缺失可减轻其胆管损伤和肝门静脉炎症[13]。在8~20周龄,大约25%的IL-2Rα-/-小鼠因重度贫血死亡[12]。
1.6 IL-2Rα-/-IL12-p40-/-小鼠 IL-12p40可调节许多T淋巴细胞介导的自身免疫性疾病[14],而IL-2Rα-/-小鼠模型中观察到血清IL-12p40水平升高[12]。在IL-2Rα-/-小鼠的基础上敲除IL-12p40发现IL-12p40发挥双重作用:IL-12p40的缺失一方面抑制了IL-2Rα-/-模型并发的结肠炎,另一方面加重了自身免疫性胆管炎,并促进其向肝纤维化发展,由此形成一个新的PBC小鼠模型[15]。
IL-2Rα-/-IL12-p40-/-小鼠表现出比IL-2Rα-/-模型更严重的肝门静脉炎症和胆管损伤,肝门静脉区浸润大量CD4+和CD8+T淋巴细胞,部分小鼠出现门静脉高压和肝纤维化。ALT水平显著高于IL-2Rα-/-模型鼠。并且IL-12p40的缺失导致IFNγ反应增强,肝脏中TNFα也上调[15]。此外,部分小鼠发生脾肿大[15],而在PBC患者中,发生门静脉高压症的患者存在脾肿大现象[16]。相比于IL-2Rα-/-模型,IL-2Rα-/-IL12-p40-/-小鼠肝脏浸润的T淋巴细胞中CD4+T、CD8+T淋巴细胞都增多,其中CD8+T淋巴细胞的效应记忆性细胞亚群比例增加[15]。CD4抗体治疗和CD4缺陷的IL-2Rα-/-IL12-p40-/-小鼠PBC样症状无缓解,而CD8抗体治疗和CD8缺陷的IL-2Rα-/-IL12-p40-/-小鼠肝脏炎症被抑制,说明CD8+T淋巴细胞是该模型鼠的主要致病细胞[17]。”
与人类PBC常见的情况相似,IL-2Rα-/-IL12-p40-/-小鼠并发干燥综合征[17]。干燥综合征是一种以眼睛、口腔和其他黏膜组织过度干燥为特征的自身免疫性疾病。这两种疾病都由过度活化的浸润性淋巴细胞导致上皮结构严重损伤引起,因此被认为是具有重叠特征的自身免疫性上皮炎[18]。该模型的另一个并发症是自身免疫性骨髓纤维化,表现出贫血和髓外造血的特征,但临床PBC患者并没有这样的并发症[19]。

15月龄的Ae2a,b-/-小鼠中80%自发地产生了抗PDC-E2的AMA,且血清IgM和IgG水平升高。6月龄的小鼠中检测到ALP升高,15月龄时更高,随着时间的推移,它们的免疫反应性有增加的趋势。大约三分之一的小鼠有广泛的肝门静脉炎症,但程度不一,部分在受损的小叶间胆管周围可观察到单个核细胞浸润和轻度纤维化,偶尔出现嗜酸性粒细胞浸润。严重病变的肝脏显示门静脉区有大量CD4+和CD8+T淋巴细胞,且围绕受损的胆管分布。该模型也有脾肿大现象[23]。
2 诱导小鼠模型
诱导小鼠模型,通过打破对特异性自身抗原或抗原模拟物的耐受性,来诱导自身免疫性胆管炎。诱导效果受动物本身条件、自身抗原或抗原模拟物的性质和佐剂等变量影响。
2.1 2-辛炔酸(2OA)-BSA免疫小鼠 研究[24-26]表明AMA能和一些分子模拟物发生交叉反应,其中筛选出了2OA,它能被AMA识别为一种高活性的半抗原。2OA在自然界中不存在,但这种化合物的甲基和乙基酯广泛应用于香水、口红、肥皂、洗涤剂、乳霜、乳液和许多常见的食品调味料[25-27]。由此在C57BL/6小鼠上建立2-辛炔酸偶联牛血清白蛋白(2-octynoic acid coupled to bovine serum albumin, 2OA-BSA)诱导小鼠模型[28]。
经2OA-BSA免疫8周后,100%的小鼠血清出现抗PDC-E2抗体阳性。免疫12周后,肝门静脉中有大量的CD4+和CD8+T淋巴细胞浸润,门静脉区损伤胆管周围常可见淋巴细胞轻度浸润,以及与临床PBC相似的导管减少、散在于门静脉区和肝实质的上皮样肉芽肿,肝实质也有小区域的轻度局灶性坏死现象。免疫4~12周的小鼠血清中均检测到TNFα和IFNγ明显升高。免疫小鼠肝组织中CD4+T淋巴细胞比例降低,同时CD8+T淋巴细胞比例增加,并且CD8+T淋巴细胞参与了2OA-BSA免疫小鼠胆管炎的免疫发病机制[28]。
2OA-BSA诱导小鼠模型的缺点包括检测不到胆汁淤积酶和不能进展为肝脏纤维化[28]。此外,利用另一种对胆道疾病易感性更高的小鼠品系NOD.1101小鼠,建立2OA-BSA诱导模型,结果显示更严重的PBC样症状。免疫仅2周后,100%的NOD.1101小鼠血清均呈现抗PDC-E2抗体阳性。与2OA-BSA免疫的B6小鼠相比,2OA-BSA免疫的NOD.1101小鼠肝门静脉炎症中观察到大量的粒细胞,与人类PBC早期肝脏的粒细胞浸润相似[29]。
总的来说,该模型适于用来探究导致肝脏浸润和产生AMA的PBC早期发病过程,并且疾病表型与所用的动物背景和佐剂密切相关。
2.2 2OA-poly I∶C联合免疫小鼠 聚肌苷酸-聚胞苷酸(polyinosinic polycytidylic acid, poly I∶C)是一种病毒RNA模拟物,通过TLR-3诱导IFNα免疫应答[30]。poly I∶C免疫模型诱导8周后,在小鼠肝门静脉区观察到明显的单个核细胞浸润。免疫16周后,在80%~100%的poly I∶C注射小鼠血清中检测到AMA阳性。伴有血清ALT和ALP升高[31-32]。但poly I∶C诱导模型疾病较轻,胆管上皮细胞未见结构改变[32],只能模拟早期的PBC症状。
在2OA诱导模型的基础上,联合使用poly I∶C免疫可以诱导更明显的PBC样症状[33]。虽然小鼠的自身抗体水平与单独2OA-BSA免疫模型相似,但在肝脏病理上,poly I∶C联用显著促进了2OA免疫小鼠的疾病进展,包括淋巴细胞浸润、肉芽肿和胆管损伤。尤其是联合免疫小鼠在肝门静脉区和肝实质中发现嗜酸性粒细胞浸润,部分小鼠出现肝纤维化。此外,血清炎性细胞因子IFNγ、TNFα、IL-12p40和IL-6的水平显著升高。在poly I∶C单独免疫小鼠中肝脏没有显示明显的CD8+T淋巴细胞浸润,但poly I∶C联用使2OA免疫小鼠的肝脏中聚集了更多的效应CD8+T淋巴细胞,表明poly I∶C不能单独诱导CD8+T淋巴细胞的活化,但能诱导细胞毒性效应CD8+T淋巴细胞进入肝脏,这可能是poly I∶C促进2OA免疫小鼠PBC疾病进展的原因。另外,poly I∶C给药导致的炎性粒细胞积累可能加重小鼠局部肝脏炎症和2OA-BSA诱导的自身免疫性胆管炎[33]。
3 小结
PBC发病机制尚不清楚,目前一般认为这种慢性肝病是由基因和环境诱导因子共同作用导致的,并且大约三分之一的PBC患者会合并其他自身免疫性疾病[34]。目前仅有熊去氧胆酸和奥贝胆酸两种对症药物,并且药物治疗只能缓解病情、减慢疾病发展速度,尚无治愈PBC的方法[35]。因此需要更深入地探究PBC的发病机制,加强对这种疾病的理解,并寻找新的治疗靶点。
由于PBC早期临床组织样本较难获得,基于动物模型的研究对于探究PBC的发生发展机制和开发新的治疗方案显得尤为重要。在对PBC疾病机制的探究过程中,有许多动物模型起到了重要作用。然而,迄今为止,没有一个单一的模型完全模仿人类PBC的所有病理特征。表1列出了不同PBC模型的造模原理、优缺点、并发症和主要致病细胞,对部分模型给出了选择建议。了解PBC动物模型的建模原理和疾病特征,既有利于加深对PBC疾病特性的认识,也有助于研究者对研究工具的选择。
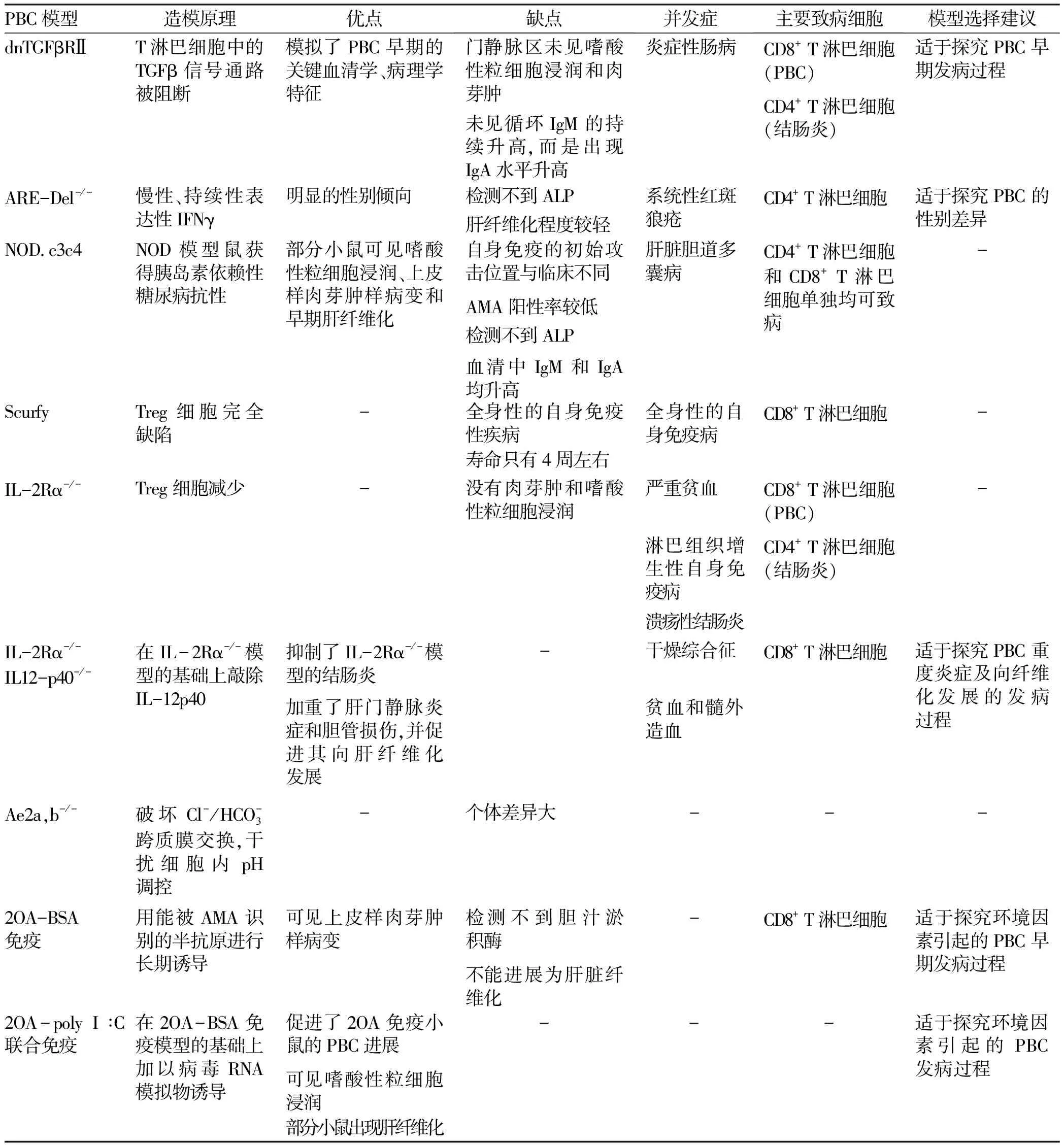
表1 不同PBC模型特点比较
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:徐雅菲、赵志斌、廉哲雄参与起草和修改文章关键内容。
