精氨酸血管加压素对海水浸泡合并非控制性失血休克大鼠复苏效果的观察
2021-10-25周孝伟彭小勇田昆仑刘良明
王 莉,周孝伟,彭小勇,田昆仑,刘良明,李 涛
陆军军医大学大坪医院战伤休克与输血研究室,创伤、烧伤与复合伤国家重点实验室,重庆 400042
失血性休克是严重战创伤中常见的并发症,其所致死亡占创伤早期死亡的50%[1]。我国海域辽阔,海战是未来重要的作战形式。海洋环境发生战创伤时,战创伤出血伤者遭受低温海水浸泡后,形成低温海水浸泡合并创伤失血的复合伤,可加速和加重失血性休克损伤,机体生理代谢功能在短时间内迅速恶化,严重威胁伤者生命[2]。针对其救治措施的研究对提高海战伤救治水平有重要意义。
关于常规环境非控制性失血休克的救治研究,近年来提出了许多新的观念和措施,如低压复苏、延迟复苏等,对提高休克救治的效果有显著作用。但无论是低压复苏还是延迟复苏,伤员均处于相对低的血压水平,组织灌注相对不足,致其后送时间有限,器官功能损伤也较重。 在海战伤海水浸泡环境下,由于后送距离更长,单纯液体复苏不能满足海水浸泡联合非控制性失血休克伤员的救治,需要寻找新的措施来改善救治效果。精氨酸血管加压素(arginine vasopressin,AVP)是一种血管活性药物,以往研究发现低剂量AVP可以维持组织灌流,改善器官功能[3],但是AVP能否在海战伤合并非控制性失血休克早期救治中发挥作用不清楚。本项目采用低温海水浸泡联合非控制性失血休克大鼠模型模拟海战伤,观察AVP在海战伤早期急救中的复苏效果,为海战伤早期救治提供实验基础。
材料与方法
1 实验动物与分组
Sprague-Dawley(SD)雄性大鼠72只, 14~16周龄,体重(230±20)g,由陆军军医大学大坪医院实验动物中心提供(动物伦理证明批号:AMUWEC20161289)。实验前大鼠禁食12h、自由饮水。按随机数字表法将SD大鼠分为单纯乳酸林格液(lactated ringer’s solution,LR)复苏对照组(LR组)、去甲肾上腺素(norepinephrine,NE)联合LR复苏组(NE组)、AVP联合LR复苏组(AVP组),各24只。大鼠实验和饲养过程严格遵守实验动物管理与保护准则。
2 动物模型制备
参照本实验室建立的大鼠海水浸泡合并非控制性失血休克方法制作动物模型[4-5]:SD大鼠经3%戊巴比妥钠腹腔麻醉,右侧颈动脉插管用于放血和监测血压,颈静脉插管用于输注复苏液体。插管后稳定10min,大鼠腹中线开腹,暴露脾脏,用眼科剪从脾动脉分支间剪开脾实质,并切断其中一支脾动脉分支,使大鼠处于失血状态,关闭腹腔。同时将大鼠置于15℃人工配置的海水[参照国家海洋局第三研究所配方配置:海盐浓度:2.535%,pH:8.2,渗透压:(12501±1.52)mmol/L,K+:(10.88±0.68) mmol/L,Na+:(630±5.33) mmol/L,Cl-:(658.8±5.25) mmol/L]中。大鼠 40min~1h失血量达全身血容量的40%,平均动脉压下降至40mmHg,即非控制性失血休克模型制作成功。从大鼠入水开始计时,在海水中浸泡1.5h后开始后续实验。
3 实验设计及检测指标
本实验设计共分为四个阶段,第Ⅰ阶段为模型制作阶段(如前所述)。第Ⅱ阶段大鼠在海水中浸泡完毕后将其移入43℃复温箱中进行阶梯复温,同时开始低压复苏。各组大鼠分别采用不同方案进行复苏,使平均动脉压稳定在50~60mmHg,1h。LR组采用LR复苏;NE组是在LR中加入0.5μg/kg NE复苏;AVP组是在LR中加入0.1U/kg AVP复苏[2]。复苏结束后结扎脾动脉止血,缝合腹部伤口,记录失血量并计算失血率(失血率=失血量/血容量)。第Ⅲ阶段即确定性治疗:各组大鼠继续采用如前液体进行复苏,维持平均动脉压70~80mmHg 2h。分别记录第Ⅱ、Ⅲ阶段输液量。第Ⅳ阶段为观察阶段,复苏结束后2h时取大鼠血样检测凝血功能和血气,最后观察大鼠存活情况。实验方案设计见图1。
4 统计学分析
结 果
1 AVP对海水浸泡合并非控制性失血休克大鼠失血率的影响
海水浸泡合并非控制性失血休克后,在彻底性止血前(第Ⅱ阶段)平均动脉血压维持在50~60mmHg,不同液体复苏方案对大鼠失血率有不同影响。LR组失血率(52±6.0)%;NE组失血率会进一步增加,但AVP组失血率会降低至(49±3.6)%,各组失血率统计学比较,P>0.05。见图2。
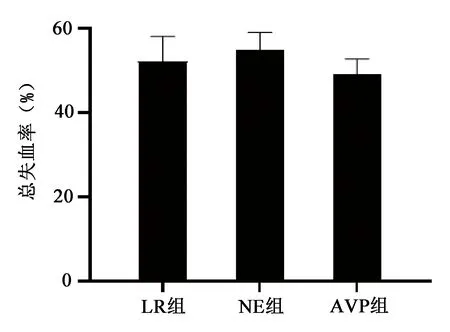
图2 AVP对海水浸泡合并非控制性失血休克大鼠失血率的影响
2 AVP对海水浸泡合并非控制性失血休克大鼠复苏液体量的影响
海水浸泡合并非控制性失血休克大鼠采用不同药物复苏后,各组间复苏液体量有显著差异: AVP组复苏液体量显著少于LR组(P<0.01),NE组液体复苏量与LR组和AVP组无显著差异(P>0.05)。各组大鼠在低压复苏阶段(阶段Ⅱ)复苏液体量无显著差异(P>0.05),差异主要表现在彻底止血后的确定性治疗阶段(阶段Ⅲ):LR组复苏液体量为(66.7±5.63)mL;AVP组复苏液体量显著降低(P<0.01); NE组复苏液体量虽有所减少,但与LR组比较,P>0.05。由于在确定性治疗阶段(阶段III)AVP组复苏液体量显著减少,因此,AVP组复苏液体总量显著少于LR组,NE组复苏液体总量与LR组比较,P>0.05。见表1。
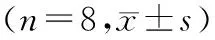
表1 AVP对海水浸泡合并非控制性失血休克大鼠复苏液体的影响
3 AVP对海水浸泡合并非控制性失血休克大鼠致死三联征的影响
核心温度:海水浸泡合并非控制性失血休克后,各组大鼠核心体温均显著降低至33℃左右。根据前期实验结果提示阶梯复温有利于提高低温海水浸泡大鼠的核心体温。本实验中大鼠经海水浸泡后先移至43℃复温箱中复温至34℃,然后将大鼠移至室温环境继续复温,各组大鼠核心体温均显著升高,维持在37℃左右,差异无统计学意义(P>0.05)。
凝血功能:海水浸泡合并非控制性失血休克后大鼠凝血功能受损(数据未显示)。经不同药物复苏后,AVP组凝血功能显著改善。LR组复苏后凝血酶原时间国际化比值(PT-INR)、凝血酶原时间(PT)、活化部分凝血活酶时间(APTT)和纤维蛋白原(FIB)与休克末比无显著改善。AVP组复苏后PT-INR、PT和APTT较LR组缩短,其中PT-INR和PT差异显著(P<0.05,P<0.01),分别为(2.0±0.11)s和(23.2±1.20)s。NE组复苏后各项凝血指标较LR组有一定程度改善,但无显著差异(P>0.05)。因此,AVP对海水浸泡合并非控制性失血休克大鼠凝血功能的改善优于LR和NE。见表2。
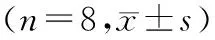
表2 AVP对海水浸泡合并非控制性失血休克大鼠凝血功能的影响
血气分析:海水浸泡后各组大鼠pH值均降低,不同药物复苏后各组大鼠pH值均回复至7.3左右,基本纠正了休克后大鼠代谢性酸中毒的状态。进一步分析其它血气指标,各组大鼠氧分压(PaO2)和二氧化碳分压(PaCO2)虽无统计学差异(P>0.05),但AVP组大鼠PaO2较LR组和NE组大鼠有一定程度提高。见表3。
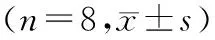
表3 AVP对海水浸泡合并非控制性失血休克大鼠血气的影响
4 AVP对海水浸泡合并非控制性失血休克大鼠存活时间及存活率的影响
海水浸泡合并非控制性失血休克大鼠经不同药物复苏后,LR组中位生存时间为17h,NE组和AVP组中位生存时间分别为20h和36h。LR组平均存活时间为16h,24h存活率仅为25%;与LR组比较AVP组平均存活时间显著延长至26h(P<0.01), 24h存活率为50%(P<0.05)。NE组平均存活时间、24h存活率与LR组无显著差异(P>0.05)。见图3。

图3 AVP对海水浸泡合并非控制性失血休克大鼠存活的影响(n=16)。a.存活时间;b.存活率。与LR组比较:*P<0.05,**P<0.01
讨 论
海水浸泡合并非控制性失血休克是海战及海难中的常见复合型创伤,由于海上环境的特殊性致伤员后送时间延长,复苏液体运输不便,因此陆地失血性休克早期救治技术效果有限。LR是经典的晶体复苏液,能改善休克患者血容量,但其血流动力学维持效率有限[6]。海上救治在复苏液体有限的条件下,寻找新的措施改善海水浸泡合并非控制性失血休克伤员的早期救治效果,延长黄金救治时间,对降低伤员病死率有重要意义。本研究发现AVP有利于减少海水浸泡合并非控制性休克大鼠出血率,显著减少复苏输液量,改善“致死三联征”症状,显著延长大鼠的存活时间,提高存活率。
AVP是下丘脑合成的神经垂体激素,它可以通过与G蛋白偶联受体相互作用,发挥血管收缩功能,改善休克过程中的血管扩张和低血压[7-8]。本研究观察到AVP能减少海水浸泡合并非控制性失血休克大鼠失血率,NE则增加大鼠失血率。NE作为常用的抗休克药物,和AVP一样具有血管收缩作用,但NE缩血管作用较强,休克早期液体复苏过程中强烈的血管收缩,虽然有利于血压的维持,但强烈的血管收缩和升压作用会加重出血,导致血容量进一步减少。而AVP缩血管作用较NE弱,在维持血压的同时不会增加出血量。同时,本研究发现AVP较NE能显著减少休克大鼠的复苏液体总量,尤其第Ⅲ阶段复苏液体量显著减少,这可能也与AVP减少出血有关。因此AVP可通过适当的血管收缩,维持血压,减少出血,在复苏液体有限的条件下发挥良好的复苏作用。
海水浸泡合并非控制性失血休克易诱发“致死三联征”——低温、酸中毒和凝血功能障碍[9]。低温是海水浸泡伤的重要特点,低温合并失血可加重机体缺血缺氧,减少组织灌流,诱发酸中毒等,是导致机体功能障碍的重要原因[10-11],因此复温是低温海水浸泡合并失血性休克患者急救的第一需要[12]。笔者前期研究发现阶梯复温能有效恢复海战伤合并非控制性失血休克大鼠的核心体温,因此本实验对低温海水浸泡大鼠首先采取阶梯式复温,将各组大鼠核心体温均提升至37℃左右,有效减轻低温对机体生理代谢功能的影响。然后通过不同药物方案复苏,较好地纠正海战伤合并非控制性失血休克引起的代谢性酸中毒,使血液pH值回复至7.3左右。
凝血功能检测发现AVP可显著缩短PT-INR和PT,这可能与既往研究发现的小剂量AVP可增加整体动物血管反应性有关[13],血管收缩可减小血管壁创面,同时减少血小板和纤维蛋白的损耗,使凝血时间缩短。同时AVP可提高休克大鼠PaO2至(153.0±14.49)mmHg,可能由于AVP一方面通过适当的血管收缩,减少出血,维持组织器官灌流;另一方面AVP能改善失血所致的心肌收缩力降低[14],增加心输出量,减轻组织器官如肺组织的缺血缺氧[15],从而改善呼吸,提高PaO2。AVP通过减少出血、改善凝血功能障碍、纠正酸中毒和增加PaO2,有利于器官功能保护,因此AVP组存活时间和存活率均显著高于其余两个实验组。本实验中NE组凝血功能和血气与LR组复苏无显著差异,原因可能是NE具有较强的血管收缩作用,过度的血管收缩会加重低温环境下组织器官灌流不足和缺血缺氧,导致机体功能及代谢改善不显著。此外,有研究者发现低温环境下NE的作用会被抑制[16],这也可能是NE在低温海水浸泡合并非控制性失血休克大鼠模型中复苏效果不显著的原因。
综上所述,AVP能明显减少海水浸泡合并非控制性失血休克大鼠早期救治的失血量和复苏液体需求量,显著改善休克大鼠的凝血功能和血气,延长大鼠存活时间,提高存活率,具有较好的早期复苏效果。由于海水浸泡合并非控制性失血休克的伤情特点较陆地失血性休克更加复杂多变,对休克早期救治提出了更高的要求。本研究仅初步探索了AVP在海水浸泡合并非控制性失血休克中的作用,但如何根据休克的发生发展细化用药剂量、给药途径以及联合用药等,尚需进一步研究。