运用细胞代谢组学策略探究蒲公英提取物的抗肿瘤作用机制
2021-10-22高孜博王艺琳何磊良玉崧成田咏梅吴拥军刘利娥
满 瑾,韩 培,高孜博,王艺琳,何磊良,于 斐,玉崧成,田咏梅,吴拥军,刘利娥,王 佳
1)郑州大学公共卫生学院卫生毒理学教研室 郑州 450001 2)郑州市纳米医学与卫生检验重点实验室 郑州 450001
蒲公英是一种多年生开花菊科草本植物[1];它的形态和分类复杂,有近2 500种,在我国大部分地区广泛分布。中医认为蒲公英性属寒,味甘苦,可清热解毒、利尿通淋[2]。蒲公英提取物(extract from taraxacum monogon,ETM)也被广泛用于利尿、抗菌消炎等方面[3]。植物化学研究[4]显示ETM中含有非常丰富的黄酮类、内酯类、三萜类等化合物,这些化合物具有良好的抗菌消炎、抗氧化、抗肿瘤等生物活性[5-6],而ETM的抗肿瘤作用更是引起了众多国内外学者的关注,ETM有望成为一种新型的天然抗癌药物[7-8]。
代谢组学是重要的组学技术之一,主要研究生物体受到刺激后相对分子质量小于1 000的代谢产物的变化[9-10]。基于细胞的代谢组学研究已成为发现新的生物标志物、评价药物作用效果、揭示药物作用机制的重要工具[11-12]。细胞等生物体受到刺激后会发生一系列细小且不易察觉的波动和改变,而作为下游产物的小分子代谢物则会随之出现明显变化。利用代谢组学技术可以提供全面的细胞代谢物的瞬时快照,从而反映细胞当下最真实的状态,有助于了解特定干预下细胞代谢产物的变化,为药物的作用机制研究提供线索[9]。因此本研究采用超高效液相色谱-质谱(UPLC-MS)联用技术,观察ETM作用于人非小细胞肺癌A549细胞后细胞代谢组学变化,并结合代谢通路分析对其作用机制进行深入研究,从代谢组学的角度分析ETM的抗肿瘤机制。
1 材料与方法
1.1 细胞、试剂与仪器A549细胞购自中国科学院上海细胞库。ETM(南京泽朗生物科技有限公司),二甲基亚砜(DMSO)(美国Sigma公司),100 mm细胞培养皿(美国Corning公司),胎牛血清(美国Gemini公司),RPMI 1640 培养基(北京索莱宝科技有限公司),甲醇、乙腈(HPLC级,美国Thermo Fisher Scientific公司)。CCK-8试剂盒(日本同仁化学公司),超高效液相色谱-质谱联用仪(UPLC-Vion IMS QTOF,美国Waters公司),色谱柱(ACQUITY UPLC BEH C18色谱柱,2.1 mm×100 mm, 1.7 μm,美国Waters公司)。
1.2 细胞培养将A549细胞培养于含青链霉素双抗以及体积分数10%胎牛血清的RPMI 1640培养基中,置于体积分数5% CO2、37 ℃细胞培养箱中培养。每隔1~2 d换液一次。
1.3 CCK-8实验检测ETM对A549细胞活力的影响用胰蛋白酶消化贴壁生长的细胞,调整细胞密度为4×104个/mL,以每孔100 μL接种于96孔板,置于体积分数5% CO2、37 ℃细胞培养箱中培养24 h使之贴壁。分别用不同质量浓度(0、5、10、25、50、100、200、400、800 mg/L)的ETM处理细胞,每个浓度设4个复孔。24 h后,每孔加入10 μL CCK-8溶液继续培养2 h,用吸光度微平板阅读器测量波长450 nm处吸光度(A)。细胞存活率=[(实验孔A值-调零孔A值) /(对照孔A值-调零孔A值)]×100%。
1.4 ETM干预A549细胞后代谢产物的分离另取细胞培养于100 mm细胞培养皿中,过夜培养使细胞贴壁。分为空白对照组和干预组,分别给予0、25 mg/L ETM处理,每组6个平行样品。24 h后,用预冷的PBS冲洗3次,收集细胞;以1 000 r/min离心5 min,弃上清,收集细胞。加入1 mL体积分数80%冷甲醇溶液以淬灭细胞,静置3 min;用细胞超声仪间断超声(5 s超声,5 s间隔)3 min,整个过程都在冰上操作。之后在4 ℃、15 000 r/min下离心10 min,收集上清,吹干,重新溶解于体积分数80%的乙腈中,14 000 r/min离心20 min,收集上清。
在ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm, 1.7 μm)上进行代谢产物的分离。柱温为40 ℃,流动相为含体积分数0.1%甲酸的水(A)和含体积分数0.1%甲酸的乙腈(B),流速为0.4 mL/min。洗脱梯度如下:0~ 1 min,2%(体积分数,下同) B;1~12 min,2%~70% B;12~18 min,70%~100% B;18~22 min,100% B;22~25 min,100%~2% B。自动进样器的样品室温度为8 ℃。进样量为 5 μL。
质谱使用电喷雾电离源(ESI),采用正、负离子检测模式。优化ESI条件为:正模式和负模式的锥孔电压分别为3 kV和2.5 kV。离子源温度为120 ℃,脱溶剂气温度为500 ℃。气帘气流速和脱溶剂气流速分别为50 L/h和800 L/h。该质谱仪的扫描范围为100~1 200 m/z。扫描时间为0.2 s。
1.5 代谢组学分析将UPLC-MS 获得的总离子色谱图导入Progenesis QI V2.0软件进行去噪、峰识别、峰对齐和积归一化等数据预处理,之后运用在线分析软件MetaboAnalyst 4.0(https://www.metaboanalyst.ca/)进行多元统计分析和单变量统计分析。采用主成分分析(principal component analysis,PCA)及正交偏最小二乘判别分析(orthogonal to partial squares discriminant analysis, OPLS-DA)对数据进行模式识别,分析2组细胞的代谢谱差异。变量权重值(variable important in projection,VIP)>1.0,最大变化倍数(fold change,FC)>2.0,和P<0.05的变量被认为是潜在的差异代谢物。根据误差范围内相对分子质量及相应的二级碎片信息,在HMDB、Chem Spider和KEGG网络数据库中识别化合物。最后,采用MetaboAnalyst 4.0进行代谢通路分析,P<0.05的通路被认为是有意义的通路。
1.6 统计学处理采用SPSS 21.0处理数据。采用单因素方差分析比较不同质量浓度ETM作用后A549细胞存活率的差异,两两比较采用Dunnett′st检验。检验水准α=0.05。
2 结果
2.1 不同质量浓度的ETM对A549细胞存活率的影响不同质量浓度的ETM处理细胞24 h后细胞存活率见表1。由表1可看出,细胞存活率随着ETM浓度的增加有降低的趋势。25 mg/L ETM干预24 h,大多数细胞未死亡,后续选择25 mg/L进行代谢组学研究。
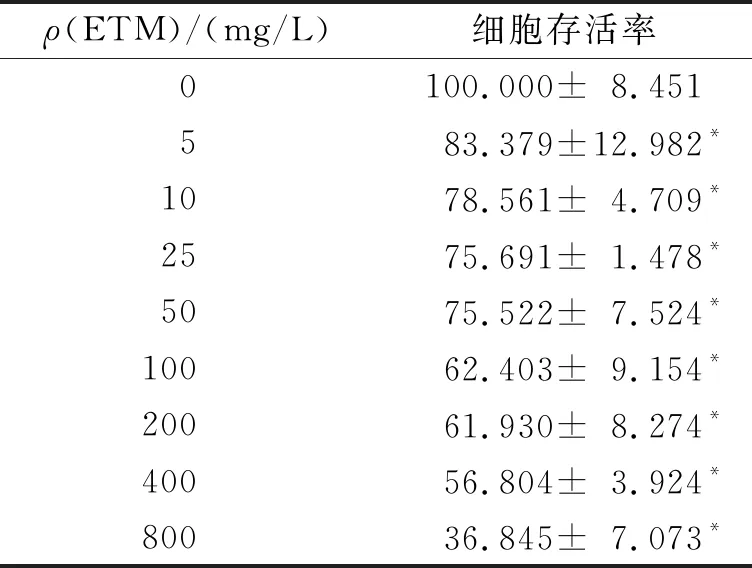
表1 ETM对A549细胞活性的影响(n=4) %
2.2 PCA分析结果见图1。在正离子模式下,第一主成分(PC 1)差异贡献度为 47.7%;在负离子模式下,PC 1差异贡献度为 41.0%。每一个点代表一个样本,样本在PCA得分图中的位置由其所含有的代谢物决定。由得分图可以看出,干预组与空白对照组的代谢物分开明显,说明2组细胞之间的代谢存在差异。
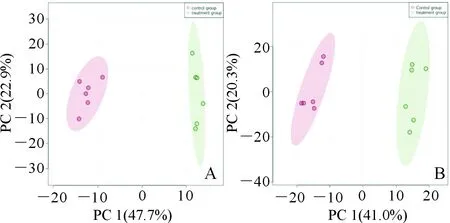
A:正离子模式;B:负离子模式;红色:空白对照组;绿色:干预组;PC 1:第一主成分;PC 2:第二主成分
2.3 OPLS-DA分析结果见图2。正离子模式下R2Y=0.990,Q2=0.975;负离子模式下R2Y=0.989,Q2=0.955,说明模型拟合较好,且由得分图可以看出,2组具有明显的分离趋势,表明2组细胞间存在多种差异代谢物。
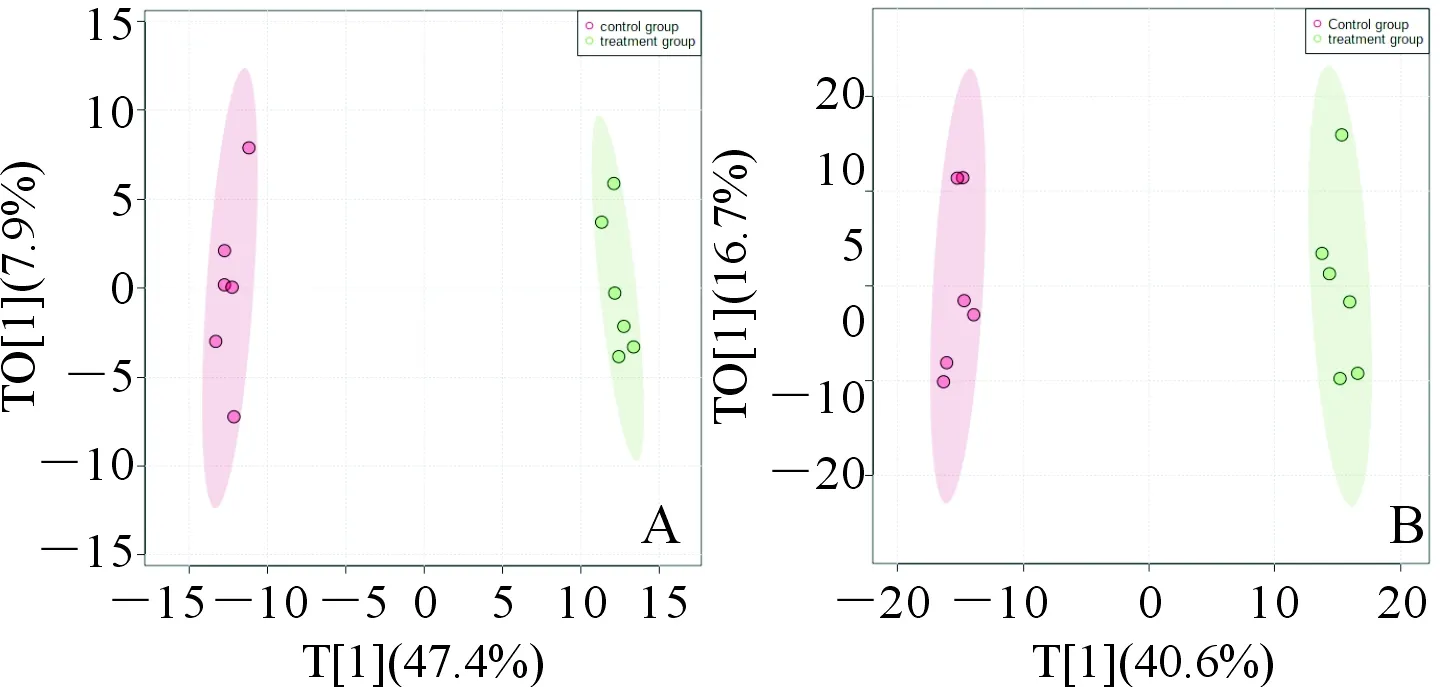
A:正离子模式;B:负离子模式;红色:空白对照组;绿色:干预组;T[1]、TO[1]:分别为主成分的得分和正交成分的得分
2.4 差异代谢物的筛选及其变化趋势分析正负离子模式下,共鉴定出 1 248种化合物。其中,正离子模式下鉴定出399种,负离子模式下鉴定出849种;从中筛选出136种差异代谢物,其中50种差异代谢物上调,86种下调。见图3。在热图上可以直观地显示正离子和负离子模式下差异代谢物的相对含量。由结果可知,干预组和空白对照组间多个代谢物的表达水平发生了显著变化,如:与嘌呤代谢密切相关的鸟苷酸、二磷酸腺苷核糖、甲酰基甘氨酸的含量增加,而天冬氨酸腺苷酸、尿囊酸的含量减少;与嘧啶代谢相关的尿苷二磷酸和胞苷二磷酸的含量增加,胸苷二磷酸的含量减少;与氨基糖和核苷酸糖代谢相关的尿苷二磷酸葡萄糖的含量增加,n-乙酰-d-葡萄糖胺-6-磷酸和藻糖1-磷酸的含量降低;提示ETM干预后,A549细胞的多个代谢通路发生了紊乱。
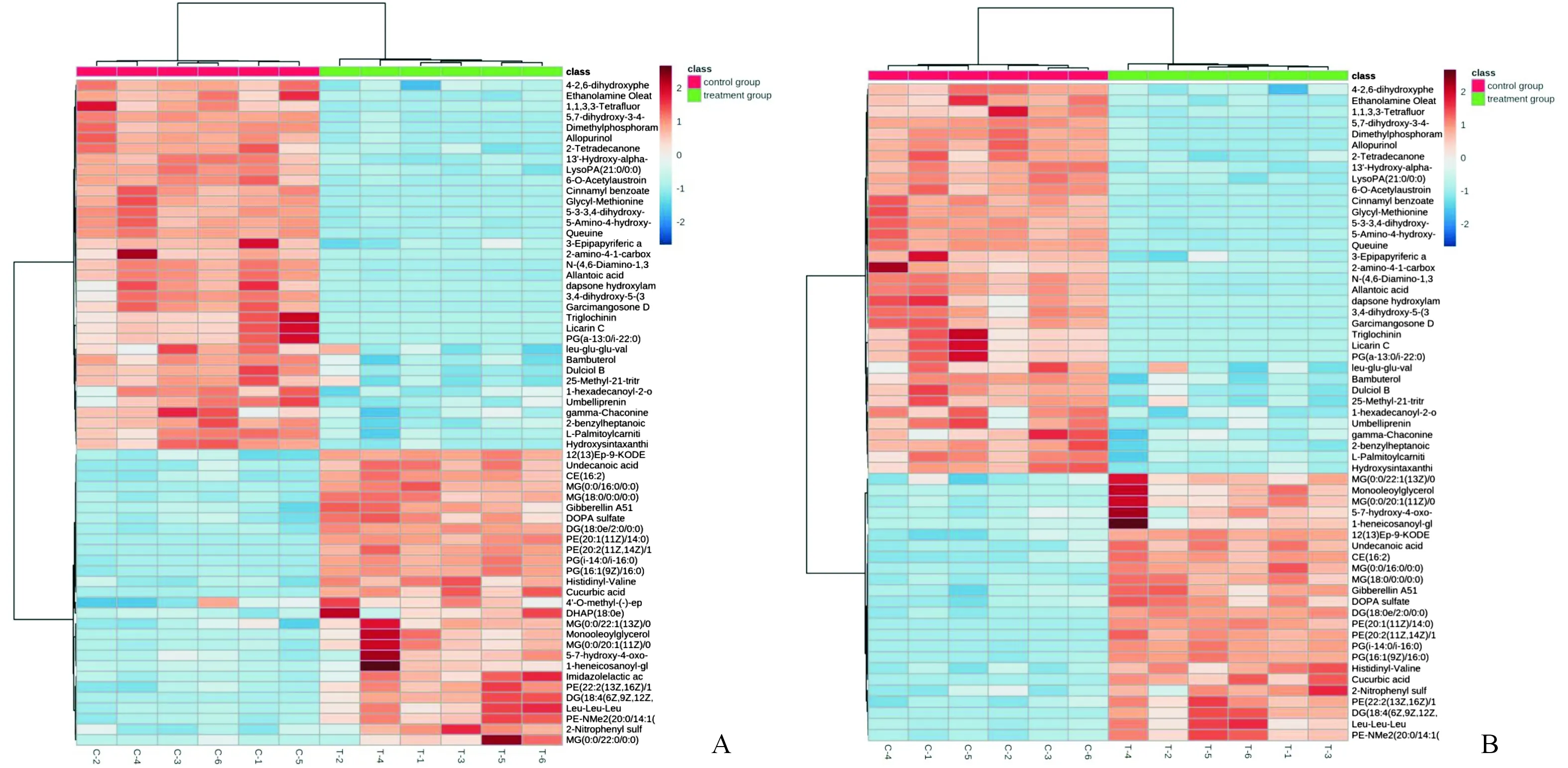
A:正离子模式;B:负离子模式;行:代谢物;列:样本;红色:空白对照组;绿色:干预组。各化合物的相对含量用颜色深度表示,红色:上调;蓝色:下调
2.5 差异代谢物的筛选及其变化趋势分析使用MetaboAnalyst 4.0对上述代谢产物参与的通路进行富集,结果见图4。其中每一个圆圈代表一个代谢通路,圆圈颜色根据P值的大小确定,颜色越深,P值越小;圆圈半径由富集因子所决定,半径越大,富集因子越大。涉及的通路有14条, 差异代谢物主要集中在与嘌呤代谢、氨基糖和核苷酸糖代谢以及嘧啶代谢相关的通路上。
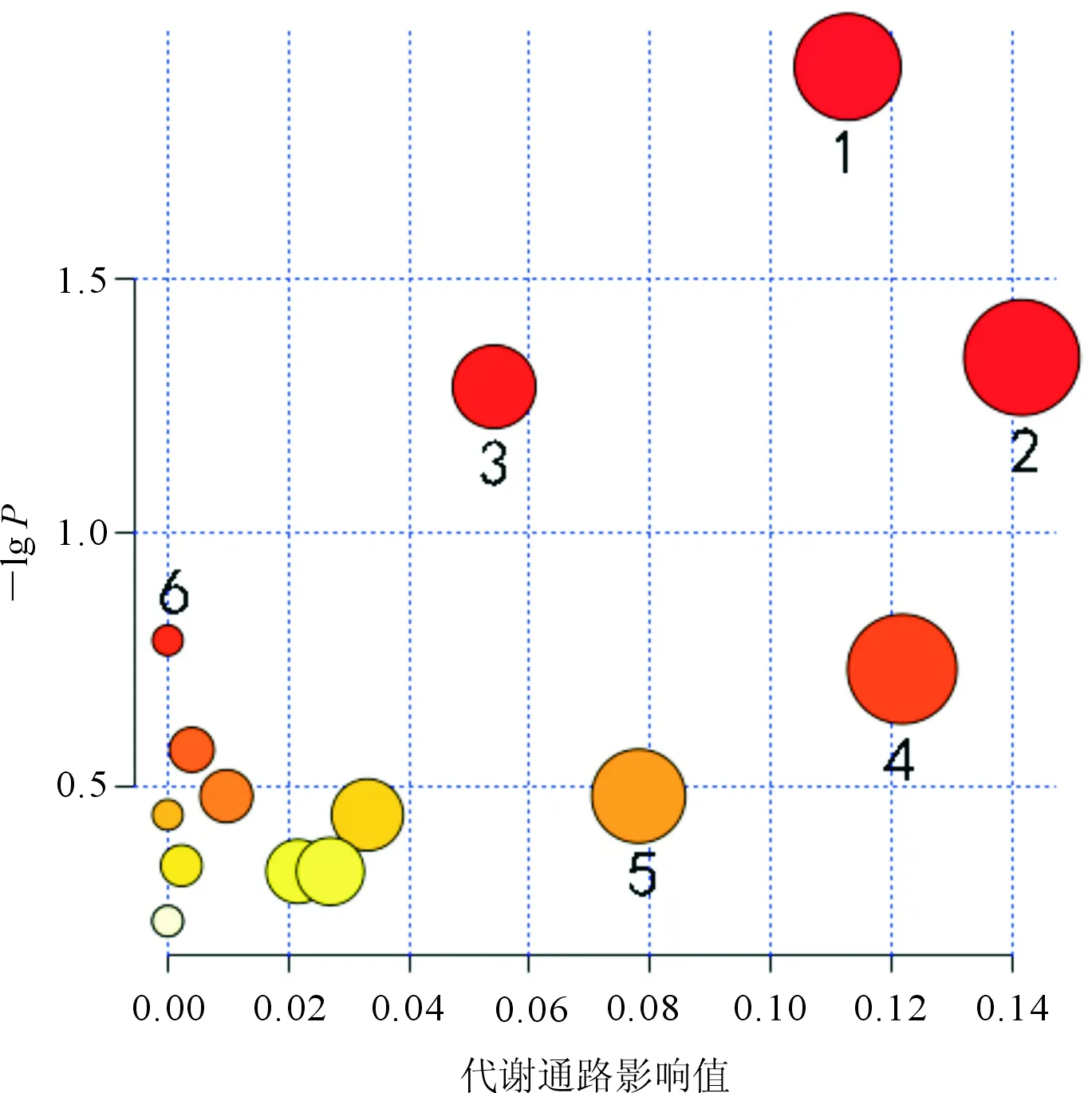
1:嘌呤代谢;2:氨基糖和核苷酸糖代谢;3:嘧啶代谢;4:甘油酯代谢;5:戊糖、葡萄糖醛酸转换;6:抗坏血酸和醛酸代谢
3 讨论
本研究考察了ETM对人肺癌A549细胞活力的影响并基于UPLC-MS联用技术,采用细胞代谢组学研究策略,结合代谢通路分析探讨其可能的抗肿瘤作用机制,从代谢组学的角度为ETM的抗肿瘤机制提供新的线索。结果发现,经ETM干预后,干预组细胞与空白对照组细胞的代谢谱差异具有统计学意义;本研究筛选并鉴定出了136种差异代谢物,其中50种上调,86种下调。代谢通路分析发现,嘌呤代谢、氨基糖和核苷酸糖代谢、嘧啶代谢是受ETM影响的主要通路。
本研究结果显示,与空白对照组相比,ETM干预后细胞的鸟苷酸、二磷酸腺苷核糖、甲酰基甘氨酸含量增加,天冬氨酸腺苷酸、尿囊酸含量减少,这些差异代谢物与嘌呤代谢密切相关;同时,与嘧啶代谢密切相关的尿苷二磷酸和胞苷二磷酸的含量增加,胸苷二磷酸的含量减少,说明A549细胞的嘌呤代谢和嘧啶代谢在ETM的作用下发生了紊乱。癌细胞的特征是能量生产和生物合成过程的增加,癌细胞需要以此来维持细胞的生长和增殖[9, 13]。嘌呤代谢和嘧啶代谢作为核苷酸代谢的分支,除了可以产生嘌呤分子和嘧啶分子为DNA复制和RNA合成提供必要的成分外[14],还可以提供必要的能量和辅助因子,以促进细胞存活和增殖,是细胞生物能量产生的一个关键途径[15]。ETM可能通过影响细胞内的嘌呤代谢和嘧啶代谢来扰乱肿瘤细胞的生长和增殖等生命活动,从而进一步诱导细胞凋亡。除了增殖作用之外,研究[16]发现在一些高侵袭性的癌细胞中存在胸腺嘧啶等嘧啶的含量升高,甚至超过癌细胞增殖所需的含量,认为过量的嘧啶可能被降解后用来支持上皮间质转化这一过程。上皮间质转化是一种遗传和分子程序,它可以使细胞呈间充质样状态,与肿瘤细胞侵袭和分化能力的增强以及嘧啶代谢密切相关[17-19]。因此,嘧啶代谢被扰乱后,A549细胞的上皮间质转化过程可能会受到影响,从而导致肿瘤细胞的侵袭能力减弱。
氨基糖代谢是指利用葡萄糖衍生的碳和氨基酸衍生的氮来生产葡萄糖胺的过程[20]。当氨基糖和核苷酸糖的代谢被干扰后,肿瘤细胞的增殖会受到抑制。在该研究中,ETM干预后A549细胞活性受抑,尿苷二磷酸葡萄糖的含量增加,n-乙酰- d-葡萄糖胺-6-磷酸和藻糖1-磷酸的含量降低,这些差异代谢物与氨基糖和核苷酸糖代谢密切相关,提示A549细胞的氨基糖和核苷酸糖代谢受到了影响,从而抑制了肺肿瘤细胞的增殖。郝秀玉[21]发现在抗肿瘤药物紫杉醇的作用下,HeLa细胞的氨基糖和核苷酸糖代谢受到了扰乱,认为HeLa细胞的增殖受到了抑制。本研究结果与上述研究一致。
癌细胞的增殖和侵袭过程中往往会伴随着代谢网络的重编程和代谢物的改变。本研究基于UPLC-MS技术,探讨了ETM处理后A549细胞差异代谢物的变化,结合代谢通路分析,提供了ETM抗肿瘤作用的可能机制,为ETM的后续肿瘤药理学研究提供了实验依据。
