低盐接种发酵对黄豆酱的发酵过程的影响
2021-10-15肖龙泉何苗江鹏毛竞竟肖迪刘达玉刘明学
肖龙泉,何苗,江鹏,毛竞竟,肖迪,刘达玉,刘明学*
(1.西南科技大学 生命科学与工程学院,四川 绵阳 621010;2.成都大学农业农村部杂粮加工重点实验室,成都 610106)
生产豆酱以蛋白质原料和淀粉质原料为主,因大豆在谷类作物和豆类作物中的蛋白质含量最高,故生产中通常选择大豆作为蛋白质原料[1],大豆还含有磷脂、维生素、矿物质和大豆异黄酮等多种营养成分[2-3]。绝大部分市面上销售的黄豆酱的食盐含量在10%以上[4-5],高盐豆酱不仅限制了产品的使用量,而且与现在所流行的低盐饮食有所冲突。随着生活条件的改善,高盐饮食越来越不被提倡。高盐摄入不仅会引起血管功能障碍[6],而且会诱发高血压[7-8]。因此,低盐饮食被越来越多的消费者所接受,豆酱产品低盐化是产品升级换代的必然趋势,使用低盐接种工艺不仅使得产品更加绿色健康,风味更加饱满,且豆酱在低盐环境下发酵,微生物的生长更加旺盛,有利于改善豆酱的风味[9]。
1 材料与方法
1.1 实验材料
黄豆、面粉:购于沃尔玛超市;氢氧化钠、福林酚、无水碳酸钠、三氯乙酸、硝酸铝、醋酸钾、磷酸二氢钠、磷酸氢二钠、盐酸、邻苯二甲酸氢钾:均为分析纯;酚酞(指示剂)、酪氨酸(BR)、干酪素(BR):均购于成都市科隆化学品有限公司;米曲霉沪酿3.042:山东和众康源生物科技有限公司。
1.2 主要仪器与设备
UV-5200型紫外可见分光光度计 上海元析仪器有限公司;KH3200V型超声波清洗 昆山禾创超声仪器有限公司;HH-8型电热恒温水浴锅 北京科伟永兴仪器有限公司;LD-5型离心机 江苏省金坛市荣华仪器制造有限公司;SPX-150B智能型生化培养箱、101-4型恒温鼓风干燥箱 上海琅玕实验设备有限公司;FA2004型电子天平 上海佑科仪器仪表有限公司;PHS-2F pH计 上海仪电科学仪器股份有限公司;Testo 205便携式pH计 德图仪表(深圳)有限公司;CS-220粉末色差仪 杭州彩谱科技有限公司;HZ85-2型磁力搅拌器 北京中兴伟业仪器有限公司。
1.3 实验方法
1.3.1 黄豆酱的制曲工艺
泡豆→蒸煮→拌粉接种→制曲→装罐发酵。
1.3.1.1 泡豆
豆与水以1∶3(g/mL)的配比于25 ℃条件下浸泡12 h,大豆的完全吸水率可达到2.1倍。
1.3.1.2 蒸煮
隔水蒸煮黄豆约45 min,直至豆粒完整,有弹性,手搓可成粉且无夹生,颜色为黄褐色。
1.3.1.3 拌粉接种
将面粉与米曲霉按10000∶4的比例混合,然后和蒸熟冷却到45 ℃左右的黄豆以4∶1的比例混合。
1.3.1.4 制曲
将拌好的大豆放入恒温培养箱中,调节温度为30 ℃,并在大豆上面盖一层湿润的纱布,从而使制曲过程中的霉菌获得适宜的空气和湿度。
1.3.1.5 装罐发酵
将黄豆和盐水(低盐浓度为10%,高盐浓度为15%)按质量比1∶1加入已用沸水煮10 min的玻璃罐中,置于30 ℃培养箱中进行发酵。
1.3.2 水分含量的测定
根据GB 5009.3-2016《食品中水分的测定》中的直接干燥法进行水分测定[10]。
1.3.3 蛋白酶活力的测定
根据SB/T 10317-1999《蛋白酶活力测定法》测定[11]。
1.3.4 氨基酸态氮含量的测定
根据GB 5009.235-2016中的电位滴定法进行测定[12]。
1.3.5 色差的测定
均匀取样10.000 g样品于研钵中,碾成均匀糊状,然后转移至洁净的称量纸上,色差仪在每次使用前保证仪器洁净无污染并校正,用色差仪测量3次后取平均值。
1.3.6 pH值的测定
使用便携式pH计直接插入样品中测量,直接读数,pH计使用前按照说明书进行校正。
1.3.7 总酸的测定
根据GB/T 12456-2008中的方法进行检测[13]。
2 结果与分析
2.1 制曲过程中水分含量的变化
由图1可知,在制曲过程中,两组样品的水分含量均随着时间的增加而逐渐降低,其水分含量均从50%左右降低至30%左右,且自然制曲和接种制曲条件的样品水分含量下降趋势基本相同,水分降低的主要原因是制曲过程中水分蒸发所致。30 ℃条件下培养72 h时,自然制曲组水分含量下降至31.1%,接种米曲霉组的水分含量为30.7%,二者水分含量变化未出现明显差异。

图1 豆酱制曲过程中水分含量的变化Fig.1 The changes of moisture content in soybean paste during koji making
2.2 制曲过程中蛋白酶活力的变化
由图3可知,在制曲过程中,二者相比,接种米曲霉的样品的蛋白酶活力始终大于自然发酵的样品,自然制曲组和接种米曲霉的样品蛋白酶活力都随着时间的增加先呈现出递增趋势,并且蛋白酶活力在60 h时达到最大值,此时自然制曲组蛋白酶活力为1215 U/g干基,接种米曲霉组的蛋白酶活力为1813 U/g干基,两组相差598 U/g干基,接种米曲霉组蛋白酶活力是自然组蛋白酶活力的1.5倍。而在制曲60 h后蛋白酶活力出现下降趋势,其原因可能是水分含量下降导致微生物生长繁殖受限;此外,米曲霉分解蛋白质产生的氨基酸、多肽等胞外蛋白物质在60 h后开始大量积累,对蛋白酶的抑制作用和淀粉水解产物葡萄糖等对霉菌产蛋白酶的阻碍作用都会导致蛋白酶活力先增加后减小[14]。

图2 蛋白酶活力标准曲线Fig.2 The standard curve of protease activity

图3 豆酱制曲过程中蛋白酶活力的变化Fig.3 The changes of protease activity of soybean paste during koji making
2.3 氨基酸态氮含量的变化
由图4可知,3组样品的氨基酸态氮含量都随着时间而增加,最后趋于稳定,其中,自然发酵的豆酱的氨基酸态氮含量上升趋势较缓,而接种米曲霉的豆酱的氨基酸态氮含量涨幅则较大,在发酵第13天时,3组样品的氨基酸态氮含量差值达到最大,此时自然发酵组的氨基酸态氮含量为0.34 g/100 g,接种米曲霉的高盐组氨基酸态氮含量为1.11 g/100 g,接种米曲霉的低盐组氨基酸态氮含量为1.22 g/100 g,三者最大相差0.88 g/100 g,说明接种米曲霉的豆酱生长趋势优于自然发酵的豆酱,且低盐接种发酵优于高盐接种发酵。

图4 氨基酸态氮含量的变化Fig.4 The changes of amino acid nitrogen content during fermentation
2.4 总酸含量的变化
由图5可知,无论是低盐黄豆酱还是高盐黄豆酱,总酸含量的变化趋势都是先逐渐上升后变缓。对比3组样品可以发现,在发酵第14天时,低盐接种米曲霉组样品的总酸含量最高,其次为高盐接种米曲霉组,自然发酵组的总酸含量最低。由于在酶系作用下产生的氨基酸、脂肪酸、乳酸等有机酸使得总酸含量增加,发酵后期微生物代谢减缓,酸类物质生成量参与酯化反应和美拉德反应的消耗量基本持平。在发酵第4~5天之间,自然发酵的总酸含量高于接种发酵(高盐)的总酸含量,这是由于在自然发酵的初期,罐内大量繁殖乳酸菌,尤其在温度较高的后期,乳酸菌利用发酵性糖代谢产生乳酸等有机酸,因此总酸含量较高。总酸含量趋于平缓的原因是随着发酵的不断进行,由于豆酱体系环境的变化,瓶中微生物衰亡,从而导致微生物的代谢活动基本停止,而代谢活动中产生的酸类物质参与酯化反应等,所以总酸含量下降至稳定。

图5 总酸含量的变化Fig.5 The changes of total acid content during fermentation
2.5 pH值的变化
由图6可知,豆酱的pH总体呈先下降后保持平稳的趋势,3组中自然发酵组的pH最低,其原因可能是接种米曲霉组米曲霉大量繁殖,与产酸细菌如乳酸菌之间形成竞争关系,3组相比,自然发酵组产乳酸菌生长最旺,导致其pH最低。随着发酵时间的增加,厌氧菌乳酸菌逐渐繁殖起来,从而使pH继续下降;最后由于豆酱体系环境的变化,使得微生物逐渐衰亡,从而导致微生物代谢活动基本停止;而代谢产生的酸类物质参与酯化反应等,所以最终pH趋于平缓。

图6 pH值的变化Fig.6 The changes of pH values during fermentation
2.6 色差的变化
由表1可知,在装罐发酵过程中,3组样品的黄度值b*、亮度值L*整体上均呈现逐渐降低趋势,说明豆酱会随着时间的增加而变暗。三者相比,自然发酵过程中L*值最高,b*值最低,主要原因是接种制曲组米曲霉生长旺盛,使其颜色与自然发酵组出现明显差异,最终导致接种发酵组的亮度值L*相对偏低,b*偏高。
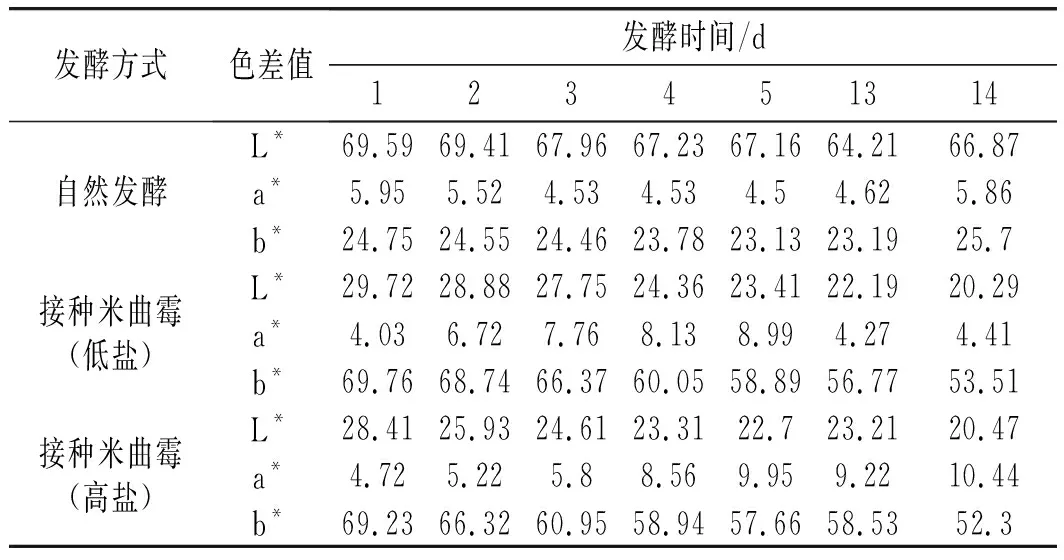
表1 不同发酵方式色差值的变化Table 1 The changes of color difference values by different fermentation methods
3 小结
豆酱的制曲过程中,所有样品的水分含量都呈现下降趋势,蛋白酶活力呈现先上升后下降的趋势,无论是自然发酵组还是接种米曲霉组,其蛋白酶活力均在60 h达到最大值,自然发酵的蛋白酶活力为1215 U/g干基,而接种了米曲霉的样品的蛋白酶活力为1813 U/g干基,是自然发酵的1.5倍,之后酶活开始下降。
随着发酵的进行,自然发酵和接种发酵样品的颜色逐渐加深,pH逐渐下降。氨基酸态氮含量均呈现上升趋势,接种米曲霉的上升趋势明显高于自然发酵的豆酱;在发酵第14天时,自然发酵组的氨基酸态氮含量为0.34 g/100 g,接种米曲霉的高盐组氨基酸态氮含量为1.11 g/100 g,接种米曲霉的低盐组氨基酸态氮含量为1.22 g/100 g。
