超声结合酶法辅助提取甘蔗渣中水溶性多糖的工艺优化
2021-10-13吴金松许美娟耿广威任聪徐军杨新玲陈晓培
吴金松,许美娟,耿广威,任聪,徐军,杨新玲,陈晓培
(河南牧业经济学院,河南 郑州 450046)
甘蔗(Saccharum officinarum)属草本植物禾本科,有薯蔗、糖杆、甜棒儿等别称,甘蔗秆直立高3 m~5 m,根状茎粗壮发达且多汁,是一年生或多年生的草本植物,普遍分布在热带和亚热带地域,在我国主要分布的两广、贵州等南方地区[1]。甘蔗渣中主要成分为50%左右的纤维素(α、β、γ 3种纤维素)、20%以上的半纤维素、20%以上的木质素、含有机物质和二氧化硅[2-4]。甘蔗中富含多种糖类、蛋白质、维生素(B1、B2、B6)、蔗脂、钙、磷、铁、植物甾醇、氨基酸等营养成分。随着我国制糖产业的发展与需求,甘蔗被用于制作糖类物质,每制成1 t的糖类物质就会产生2 t~3 t的甘蔗渣,若这些甘蔗渣不加以利用,会造成环境污染和资源浪费;对于甘蔗渣的综合利用主要是包括生物发电、制浆造纸等[5-8],而国内外对于从甘蔗渣中提取水溶性多糖的研究鲜有报道,因此探究甘蔗渣多糖的提取工艺对于甘蔗渣资源的再利用具有重要意义。
植物中多糖的提取方法有溶剂提取法、酶提取法、超声辅助提取法、微波辅助提取法、超临界流体萃取等[9]。不同的提取方法各有优缺点,根据原料的处理方式不同采取相应的提取方法。刘宝田等[10]采用纤维素酶提取甘蔗渣多糖,发现经亚硫酸盐处理后的甘蔗渣溶液是较易水解的纤维素底物,总糖得率84.23%;肖亚聪[11]采用木瓜蛋白酶、纤维素酶和果胶酶优化甘蔗渣水溶性多糖提取工艺,其中木瓜蛋白酶提取率最高。翁艳英等[12-13]采用超声辅助提取和解吸-超声辅助提取甘蔗渣中多糖,并和传统的水提取法作比较,发现超声辅助提取优于传统水煮法,超声辅助提取率为0.668%,解吸-超声辅助提取多糖的提取率平均值达到0.695%,提取率较低。本文拟采用3种酶(中性蛋白酶、果胶酶、纤维素酶)辅助提取甘蔗渣中多糖,从中筛选出最佳的一种酶[1],同时结合超声辅助法考察酶用量、超声酶解温度、超声酶解时间、超声波功率、酶解pH值等因素对甘蔗渣水溶性多糖提取率的影响,采用正交试验优化,结合方差和极差分析来确定较优提取工艺条件,通过紫外吸收扫描和红外光谱扫描来分析测定多糖组分,为工业化提取甘蔗渣多糖在功能食品、药品等领域的应用开发提供理论依据和数据参考。
1 材料与方法
1.1 原料与试剂
紫皮甘蔗:市售。
无水乙醇:新乡市三伟消毒制剂有限公司;葡萄糖标品、苯酚、溴化钾(均为分析纯):天津市科密欧化学试剂有限公司;硫酸(分析纯):洛阳昊华化学试剂有限公司;盐酸(分析纯):开封市盛源化工有限公司;果胶酶(食品级,酶活≥100 000 U/g):上海士锋生物科技有限公司;中性蛋白酶(食品级,酶活≥100 000 U/g)、纤维素酶(食品级,酶活≥100 000 U/g):南宁庞博生物工程有限公司。
1.2 仪器与设备
FA3204B分析天平(感量0.000 1 g):上海佑科仪器仪表有限公司;101-1型电热恒温鼓风干燥箱:天津市泰斯特仪器有限公司;HH-2型电热恒温水浴锅:北京科伟永兴仪器有限公司;pH酸度计:上海雷磁有限公司;SHZ-Ⅲ循环水式多用真空泵:郑州长城科工贸有限公司;HW-3型红外烘干箱:天津市拓普仪器有限公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器有限公司;BJ-150多功能粉碎机:德清拜杰电器有限公司;Hanon i2可见光分光光度计:济南海能仪器股份有限公司;TU-1901双光束紫外可见光光度计:北京普析通用仪器有限责任公司;is10傅里叶变换红外光谱仪:美国尼高力公司。
1.3 方法
1.3.1 流程
新鲜甘蔗→去皮、榨汁→收集甘蔗渣→烘干→粉碎→过筛(50目)→得到甘蔗渣粉→准确称取3.000 g甘蔗渣粉→调节酶解pH值→超声辅助酶解→抽滤→稀释滤液→测量吸光值→计算多糖提取率→滤液浓缩→醇沉→抽滤→干燥→紫外吸收扫描→红外光谱测定。
1.3.1.1 甘蔗渣样品前处理
把新鲜的甘蔗去皮保留干净的甘蔗,通过榨汁后得到甘蔗渣,把得到的甘蔗渣放入电热鼓风干燥箱中,调节温度为60℃,烘干6 h~8 h,将干燥后的甘蔗渣放进粉碎机中粉碎,将粉碎后的甘蔗渣粉过筛(50目),将得到的甘蔗渣粉放入密封袋中备用。
1.3.1.2 甘蔗渣粉酶解液的制备
准确称取3.000 g甘蔗渣粉,按一定的料液比(甘蔗渣粉和蒸馏水比例)配制溶液,通过pH计对溶液进行酶解pH值的调节,调节pH值所用的缓冲溶液为1∶50(g/L)的乙酸分析纯稀释液,调节到所需的酶解pH值。调好pH值后,加入一定比例的酶,进行充分搅拌。
1.3.1.3 超声波辅助提取
将溶液放入超声波清洗机中,按照需要的条件设置参数进行超声。
1.3.1.4 抽滤
将超声酶解后的溶液通过布氏漏斗和抽滤瓶在真空泵作用下抽滤,收集抽滤好的滤液。
1.3.1.5 旋转蒸发
将得到的滤液放入旋转蒸发仪中进行浓缩,调节旋转蒸发仪参数为温度60℃,转速70 r/min,将滤液旋转蒸发至10 mL~20 mL。
1.3.1.6 醇沉多糖
将旋转蒸发后的滤液,按照1∶4的体积比加入95%乙醇溶液,将混匀的溶液放置在4℃的冰箱中静置醇沉12 h。
1.3.1.7 干燥
将醇沉后的溶液进行抽滤,将得到的沉淀物放入鼓风干燥箱中进行干燥,设置参数为温度60℃,干燥4 h,得到干燥后的多糖。
1.3.2 超声结合酶法辅助提取甘蔗渣多糖的单因素试验
影响超声结合酶法辅助提取植物多糖的主要因素有辅助酶的种类、酶添加量(%)、酶解pH值、料液比(g/mL)、超声酶解时间(min)、超声酶解温度(℃)、超声功率(W)[14-17],选择此为单因素进行试验,平行测定3次。
1.3.2.1 不同酶对甘蔗渣多糖提取率的影响
准确称取3份3.000 g甘蔗渣粉,分别添加不同种类的酶(果胶酶、纤维素酶、中性蛋白酶)。固定料液比1∶30(g/mL)、酶添加量 4.0%、酶解 pH 5.0、超声酶解时间40 min、超声酶解温度50℃、超声功率300 W。将溶液超声酶解,真空泵抽滤,得到滤液,稀释得到的滤液进行吸光值的测定,计算多糖的提取率,探究酶的种类对多糖提取率的影响,通过此试验确定最优酶的种类,以备后续试验选用。
1.3.2.2 酶添加量对甘蔗渣多糖提取率的影响
准确称取5份3.000 g甘蔗渣粉,分别设置加酶量3.0%、3.5%、4.0%、4.5%、5.0%。其它步骤同 1.3.2.1,探究酶添加量对多糖提取率的影响。
1.3.2.3 酶解pH值对多糖提取率的影响
准确称取5份3.000 g甘蔗渣粉,分别设置酶解pH 值为 4.6、4.8、5.0、5.2、5.4,其它步骤同 1.3.2.1,探究酶解pH值对多糖提取率的影响。
1.3.2.4 料液比对多糖提取率的影响
准确称取5份3.000 g甘蔗渣粉,分别设置料液比1∶10、1∶20、1∶30、1∶40、1∶50(g/mL),其它步骤同 1.3.2.1,探究料液比对多糖提取率的影响。
1.3.2.5 超声酶解时间对多糖提取率的影响
准确称取5份3.000 g甘蔗渣粉,分别设置超声酶解时间 20、30、40、50、60 min,其它步骤同 1.3.2.1,探究超声酶解时间对多糖提取率的影响。
1.3.2.6 超声酶解温度对多糖提取率的影响
准确称取5份3.000 g甘蔗渣粉,分别设置超声酶解温度 40、45、50、55、60 ℃,其它步骤同 1.3.2.1,探究超声酶解温度对多糖提取率的影响。
1.3.2.7 超声功率对多糖提取率的影响
准确称取5份3.000 g甘蔗渣粉,分别设置超声功率 200、250、300、350、400 W,其它步骤同 1.3.2.1,探究超声功率对多糖提取率的影响。
1.3.3 超声结合酶法辅助提取甘蔗渣多糖的正交试验优化
分析单因素试验结果,选酶解pH值、料液比(g/mL)、超声酶解温度(℃)、超声功率(W)进行L9(34)正交试验,因素水平见表1。

表1 正交试验因素水平Table 1 Orthogonal experimental factors level
1.3.4 甘蔗渣多糖提取率的测定
1.3.4.1 葡萄糖含量标准曲线的绘制
采用硫酸-苯酚法[18]绘制葡萄糖溶液标准曲线。准确称取0.1000 g无水葡萄糖,用蒸馏水将其溶解并定容于100 mL容量瓶中,配制成1.0 mg/mL的葡萄糖标准溶液,用5.0 mL的移液管吸取5.0 mL定容好的1.0 mg/mL葡萄糖溶液放入50 mL的容量瓶中,配制成0.1 mg/mL的葡萄糖溶液,以备后续试验使用。使用干燥洁净并编号的试管,用1.0 mL的移液管分别吸取0、0.2、0.4、0.6、0.8、1.0 mL 定容好的 0.1 mg/mL 葡萄糖溶液放入试管中,再用1.0 mL的移液管吸取1.0、0.8、0.6、0.4、0.2、0 mL 的蒸馏水使其总体积为 1.0 mL,再用1.0 mL的移液管吸取1.0 mL配制好的5%苯酚溶液,用5.0 mL移液管吸取5.0 mL的浓硫酸,立即振荡均匀,静置30 min,测量490 nm处吸光值,根据每组测出的吸光值绘制葡萄糖标准曲线,回归方程为y=0.010 5x+0.000 8,相关系数为R2=0.998 6。
1.3.4.2 甘蔗渣多糖提取率的测定
根据测量溶液的吸光值,计算出多糖浓度,再根据公式[19]计算多糖的提取率。
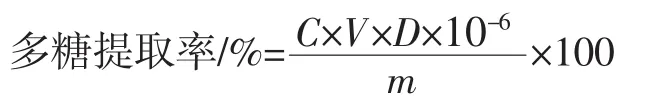
式中:C为从葡萄糖标准曲线上计算得到的浓度,μg/mL;V为抽滤后得到的滤液体积,mL;D为取一定滤液稀释的倍数;m为称取甘蔗渣的质量,g。
1.3.5 甘蔗渣多糖的紫外全波段扫描
称取0.500 0 g,按照最优试验方案提取的甘蔗渣多糖加蒸馏水定容至100 mL,配制成5 μg/mL溶液,设置波长范围为190 nm~400 nm,通过双光束紫外可见分光光度计测量吸收峰,观察图谱[20]。
1.3.6 甘蔗渣多糖的红外光谱测定
称取0.010 0 g,按照最优试验方案提取的甘蔗渣多糖放在表面皿上,放进红外干燥箱中,干燥后将其放在研钵中,按比例1∶100(g/g)加入溴化钾晶体进行研磨。将研磨后的粉末进行压片,采用傅里叶红外光谱仪测量官能团的伸缩振动峰[21]。
1.3.7 数据分析
利用Origin 8.6和Excel软件对数据进行制图,采用正交表对试验数据进行分析。
2 结果与分析
2.1 单因素对甘蔗渣多糖提取率的影响
2.1.1 不同辅助酶对多糖提取率的影响
不同辅助酶对多糖提取率的影响见图1。

图1 不同酶提取甘蔗渣多糖提取率Fig.1 The extraction rate of crude polysaccharide from bagasse with different enzymes
根据图1所示,果胶酶、纤维素酶和中性蛋白酶的提取率分别为4.87%、9.69%、5.55%,采用纤维素酶作为辅助酶时提取率要高于果胶酶和中性蛋白酶,这可能是因为甘蔗渣中含有大量的纤维素和半纤维素。因此选择纤维素酶进行酶解试验效果会更好。
2.1.2 酶添加量对多糖提取率的影响
酶添加量对多糖提取率的影响见图2。
根据图2所示,在纤维素酶添加量为底物质量的3.0%~5.0%时,提取率随酶添加量的增加呈上升趋势。当酶添加量为4.5%时,酶分子逐渐趋向饱和状态,会有一部分的酶分子失去与甘蔗渣多糖结合的机会,会造成甘蔗渣中多糖溶解的速度下降[22],导致提取率不再显著上升。从成本的角度考虑,选择酶的添加量为底物质量4.5%为最佳。

图2 不同酶添加量对甘蔗渣多糖提取率的影响Fig.2 Effect of different enzyme addition on the extraction rate of crude polysaccharide from bagasse
2.1.3 酶解pH值对多糖提取率的影响
酶解pH值对多糖提取率的影响见图3。

图3 不同酶解pH值对甘蔗渣多糖提取率的影响Fig.3 Effect of different enzymatic hydrolysis of pH on extraction rate of crude polysaccharide from bagasse
根据图3所示,多糖提取率在酶解pH值的影响下呈先升后降的趋势,在酶解pH值为4.6~5.0时,多糖提取率呈上升趋势;在酶解pH值为5.0~5.4时,多糖提取率为下降趋势。酶解pH值的改变会造成酶的活性降低、空间结构被破坏、影响酶活性中心催化基团的解离[23]。酶解pH值对甘蔗渣多糖提取率影响较显著,因此把酶解pH值作为正交试验的一个因素,选择pH 5.0、5.2、5.4 3 个水平进行试验。
2.1.4 料液比对多糖提取率的影响
料液比对多糖提取率的影响见图4。
根据图4所示,多糖提取率随溶剂的增加呈先上升后下降的趋势,在料液比为1∶40(g/mL)时,多糖提取率最高。这可能是因为溶剂用量较低时,溶液的浓度大,多糖的溶出达到饱和状态,多糖提取率不高;随着溶剂用量升高,溶剂对超声波能量吸收也在逐渐增大,造成底物对超声波能量的吸收减小,细胞壁被破坏的不完全,溶出减少,因此多糖提取率下降[24]。提取率在料液比的影响下较显著,因此可将料液比作为正交试验的一个因素,选择料液比为 1∶30、1∶40、1∶50(g/mL)作为3个水平进行试验。

图4 料液比对多糖提取率的影响Fig.4 Effect of different material-liquid ratio on extraction rate of crude polysaccharide from bagasse
2.1.5 超声酶解时间对多糖提取率的影响
超声酶解时间对多糖提取率的影响见图5。

图5 超声酶解时间对甘蔗渣多糖提取率的影响Fig.5 Effect of different enzymatic time on the extraction rate of crude polysaccharide from bagasse
根据图5所示,多糖提取率随着超声酶解时间的延长呈上升趋势,在超声酶解时间为60 min时,多糖提取率最高。这可能是因为超声时,甘蔗渣细胞破碎的程度较大,使多糖溶出,增大了提取率。在超声酶解时间40 min后,多糖提取率增加缓慢,为了能达到最好的提取效果,选择超声酶解时间60 min为固定因素。
2.1.6 超声酶解温度对多糖提取率的影响
超声酶解温度对多糖提取率的影响见图6。
根据图6所示,多糖提取率随着超声酶解温度升高呈先上升后下降的趋势,在超声酶解温度为55℃时达到最高值。这可能是因为液体介质的表面张力与黏性下降、扩散系数变大,多糖提取率上升[25]。在超声酶解温度50℃后,多糖提取率逐渐增大且显著,可以把超声酶解温度作为正交试验的一个因素,选择超声酶解温度为50、55、60℃作为3个水平进行试验。
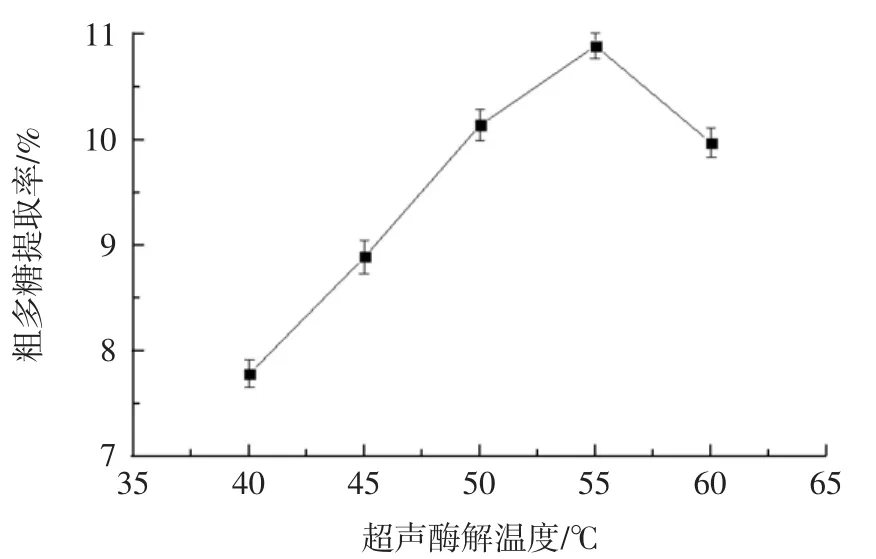
图6 不同超声酶解温度对甘蔗渣多糖提取率的影响Fig.6 Effect of enzymatic hydrolysis temperature on the extraction rate of polysaccharide from bagasse
2.1.7 超声功率对多糖提取率的影响
超声功率对多糖提取率的影响见图7。
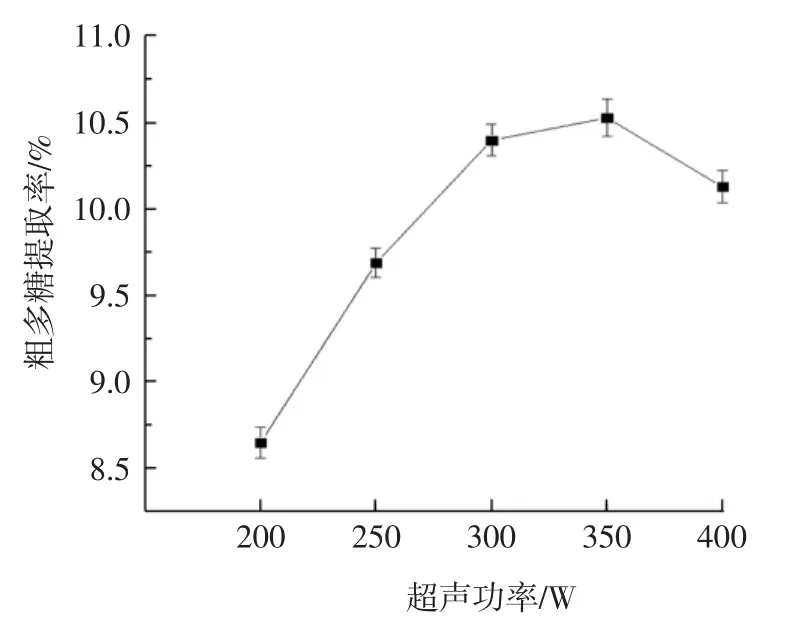
图7 超声功率对甘蔗渣多糖提取率的影响Fig.7 Effect of different ultrasonic power on the extraction rate of crude polysaccharide from bagasse
根据图7所示,多糖提取率随着超声功率的增加呈先升后降的趋势。在超声功率为350 W时,多糖提取率达到最高值。这可能是因为功率越高,产生的空化作用越大,但功率过高时,会发生空化屏障现象,从而影响提取率[26]。超声功率对提取率影响较显著,可将超声功率作为正交试验的一个因素,选择超声功率为300、350、400 W作为3水平进行试验。
2.2 正交试验结合方差分析结果
正交试验结果见表2,方差分析见表3。

表2 正交试验结果Table 2 Orthogonal experimental results
根据表3所示,影响提取率的主次因素为C>B>D>A,即超声酶解温度>酶解pH值>超声功率>料液比。临界值F0.05(2,9)=4.26,F0.01(2,9)=8.02,因素A、B、C、D对提取率有极显著影响,最优的提取方案是C2B1D2A1,即超声酶解温度为55℃、酶解 pH 5.0、超声功率350 W、料液比1∶30(g/mL)。在最优水平C2B1D2A1提取条件下,平行测定3次,多糖平均提取率为12.78%,比优化之前提取率高了16.78%,表明该方法的重现性较好。
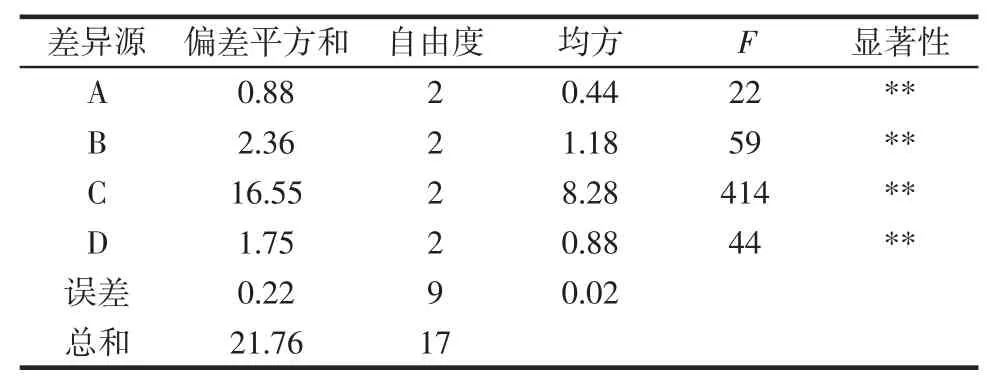
表3 方差分析Table 3 Variance analysis
2.3 紫外吸收曲线
甘蔗渣多糖的紫外扫描图谱见图8。

图8 甘蔗渣多糖紫外扫描图谱Fig.8 Ultraviolet spectrum of crude polysaccharide from bagasse
根据图8所示,设置波长在190 nm~400 nm进行紫外光谱扫描,发现在260 nm~280 nm无特征吸收峰,说明多糖中不含核酸和蛋白质。
2.4 红外扫描图谱
甘蔗渣多糖的红外扫描图谱见图9。
根据图9所示,甘蔗渣多糖具有多糖的一般吸收峰。通过把压片放在4 000 cm-1~400 cm-1处观察吸收峰来确定物质是否为多糖。在3 416.90 cm-1处的吸收峰为O-H键,为分子内氢键;在2 922.96 cm-1处的吸收峰为-CH2-;在1 654.00 cm-1处的吸收峰为羰基和-C=C-;在1 112.25 cm-1和1 061.30 cm-1处有两个吸收峰,为糖苷键[20]。结果表明,符合多糖的基本特征。
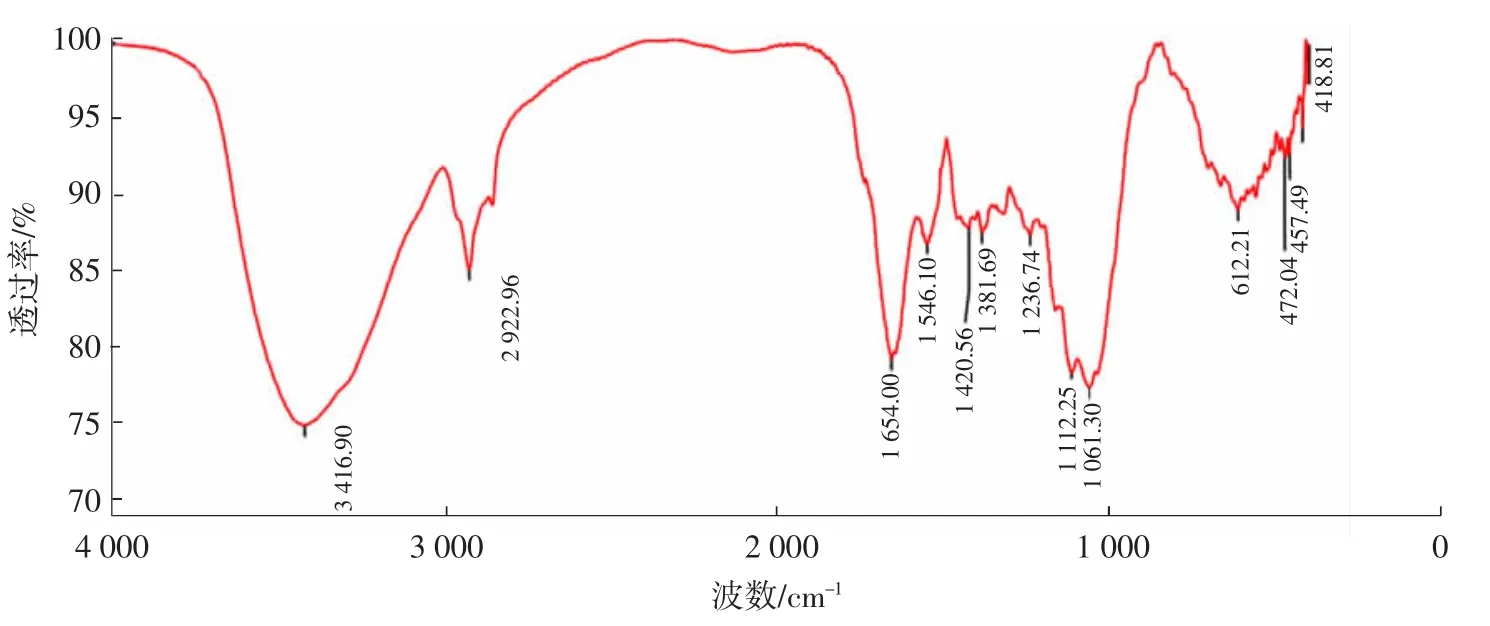
图9 甘蔗渣多糖红外扫描图谱Fig.9 Infrared spectrum of crude polysaccharide from bagasse
3 结论
通过试验选择出最适合的酶为纤维素酶,采用超声结合纤维素酶辅助提取甘蔗渣中水溶性多糖,采用单因素试验和正交试验对提取方法做进一步的优化。最佳工艺条件:即料液比 1∶30(g/mL)、酶解 pH 5.0、纤维素酶添加量为底物质量的4.5%、超声功率350W、超声酶解时间60 min、超声酶解温度55℃,多糖提取率为12.78%,比优化前提高了16.78%。通过紫外吸收扫描图谱显示在260 nm~280 nm无特征吸收值,表明提取的多糖不含核酸和蛋白质,通过红外光谱扫描图谱显示提取的物质符合多糖的基本特征。
