鸡血血肽分离纯化与抗氧化性研究
2021-10-13李新汪兰丁安子吴文锦孙静乔宇石柳
李新,汪兰*,丁安子,吴文锦,孙静,乔宇,石柳
(1.湖北省农业科学院农产品加工与核农技术研究所,湖北 武汉 430064;2.湖北省农业科学院畜牧兽医研究所,湖北 武汉 430064)
我国是家禽养殖、屠宰加工大国,近年来家禽养殖业呈规模化、集约化方向发展,成为我国农业经济中最活跃的增长点和主要的支柱产业。家禽屠宰加工过程中产生大量的血液,是一种优质的蛋白资源,目前关于禽血精深加工与高值化利用研究较少。
氧化是人类衰老与疾病主要诱因,脂质与蛋白质氧化均可以产生自由基,自由基的形成与累积会进一步损伤生物大分子,导致细胞及组织的氧化损伤[1-2]。抗氧化剂可以有效抑制自由基的氧化反应,在减少细胞氧化、防止脂质过氧化、降低自由基生成速率等方面具有重要作用[3]。检测ABTS+自由基、DPPH自由基、羟基自由基等自由基清除率是评价抗氧化活性常规方法[4-5]。通过酶解食源性蛋白质获得的多肽,可以具备与天然或合成类抗氧化剂同样甚至更好的抗氧化活性。国内外研究表明,活性肽具备抑制脂质过氧化、螯合金属离子、清除活性氧能力[6-7]。活性肽抗氧化能力与多肽的分子量、结构和疏水性有着密切的关系[8-9]。本研究以鸡血血红蛋白为原料,采用中性蛋白酶水解,结合离心、浓缩、冻干等方法制备血肽,应用葡聚糖凝胶色谱分离纯化,收集并测定不同分子量范围血肽体外抗氧化性,为实现禽血高值转化利用提供技术支撑与理论基础。
1 材料与方法
1.1 材料与试剂
新鲜鸡血:市售。三氟乙酸、过硫酸钾、ABTS、DPPH、邻二氮菲、硫酸亚铁、乙醇、双氧水、邻苯三酚(分析纯):国药集团化学试剂有限公司;中性蛋白酶(酶活≥100 U/mg,分析纯):合肥博美生物科技有限公司;乙晴、细胞色素C、抑肽酶、杆菌酶、乙氨酸-乙氨酸-酪氨酸-精氨酸、乙氨酸-乙氨酸-乙氨酸(色谱纯):北京安捷飞科技有限公司。
1.2 仪器与设备
GL-25MS高速冷冻离心机:上海卢湘仪离心机仪器有限公司;L5S紫外分光光度计:上海仪电分析仪器有限公司;Waters1525高效液相色谱仪(配2487紫外检测器和Empower工作站GPC软件):美国Waters公司;SIM FDS-2.5E真空冷冻干燥机:美国SIM公司。
1.3 试验方法
1.3.1 原料处理
鸡宰杀时收集鸡血,添加0.2%乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium salt,ED TA-2Na),搅拌均匀,置于冰盒中备用,离心处理(4000r/min,20 min),收集沉淀,冻干即为鸡血血红蛋白粉。以血红蛋白粉为酶解底物,选用中性蛋白酶酶解,根据单因素试验确定血肽酶解条件,即血红蛋白底物浓度、酶添加量与酶解时间,研究分析血肽相对分子质量分布、分离纯化方法及其抗氧化性研究。
1.3.2 氨基酸态氮含量的测定
酶解液中的氨基酸态氮含量采用中性甲醛滴定法测定[10]。
1.3.3 总氮含量的测定
总氮含量采用半微量凯氏定氮法测定[11]。
1.3.4 水解度(degree of hydrolysis,DH)测定
水解度计算公式如下[12]。
DH/%=AN/TN×100
式中:AN为氨基酸态氮的含量,g/L;TN为总氮量,g/L。
1.3.5 血肽相对分子质量分布检测
1)样品制备:称取样品10 mg于10 mL容量瓶中,用流动相稀释至刻度,0.45 μm微孔滤膜过滤后供进样。
2)色谱条件:色谱柱TSKgel 2000 SWXL 300 mm×7.8 mm;流动相为乙腈、水、三氟乙酸体积比 45∶55∶0.1;检测波长220 nm;流速0.5 mL/min;柱温30℃。
1.3.6 血肽分离纯化试验
参考文献[13-14]的方法,称量SephadexG-154.5g,用蒸馏水加热溶胀,脱气,匀速倒入垂直放置的凝胶柱(16 mm×100 cm)中,置于4℃层析柜中。将柱的上端与恒流泵相连,0.5 mg/mL NaCl溶液洗脱12 h,使凝胶处于均匀紧实状态。将血肽样品配制成100 mg/mL溶液,过0.45 μm微孔滤膜,上样量1.0 mL,流动相为NaCl溶液,流速为0.5 mL/min,紫外检测波长260 nm,以时间为横坐标,洗脱液吸光度为纵坐标绘制洗脱曲线。根据洗脱曲线,合并同一洗脱峰,洗脱液真空浓缩,冷冻干燥后得到纯化后血肽样品。
1.3.7 血肽抗氧化性试验
1.3.7.1 ABTS+自由基清除率测定
参照WANG等[15]的方法。取2.45 mmol/L K2S2O8溶液和7 mmol/L ABTS溶液等体积混合,室温25℃避光放置12h~16h制得ABTS+自由基反应液,用0.2mol/L pH7.4磷酸盐缓冲液将0.8 mL ABTS+自由基反应液进行稀释,使其在734 nm下吸光值为0.68~0.72,备用。配制3.0 mg/mL样液,取0.04 mL样液与4 mL ABTS+自由基反应液混合均匀,常温避光反应1 h,测定其在734 nm下的吸光值(A1),用去离子水做空白对照测定在734 nm下的吸光值(A2),按下式计算ABTS+自由基清除率。

1.3.7.2 DPPH自由基清除率测定
参照BAEA S H等[16]的方法。取2 mL样液(3.0 mg/mL),加入2 mL 0.15 mmol/L DPPH溶液(用95%的乙醇溶解),混匀后在室温25℃条件下避光反应30 min,在517 nm波长处测吸光度(A1),空白组为2 mL 95%的乙醇溶液代替DPPH溶液,加入2 mL样液混合,在517 nm波长处测定吸光度(A2),对照组为2 mL DPPH溶液加2 mL 95%的乙醇溶液,在517 nm处测定其吸光度(A0)。按下式计算DPPH自由基清除率。

1.3.7.3 羟基自由基清除率测定
参照马赛蕊等[17]的方法。取0.6 mL 5 mmol/L邻二氮菲的无水乙醇溶液,加入0.4 mL 0.15 mol/L的磷酸盐缓冲溶液(pH 7.40)和0.6 mL 0.75 mmol/L的硫酸亚铁,加入2 mL样液(3.0 mg/mL),加入0.4 mL 0.1%双氧水,37℃条件下水浴60 min,在波长536 nm波长处测其吸光度(A1);以去离子水代替样液和双氧水溶液重复以上操作,在536 nm波长处测其吸光度(A2);以去离子水代替样液来重复以上操作,在536 nm波长处测定其吸光度(A3)。按下式计算羟基自由基清除率。

1.3.7.4 O2-自由基清除率测定
参照张金豫等[18]的方法。取样液0.1 mL(3.0 mg/mL),加入2.8 mL 0.1 mol/L Tris-HCl(pH 8.2)缓冲溶液振荡混匀,在25℃水浴10 min后加入0.1 mL 3 mmol/L的邻苯三酚溶液(25℃预热),在322 nm波长测定吸光度,每隔30 s读取吸光度,4 min后结束;以去离子水0.1 mL加 2.8 mL 0.1 mol/L的 Tris-HCl(pH 8.2)缓冲溶液调零;空白对照管以去离子水代替样液。作吸光度随时间变化的回归方程,其斜率为邻苯三酚的自氧化速率V,按下式计算O2-自由基清除率。

式中:V对照为邻苯三酚自氧化速率,即自氧化曲线斜率;V样品为加入血肽氧化曲线斜率。
1.4 数据处理
试验数据采用平均值±标准差表示,试验重复3次,使用Excel、Origin 8.0进行数据处理和制图。
2 结果与讨论
2.1 单因素试验
不同底物浓度、酶添加量、酶解时间对血红蛋白水解度的影响见图1。

图1 不同酶解条件下鸡血血红蛋白水解度Fig.1 Degree of hydrolysis of hemoglobin in chicken blood at different enzymatic hydrolysis conditions
由图1可知,底物浓度为5%~6%时,水解度变化不明显,表明底物浓度大于5%时趋于饱和;随着酶添加量增加,血红蛋白水解度呈缓慢增加趋势,酶添加量大于1.5%后,水解度趋于稳定值;随着酶解时间的延长,水解度缓慢增加。水解度直接关系到血红蛋白水解程度,随着水解度的增加,酶解产物的分子质量分布表现出大分子肽含量逐渐减少,小分子肽含量逐渐增多[19-20]。综合考虑原辅料成本、生产周期、能耗等问题,确定血肽酶解制备条件:底物浓度5%,酶添加量1.5%,酶解时间5 h。
2.2 血肽相对分子质量分布
血肽高效液相色谱(high performance liquid chromatography,HPLC)图以及相对分子质量分布见图2和表1。

表1 血肽相对分子质量分布Table 1 Relative molecular mass distribution of hemepeptide
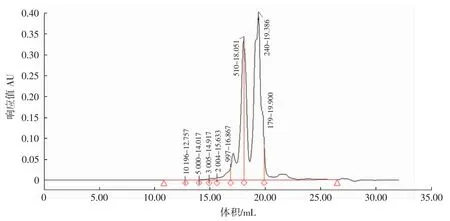
图2 血肽高效液相色谱图Fig.2 HPLC of hemepeptide
鸡血血红蛋白经中性蛋白酶酶解后,酶解液中肽的相对分子质量主要分布在1 000 Da以下,1 000 Da~2 000 Da的肽含量较低,仅为2.69%,500 Da~1 000 Da的肽含量为 23.97%,180 Da~500 Da的肽含量为66.07%,低于180 Da的肽含量为6.52%,属于氨基酸或其残基。根据氨基酸平均相对分子质量180 Da,可以推断酶解液中肽大部分由2个~6个氨基酸组成,属于小肽(或寡肽)范畴。由此可以说明,采用上述的酶解工艺条件可以得到含量超过90%以上小肽样品。
2.3 血肽SephadexG-15分离纯化
根据表1血肽大部分相对分子质量小于1000Da,而Sephadex G-15分离的分子质量范围是<1 500 Da,因此选择采用交联葡聚糖凝胶Sephadex G-15分离纯化血肽粗品,洗脱峰见图3。

图3 血肽葡聚糖凝胶层析图谱Fig.3 Dextran gel chromatography of hemepeptide
凝胶层析过程中多肽按照分子量大小先后被洗脱出来,共分离出P1、P2、P3与P4共4个组分,分子量大小顺序依次为P1>P2>P3>P4,根据各组分峰面积,4个组分含量与HPLC相对应,分别收集P2、P3组分,冷冻干燥后研究其抗氧化活性。
2.4 血肽抗氧化活性
血肽粗品、P2组分、P3组分的 ABTS+自由基、DPPH自由基、羟基自由基、O2-自由基的清除率结果见图4。
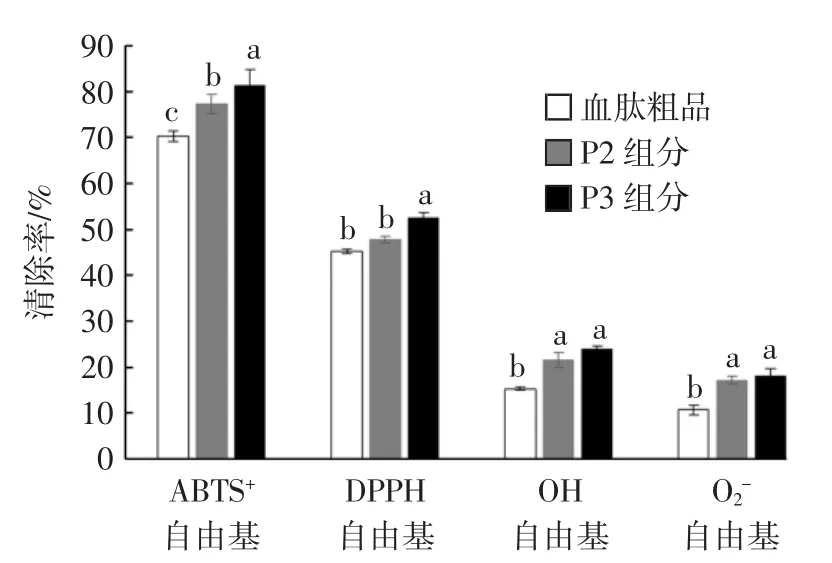
图4 血肽粗品与Sephadex G-15分离组分抗氧化活性Fig.4 Antioxidant activities of crude hemepeptides and Sephadex G-15 isolated components
鉴于多肽抗氧化活性存在剂量-效应关系,因此在抗氧化活性测定试验中,确定血肽粗品及各组分质量浓度为3 mg/mL。结果表明,血肽粗品经Sephadex G-15的分离纯化后,多肽组分的抗氧化活性增加,且分子量越低的组分ABTS+自由基、DPPH自由基、羟基自由基、O2-自由基的清除率越高,分离纯化得到的血肽P3组分具有最强的抗氧化性能。肽的抗氧化活性与其分子量之间存在相关性,其活性可能随着肽分子量的降低而增加,另外,肽的氨基酸组成、序列以及重要氨基酸所在肽链中位置也与多肽抗氧化性相关[21-22]。
3 结论
鸡血血红蛋白通过中性蛋白酶酶解,血红蛋白底物浓度5%,酶添加量1.5%,酶解时间5 h,酶解液离心冻干获得血肽粗品,血肽相对分子质量大部分集中在1 000 Da以下,主要分布于500 Da~1 000 Da与180 Da~500 Da,含量分别为23.97%、66.07%,由此可以推断,在此酶解工艺条件下,可以获得2个~5个氨基酸组成的血肽分子。经交联葡聚糖凝胶Sephadex G-15分离得到4个洗脱峰,与高效液相色谱分析结果一致。分子量180 Da~500 Da的血肽ABTS+自由基、DPPH自由基、羟基自由基、O2-自由基的清除率分别为81.28%、52.45%、23.86%与18.14%,高于血肽粗品与500 Da~1 000 Da的血肽,表明纯化后的血肽的抗氧化活性增加,且分子量小的血肽抗氧化活性较高。
