南方红豆杉人工林针叶C、N、P化学计量特征
2021-10-10刘成功钱莹莹唐晓蝶王生树李志东
陈 黎,刘成功,钱莹莹,唐晓蝶,王生树,李志东,李 燕, 崔 珺
(1.黄山学院生命与环境科学学院,安徽 黄山 245041; 2.中国林业科学研究院林业研究所,北京 100091)
自然界中植物均由16种以上的化学元素组成,其中碳(C)构成了植物近50%的干物质[1],是植物体重要的结构性元素和新陈代谢的能量来源之一[2],而氮(N)和磷(P)作为植物体的功能性元素,与核酸、蛋白质、酶等的合成以及光合作用等生理活动关系密切[3],是决定初级生产者生长发育的主要营养元素[4],在植物功能演变过程中起着植物体与自然资源之间的纽带作用[5]。在陆地生态系统中,植物的生物化学功能之间存在耦合关系,各元素间通过相互作用所形成的平衡关系称为生态化学计量[6]。生态化学计量学是生态学中研究能量平衡和多重化学元素平衡的一门新兴科学,它将生态学研究从个体、种群、群落、生态系统和全球尺度上进行了多层次的有机统一,为解决生物圈的营养代谢、供求和循环问题,以及生态系统功能结构与稳定性维持机制的研究提供了新手段[7]。
近年来,生态化学计量特征已成为森林、湿地、草地等生态系统中的研究热点[8-9]。C、N、P作为生态化学计量学中研究最多的3种元素,其C、N、P质量比(记为C∶N∶P)不仅可以表征植物的功能性状[10],还可以反映植物的生境适应性以及土壤养分与植物地上部分营养需求的动态平衡关系[11]。在植物器官中,叶片作为蒸腾作用和光合反应的核心场所,它的化学计量特征能够用来代表全株状况[12]。研究表明,叶片对N、P的可获取量决定其C储量[2],当叶片进入衰老凋落前会对N、P等养分进行重吸收来改变自身的养分供应状况和限制格局,降低和避免植物对土壤养分库的过度依赖[13]。因此,加强植物叶片养分元素化学计量和重吸收特征的研究,深入了解植物生长过程中的养分利用策略,可为植物生长过程中土壤养分的合理补充提供重要参考依据。
南方红豆杉(Taxuschinensisvar.mairei)为常绿乔木,是中国亚热带至暖温带特有树种之一,其木材坚硬、纹理致密、枝叶浓郁,全株均可提取抗癌药物紫杉醇,属国家Ⅰ级珍稀濒危植物。常零星分布于阔叶林中,在安徽的黄山地区有野生分布和人工林。当前,有关南方红豆杉的品种选育[14]、栽培管理[15]、群落结构特征[16]等研究已取得相应进展。作为典型喜阴树种,研究者还发现其对环境的变化较为敏感,例如高海拔山地的南方红豆杉引种至低海拔区后,一些个体的叶片出现了不同特征的变化[17],但这一过程是否会与其养分含量、化学计量比和养分重吸收特征的变化有关尚不明确,且国内外有关此方面的研究鲜见报道。对南方红豆杉碳氮磷化学计量特征的研究,不仅可以揭示植物与环境变化的适应性关系,还可以探究其生长的限制性元素,从而为南方红豆杉的繁衍和保护提供帮助。本研究以温暖湿润的黄山市屯溪区人工栽植的9年生南方红豆杉为研究对象,分析其针叶的C、N、P含量和生态化学计量比的季节变化,以及N、P养分的重吸收特征,探讨N、P养分重吸收特征与针叶养分、生态化学计量比的相关关系,揭示南方红豆杉的养分限制格局,并提出养分高效利用策略,以期为南方红豆杉造林和科学施肥提供指导。
1 材料与方法
1.1 试验区概况及样地选择
试验地位于安徽省屯溪区黄山学院实验教学实践基地(118°19′48″E,29°43′12″N),海拔130~140 m,属于中亚热带湿润性季风气候,年均气温15.5~16.4 ℃,冬无严寒,无霜期可达236 d,雨水充沛,年均降水量1 696 mm,土壤类型为红壤土。试验林为9年生南方红豆杉人工林(2011年春采用营养钵完成播种育苗;2014年春按1 m × 1 m株行距完成造林),林分密度为1×104株/hm2,郁闭度为0.90%。因该人工林经营管理强度较高,林分内植被多样性较小,仅零星可见少量的黄山栾树(Koelreuteriabipinnatavar.integrifoliola)和青冈栎(Cyclobalanopsisglauca)幼苗;灌木以人工套植的少量檵木(Loropetalumchinense)和黄山杜鹃(Rhododendronmaculiferum)为主;偶见蛇莓(Duchesneaindica)、鱼腥草(Houttuyniacordata)等草本。
2019年5月,于人工林内设置4个10 m × 10 m的样方,分别对样方内南方红豆杉的苗高、冠幅和地径等进行每木调查,平均树高为(2.68 ± 0.52) m,平均冠幅为(159.17 ± 33.76) cm,平均胸径为(3.02 ± 0.21) cm。根据调查结果于每个样方内选取3株长势优良的典型植株作为试验样株,在距离样株树基部20 cm处,沿东、南、西、北4个方向,采用容积为100 cm3的环刀对0~30 cm土壤剖面内进行取样,并测定土样的pH为5.61 ± 0.32、含水率为(20.13 ± 2.52)%、容重为(1.34 ± 0.02) g/cm3、孔隙度为(49.56 ± 3.26)%、有机碳含量为(8.38 ± 1.38) g/kg、全N含量为(7.33 ± 0.42) g/kg、全P含量为(0.52 ± 0.15) g/kg。
1.2 研究方法
1.2.1 样品采集与处理
2019年6—11月,每月中旬分别在9年生南方红豆杉样株的东、南、北、西4个方位,于冠层上、中、下部各随机选取大小与生长相对一致的多年生小枝,摘取其全部针叶(包括多年生针叶),充分混合为1个样品,质量约为100 g,采样时间均为每天9:00—11:00,将采集的样品带回实验室,用纯水洗除表面灰土,再用吸水滤纸吸干针叶表面水分,转至105 ℃烘箱中杀青30 min,再经60 ℃烘干至质量恒定,最后粉碎过孔径为0.15 mm(100目)的筛备用。
1.2.2 样品测定
南方红豆杉针叶C、N含量采用德国产Elementar ELVario Max全自动碳氮分析仪测定,P含量采用硝酸-高氯酸消煮-钼锑抗分光光度法测定[8],各针叶样品测定重复3次。
1.3 数据分析
针叶的C、N、P化学计量特征采用质量比表示。针叶N、P养分重吸收效率采用新鲜(8月)成熟叶和当年生长末期(11月)衰老叶,计算公式如下[9]:
式中:δ为N或P的重吸收率;m1为新鲜成熟针叶中N或P含量,g/kg;m2为当年生长末期衰老针叶中N或P含量,g/kg。
应用Excel 2010进行数据处理和图表制作,采用SPSS 21.0进行参数的统计分析,应用单因素方差分析(One-way ANOVA)进行差异显著性分析,通过LSD(最小显著差异法)进行差异比较(α=0.05),采用Pearson分析来揭示叶片元素含量及其化学计量比与养分重吸收率的关系。
2 结果与分析
2.1 南方红豆杉针叶C、N、P含量特征及其变异系数
南方红豆杉针叶C、N、P的平均含量见表1,主要元素C、N、P含量的均值分别为479.67、22.52、2.21 g/kg,碳氮质量比(记为C∶N)、碳磷质量比(记为C∶P)、氮磷质量比(记为N∶P)分别为21.74、226.25、10.55。从变异系数可以看出,南方红豆杉针叶C的含量和C∶N的离散程度较小,其变异系数分别为3.90%和13.80%,P含量的变异系数较大(22.43%),N的自我调控系数强于P,C∶P和N∶P的变异系数也较大。
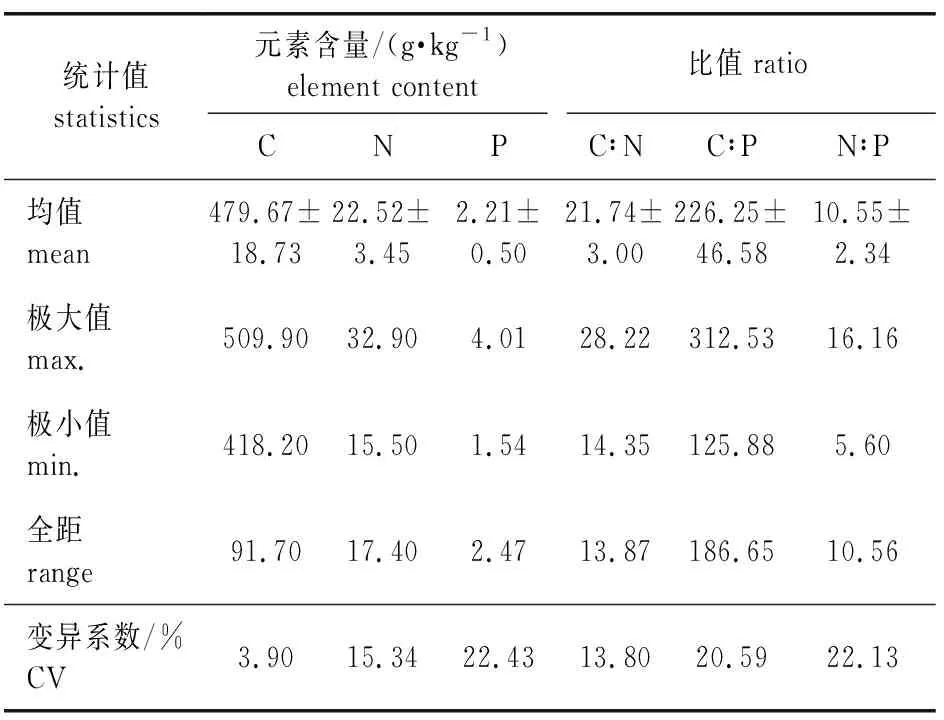
表1 南方红豆杉人工林针叶元素含量及其变异系数Table 1 Elements contents and their coefficient of variation of T. chinensis var. mairei plantation needles
2.2 南方红豆杉针叶C、N、P含量及化学计量比动态变化
南方红豆杉针叶C、N、P含量在生长季均呈一定程度的动态变化模式,且变化特征不完全相同(图1)。从图1可以看出,各月份针叶C与N含量均表现为先平缓上升后显著下降趋势,8—9月,针叶中C、N含量均要高于其他时期,其中8月针叶C含量(489.27 g/kg)显著高于10月(468.38 g/kg),11月针叶N含量比8、9月显著降低了16.25%和15.37%。相较于C、N含量而言,随着生长季节的变化,南方红豆杉针叶中P含量总体呈先显著升高后显著降低的变化趋势,于9月达到峰值(2.66 g/kg),显著高于6、10和11月,其他各月份差异不显著。
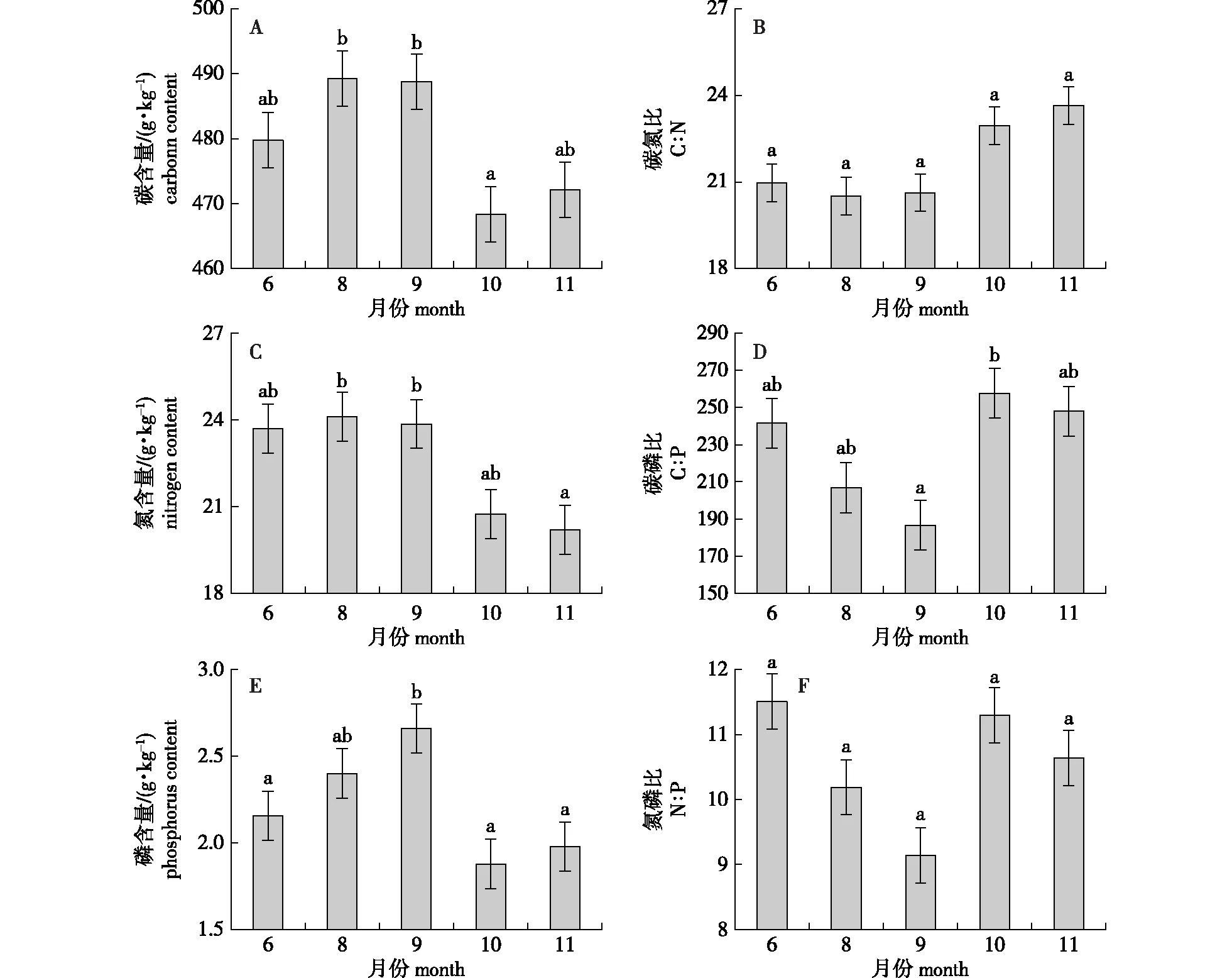
不同小写字母表示差异显著(P<0.05)。Different lowercase letters mean significant differences at 0.05 level.图1 南方红豆杉人工林针叶C、N、P含量及其化学计量比的季节变化Fig.1 Seasonal variations of C, N, P contents and stoichiometric ratios of T. chinensis var. mairei plantation needles
针叶化学计量比在各月份间的变化显示:C∶N在6—11月总体呈上升趋势,于11月达到最大值(23.65),但各月份间的C∶N差异均不显著;C∶P在6—11月表现为先降低后升高的波动变化,变化范围为186.66~257.73,其中9月比10月低23.96%,其他月份间无显著差异。N∶P变化趋势与C∶P相似,具有波动性,变化范围为9.14 ~ 11.51,但不同月份间的N∶P差异均不显著。说明针叶在生长季中C∶N和N∶P比C∶P 更稳定,C、N与P具有较好的耦合协同性。
2.3 南方红豆杉针叶C、N、P含量与化学计量比相关性
南方红豆杉针叶C与N含量呈极显著正相关,与P含量呈显著正相关,N含量与P含量呈极显著正相关(表2)。可见,C、N、P含量在南方红豆杉针叶中存在较高的耦合度。从南方红豆杉针叶C、N、P含量与化学计量比之间的关系可以看出,N含量与C∶N和C∶P分别呈极显著负相关,因为C∶N的值与N成反比,而N和P呈极显著正相关;P含量与C∶N、C∶P及N∶P均呈极显著负相关,说明针叶中化学计量比的变化,P含量起重要作用。
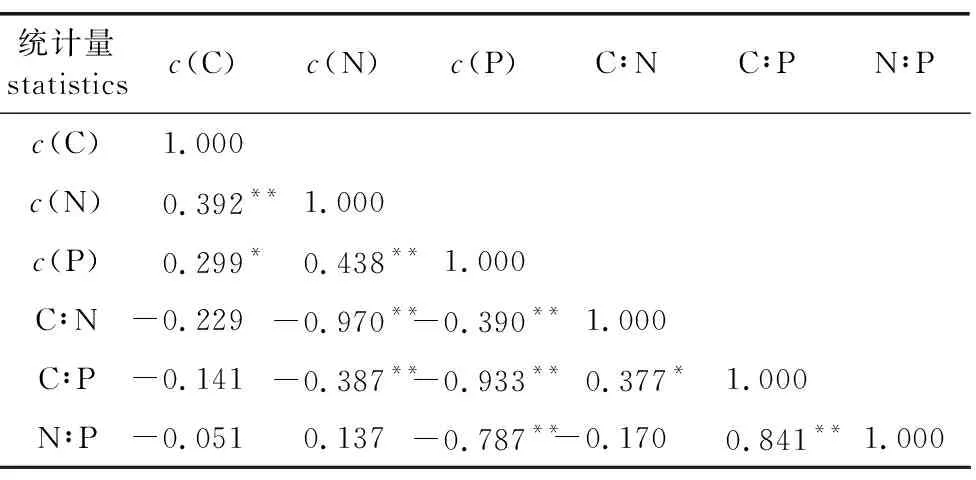
表2 C、N、P含量及化学计量比之间的相关系数Table 2 The correlation coefficient among C,N and P contents and their stoichiometric ratios
2.4 南方红豆杉针叶N、P营养元素重吸收率
植物叶片在衰老凋落前往往会通过养分重吸收来降低自身的养分损失。从图2中看出,南方红豆杉作为常绿树种,其生长末期针叶中N和P两种营养元素同样存在这种重吸收过程。其中,针叶N的重吸收率为19.33%,变异系数为11.28%;而P的转移度要略高于N,重吸收率为22.16%,变异系数为13.72%。
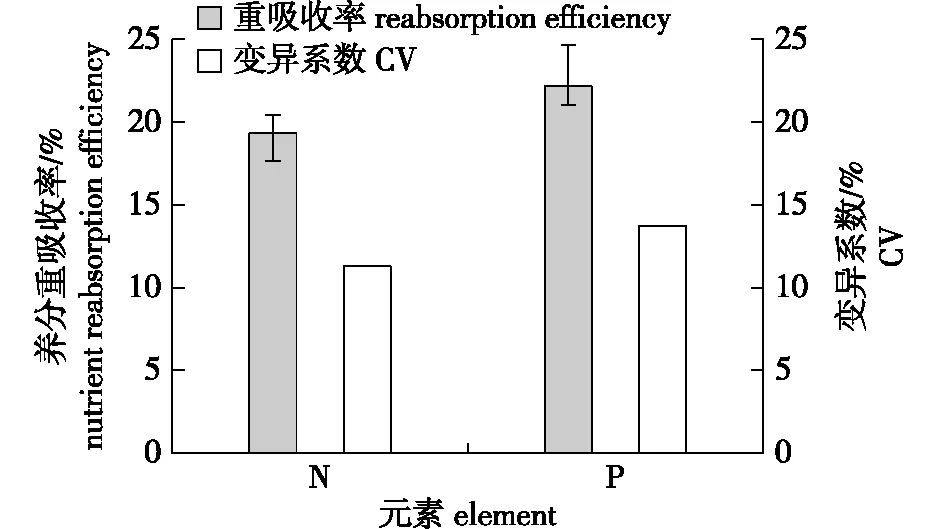
图2 南方红豆杉人工林叶片N、P 重吸收率及其变异系数Fig.2 Needles nutrient reabsorption efficiency and thier coefficient of variation of T. chinensis var. mairei plantation
2.5 南方红豆杉针叶养分重吸收率与元素含量及其化学计量比的相关性
以养分重吸收率为因变量,分别以针叶元素含量和化学计量比为自变量,对南方红豆杉成熟叶和衰老叶元素含量及化学计量比与其N、P重吸收率进行线性回归分析(表3)。由表3可知,南方红豆杉针叶N重吸收率(NRE)与成熟叶C、N、P含量均呈不显著线性正相关(P>0.05),而与化学计量比呈不显著线性负相关;与衰老叶C、N含量及C∶P和N∶P均呈不显著线性负相关,与P含量和C∶N呈不显著线性正相关。P重吸收率(PRE)与成熟叶N、P含量、N∶P均呈不显著线性正相关,与C含量、C∶N和C∶P呈不显著线性负相关;与衰老叶C、N含量呈不显著线性正相关,与C∶N呈不显著负相关。但P的PRE与衰老叶P含量和C∶P呈显著线性负相关(P<0.05),回归方程分别为y=-17.824x+56.336(R2=0.345)和y=-1.909x+67.265(R2=0.283),与N∶P呈显著线性正相关(P<0.05),回归方程为y=3.106x-11.709(R2=0.534)。

表3 针叶养分浓度及其化学计量比与重吸收率的相关性Table 3 Correlation between needles nutrient elements contents and stoichiometric ratios and their reabsorption efficiency
3 讨 论
3.1 针叶元素含量分析
一般而言,叶片C含量越高,光合速率和生长速率越小,防御不利环境的能力越强,而叶片N、P含量越高,光合速率和生长速率越大,资源竞争力越强[18]。本研究中,南方红豆杉针叶C含量高于全球陆地植物叶片平均值(464.20 g/kg)[19],表明针叶C储存能力较强,这与常绿植物针叶更新慢、光合固定的碳素在针叶中大量积累有关[20];但低于香榧(Torreyagrandis,533.0 g/kg)[21]以及青藏高原东缘主要针叶树种(504.83 g/kg)[12],可见生活型或生态系统类型的差异也会影响叶片的固碳作用[22]。研究地南方红豆杉针叶N、P含量(22.52、2.21 g/kg)高于全球尺度植物平均值(20.10、1.77 g/kg)[20]、中国西北温带森林针叶树种平均值(18.04、1.32 g/kg)[23]和我国陆地植物的N、P含量(20.24、1.46 g/kg)[24],可能是温暖湿润的黄山地区雨季和雾日较长,植物生长季日照较短,较高的N、P含量更利于慢生型南方红豆杉生长。同时,植物趋向于将更多的养分分配至光合叶片中,以确保有限的生长期内拥有高效的光合效率与酶活性来维持代谢[20,25]。另外,C作为植物骨架的基本结构物质本身具有很强的稳定性,在南方红豆杉针叶中同样表现为高含量且变异系数小的特点。Pan等[26]研究发现,N含量往往被植物控制在较窄的范围,比P含量具有更高的自我调控系数,表现出较强的化学内稳性,本研究结果与之具有一致性。
有关研究表明,植物叶片C与N、P含量间呈负相关,而N与P含量则呈正相关,体现着植物叶片功能性状间的经济权衡策略[27]。但对喀斯特森林植物叶片研究发现,其C、P含量间无明显相关性[28];辽西油松(Pinustabuliformis)叶片C、N含量间呈正相关[29];云杉(Piceaaspoerata)幼苗叶片C、P含量间呈极显著正相关[30],本研究与上述观点略有不同,表明南方红豆杉固C过程中在对N、P养分利用的权衡策略上与之有别;而N、P含量间极高的相关性,则说明了其含量变化的相对一致性。
3.2 针叶C∶N∶P化学计量特征
生态系统中C储存在一定程度上是由关键养分N、P的可获得量所控制,N、P不足意味着C的相对过量,C∶N、C∶P升高,反之,C∶N、C∶P下降[2],而植物叶片C∶N∶P作为生长限制性的诊断依据,还与N、P养分利用效率相关[10]。研究表明,相同或不同生活型的植物叶片C∶N∶P会因温度、光照、水分、纬度以及系统分类等不同而存在较大差异[24]。南方红豆杉针叶C∶N和C∶P均低于全球水平[31],茂兰喀斯特地区68种典型植物[28]和安徽石台亚热带常绿阔叶林的研究结果[32]表明,南方红豆杉针叶对N、P的利用效率相对较低;但高于伏牛山区宝天曼自然保护区内的红豆杉[33],进一步验证了植物在维持固C功能方面存在N、P利用效率或生存策略差异。
Koerselman等[34]提出,当N∶P< 14时,植物地上生物量受N限制;当N∶P> 16时则受P限制;当14≤N∶P≤16时则表现为N、P共同限制。吴鹏等[28]认为,当N∶P< 10时,植物生长即受到N的限制,当N∶P> 14时,植物生长开始受P限制。南方红豆杉针叶N∶P低于全球平均值(12.60)[19],这可能与单一针叶树纯林凋落物量较少、林地凋落物积累不足、林地土壤有机质含量相对较低有关[35]。但本研究认为南方红豆杉针叶具有较高的N、P含量,仍处于幼年林阶段的林分生长,土壤中的养分足以满足其生长所需,这与贺合亮等[36]对青藏高原东部窄叶鲜卑花(Sibiraeaangustata)的研究结果相似。相关性分析显示,南方红豆杉针叶C∶P与N∶P呈极显著正相关,而C∶N与N∶P呈负相关,这与塔里木河上游荒漠区4种灌木植物的研究结果一致[37],从生态化学计量特征上反映了植物对营养元素的经济利用策略。
3.3 针叶元素含量及化学计量比季节动态
随着生长季节的变化,植物光合作用、生长速度、有机质累积等都会影响叶片养分含量[38]。本研究中,南方红豆杉针叶C、N、P含量6月低于8月和9月,这可能是6月的黄山雨水较多,容易发生养分淋溶,针叶吸收的有效N和有效P移动性增强,影响了C固定和N、P吸收;气温升高后,光合作用增强,糖类等产物逐渐积累,C含量显著提高[39]。针叶伸展后,为了维持细胞的快速分裂,需要合成大量的蛋白质和核酸,此时土壤及其他器官中的N和P开始向针叶转移,表现为针叶N、P含量升高,这与溱湖湿地的芦苇(Phragmitesaustralis)在夏季N、P含量均显著升高的现象相似[40]。同时,南方红豆杉针叶面积较小,幼叶和成熟叶相差不大,且生长缓慢,即使在生长旺季,N和P元素也不易急速降低,这一现象与有关落叶松(Larixgmelinii)的研究结果相似[38]。生长末期,环境温度降低,光合作用逐渐停止并伴有养分回流,而植物生长终究是靠消耗N和P实现,致使南方红豆杉针叶养分含量降低。
除植物叶片C、N、P含量会因发育阶段的不同而发生变化,其C∶N∶P化学计量比也存在动态变化特征。一般认为,生态化学计量与RNA分配以及细胞生长速率有关,高生长速率需要较多的rRNA来满足生长。Matzek等[41]发现rRNA含量的增加会导致细胞中P含量增加,C∶P和N∶P会在植物快速生长时呈降低趋势。南方红豆杉针叶C∶N、C∶P及N∶P在8—9月最低,说明在这段时间内其生长速率有所提高,这与植物生长速率越高其体内的N、P含量越高,而C∶N、N∶P、C∶P较低的“生长速率理论”[19]相符合。另外,南方红豆杉针叶C∶N和N∶P在各月份间的差异不显著,而C∶P在10月呈短暂的急速增大,这可能与植物体P含量的变异性大于N有关[26]。
3.4 针叶N、P重吸收率与元素含量及化学计量比的关系
养分重吸收可以减少植物因衰老而造成养分流失来延长养分在体内的驻留时间,降低生境依赖性,实现贫瘠生境中的生存[13]。一般认为,植物在养分匮乏的生境下具有较强烈的养分重吸收率,反之较弱[42]。本研究中,南方红豆杉针叶对P的重吸收能力高于N,这与有关黄土高原子午岭林区典型树种研究结果一致[9];但均低于全球陆地森林生态系统叶片N重吸收率(62.10%)、P重吸收率(64.90%)[43],也低于落叶树辽东栎(Quercusmongolica,N重吸收率为43.34%,P重吸收率为58.12%)和刺槐(Robiniapseudoacacia,N重吸收率为40.99%,P重吸收率为42.51%)[9],这是因为常绿植物叶片较落叶植物有着更长的生命周期,光合时间和养分驻留时间长,养分利用率高[44],落叶植物则具有更高的光合速率、凋落物分解率和养分重吸收率[29]。相比黄土高原地区和辽西地区的油松,同样具有较低的N、P重吸收率[30],这可能是物种间的差异导致了植物叶片养分含量、衰老叶养分含量以及养分重吸收效率的差异[45],间接反映了温暖湿润的黄山地区土壤养分比辽西和黄土高原地区富裕,土壤养分不足以限制南方红豆杉的生长。
目前,有关植物叶片养分含量与重吸收率的关系尚未达成定论。Kobe等[46]认为,植物养分重吸收率随成熟叶养分含量的增加而降低;而An等[47]认为,较高的养分含量有利于养分的重吸收。南方红豆杉成熟针叶C、N、P化学计量均与其N、P重吸收率无显著关系,与Aerts[48]观点相符;而N重吸收率与衰老叶中养分含量及其C∶N∶P的关系与赤桉(Eucalyptuscamaldulensis)凋落叶的研究结果不尽相同[49],本研究中,P重吸收率与衰老叶P含量、C∶P以及N∶P的关系说明,较高的养分重吸收率降低了衰老叶P的含量,原因是随着养分有效性的变化,植物从土壤吸收养分和自身的养分回收得以优化,表现出养分元素间的差别利用[50]。
综上所述,9年生南方红豆杉人工林正处于生长旺盛期,针叶C、N、P含量高于全球陆地植物平均值,呈现较好的C储存能力和养分资源竞争力,生长尚未出现N、P养分限制;针叶养分含量及其化学计量比的月变化符合植物生长速率的变化规律;针叶N、P重吸收率水平较低,养分驻留时间较长,有利于针叶的结构支撑和保护。当然,植物-凋落物-土壤系统的养分互作和循环是一个复杂的程序,本研究仅从对环境敏感的叶片来反映南方红豆杉的养分利用策略,对凋落物和土壤的研究不足,应结合施肥试验、同位素示踪等技术进一步探讨该植物的养分利用与循环特点将是未来的研究重点。
