中药研发外包产业现状调研与分析*
2021-10-08陈子琪罗菊元郭明雪杜守颖
陈子琪,罗菊元,郭明雪,杜守颖,陆 洋,2
(1.北京中医药大学中药学院,北京102488;2.北京中医药大学深圳研究院,广东 深圳518000)
2003年颁布的《药物临床试验质量管理规范》(以下简称《规范》)首次确定合同研究组织(CRO)的定义,此后,承办医药研发外包服务的CRO便逐渐成为医药生物研发领域中热门且规模发展潜力巨大的产业。但CRO在我国中医药行业的发展缓慢,至今仍无单纯经营中药产业外包服务的CRO,专注于中药主体的CRO相关报道也寥寥无几。本研究中对医药企业和CRO公司进行问卷调研,初步了解中药研发外包产业的现状,并进行深入分析,提出应对策略,同时帮助企业或行业了解中药产业,加强中药研发服务工作,引导中医药行业发展走向,提高我国中医药的自主创新能力。
1 我国医药研发外包现状
我国CRO起步较国际CRO晚。国内CRO的起源可追溯到1996年,昆泰医药在香港设立办事处及美迪生药业在北京成立投资公司[1]。第2年,中国首家CRO依格斯成立[1-2]。21世纪初,在外资与内资的刺激与拉动下,我国CRO市场初具雏形。加之《规范》规定申办者可以委托CRO执行临床试验中的某些工作和任务,从而直接带动了临床CRO的发展。在2008年金融危机的打击下,众多跨国制药企业纷纷将研发机构与业务投入到中国,为中国带来了更多的资金、机会与行业建设[3]。根据《中国医药CRO产业图谱》数据,截至2017年9月,国内约有500家CRO公司可承接临床前或临床业务,22家本土CRO公司已上市。这些公司大多分布在中国东部的沿海地区,整体呈金字塔模式分布[4]。其中,位于金字塔塔尖的本土公司有杭州泰格医药科技股份有限公司、上海药明生物技术有限公司、普蕊斯(上海)医药科技开发股份有限公司等。这些公司大多拥有自己的产业链,具有流程化的服务和品牌知名度优势。其余绝大多数是位于金字塔底部的小型CRO公司,提供的服务单一、市场占有度较低[4]。近几年来,我国开始加大对药品研发的投入,申报和获批的药品数量呈上升趋势,参与其中项目的花费和潜在利润均较大。伴随着世界医药企业结构改变和创新药物研发的全球化发展,中国需要融入这样的趋势和环境并从中获益,国内医药企业的市场也必将会跟随国际的趋势,迎来更大的挑战与发展。
2 调研对象与方法
2.1 对象
调研对象主要涉及医药企业与CRO公司,内容涉及中药研发现状、各企业对行业未来发展的预测及中药项目的优劣势因素分析等。
2.2 方法
采用问卷调查法,调查时间为2020年4月至10月。通过线上问卷平台向就职于医药行业人群发放调查问卷,筛选、剔除无效问卷后回收有效问卷共112份。采用SPSS20.0统计学软件分析,计数资料以率(%)表示,行χ2检验,检验水准α=0.05,P<0.05为差异有统计学意义。
3 调研结果与分析
3.1 中药研发外包现状
3.1.1 企业分布与规模
本次调查对象中,66人来自传统医药企业,46人来自CRO公司。来自医药企业的人数以北京(29人)最多,其次为广东(9人)、江苏(8人)等;来自CRO公司的人数也以北京(13人)最多,其次为广东(5人)、浙江(4人)、上海(4人)、山东(4人)等。参与调研对象就职公司多为10~300人规模的中小型公司。
3.1.2 中药业务开展情况
结果见表1。可见,无论是对现阶段还是5年后中药项目占比的预测,医药企业与CRO公司均有明显差异(对现阶段的预测,χ2=20.07、P<0.0001;对5年后的预测,χ2=45.98、P<0.0001),且中药企业预测5年后 的 中 药 项 目 数 目 将 显 著 增 加(χ2=18.28,P=0.001),对中药研发项目外包的意愿也将提高。

表1 医药企业与CRO公司中药项目分布(项)Tab.1Distribution of Chinese medicine projectsin pharmaceutical enterprises andCROs(item)
业务类型方面,传统企业主要将药品临床试验(78.79%、n=52)、数据整理分析(68.18%、n=45)及新药注册文档准备的工作(39.39%、n=26)交付给CRO公司,主要原因是医药企业认为这类项目较烦冗,且没有相应的项目经验。此外,几乎所有(97.83%、n=45)CRO公司的业务来源是传统医药企业;CRO公司经营的中药项目类型以临床试验为主(n=14),其次为经典名方研究(n=5)及中药药物经济学评价(n=3)。
3.1.3 中药药品类型及针对疾病
根据CRO公司员工反馈的统计结果,注册的中药类型主要是未在国内上市销售的中药、天然药物、复方制剂(n=20)和仿制药(n=20),依照2020年版新《中药注册管理办法》应划分为同名同方药。医药企业内部的中药研发类型与CRO公司中的情况相似,也是以未在国内上市销售的中药、天然药物复方制剂(n=21)和已有国家标准的中药、天然药物(n=16)为主。
CRO公司经营的中药药品涉及的疾病类型主要为内分泌、营养和代谢疾病,神经系统疾病,呼吸系统疾病,与医药企业预估类型无显著差异(P=0.859>0.05)。详见表2。
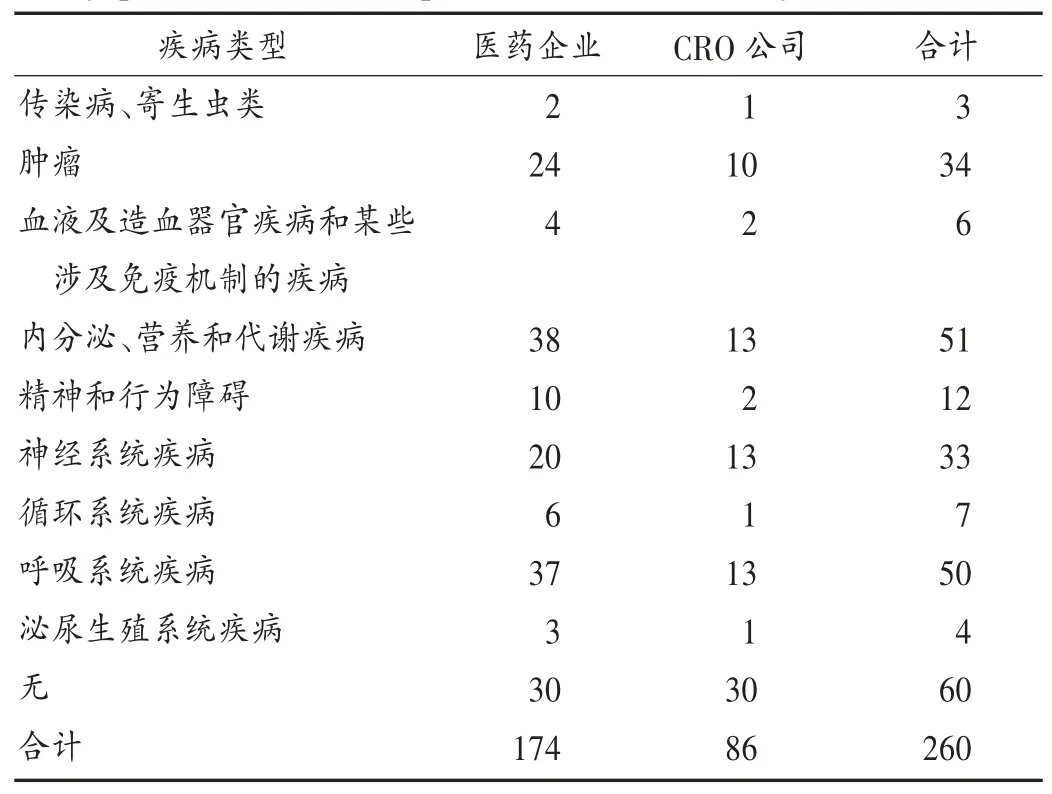
表2 医药企业预测与CRO公司承接中药药品针对疾病类型(种)Tab.2 Typesof diseases targeted by Chinese medicine that predicted by pharmaceutical enterprisesand undertaken by CROs(kind)
3.1.4 中药项目的优劣势因素影响
选出对医药企业及CRO公司调研中重合的优势因素,根据调研结果将各方的选项数与选项分数相乘求和,得出各方对各项优势因素的总分;得χ2=37.16、P<0.0001,得出政策的支持、受众面广、有项目研发经验、药物疗效好、项目成本低5项因素对医药企业与CRO公司影响程度不完全一致,因此,对5项因素与总影响程度得分进行关联分析。
优势因素结果见表3。可知,仅“政策支持”“有项目研发经验”对医药企业和CRO公司的影响程度存在显著差异(P<0.05),且“有项目研发经验”的影响更显著。即双方均认可中药药物的疗效好及中药项目的经营成本较低将是整个中药行业发展的优势,但对中药项目受众面广的说法比较不认可。有项目研发经验是CRO公司的最大优势,而政策支持是医药企业方的最大优势。

表3 医药企业与CRO公司对中药发展优势项目的选择Tab.3 Selection of Chinese medicine-development advantageous projects by pharmaceutical enterprises and CROs
劣势因素结果见表4。可知,仅“难找到CRO/医药企业”项对医药企业及CRO公司的影响程度存在显著差异(P<0.05)。因此,可认为中药项目的“药物毒副作用难明确”“缺乏‘金标准’”“项目利润低”“数据难以量化”是整个行业将共同面临的问题;且这类问题较宏观,很难依靠部分医药企业/CRO公司的调整得以解决。此外,双方“难找到CRO/医药企业”,说明双方对彼此的了解度还不够,特别是具有经营中药项目研究能力的CRO公司在自我宣传与行业影响力方面尚需进一步提升;但这项劣势因素较微观,可通过双方的自行调节得以改善。

表4 医药企业与CRO公司对中药发展劣势项目的选择Tab.4 Selection of Chinese medicine-development inferior projects by pharmaceutical enterprises and CROs
3.2 制约中药CRO发展的原因探析
3.2.1 主流医学的环境压力
我国医药产业发展从建立化学药、生物药药厂开始,到以西药药品为主的注册管理及研究方式等,长期偏向于西医药。现阶段,西医医院基础建设、物资状况及培养的人才数目等仍占主导地位,与新中国建立初期中西医并重的目标略有出入。在这样的环境下,中药的研究方式更偏向于西药或中药中单成分研究,偏离了其原本的理论基础与自身特色,也限制了中药的应用范围。同时,人力资源是CRO行业发展的重要资源。医药研发市场中存在着更多西药研发的项目、岗位、资源等,吸收了中医药专业背景人才,造成了中医药行业人才的流失。
3.2.2 中药研发内需动力不足
统计国家药品监督管理局药品审评中心(CDE)过去5年的药品审评报告数据发现,2015年至2019年,中药每年通过新药临床试验申请(IND)的分别有22,84,36,44,15件;每年通过新药申请(NDA)的分别有7,2,1,2,2件,虽然2017年至2019年中药药品注册申请的数目逐年在增加,但总体批准的IND申请却在减少。2016年是CDE受理的中药新药注册数量最少的一年,推测是受2015年的“722事件”影响,导致大多企业自主撤回、推迟对药品的注册申报,导致当年通过NDA的数目仅有2件,且在之后几年保持稳定。2019年是CDE受理的中药药品注册数目最多的一年,但也仅占2019年全年受理药品申请总数的5.24%。并且2019年中药的注册申请多为补充申请和直接行政审批,仅有18件为中药新药注册申请,通过评审批准的中药IND为15件,是5年间数量最少的。调研结果与市场情况表明,中药行业竞争力在医药产业还未能与化学药行业势均力敌。可见,中药研发暂时还未出现“引爆点”,中药研发热情较弱,市场并不活跃,研发质量水平还有待提升。
3.2.3 中药研究认可度有待提升
临床试验项目为CRO公司参与最多的药品研发环节,为此,肖爽等[5]对中药新药临床试验方案认知进行了调研。结果表明,大多研究者对中药临床试验设计方案的整体印象略消极,认为中药的临床研究项目在对比各类型药物临床研究项目时质量还有差距,承接积极性不高。在实际情况中也存在相似问题,研究者在接收中药临床研究项目时大多会优先选择国际多中心项目,而大多数一般类型的中药项目则位居其末。在整体上,中药临床试验研究存在方案设计创新亮点较少,可操作性较差,观察费用较低,得到的结果未能很好地体现中医药特色,研究者收获较少等因素,故很难将其向非中医机构推广,难以提高中药临床研究在国内、国际的认可度[6]。
此外,对公众来说,大众传媒是大多数公民了解和认识中医药研究的主要途径。部分媒体的不实报道及误报削弱了公众对中药临床研究的信任度。在HAN等[7]的分析中,研究者也提及了媒体对临床试验招募受试者的影响;媒体更注重研究数据“率”的情况,而忽略了试验开展的目的与结果,这也是导致部分群众怀疑中医药科学研究真实性的重要原因。
3.2.4 中药企业研发方向不明确
除医疗机构的研究者外,中药企业是申办中药研究的另一个主体。近3年,中药IND和NDA数量的急剧下降,也反映出企业对发展方向的迷茫。企业与研究者发起的临床研究间的重要差异是企业需考虑成本,故不会轻易进行行业标准定义尚较宽泛的研发尝试[8]。如国家中医药管理局2018年颁布的《古代经典名方目录(第一批)》[9]有100个中药处方,但目前仅给出了7首方剂在现代研究后经标准化的关键信息。此外,国内也仅有少数CRO公司能提供较成熟的药品研发全周期的服务。加上2020年更新的法律法规,使得企业对中药药品的研发还处于探索中的适应期,更加减少了项目创新、项目外包的活动。总之,市场上以中药研发、生产外包为主的CRO尚未形成气候,其技术与实力还不足以引领中药的研发热潮。
3.2.5 临床试验执行时问题较多
由于我国临床试验经验较少,2020年版《规范》[10]作为指导性文件更新也较晚。因此,在实际开展临床试验时常遇到责任主体不清、遗传资源约定不够完善、研究方案合规性较差、经费计算错误[11]及入组受试者较少、受试者相关权益保护不足[12]等问题,阻碍了临床试验的开展进度。
考虑到中药的特殊性与复杂性,开展与其相关的临床试验将会更困难,如将面临安慰剂的选择[13]、中药复方临床试验设计理念、主要结局指标选取与测量[14]、中药的不良反应评价[15]等问题。尽管我国为了提升中药的质量出台了多部政策支持,但距离落实到实际层面及具体实施细节方面,仍需经历时间和实践的检验。
4 建议
4.1 做好中药临床研究准备
中药的临床研究离不开临床试验与临床运用,同时,临床试验也是医药外包市场空间最大的细分领域。2019年末,为更好地鼓励中药新药的研发,药物临床试验机构管理制度也由资格认定调整为备案管理,扩大了基层医院接洽临床试验项目的范围,提高了医疗资源研发的利用度,提升了临床科研实力。
此外,在我国千百年的临床实践中,记载了不少使用安全、效用显著的中药方剂。依照国家药监局指导,源自《古代经典名方目录》的中药复方制剂可豁免药效学及临床申报资料。简化申报后的中药临床研究将加快中药临床试验的进展,是中医药传承发展的突破,对于企业临床研发与产业升级具有积极的指导作用。
《药品注册办法》的更新完善对药物研究有更严格的要求。先前动物实验和临床试验研究人群多以成年雄性样本为主,具有一定的偏颇,还需医药研发企业主动更新扩大化后的临床试验结果及更新药品说明书,由此带动的中药上市后再评价工作也将增加,为CRO带来更多机遇。根据调研结果的劣势因素分析,中药企业在寻找CRO公司时较CRO公司寻找中药企业的项目难度更大,证明了CRO公司的自我宣传效果还有待提高。再结合调研结果中企业所预测的中药业务增长趋势分析,CRO需借此机遇做好中药临床研究的准备,赶上中药研发的热潮。
4.2 继续扩大中药的海外市场
近年来,国家药监局开展了多方位的国际交流与合作,在药品不良反应监测、药品监管、药品法规制定、药品注册等方面不断深化。2020年初,新型冠状病毒肺炎(简称新冠肺炎)疫情在多个国家出现,我国率先使用中医药疗法,形成了多版中医药治疗新冠肺炎的诊疗方案,这些方案在疫情防控中发挥了重要作用。为帮助国际社会应对疫情的防控,我国提出了新冠肺炎疫情国际项目合作,并将其列为国家重点研发计划,支持国内诊疗指南中的方剂/中成药与国外高水平科研机构合作,进行国际多中心临床研究等,扩大了中药在国际上的影响[16]。因此,CRO可借此机遇帮助医药企业完成海外市场的注册申报,扩大中医药在国际的认知度与应用范围。
4.3 保证中药研发质量
企业是多数中药科研到产品转化的主体。中药研究涵盖大量综合性学科的知识,包括统计学、经济学、管理学、计算机科学等。因此,中药的研发不仅需要医药企业的全情投入,还需向其他行业辐射延伸,加强中药与其他学科的联系,保证中医药类研究的科学性。同时,这也是我国CRO发展的转折点,由此发展出的业务、技术、人才储备多样性将进一步提升CRO行业的竞争力。
在此期间,CRO公司需完善依照政策措施的执行标准,明确政策执行者与受益者。2020年版《规范》[10]指出,申办者是临床试验数据质量和可靠性的最终责任人。CRO应实施质量保证和质量控制,并规定《规范》中对申办者的要求,上述要求同样适用于承担申办者相关工作和任务的CRO,可直接加强研究执行者的责任与义务,中药临床研究的质量与认可度也将因此得以保障。
4.4 强化多方合作模式
由于历史原因,我国医药事业发展还并未达到真正的中西医并重。与主流医学发展所带动的经营化学药、生物药和医疗器械的CRO公司相比,中医药领域的CRO公司尚存在公司之间的经营水平参差不齐、缺少龙头企业、从业人员医学素质较低等问题,无法满足医药企业对中药研发外包服务的需求[17]。经营中药业务的CRO公司应加强整合产学资源,如规模较大的CRO公司在承接全国性项目之后,可借助地方性CRO公司熟悉当地资源的优势,加强CRO公司之间的横向合作。有中药注册经验优势的CRO公司也可与临床类CRO公司合作,联手完善中药研发全周期服务链,共同发展[18-19]。
在此基础上,李睿等[20]曾提出“ARO-CRO”(即学术研究组织-合同研究组织)运营模式,可更好地将ARO的专业性和CRO的执行力相结合,通过整合多方资源、分工协作的方法,保证临床试验的质量和效率,弥补CRO公司中药研发的短板。
5 小结
近年来,随着全球新药研发及销售市场竞争的日益激烈、新药研发时间成本不断提高,医药研发服务企业凭借其成本优势、效率优势等特点,成为医药研发产业链中新药研发领域中社会化、专业化分工的必然产物。而中药的临床研发作为中药药物上市前必不可少的环节,在评价药物的安全性、有效性和稳定性,提高中药临床疗效,减少药品不良反应等方面具有十分重要的作用。
本调研结果显示,现阶段的中药研发外包项目类型主要是临床研究;中药业务在CRO中为小众;医药企业与CRO公司研究的中药类型均多为同名同方药,所针对疾病均主要为内分泌、营养和代谢疾病,神经系统疾病和呼吸系统疾病。多数医药企业表明,在未来5年内会显著加大对中药的研发投入,所以,CRO公司可根据医药企业的中药研发热点方向,做好对中药业务的准备。如选择开展其有经验的某种疾病临床试验,加强专业化团队的建设与培训。最后,CRO公司还需加强其自身在“企业宣传”“企业形象”等方面的建设,缓解国内CRO规模较小、业务模式较单一的局面,促使CRO能真正借助外部资源提高中药研发的项目质量。
