lncRNA RP11-351J23.1靶向miR-765对食管鳞癌细胞增殖、侵袭和迁移的影响及其机制研究
2021-10-06康书红蔺红丽赵霞
康书红,蔺红丽,赵霞
(1.安阳市人民医院心胸外科,河南 安阳 455000;2.河南护理职业学校科研处,河南 安阳 455000;3.南阳医学高等专科学校护理系,河南 南阳 473000)
食管癌是常见的消化系统肿瘤,预后差,死亡率高[1]。尽管食管癌患者的治疗效果有所改善,但总体5年生存率和食管切除术后5年生存率仍然很差[2]。研究表明,lncRNA(long non-coding RNA)是蛋白质表观遗传调控、转录、转录后调控和翻译后修饰的重要元素,它们可能是食管癌的新生物标志物和治疗靶点[3]。lncRNARP11-351J23.1(LINC0 2487,ENST00000400831)在食管癌中显著低表达[4],RP11-351J23.1 抑制口腔癌细胞侵袭和迁移[5],且与乳腺癌进展有关[6]。本研究通过生物信息学预测,发现RP11-351J23.1与miR-765 存在结合位点。miR-765在食管癌组织中显著高表达,与食管癌进展有关[7]。miR-765 促进肝癌细胞的增殖[8]。但RP1 1-351J23.1和miR-765在食管鳞癌中是否存在调控关系还不清楚。本课题以食管鳞癌细胞Eca109为主要研究对象,假设lncRNA RP11-351J23.1 可通过靶向miR-765 调控Eca109细胞增殖、侵袭和迁移,并对此假设进行验证。
1 材料与方法
1.1 材料 人食管鳞癌细胞株Eca109、KYSE150和EC9706细胞购自ATCC,正常食管上皮细胞HEEC 购自北纳生物;RPMI-1640 培养基、DMEM高糖培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco 公司,牛血清白蛋白(Bovine Serun Albumin,BSA)和胰蛋白酶购自美国Sigma-Aldrich公司;Transwell 板购自美国Corning 公司;引物、RP11-351J23.1 过表达载体(pcDNA-RP11-351J23.1)、miR-765 mimics(miR-765)、miR-765 抑制剂(anti-miR-765)、阴性对照(pcDNA-control、miR-con和anti-miR-con)、lncRNA RP11-351J23.1 野生型(WT)和突变型(MUT)双荧光素酶报告系统载体购自苏州吉玛基因;Lipofectamine 2000 转染试剂、Total RNA 提取试剂盒、real-time PCR 试剂盒、反转录试剂盒(RT-PCR)购自宝生物工程(大连)有限公司;Cell Counting Kit-8(CCK-8)试剂盒购自上海碧云天生物技术有限公司;双荧光素酶报告系统(Dual-Luciferase Reporter Assay System)购自美国Promega 公司;光学显微镜、全自动酶标仪、发光仪及Real-time PCR 仪购自美国Bio-Rad 公司。
1.2 方法
1.2.1 细胞培养 将人食管癌细胞株Eca109和KYSE150 培养在RPMI-1640 培养液中,EC9706和正常食管上皮细胞HEEC 培养于DMEM 高糖培养液中,培养液中均添加10 % FBS、100U/ml 青霉素和100μg/ml 链霉素,在饱和湿度、37 ℃5% CO2培养箱中常规培养,消化传代。
1.2.2 细胞转染 收集对数生长期的Eca109细胞,培养液稀释后以2×l05个细胞/孔接种于6 孔板中,培养至融合度达80%,根据Lipofectamine 2000 试剂说明书进行转染。转染分组:RP11-351J23.1 过表达组 (转染pcDNA-control和pcDNA-RP11-351J23.1),miR-765 抑制组(转染anti-miR-con和anti-miR-765),miR-765 过表达组(转染miR-con和miR-765),RP11-351J23.1和miR-765 过表达组(转染pcDNA-RP11-351J23.1+miR-con和pcDNA-RP11-351J23.1+miR-765)及RP11-351J23.1野生型(WT)和突变型(MUT)双荧光素酶报告系统载体组(分别转染RP11-351J23.1(WT)+miR-con、RP11-351J23.1(WT)+miR-765、RP11-351J23.1(MUT)+miR-con和RP11-351J23.1(MUT)+miR-765),转染48h,收集细胞,验证无误,进行后续实验。
1.2.3 Real-timePCR 检测RNA的表达 收集食管癌Eca109、KYSE150和EC9706和正常食管上皮细胞HEEC,使用Total RNA 提取试剂盒提取细胞总RNA,然后按照反转录试剂盒说明书反转录合成cDNA,以cDNA 为模板,参照real-time PCR 试剂盒说明书进行反应合成miR-765和lncRNA RP11-351J23.1,反应程序为:95℃5min;94℃30s、59℃40s、72℃45s,40 个循环;72℃5min。miR-765上游引物序列:5’-GTAGCCAAGGAATCCGAAGGA-3’,下游引物序列:5’-GCGAGGAAGGAGGAC GAAGGT-3’;lncRNA RP11-351J23.1 上游引物序列:5’-CTCACTGGCAATTGTCGTGGA-3’,下游引物序列:5’-CAGGCACCCTAATGCTGTGCT -3’。用2-ΔΔCt 方法进行数据分析。
1.2.4 CCK8 实验检测细胞活力 收集转染后的Eca109细胞(pcDNA-RP11-351J23.1 组、anti-miR-765 组和pcDNA-RP11-351J23.1+miR-765 组及对照组),消化并稀释,以2×103个细胞/孔(200μl/孔)接种于96 微孔板中,在细胞培养至48h 进行CCK8实验,每孔加入10μl CCK8 溶液,置于37℃继续培养2h,上酶标仪检测450 nm 处的吸光度(A)值。
1.2.5 Transwell 实验测定细胞侵袭和迁移 迁移实验:收集转染后培养至对数生长期的Eca109细胞,用无血清RPMI-1640 培养基过夜饥饿培养,用培养液稀释至1×l06个细胞/ml,在Transwell 上层小室加入100μl 稀释后的Eca109细胞,下层小室加入500μl 含10%FBS的RPMI-1640 培养基作为迁移趋化物,培养24h,取出后用棉签拭去上层小室未迁移的细胞,甲醛固定迁移细胞,结晶紫染色,拍照,显微镜取10 个视野观察迁移细胞并计数,计算平均值。侵袭实验:将-20℃取出的Matrigel置4℃冰箱过夜液化,用4 ℃无血清培养基1:3 比例稀释Matrigel,取100μl稀释的Matrigel 加入Transwell 上层小室,37℃3h 使其固态化,以下步骤同迁移实验。
1.2.6 双荧光素酶报告系统实验 根据1.2.2 方法进行Eca109细胞培养和转染,将构建好的RP11-351J23.1 野生型(WT)和突变型(MUT)双荧光素酶报告载体与miR-con 或miR-765 共转染培养好的Eca109细胞,转染后培养48h,收集细胞并加入RIPA 裂解液重悬细胞,4℃过夜裂解细胞,然后离心收集裂解上清,检测上清中的荧光素酶活性。以海肾荧光素酶活性为对照,分析萤火虫荧光素酶活性。
1.3 统计学处理 采用SPSS17.0 统计软件进行数据分析,计量数据均以均值±标准差()表示,两组间比较采用两独立样本t 检验,多组间比较采用单因素方差及两两比较LSD-t 检验进行分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 lncRNA RP11-351J23.1和miR-765在食管癌细胞株中的表达与正常食管上皮细胞HEEC组相比,在食管癌Eca109、KYSE150和EC9706细胞中lncRNA RP11-351J23.1表达量均显著降低(P<0.05),miR-765表达量均显著升高(P<0.05),见表1。lncRNA RP11-351J23.1和miR-765在三种食管癌细胞株中表达情况一致,选择表达差异较大的Eca109细胞进行后续实验。
表1 qRT-PCR 检测不同食管癌细胞株中lncRNA RP11-351J23.1和miR-765的表达(,n=9)
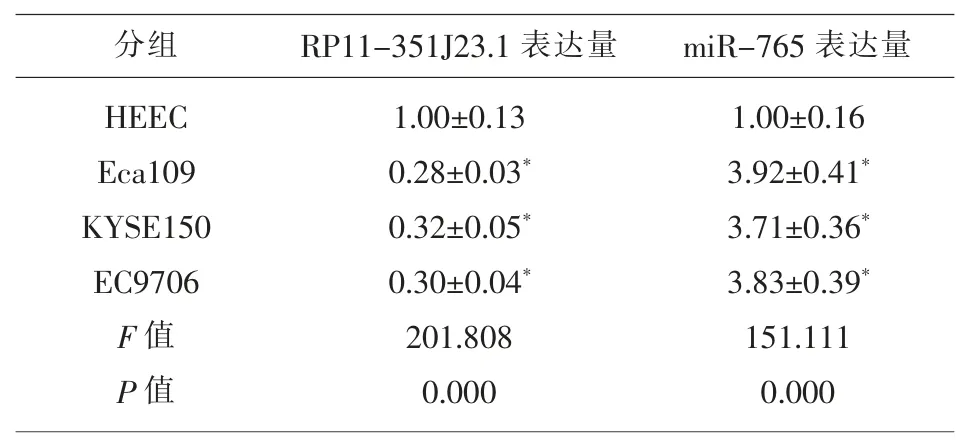
表1 qRT-PCR 检测不同食管癌细胞株中lncRNA RP11-351J23.1和miR-765的表达(,n=9)
注:与正常食管上皮细胞HEEC 组比较,*P<0.05。
2.2 过表达lncRNA RP11-351J23.1 抑制食管癌细胞Eca109 增殖、侵袭和迁移与pcDNA-control组相比,pcDNA-RP11-351J23.1 组Eca109细胞中lncRNA RP11-351J23.1表达量显著升高(P<0.05),细胞OD 值、侵袭细胞数和迁移细胞数均显著下降(P<0.05),Cyclin D1和MMP-2表达量显著降低(P<0.05),见图1、图2和表2、3。说明lncRNA RP11-351J23.1 过表达可抑制Eca109细胞增殖、侵袭和迁移。
表2 过表达lncRNA RP11-351J23.1对Eca109细胞的活力、侵袭和迁移的影响(,n=9)
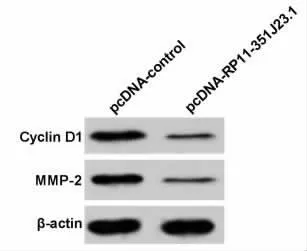
图1 RP11-351J23.1 过表达对Eca109细胞增殖、侵袭和迁移相关蛋白表达的影响
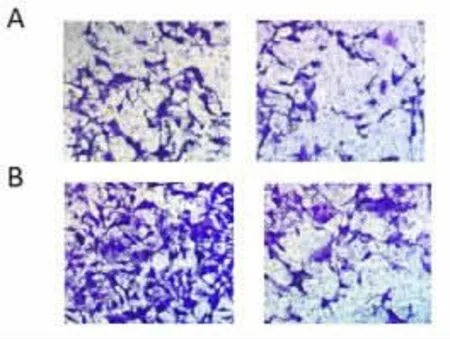
图2 过表达lncRNA RP11-351J23.1对Eca109细胞的侵袭和迁移的影响(,n=9)
表3 RP11-351J23.1 过表达对Eca109细胞增殖、侵袭和迁移相关蛋白表达的影响(,n=9)
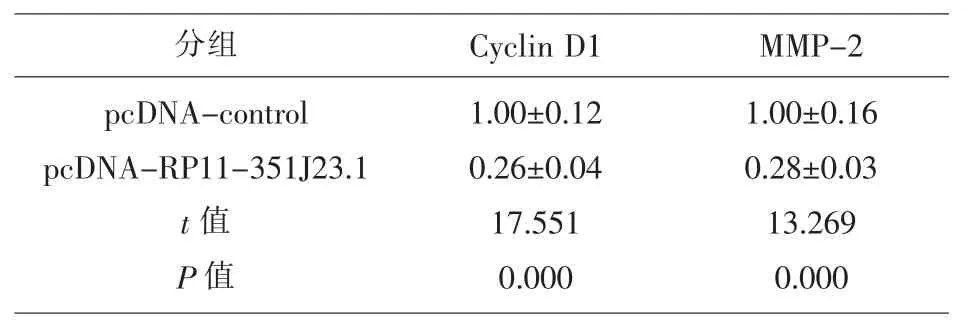
表3 RP11-351J23.1 过表达对Eca109细胞增殖、侵袭和迁移相关蛋白表达的影响(,n=9)
2.3 lncRNA RP11-351J23.1靶向miR-765,抑制miR-765的表达通过LncBase 网站预测到miR-765与lncRNA RP11-351J23.1 可能存在结合位点,见图3;双荧光素酶报告系统结果显示,与miRcon 组相比,过表达miR-765 组lncRNA RP11-351J23.1 野生型(WT)的荧光素酶活性显著下降(P<0.05),lncRNA RP11-351J23.1突变型(MUT)荧光素酶活性无变化,见表4;与pcDNA-control 组相比,过表达lncRNA RP11-351J23.1 组Eca109细胞中miR-765表达显著下降(P<0.05),见表5。
表5 qRT-PCR 检测Eca109细胞中lncRNA RP11-351J23.1的表达对miR-765表达的影响(,n=9)

表5 qRT-PCR 检测Eca109细胞中lncRNA RP11-351J23.1的表达对miR-765表达的影响(,n=9)

图3 lncRNA RP11-351J23.1与miR-765的结合位点
表4 双荧光素酶活性检测Eca109细胞中lncRNA RP11-351J23.1与miR-765的靶向关系(,n=9)
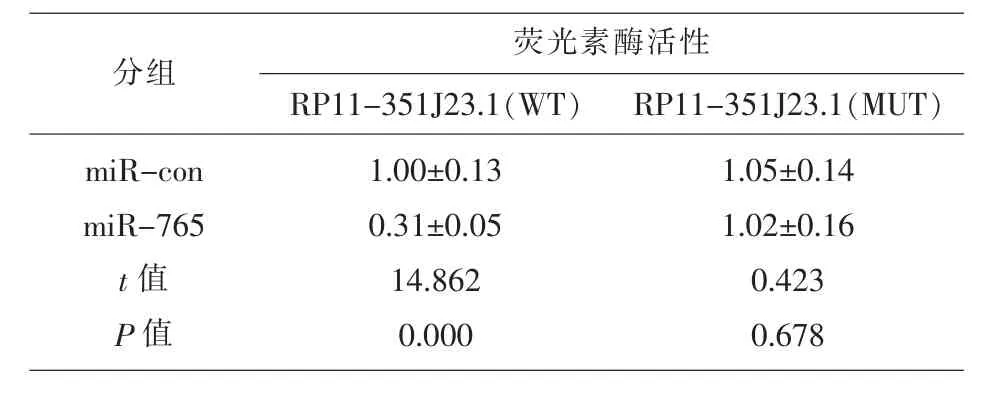
表4 双荧光素酶活性检测Eca109细胞中lncRNA RP11-351J23.1与miR-765的靶向关系(,n=9)
2.4 抑制miR-765的表达可抑制Eca109细胞活力、侵袭和迁移与anti-miR-con 相比,anti-miR-765 组miR-765表达降低(P<0.05),Cyclin D1和MMP-2表达显著降低(P<0.05),细胞OD 值、侵袭和迁移细胞数均显著降低(P<0.05),见图4、图5、表6和表7。说明抑制miR-765表达可抑制Eca109细胞增殖、侵袭和迁移。
表6 抑制miR-765的表达对Eca109细胞活力、侵袭和迁移的影响(,n=9)

表6 抑制miR-765的表达对Eca109细胞活力、侵袭和迁移的影响(,n=9)
表7 抑制miR-765的表达对Eca109细胞增殖、侵袭和迁移相关蛋白表达的影响(,n=9)
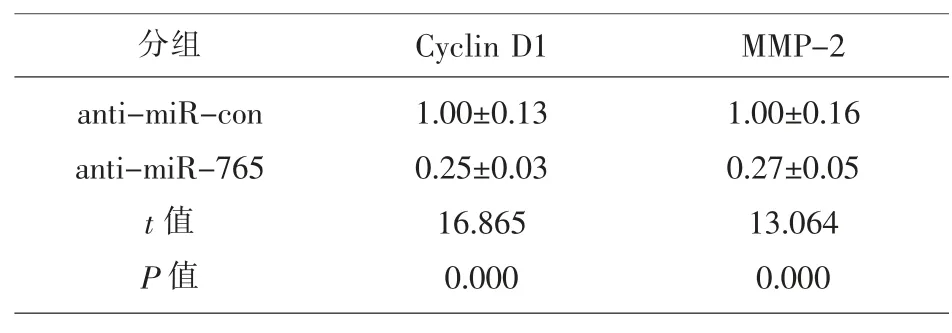
表7 抑制miR-765的表达对Eca109细胞增殖、侵袭和迁移相关蛋白表达的影响(,n=9)
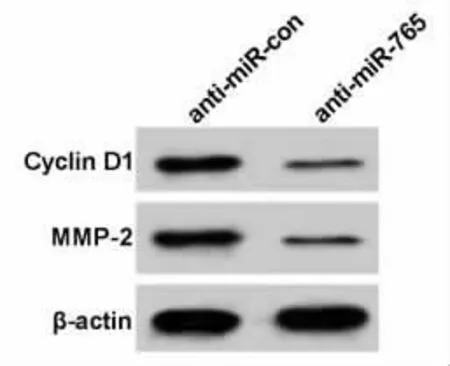
图4 抑制miR-765表达对Eca109细胞增殖、侵袭和迁移相关蛋白表达的影响
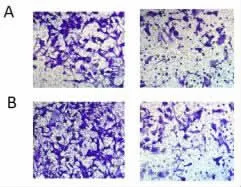
图5 抑制miR-765的表达对Eca109细胞侵袭(A)和迁移(B)的影响
2.5 过表达miR-765 逆转lncRNA RP11-351J23.1对Eca109细胞活力、侵袭和迁移的抑制作用 为确认lncRNA RP11-351J23.1 是否通过miR-765调控Eca109细胞的增殖、侵袭和迁移,我们过表达RP11-351J23.1的同时过表达miR-765。结果发现,与pcDNA-RP11-351J23.1+miR-con相比,pcDNA-RP11-351J23.1+miR-765 组miR-765表达升高(P<0.05),细胞OD 值、侵袭和迁移细胞数均显著升高(P<0.05),Cyclin D1和MMP-2表达显著升高(P<0.05),见图6、表8和表9。说明过表达miR-765 可逆转过表达lncRNA RP11-351J23.1对Eca109细胞增殖、侵袭和迁移的抑制作用。
表8 过表达miR-765 逆转RP11-351J23.1对Eca109细胞活力、侵袭和迁移的抑制作用(,n=9)
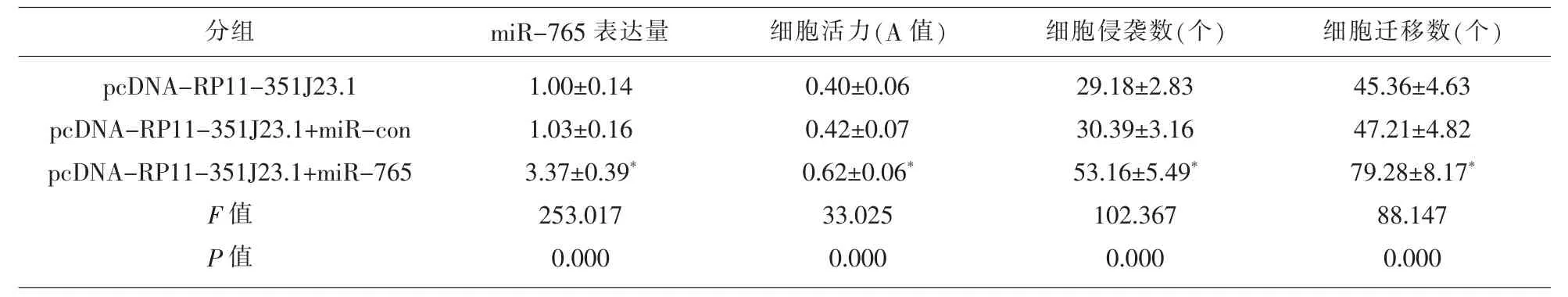
表8 过表达miR-765 逆转RP11-351J23.1对Eca109细胞活力、侵袭和迁移的抑制作用(,n=9)
注:与pcDNA-RP11-351J23.1+miR-con 组比较,*P<0.05。
表9 过表达miR-765 逆转RP11-351J23.1对Eca109细胞增殖、侵袭和迁移相关蛋白表达的抑制作用(,n=9)

表9 过表达miR-765 逆转RP11-351J23.1对Eca109细胞增殖、侵袭和迁移相关蛋白表达的抑制作用(,n=9)
注:与pcDNA-RP11-351J23.1+miR-con 组比较,*P<0.05。
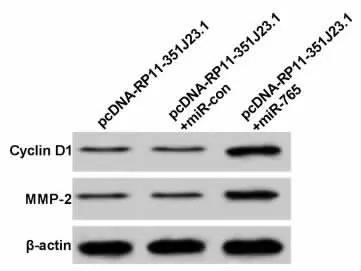
图6 Western blot 检测Eca109细胞中增殖、侵袭和迁移相关蛋白的表达
3 讨论
食管癌是常见的胃肠道恶性肿瘤之一,其发病率呈逐年升高趋势[9]。研究表明,食管癌患者组织和血浆中miRNA和lncRNA水平与患者生存和疾病进展密切相关,可作为食管癌的预后标志物和治疗靶点[10]。RP11-351J23.1在口腔鳞状细胞癌(OSCC)去分化过程中发挥作用[11]。高表达RP11-351J23.1的OSCC患者存活时间更长,RP11-351J23.1 可能是反应OSCC和舌鳞状细胞癌(TSCC)预后的指标[12]。RP11-351J23.1在喉部鳞状细胞癌(LSCC)[13]中也表达下调,具体作用尚不清楚。lncRNA RP11-351J23.1在食管癌中表达下调,具体作用尚不清楚[4]。本研究结果表明,与正常食管上皮细胞HEEC 组相比,lncRNA RP11-351J23.1在食管癌Eca109、KYSE150和EC9706细胞中表达均显著下调,与上述研究结论[4]一致,过表达RP11-351J23.1 可抑制Eca109细胞增殖、侵袭和迁移。说明lncRNA RP11-351J23.1在食管癌的发展中起重要作用。
miR-765在多种肿瘤中表达异常,与肿瘤的进展有关,在TSCC 中,LINC00511与miR-765 相互作用,通过靶向LAMC2 调控TSCC的进展[14]。miR-765在黑色素瘤组织中表达上调,通过miR-765/FOXA2通路维持癌症干细胞的特性,在内质网应激作用下促进黑色素瘤的存活[15]。miR-765在乳腺癌中表达明显下调,与患者临床分期相关[16]。研究表明,miR-765在食管癌组织中显著高表达,其高表达与食管癌肿瘤分期、淋巴结转移和临床分期显著相关,可能是食管癌预后的标志物[7]。本研究结果表明,miR-765在食管癌Eca109、KYSE150和EC9706细胞中表达均显著升高,与上述研究结论[7]一致,提示抑制miR-765表达可抑制Eca109细胞增殖、侵袭和迁移。
本研究通过LncBase 数据库预测发现,lncRNA RP11-351J23.1和miR-765 存在结合位点,因此假设lncRNA RP11-351J23.1靶向miR-765 调控食管癌细胞的增殖、侵袭和迁移。本研究通过双荧光素酶报告系统及同时过表达miR-765和RP11-351J23.1发现,RP11-351J23.1靶 向miR-765 并可抑制miR-765的表达;过表达miR-765可逆转过表达RP11-351J23.1对Eca109细胞增殖、侵袭和迁移的抑制作用,验证了研究之初的假设,两者在食管癌中确实存在调控关系,与上述研究结果[7]共同证实miR-765在食管癌发展中的重要作用。
综上,本研究结果表明,在食管鳞癌细胞系中,lncRNA RP11-351J23.1 下调,miR-765 上调。在食管鳞癌Eca109细胞中,lncRNA RP11-351J23.1通过靶向miR-765 调控Eca109细胞增殖、侵袭和迁移,过表达RP11-351J23.1 可抑制miR-765表达进而抑制癌细胞的增殖、侵袭和迁移。lncRNA RP11-351J23.1 是食管癌的潜在分子靶点。
