河源地区新生儿听力与基因联合筛查模式应用分析
2021-10-06刘运华吴坤刘晓燕李婷婷王葭李登峰
刘运华,吴坤,刘晓燕,李婷婷,王葭,李登峰
(1.广东省河源市妇幼保健院医学遗传实验室;2.广东省河源市妇幼保健院儿童保健科,广东 河源 517000)
先天性听力损失作为全球最常见的感觉功能障碍性疾病,除表现患儿听力功能下降外,还可对患儿智力、语言的发育造成不良后果[1]。幼儿期的听力下降会导致言语障碍、学习表现差和增加辍学的风险,影响未来就业等问题[2]。研究发现2015年全球听力损失率大大高于2013年之前公布的估计值[3]。因此提高听力损失防范意识、重视耳聋的出生缺陷防控工作显得尤为重要。
传统技术,耳声发射法(otoacoustic emission,OAE)不能用于检测听神经性功能障碍,其结果存在一定假阴性,而自动判别听性脑干诱发电位法(auto auditory brainstem response,AABR)费时长,成本高,最关键是其不能发现迟发型、渐进性及药物敏感性的听力损失。研究发现先天性听力损失的儿童,80%是由遗传原因导致。遗传性耳聋根据有无外耳及其它器官畸形等临床症状分为综合征型耳聋(约30%)和非综合征型耳聋(约70%)。非综合征型遗传性听力损失具有遗传异质性的特点,东亚人群遗传性耳聋基因以GJB2、SLC26A4、线粒体12SrRNA及GJB3 突变为主。迄今为止,已在110多个基因中鉴定出6000多个致病变异,其中确定了超过40 个致病基因[4]。由此可见,新生儿听力筛查联合遗传性耳聋易感基因筛查,将能大大减少听力损失患儿的发生。
河源地区是客家人主要聚集地之一,有种族和地域特色。河源户籍新生儿遗传性耳聋基因分布特点尚未知。本研究旨在通过分析6738例河源户籍新生儿听力筛查和4 个遗传性耳聋基因13个致病变异携带情况,探讨新生儿听力检查与遗传性耳聋易感基因联合筛查模式效果及其应用价值。
1 资料与方法
1.1 一般资料 选2018年12 月-2020年12 月在我院出生并进行听力筛查及耳聋基因检测的新生儿6738例,出生时Apgar 评分均为10 分,所有新生儿均为母婴同室,均无产科并发症;其中男婴3620例,女婴3118例。男婴母亲孕龄29.08±4.75(岁)、女婴母亲孕龄28.75±4.59(岁),男婴出生体重3166.11±441.69(g)、女婴出生体重3077.88±444.77(g),男婴身长49.99±7.65(cm)、女婴身长49.61±1.64(cm),男婴分娩孕周38.89±1.65 (周),女婴分娩孕周39.10±1.49 (周)。父母均为河源籍贯,联合筛查前均进行充分的知情同意。
1.2 材料 DNA 自动提取仪Lab-Aid 824及配套试剂(致善生物有限公司)、耳聋易感基因检测试剂(潮州凯普生物化学有限公司)、VertiTMDx 96 Well Thermal Cycler RCR 扩增仪(赛默飞)、丹麦AccuScreen 新生儿听力筛查器(上海涵荣医疗器械有限公司)。
1.3 听力筛查方法 2010年卫生部颁发《听力筛查技术规范(卫妇社发〔2010〕96 号)》,要求新生儿出生后48h 至出院前完成初筛第一阶段(OAE/AABR),未通过者及遗漏者于42d 内进行初筛第二阶段(OAE+AABR)。
1.4 耳聋基因筛查方法 采新生儿EDTA 抗凝脐带血2ml,提取基因组DNA,本研究采用PCR 导流杂交技术检测4 个耳聋基因13 个位点(见表1),杂交程序按照生产厂家说明进行。耳聋基因筛查阳性指13 个位点出现任一个位点突变,反之为阴性。
1.5 Sanger 测序法在Applied Biosystems 3500 Dx基因分析仪(Applied Biosystems by Life Technologies,Japan)中使用BigDye Terminator v3.1(Applied Biosystems by Life Technologies,USA)循环测序试剂盒。用生物信息学软件Alamut Visual 2.11进行比对和注释,检测到的序列与NCBI 所提供线粒体基因参考序列(NC_01292)进行比对和注释,突变的表述参照Human Genome Variation Society(HGVS) version 15.11 进行。
1.6 统计方法 用SPSS23.0 进行统计分析,计数资料以率表示,采用皮尔森卡方检验比较两组间计数资料的差异,例数小于5 时采用确切概率法计算卡方检验。P<0.05 为差异有统计学意义。
2 结果
2.1 听力初筛结果 初筛第一阶段总阳性率5.51%(371/6738),男婴6.24%(226/3620),女婴4.65%(145/3118),男婴高于女婴,差异有统计学意义(χ2=8.17,P<0.05)。初筛第一阶段未通过者在42d 内接受复筛,初筛第二阶段总阳性率11.32%(42/371),男婴10.62%(24/226),女婴12.41%(18/145),男婴与女婴无差异(χ2=0.28,P>0.05),听力筛查总阳性率0.62%(42/6738),男婴0.66% (24/3620),女婴0.58% (18/3118),男婴与女婴d 无差异(χ2=0.19,P>0.05)见表2。
2.2 耳聋基因筛查结果 突变总携带率3.01%(203/6738),含复合杂合突变2例,均为GJB2 合并SLC26A4 杂合突变;4 个基因突变率从高到低依次是GJB2 为1.44%(97/6738)、SLC26A4 为1.34%(90/6738)、mtDNA 为0.19%(13/6738)和GJB3 为0.07%(5/6738)。突变位点频率前6 位依次为c.235delC、IVS7-2A>G、m.1555A>G、c.1229C>T、c.2168A>G及c.299delAT。突变位点携带率在不同性别的分布无显著性差异(χ2=0.34,P>0.05),其中GJB3基因突变携带率男女之间分布无显著差异(χ2=2.41,P>0.05),见表3、图1。
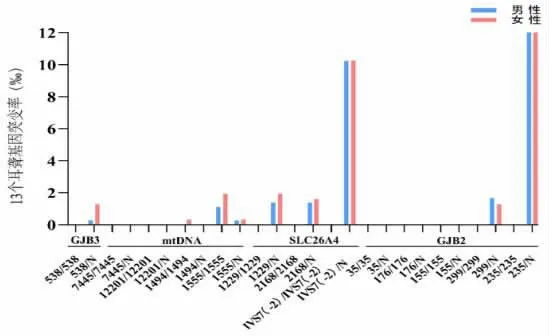
图1 6738例新生儿13 个耳聋基因位点筛查突变情况
2.3 Sanger 测序结果通过Sanger 测序法检测19例PCR 导流杂交技术未能明确突变的婴儿,送试剂厂家检测。结果显示:19例婴儿均为线粒体12sRNA 或tRNA的均质型突变者,其中致病突变4例(m.7444G>A 2例、m.7443G>A 2例),良性突变10例(m.1503G>A 8例、m.12193A>G 2例),致病性未明突变5例(m.7433C>T 3例、m.7419G>A 1例、m.12196C>T 1例),见图2。
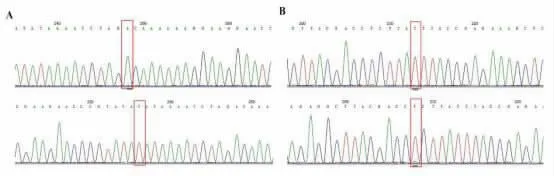
图2 线粒体基因中2 种致病性未明的突变。(A)代表正常基因的野生型mtDNA G.7445A>G(上图,起始位置使用红框标注)和代表突变基因的均质型mtDNA m.7433C>T(下图,突变位置使用红框标注)。(B)代表正常基因的野生型mtDNA G.12201T>C(上图,起始位置使用红框标注)和代表突变基因的均质型mtDNA m.12196C>T(下图,突变位置使用红框标注)。
2.4 广东省内各市新生儿耳聋基因筛查情况 广东省其它地市新生儿耳聋基因筛查数据[5-16],结果显示:河源市耳聋基因总携带率为3.04%(此处总携带率按各耳聋基因相加得出),广东省3.70%、广州市3.68%、深圳市4.38%、佛山市3.08%、东莞市3.39%、中山市3.64%、珠海市4.11%、江门市3.69%、茂名市3.07%、阳江市4.30%、韶关市3.93%、清远市2.64%及梅州市4.88%,各市间耳聋基因总体携带率差异有统计学意义(χ2=105.89,P<0.05)。河源市总体携带率低于广东省平均水平,差异有统计学意义(χ2=7.84,P<0.05)。各地市4 个耳聋基因携带率从高到低依次均为GJB2、SLC26A4、12SrRNA和GJB3,河源市4 个耳聋基因分布情况与其他市一样。河源市GJB2、SLC26A4、12SrRNA和GJB3分布百分比分别为47.32%、43.90%、6.34%、2.44%,广东省GJB2、SLC26A4、12SrRNA和GJB3 分布百分比分别为53.91%、34.78%、6.26%、5.05%,两者GJB2、SLC26A4和GJB3 分布百分比差异有统计学意义(χ2=59.94,P<0.05;χ2=42.06,P<0.05;χ2=56.15,P<0.05)。河源人群中SLC26A4 百分比高于广东省人群水平,差异有统计学意义(χ2=7.18,P<0.05),GJB2、GJB3 百分比低于广东省人群水平,提示河源地区耳聋基因筛查中需提高防范SLC26A4基因突变意识,见图3。
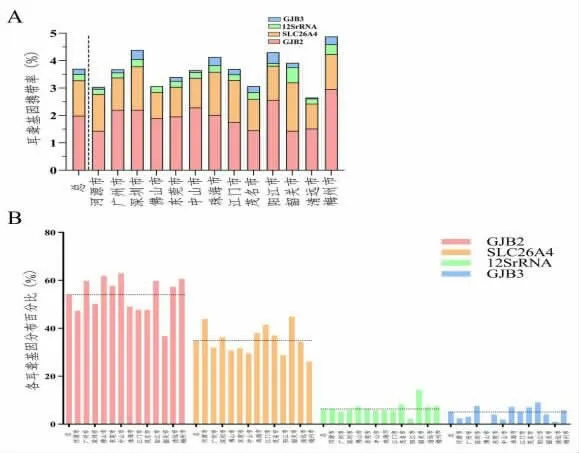
图3 广东省内各地市新生儿耳聋基因筛查情况。
2.5 听力与耳聋易感基因联合筛查结果联合筛查阳性以听力筛查、耳聋易感基因筛查结果任意一项阳性判定为阳性,作为听力损失新生儿或高危新生儿。联合筛查阳性率3.58%(241/6738)、听力筛查阳性率0.62%(42/6738),差异有统计学意义(χ2=142.94,P<0.05),见表4。
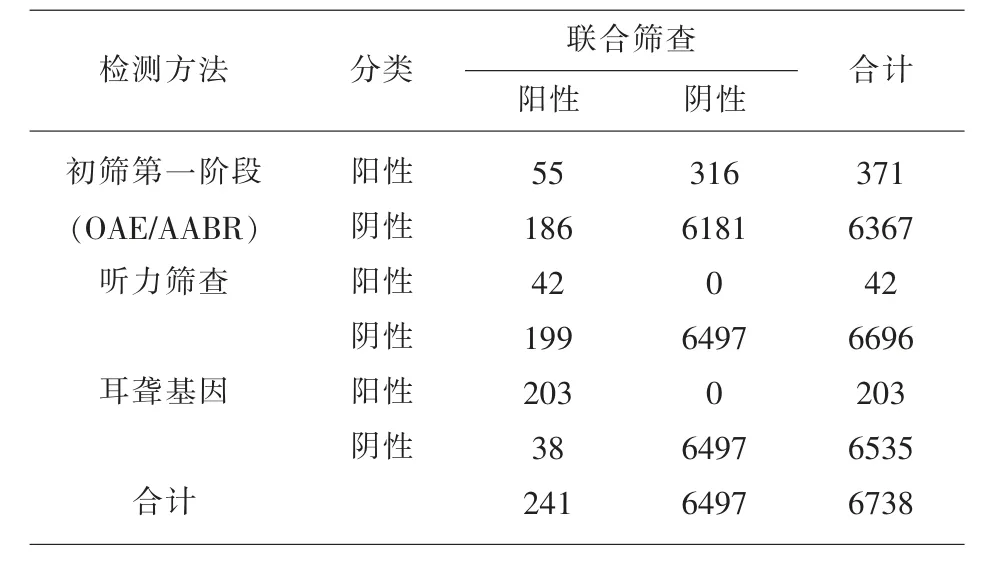
表4 听力与耳聋易感基因联合筛查新生儿听力损失效能(例)
3 讨论
新生儿听力与基因联合筛查模式理念是2007年由王秋菊[17]等首次提出。新生儿听力筛查是通过多种客观的筛查措施进行早期检测新生儿听力损失,一直以来是人们研究的方向。从主观评价研究(行为观察测听、视觉强化测听) 上升到OAE和AABR 等客观测量,近年来发展到通过PCR 导流杂交法、微阵列芯片法、全基因组测序等从基因水平筛查。主观评价高度依赖于检测人员的技能且容易受儿童的成熟年龄影响。OAE和AABR 利用测量听觉诱发电位客观确定听觉系统的功能状态,不仅降低操作人员专业能力的要求,并可在任何年龄进行。Berg[18]比较OAE 后AABR的传统方案与AABR 后OAE 两种筛查方案,发现OAE 后AABR的传统方案在时间方面更有效。发展中国家多在第一阶段进行OAE,在第二阶段进行AABR。相比之下,发达国家多采用两个阶段均进行OAE和AABR 筛查。我市采用两阶段筛查方案,第一阶段进行OAE 初筛,第二阶段进行OAE和AABR 筛查。我们研究显示,初筛第一阶段总阳性率5.51%,男婴6.24%,女婴4.65%,差异有统计学意义(χ2=8.17,P<0.05)。考虑到新生儿出生时可能存在耳道堵塞、鼓室内有羊水、外耳道狭窄、新生儿喉鸣声干扰等现象。初筛第一阶段未通过者42 天内接受复筛,初筛第二阶段总阳性率11.32%,排除了329名初筛第一阶段假阳性新生儿。与以往的研究一致,将AABR 纳入新生儿筛查项目可有效获得更好的听力筛查结果[19]。此外听力初筛总阳性率为0.6 2%,低于国内其它研究[20]。
本研究共分析6738例新生儿,耳聋基因携带率3.01%(203/6738),低于广东省其它市报道的携带率[6-17]。本研究发现河源人群SLC26A4基因百分比为43.90%,高于广东省人群百分比水平,差异有统计学意义(χ2=7.18,P<0.05)。位于7 号染色体上的SLC26A4基因编码一种转运跨膜蛋白,对于转运氯化物-碘化物和调节淋巴内的离子稳态至关重要,该基因突变可能破坏耳蜗的离子稳态,导致听力丧失[21]。已有强有力的证据表明c.1229C>T和c.2168A>G 突变与前庭导水管扩张相关[22]。有报道指出在亚洲非综合征型耳聋患者中,中国人SLC 26A4基因IVS7-2A>G 突变的风险增加[23],研究提示河源地区耳聋基因筛查中需提高防范SLC26A4基因突变意识,生活中尽量避免感冒、头部撞击等情况发生。此外,线粒体DNA(mtDNA)引起的耳聋又称为药物性耳聋,mtDNA 上12SrRNA和tRNA的变异可引起以母系遗传为主的遗传性耳聋,其中12SrRNA 变异相对常见,河源人群中12SrRNA突变基因百分比为6.34%,检出均质型药物性耳聋基因携带者10 名,若遵循医嘱避免相关氨基糖苷类药物使用,将避免药物性耳聋的发生。研究发现19例非常见耳聋易感基因位点突变,均为mtDNA均质型突变携带者,其中致病突变4例(m.7444G>A 2例、m.7443G>A 2例),良性突变10例(m.1503G>A 8例、m.12193A>G 2例),致病性未明突变5例(m.7433C>T 3例、m.7419G>A 1例、m.12196C>T 1例)。刘玲[24]等人发现广东省694例非综合征型耳聋患者GJB2、SLC26A4基因共有75种变异,其中46 个致病性突变,29 个意义不明。由此可见广东省非综合征耳聋基因突变谱需进一步完善,本研究提供2 个潜在致病位点,为建立广东省出生缺陷临床防控模式提供宝贵资料。
本研究将联合筛查结果任意一项阳性判定为阳性,作为听力损失新生儿或高危新生儿。由研究表明[25],联合筛查有重要临床实践意义。本研究与其它地市结果一致,新生儿听力和耳聋基因联合筛查在河源地区开展有良好临床效益与社会效益,一方面听力损失的基因检测可以帮助避免不必要和昂贵的临床检测,提供预后信息并对未来社会婚育提供科学的遗传指导。另一方面,随着基因治疗技术进一步发展,有望在未来缓解或逆转由遗传原因导致的听力损失。
