奥沙利铂注射剂质量分析及探索性研究
2021-09-27马利娟
马利娟,邓 博
(西安万隆制药股份有限公司,陕西 西安 710000)
奥沙利铂作为第三代铂类抗肿瘤药物,其由瑞士德彪(Debiopharm)公司研发,由法国赛菲诺(Sanofi Winthrop)公司于1996年上市[1]。我国引进该药物是在1999年,上市是在2000年[2]。在2004年,该药物被美国食品药物管理局(Food and Drug Administration,FAD)批准用于治疗晚期结肠癌,并列为一线治疗方案。该药物主要被用于治疗卵巢癌、非小细胞癌、淋巴癌、直肠癌以及结肠癌等疾病中[3-4]。我国将该药物列为国家基本药物,并在《中国药典》(2015第2版)中收录。在应用该药物时,其会对胃肠道系统、血液系统等产生不良反应。其中,胃肠道系统不良反应主要包括恶心、呕吐、腹泻以及黏膜炎等;血液系统不良反应主要包括血小板及中性粒细胞减少等[5]。除此之外,在用该药物进行治疗时,还会对神经系统产生影响,如导致外周感觉神经病变等。因此,该药物注射剂被我国列为国家食品药品监督管理局(State Food and Drug Administration,SFDA)药品质量评价性抽检计划的一个重要品种[6]。当前,在我国国家局数据库中,生产该注射剂的企业达22家,批准文号达30个。该注射剂的剂型主要有两种,第一种为注射用无菌粉末;第二种为注射液。其中,注射液又可分为大输液和小水针两类。在此次研究中,选取13家生产企业共55批次该注射剂,基于法定检验法,并结合探索性研究,以对该注射剂的质量予以分析,并提出质量控制建议。
1 样本情况
55批次该注射剂样品涉及企业13家,涉及省市自治区达21个,批准文号达16个。在13家生产企业中,10家是注射用无菌粉末,3家是注射液。其中,2家为大输液,1家为小水针。在样本抽样的过程中,经营性与医疗机构抽样批次为35批次,生产企业批次为20批次。抽样样品确认率为100.00%,均标示企业产品。
2 标准检验及标准评价
2.1 标准检验
在对抽样样品进行检验的过程中,对于注射用的无菌粉末主要是按照以下标准予以检测,即《中国药典》或企业注册标准。而对于注射液的检验标准,其则主要以国家药品注册标准为依据。在对55批次的抽样样品进行检测时,鉴于生产企业的不同,因此共依据10个不同的标准展开检验。经法定检验,结果显示,其合格率为100.00%。
2.2 标准评价
对于注射用无菌粉末,其以《中国药典》或企业注册标准为依据进行标准评价。尽管各评价标准在项目设置上基本一致,但执行依据尚不统一且不明确,且部分项目方法和限度也存在差异。例如,酸度、溶液澄清度与颜色因方法浓度的不同,其致使限度制定不一致。在杂质检查时,采用3~4个高效液相色谱(high performance liquid chromatography,HPLC)法,但对于已知杂质和未知杂质的限度、结果计算方式也是不统一的。
对于注射液,其采用的标准也较为滞后,现行的检测方法均采用1个HPLC法,其不仅具有较差的专属性,而且在色谱条件方面也较为简单。与此同时,其仅要求总杂质的限度,对于已知杂质和未知杂质均不明确。因此,在检测时,该方法是难以完全将各个杂质检出的,并且未能控制已经明确药理毒性的已知杂质,大输液未控制摩尔渗透压浓度。
3 探索性研究
3.1 注射液的有关物质
尽管该注射剂在我国已上市多年,但其作为铂的配位化合物,其在稳定性方面还比较差。同时,其对于温度、酸碱度、氧化剂、盐以及金属离子等比较敏感。因此,对于该注射剂的重点关注内容应是其稳定性、影响因素以及质量控制方法。基于现行标准检验结果,并围绕药品安全性和有效性等展开了探索性研究。
其中,经对比分析《中国药典》中注射用无菌粉末杂质检验法与美国药典USP37-NF32注射液杂质检验法,以《中国药典》杂质检查中的3个HPLC为依据,建立了强专属性的注射液杂质检验法。经研究显示,该检验方法可以有效检出奥沙利铂需要重点控制的草酸、杂质及其他杂质,并且杂质检出数和检出量均明显增加。
3.2 杂质谱的相关研究
经杂质谱研究显示,奥沙利铂共检出已知杂质5种,如表1所示。为探究此类注射剂之间的差异,对注射剂的杂质谱、杂质来源等进行归属,并经统计学分析,以对所选生产企业的情况进行了解和掌握。55批次该注射剂杂质检验结果,如表1所示。

表1 奥沙利铂杂质谱情况
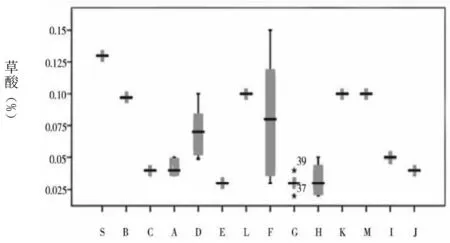
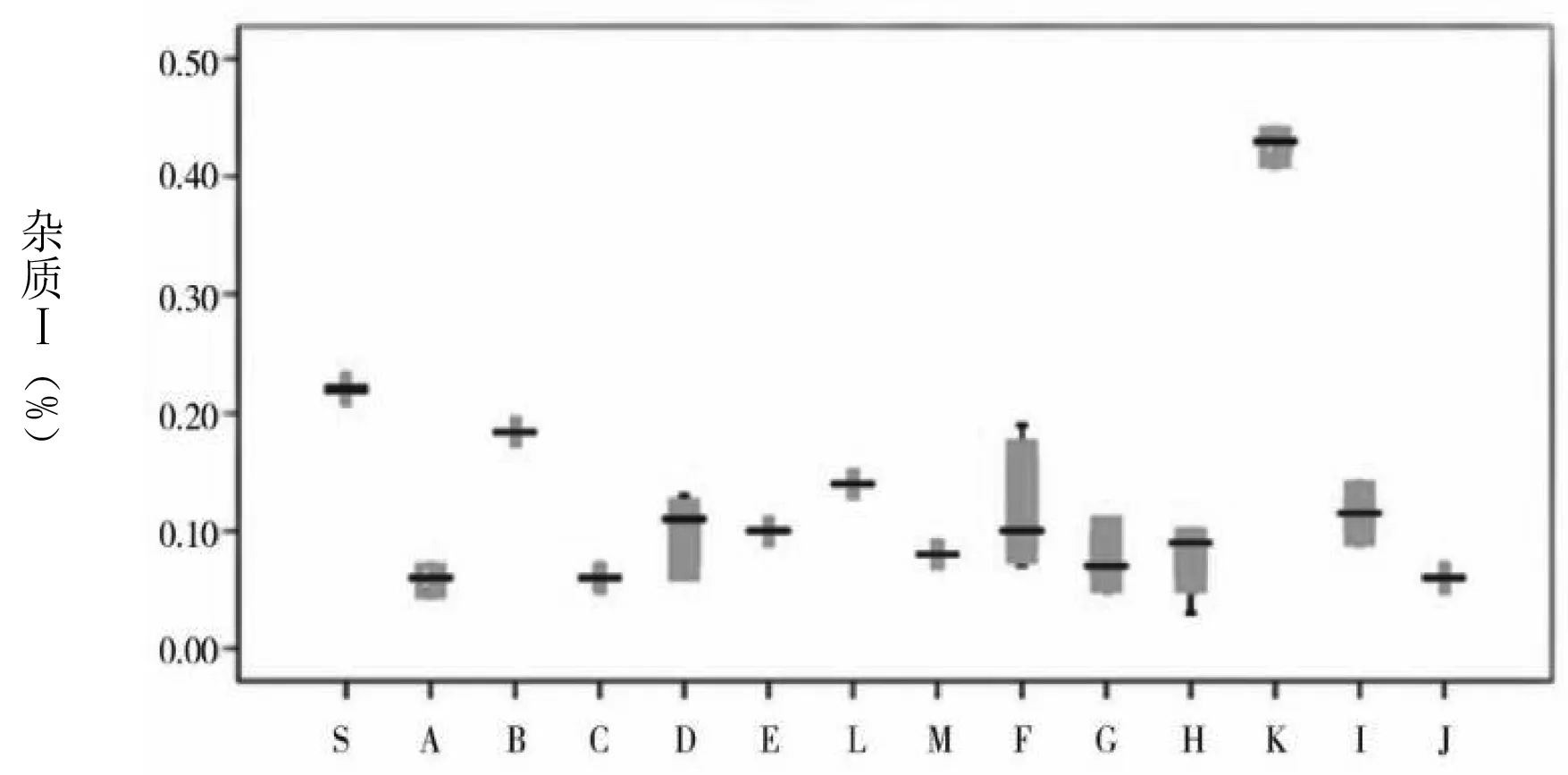

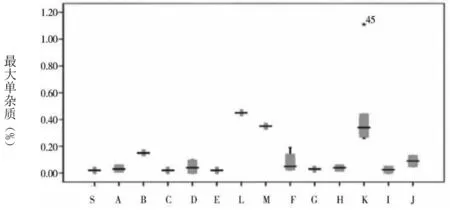

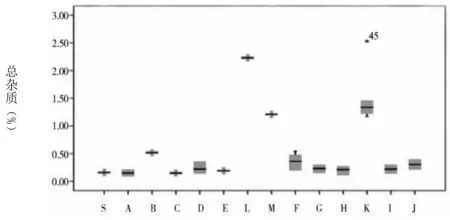
图1 各杂质及企业情况
通过图1可知,草酸的含量最大值和均值分别为0.15%、0.08%。注射用和注射液中的草酸含量均处于较低水平,且三者之间不存在统计学差异。杂质Ⅰ含量的均值为0.15%。其中,注射用、小水针、大输液的均值分别为0.09%、0.10%、0.45%。经统计学分析显示,相比于注射用和大输液含量,小水针含杂质Ⅰ的量更高,且存在统计学差异。杂质Ⅱ仅在K企业中检出,其均值为0.02%,属于小水针。杂质Ⅲ最大值及均值分别为0.73%、0.05%。注射用、小水针、大输液的均值分别为0.03%、0.06%、0.65%。在统计学分析下,显示相比于注射用和小水针含杂质Ⅲ的含量,大输液含该杂质的含量更高,且均存在统计学差异。左旋异构体中仅在C企业和K企业中检出,含量分别为0.01%、0.04%。其中,C企业属于注射用。注射用最大单杂质均值为0.05%,其他杂质均值为0.08%,总杂质均值为0.27%。B企业注射用剂型中总杂质含量为0.51%,F企业含量为0.36%,均较其他企业高。小水针、大输液的总杂质含量则均较注射用高。其中,K企业,即小水针,其对应的上述3个指标分别为0.45%、0.83%、1.50%;大输液对应的指标则为0.44%、1.25%、2.22%。经统计学分析表明,与注射液相比,注射用更佳。
3.3 大输液灭菌工艺考察
利用拟定的杂质检验方法,在115℃下进行灭菌,时间为30min,对各杂质及其含量的变化情况展开观察。经分析显示,相比于灭菌前,灭菌后样品杂质Ⅰ的含量未发生变化,但草酸、杂质Ⅲ、最大单杂质、其他杂质总和则分别增加0.25%、0.20%、0.26%、0.49%。奥沙利铂的含量下降1.19%。也就是说,灭菌工艺会对该注射液的稳定性产生影响。
3.4 大输液质量影响因素试验
在影响因素分析的过程中,对常温状态下、高温状态下大输液杂质及其含量的变化情况展开了分析。在第1天、第5天以及第10天进行取样检测,表明伴随时间的延长,杂质Ⅲ、最大单杂质、其他杂质总和中杂质含量的趋势是上升的。相比于常温状态下,在高温状态下,即当温度为(40±2)℃时,杂质增加幅度更高。也就是说,贮藏时间、温度会对其稳定性产生影响。
3.5 包材中金属离子迁移试验
包装材料中的金属离子迁移也会影响该注射剂的含量,且会将其他杂质的含量增加[7]。利用电感耦合等离子体质谱检测包材中的金属离子含量,结果显示,Li、Mg及AL等金属元素的检出量均处于较低水平。也就是说,包材金属离子对于该注射剂的影响是比较小的。
3.6 探索性研究结果
经探索性研究,结果显示,相比于注射用,注射液中杂质检出量更高,其原因主要在于奥沙利铂的水溶液不稳定。小水针中则缺乏稳定剂,从而影响其稳定性。大输液在115℃下,其稳定性会受到贮藏时间、温度以及灭菌方式的影响。因此,对于该注射剂进行质量管控时,应注重贮藏条件和生产工艺的管控。
4 奥沙利铂注射剂总体质量评价及建议
经对抽检的55批次样品予以综合研究,显示奥沙顺铂总体质量为“较好”,而该注射剂总体质量则为“一般”,尤其是小水针和大输液。因此,为确保该注射剂质量,从评价标准方面来说,应对小水针、大输液的评价标准进行修订,如增加相关检查和渗透压控制项等。而对于注射用无菌粉末的评价标准,则应注重统一化,并对执行方式予以明确。从生产企业的角度来说,应注重加强生产安全过程中的风险管控,并对可能影响该注射剂稳定性的因素予以合理控制。同时还应对产品的说明书等予以严格规范,如标明贮藏条件等,以确保质量。
