不同菌株灵芝发酵液抗氧化和美白活性差异比较分析*
2021-09-25张周美谢纯良颜少慰周映君朱作华龚文兵胡镇修彭源德
张周美,谢纯良,颜少慰,周映君,朱作华,龚文兵,严 理,胡镇修,彭源德**
(1.中国农业科学院麻类研究所,湖南 长沙 410205;2.湖南御家化妆品有限公司,湖南 长沙 410000)
灵芝(Ganoderma lucidum Karst)为层菌纲(Hymenomycetes) 多孔菌目(Polyporales) 多孔菌科(Polyporaceae) 灵芝属(Ganoderma) 真菌,又名还阳草、瑞芝等,含有多糖、氨基酸和灵芝酸等多种生物活性物质,《本草纲目》中记载其具有清除自由基、抗炎、抗过敏、保湿、延缓皮肤衰老、祛斑、美白、改善角质层等功效[1-2]。因此,灵芝提取物广泛应用于各类化妆品中。
目前在化妆品市场上应用的主要原料是灵芝子实体水提物和醇提物,如灵芝三萜等[3]。然而野生灵芝物种逐渐减少,人工培养子实体周期长,且占地面积大,易受季节和原料等诸多因素影响。因此,来源于子实体的灵芝化妆品原料成本普遍较高[4-5],产品质量不稳定,需要探索一种低成本生产灵芝化妆品原料的方法[6-7]。
目前,在抗生素的生产上已经广泛使用真菌液体深层发酵培养技术。液体深层发酵培养具有许多优点,生产量大,发酵温度、培养基组成和时间等发酵条件更容易控制,成本较低[8-9]。将灵芝的菌丝体接种于液体培养基中,以一定转速和温度进行培养,菌丝体在培养基中获得合成代谢产物或生长繁殖所需营养物质的培养方式称为灵芝液体深层发酵培养。目前,该发酵技术主要运用于生产灵芝菌丝体多糖和三萜,有研究表明,液体深层发酵产生的灵芝多糖与子实体多糖具有大致相同的功能[10-11]。但是,基于液体深层发酵培养的灵芝发酵液是否能成为化妆品原料的相关研究较少。
现已发现我国灵芝有103种,占世界灵芝种类的88%,其中具有护肤价值的仅有10种[12]。由于不同菌株遗传背景不同,其护肤活性也有显著差异[13]。已有研究表明,不同灵芝菌株通过液体深层发酵后发酵液中的多糖和三萜含量具有显著差异,但是对不同菌株的发酵液抗氧化和美白活性比较分析相关研究较少[14]。黑色素生物合成中最重要的酶是酪氨酸酶,因此检测酪氨酸酶活性的抑制率即可体现发酵液的美白活性[15]。
本研究利用液体深层发酵技术对灵芝进行培养,对不同来源灵芝菌株发酵液中DPPH自由基清除率、超氧阴离子清除率、酪氨酸酶活性以及多糖、三萜含量进行测定,以期筛选出抗氧化和美白活性更好的灵芝菌株。降低灵芝类化妆品原料成本,以期扩大灵芝发酵液在护肤品行业的应用。
1 材料与方法
1.1 试剂与仪器
齐墩果酸、Tris,赛国生物科技有限责任公司;磷酸二氢钠、苯酚,国药集团化学试剂有限公司;香兰素、无水乙醇,湖南汇虹试剂有限公司;焦性没食子酸、冰醋酸、磷酸氢二钠,天津市科密欧化学试剂有限公司;七水合硫酸亚铁,广东省台山市化工厂;Polypheno10 Oxidase,合肥博美生物科技有限责任公司;DPPH,梯希爱化成工业发展有限公司;胰蛋白胨、酵母膏,赛默飞世尔科技公司;麦芽浸膏琼脂培养基(MEA培养基),青岛日水生物技术有限公司;发酵专用豆粕粉,北京索莱宝科技有限公司。
1.2 方法
1.2.1 微生物菌株
本试验中使用的4个灵芝菌株分别来自中国普通微生物菌株保藏中心(菌株编号CGMCC 5.1817)、中国工业微生物菌株保藏管理中心(菌株编号CICC 14022)和中国农业微生物菌株保藏管理中心(菌株编号ACCC 51718和ACCC 51726)。各菌株在恒温培养箱28℃条件下分别于MEA琼脂培养基(麦芽提取物1.2%、琼脂2%、葡萄糖1%)中培养7 d。
1.2.2 灵芝液体深层发酵条件的优化
将4片不同菌株来源的灵芝菌丝体(每片约40 mm2),接种到麦芽浸粉培养基中(MEA培养基,配方为麦芽提取物20 g·L-1、葡萄糖20 g·L-1、酵母提取物 1 g·L-1、大豆蛋白胨 2.5 g·L-1、蛋白胨 1 g·L-1,pH 5.5) 或完全培养基(CYM培养基,配方为葡萄糖 20 g·L-1、酵母提取物 2 g·L-1、KH2PO41 g·L-1、蛋白胨2 g·L-1、MgSO4·7H2O 0.5 g·L-1、K2HPO40.46 g·L-1)中。30℃、180 r·min-1培养3 d~7 d。培养完成后,离心25 min(5 000 r·min-1),收集上清液,通过0.22 μm滤膜过滤后保存,用于后续试验。
1.2.3 不同灵芝菌株发酵液的抗氧化活性检测
取1 mL样品,加入1 mL的DPPH溶液(0.2 mmol·L-1),混合后室温静置30 min,于517 nm测其吸光度,每个样品测3次平行。DPPH自由基清除率(Q,%) 计算公式为[16]:
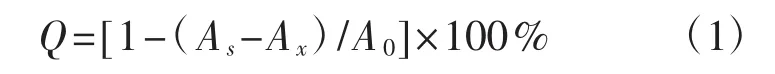
式中:As为1 mL的DPPH乙醇溶液加1 mL样品的吸光度;Ax为1 mL溶剂加1 mL样品的吸光度;A0为1 mL的DPPH乙醇溶液加1 mL溶剂的吸光度。
在10 mL试管中加入5.7 mL的Tris-HCl缓冲液(50 mmol·L-1,pH 8.2)[17],加入 0.2 mL 样品混合后放置于25℃水浴锅中,10 min后取出,再加0.1 mL(10 mmol·L-1)邻苯三酚溶液(已预热)[18]。超氧阴根离子自由基清除率(W,%)计算公式为:

式中:Aj为0.2 mL样品加5.7 mL的Tris-HCl缓冲液与0.1 mL邻苯三酚溶液快速混匀后1 min内吸光度的增加值;Ai为0.2 mL纯水加5.7 mL的Tris-HCl缓冲液与0.1 mL邻苯三酚溶液快速混匀后1 min内吸光度的增加值。
1.2.4 不同灵芝菌株发酵液酪氨酸酶活性抑制检测
使用酪氨酸酶活性抑制试验方法,以L-酪氨酸作为底物进行测定[19]。试验体系组成见表1。

表1 酪氨酸酶活性抑制率试验体系Tab.1 Experimental system of inhibition rate of tyrosinase activity
将PBS、酪氨酸酶、样液按表1体积分别添加至4组试管中,混匀,37℃水浴锅中恒温加热10 min,后加入1 mL的L-酪氨酸,继续在37℃水浴锅中恒温反应10 min,最后在冰水中迅速冷却,使用多功能酶标仪测定475 nm处4组试管吸光度[20]。酪氨酸酶活性抑制率(K,%)以下公式进行计算:

式中:A1为3 mL的PBS加1 mL的L-酪氨酸在475 nm处吸光度;A2为1 mL酪氨酸酶加2 mL的PBS、1 mL的L-酪氨酸在475 nm处吸光度;A3为2 mL的PBS加1 mL样品、1 mL的L-酪氨酸在475 nm处吸光度;A4为1 mL酪氨酸酶加1 mL的PBS、1 mL样品、1 mL的L-酪氨酸在475 nm处吸光度。
1.2.5 不同灵芝菌株发酵液多糖含量检测
采用苯酚-硫酸法,测定抗氧化及美白活性较优培养基的灵芝液体深层发酵液中多糖含量[21]。分别吸取一定梯度的标准葡萄糖溶液置于试管中,用超纯水定容至1.0 mL,得到9个不同浓度的葡萄糖溶液 (0、0.01 mg·mL-1、0.02 mg·mL-1、0.03 mg·mL-1、0.04 mg·mL-1、 0.05 mg·mL-1、 0.06 mg·mL-1、 0.07 mg·mL-1、0.08 mg·mL-1),向试管中加入1.0 mL苯酚溶液(0.5%)后,立即加入5.0 mL浓硫酸,快速混匀静放置反应30 min,490 nm下测吸光度,制定标准曲线图。
取1 mL样品液,用3倍体积95%乙醇进行醇析24 h,后5 500 r·min-1离心30 min,去除上清液,收集沉淀放超低温冷冻干燥机中干燥2 h~3 h[22],后加入超纯水20 mL,溶解其中沉淀物并稀释到一定的浓度,直至完全溶解,再吸取其中1 mL待测样品液,使用苯酚-硫酸法测定其吸光度,再按照葡萄糖标曲线计算待测样品液的总糖含量。
1.2.6 不同灵芝菌株发酵液三萜含量检测
精确移取 100 μg·mL-1齐墩果酸溶液 0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL 置于试管中[21]。将所有试管进行水浴加热直至溶剂挥发干,然后加入1 mL高氯酸和0.4 mL的5%香草醛-冰醋酸溶液,快速混匀,后于65℃水浴锅中恒温加热15 min,常温冷却后,用冰醋酸将溶液体积调节至5 mL,在550 nm波长处测量其吸光度。将标准品的吸光度和浓度分别设置为标准曲线的垂直和水平坐标,依据两者的关系,建立回归方程,重复上述方法测定灵芝中三萜的含量。
参照参考文献[23],使用香草醛-高氯酸显色法,在试管中加入0.1 mL抗氧化及美白活性较优培养基的灵芝发酵液,加入0.9 mL无水乙醇,在室温条件下静置1 h后,沸水浴使液体挥发,直至干燥,以干净试管为空白对照组,在样液及空白试管中加入0.4 mL的5%香草醛-冰醋酸溶液以及1 mL的高氯酸迅速混合均匀,进行65℃、15 min的水浴加热,测定其在550 nm波长处的吸光度,取3组平行样吸光度的平均值,利用标准曲线,算出样品的三萜含量。
2 结果与分析
2.1 不同灵芝菌株发酵液抗氧化能力
不同菌株在不同培养条件下发酵液的DPPH自由基清除率统计见图1。

图1 4个灵芝菌株液体深层发酵液中DPPH自由基的清除率结果统计Fig.1 Statistics of the scavenging rates of DPPH of the submerged fermentation broth of four Ganoderma lucidum strains
由图1结果表明,麦芽浸粉培养基(MEA培养基)中4个灵芝菌株发酵液的DPPH清除率均显著高于CYM培养基。随着发酵时间的延长,4个灵芝发酵液的DPPH清除率均显著增加,在5 d~6 d达到最大值。麦芽浸粉培养基培养比较6 d时比较4个灵芝菌株发酵液的DPPH自由基清除率发现,菌株CGMCC 5.1817发酵液的DPPH自由基清除率最高,达到94.08%,菌株ACCC 51718发酵液的DPPH自由基清除率最低,为88.64%。4个灵芝菌株液体深层发酵液对超氧阴离子清除率见图2。
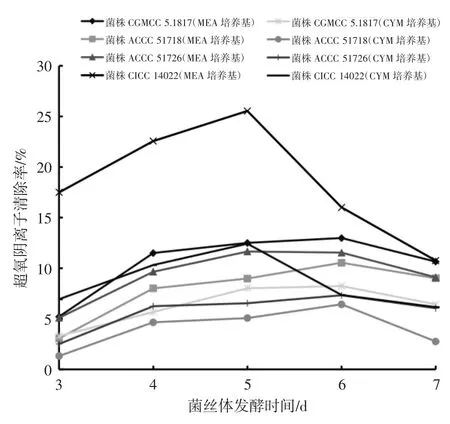
图2 4个灵芝菌株液体深层发酵液中超氧阴离子的清除率结果统计Fig.2 Statistics of the scavenging rates of superoxide anions of the submerged fermentation broth of four Ganoderma lucidum strains
由图2可知,在麦芽浸粉培养基中4个灵芝菌株发酵液对超氧阴离子清除率大部分优于CYM培养基。随着发酵时间的延长,4个灵芝发酵液的超氧阴离子清除率也均显著增加,在5 d时达到最高,6 d后逐渐下降。在培养5 d时,在麦芽浸粉培养基中菌株CICC 14022液体深层发酵液的超氧阴离子清除率达25%,高于清除率最低的菌株ACCC 51718液体深层发酵液近3倍,菌株ACCC 51718发酵液的清除率最低,仅为9%;此时,菌株CGMCC 5.1817发酵液的超氧阴离子清除率为13.6%。
2.2 不同灵芝菌株发酵液美白能力
不同菌株在不同培养条件下的灵芝发酵液美白能力检测结果见图3。

图3 4个灵芝液体深层发酵液对酪氨酸酶活性的抑制率统计结果Fig.3 Statistics of the inhibition rates of tyrosinase activity of the submerged fermentation broth of four Ganoderma lucidum strains
图3结果表明,麦芽浸粉培养基培养条件下4个灵芝菌株发酵液对酪氨酸酶活性的抑制率均高于CYM培养基。同时,不同发酵时间灵芝发酵液对酪氨酸酶活性的抑制率也有显著差异,发酵前6 d,其抑制率逐渐升高,在发酵第6天时,麦芽浸粉培养基中液体深层发酵菌株CGMCC 5.1817发酵液对酪氨酸酶活性抑制率最高,达90.26%。菌株CICC 14022发酵液的抑制率最低,为87.4%,二者差异不显著。
2.3 麦芽浸粉培养基培养的灵芝发酵液多糖含量及三萜含量
由于试验中麦芽浸粉培养基培养的灵芝抗氧化活性及美白能力较高。因此,对灵芝麦芽浸粉发酵液进行检测,其多糖及三萜含量测定结果见图4~图5。

图4 4个灵芝菌株液体深层发酵液中的多糖含量结果统计Fig.4 Statistics of the polysaccharide content of the submerged fermentation broth of four Ganoderma lucidum strains

图5 4个灵芝菌株液体深层发酵液中三萜的含量结果统计Fig.5 Statistics of the triterpene content of the submerged fermentation broth of four Ganoderma lucidum strains
由图4可知,菌丝体多糖含量从第5天开始出现明显增加趋势,至第6天时灵芝菌株发酵液中多糖含量最高。4个灵芝菌株中,菌株CGMCC 5.1817和菌株CICC 14022发酵液中的多糖含量最高,均达3.4 mg·mL-1,菌株ACCC 51726发酵液中多糖含量最低,为2.6 mg·mL-1。在7 d时灵芝发酵液中多糖含量开始下降。
由图5可知,随着发酵时间的延长(3 d~5 d),三萜含量显著增加,在第6天时达到最大值,第7天开始下降。在第6天时,灵芝菌株CGMCC 5.1817与菌株CICC 14022发酵液中三萜含量差异显著,菌株CGMCC 5.1817发酵液的三萜含量最高,达1 550 μg·mL-1,是菌株CICC 14022的3倍,其三萜含量最低,为 480 μg·mL-1。
3 讨论
灵芝富含多种生物活性物质,主要是三萜类化合物、多糖、类固醇、核苷酸、脂肪酸、矿物质、蛋白质和糖肽等[24]。由于灵芝的结构具有多样性,其功能也不同,包括抗氧化作用、抗疱疹病毒、抗肿瘤、免疫调节和抗癌等特性,只有特定品种的灵芝才有良好的抗氧化活性和美白活性[24]。市场上灵芝产品繁多,多利用的是灵芝子实体提取物,子实体价格高,使得灵芝类化妆品的原料成本过高。培养灵芝的传统方法需要数月或1年,液体深层发酵液因不需要进一步提取,可以减少生产含有功能活性成分原料的时间和成本。通过探究利用液体深层发酵技术替代子实体提取来制备低成本灵芝化妆品原料的可行性,以期筛选抗氧化和美白活性较好的菌株。结果表明,采用麦芽浸粉培养基4个灵芝菌株发酵液对DPPH自由基清除率、超氧阴离子清除率、酪氨酸酶活性的抑制率均高于CYM培养基。灵芝在进行液体深层发酵时培养基中的碳源、氮源等对其子实体的DPPH自由基清除率、超氧阴离子清除率、酪氨酸酶活性的抑制率均有影响。灵芝以可溶性淀粉为可利用碳源,其足够灵芝子实体后期生长需要且容易被吸收利用[25]。蛋白胨中含有糖类、维生素、氮源,是真菌培养基的主要原料。蛋白胨的添加量与子实体的生长在一定程度上呈正相关[24]。麦芽浸粉培养基中碳源可溶性淀粉含量、氮源中蛋白胨含量均高于CYM培养基。DPPH自由基、超氧阴离子的清除力测定结果表明,菌株CICC 14022的液体深层发酵液中超氧阴离子清除率比菌株CGMCC 5.1817高出10%,但其DPPH自由基清除率低于菌株CGMCC 5.1817,综上,菌株CGMCC 5.1817与菌株CICC 14022相比抗氧化活性无显著差异。
由于酪氨酸酶在黑色素合成过程中是必不可少的,其抑制剂在化妆品行业中的作用越来越重要[14]。酪氨酸酶抑制剂可作为一种强效美白剂,可改善皮肤问题[26]。由于灵芝是具有生物活性的化学物质的丰富来源,且大多数灵芝无较大的副作用,人们对从天然来源的酪氨酸酶抑制剂的兴趣日渐增加,灵芝的乙醇提取物已显示出抑制酪氨酸酶活性的作用[27]。然而,目前尚无灵芝液体深层发酵液抑制酪氨酸酶活性的研究报道。本研究结果显著表明,在4个菌株中,菌株CGMCC 5.1817液体深层发酵液具有良好的美白活性,其酪氨酸酶抑制率高达90.26%。
目前的研究中,多糖和三萜是灵芝最常见的天然化合物,与灵芝的抗氧化活性有关。研究结果表明,不同菌株和不同发酵时间的灵芝液体深层发酵液,其多糖和三萜含量有区别。在发酵前期,灵芝菌丝体正处于生长阶段,需要消耗发酵液中较多的营养成分,使发酵液中多糖和三萜含量增加不明显[28];在发酵中期灵芝生长旺盛,其自身所含的多糖和三萜含量显著增加;在发酵后期,灵芝中的多糖和三萜已全部释放,但随着灵芝子实体生长需继续消耗多糖和三萜,所以其多糖和三萜含量会逐渐降低[29]。菌株ACCC 51718和菌株ACCC 51726发酵液中三萜含量未有显著差异,菌株CICC 14022液体深层发酵液中多糖含量为3.4 mg·mL-1,与菌株CGMCC 5.1817多糖含量近似,但其三萜含量相差3倍(480 μg·mL-1)。因此,菌株CGMCC 5.1817发酵液中多糖、三萜的含量最高。
综上所述,研究结果清楚地表明了灵芝的培养条件和菌株来源对抗氧化活性和美白活性均有影响。4个菌株中,菌株CGMCC 5.1817具有很强的清除自由基能力以及酪氨酸酶抑制活性,且多糖和三萜含量较高。因此其在抗衰及美白类化妆品市场有很大的发展空间。
