产右旋糖酐酶Pseudarthrobacter sp.RN22的筛选、鉴定及酶学性质研究
2021-09-18祖航天田小鹏胡杰张皓丁延帅吕明生王淑军
祖航天,田小鹏,胡杰,张皓,丁延帅,吕明生*,王淑军*
1(海洋资源与环境重点实验室/海洋生物技术重点实验室(江苏海洋大学),江苏 连云港,222005) 2(江苏省海洋生物产业技术协同创新中心,江苏 连云港,222000)
右旋糖酐 (dextran) 是一种在自然界中由微生物产生的具有特异性结构的聚D-葡萄糖,主要以α-1,6糖苷键相连[1]。右旋糖酐酶 (dextranase,EC3.2.1.11) 可以特异性水解右旋糖酐中的α-1,6糖苷键[2],在食品、医药和生物技术领域有重要应用。在食品行业中,右旋糖酐酶能够降解多糖聚合物,达到降低糖黏性的目的[3];用右旋糖酐酶水解高分子右旋糖酐,可制备不同分子质量的右旋糖酐和功能性低聚糖——益生元[4-5];在医药行业中,右旋糖酐酶通过降解牙菌斑细菌生物膜结构中的右旋糖酐[6],可用于预防和治疗牙周炎和龋齿等口腔疾病。另外,右旋糖酐酶可用于制备血浆代用品,增强药物的抗菌疗效[7]。目前部分右旋糖酐酶产生菌来源为霉菌,霉菌大都存在产酶周期长和制备工艺复杂等问题,绝大部分霉菌发酵液中,次级代谢产物复杂并可能存在一定的安全隐患[8]。由于海洋的独特环境,海洋细菌产生酶制剂具有周期短、最适反应温度低等特点[9-10],从海洋中筛选新颖产酶微生物以及具有特殊酶学性质的酶具有重要意义。随着对右旋糖酐酶应用的拓展,对高效、安全的右旋糖酐酶制剂及其水解产物的需求增大,此项研究具有较好的经济和社会效益[11-12]。
本研究从日照海域海泥中筛选到1株产右旋糖酐酶的海洋细菌,研究了该菌株的形态学和生理生化特征,进行了分子鉴定,并对该菌的产酶特性、酶学性质以及酶解得到的产物进行了研究。
1 材料与方法
1.1 材料与试剂
样品为山东省日照市海域的海泥;麸皮,本市;蓝色葡聚糖2000,GE Healthcare;右旋糖酐T20,国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒(离心柱型),天根生化科技(北京)有限公司;细菌微量生化鉴定管,北京陆桥技术有限责任公司;其他试剂,国药集团,分析纯。
1.2 实验方法
1.2.1 产右旋糖酐酶菌株的筛选与鉴定
1.2.1.1 培养基的制备
初筛培养基(g/L):蛋白胨5,酵母粉1,蓝色葡聚糖2000 2,琼脂20,陈海水配制,pH 8.0;产酶培养基(g/L):蛋白胨5,麸皮5,右旋糖酐T20 10,陈海水,pH 8.0;种子培养基(g/L):蛋白胨5,酵母粉5,陈海水配制,pH 7.0。
1.2.1.2 菌株初筛和复筛
将采集的样品梯度稀释,涂布初筛培养基,30 ℃培养48 h。挑取初筛培养基上具有透明圈的菌株进行分离、纯化和保藏。将初筛获得的菌株接种产酶培养基于30 ℃,180 r/min培养48 h,发酵液离心后取上清液检测酶活性,选取右旋糖酐酶活性较高的菌株进一步研究。
1.2.1.3 菌株形态学观察与生理生化检测
取培养12 h的种子液,接种于蓝色葡聚糖平板,30 ℃培养24 h,观察菌落形态;进行菌株形态学观察;依照使用说明书检测菌株生理生化特征。
1.2.1.4 菌株的鉴定
提取菌株的基因组(TIANamp Bacteria DNA Kit),扩增选用原核微生物16S rRNA序列的通用引物27F与1492R。PCR产物寄往生工生物工程(上海)股份有限公司测序,将菌株RN22的16S rRNA基因序列提交GenBank 数据库同源性比对,运用MEGA软件(Neibor-joing method)建系统进化树。
1.2.2 酶活力测定[13]
将50 μL酶液与150 μL 30 g/L右旋糖酐T20 混合,60 ℃水浴15 min,在反应体系中加入200 μL DNS溶液终止反应,沸水浴5 min,加入3 mL超纯水后振荡混匀,取200 μL于96孔板检测540 nm处的吸光值。对照组先加入DNS溶液终止反应再加入底物,其他操作同实验组。
酶活力单位定义(U):60 ℃,pH 7.5条件下,以30 g/L右旋糖酐T20为底物,每1 min释放1 μmol麦芽糖所需的酶量为1个酶活力单位。
1.2.3 粗酶液的制备
菌株接种量按产酶培养基体积3%接种于产酶培养基中,180 r/min,30 ℃下发酵培养48 h后取出,在4 ℃、10 000 r/min离心2 min,上清液即为粗酶液。
1.2.4 菌株产右旋糖酐酶条件优化
对影响菌株产右旋糖酐酶的碳源、氮源、发酵温度、pH、发酵时间和诱导剂浓度进行单因素试验。用5 g/L碳源替代发酵培养基中的酵母粉(麸皮、可溶性淀粉、豌豆粉、蔗糖、糊精、葡萄糖、马铃薯、木薯、乳糖、麦芽糖);用5 g/L氮源替代发酵培养基中的蛋白胨(豆粕、鱼粉蛋白胨、花生粕、尿素、干酪素、氯化铵、硝酸钠、硫酸铵)。15~45 ℃下培养48 h后,测定酶活力。调节初始pH范围为5~10,30 ℃培养48 h后分别检测酶活力。发酵24 h后,每隔6 h取样测酶活力;发酵培养基中加入不同浓度的右旋糖酐T20作为产酶诱导剂,装液量20%,转数180 r/min,30 ℃培养48 h后分别测酶的活力。
1.2.5 酶学性质研究
1.2.5.1 右旋糖酐酶最适作用温度及热稳定性
在不同温度下(30~70 ℃)测定右旋糖酐酶的酶活力。将酶液分别保温于不同温度下1~5 h后,测定残余酶活力。
1.2.5.2 酶的最适作用pH及pH稳定性
设置不同pH的缓冲体系:50 mmol/L乙酸钠缓冲液(pH 4.0~6.0)、50 mmol/L磷酸钠缓冲液(pH 6.0~7.5)和50 mmol/L Tris-HCl缓冲液(pH 7.5~9.0),分别测定不同pH下的酶活力以确定其最适作用pH,将酶液与缓冲液混合,30 ℃水浴1 h后,测定残余酶活力。
1.2.5.3 金属离子对酶活力的影响
将底物与不同浓度的金属离子混合(氯化物及硫酸盐),使金属离子的终浓度分别为1、5和10 mmol/L,测定酶活力,以未加金属离子的酶液对为照计算相对酶活力。
1.2.5.4 酶的底物特异性
将不同分子质量的右旋糖酐以及可溶性淀粉、壳聚糖、普鲁兰等作为底物,加酶后60 ℃反应15 min,测量相对酶活力。
1.2.5.5 有机溶剂对酶活力的影响
在底物中加入有机溶剂(乙醇、乙二醇、异丙醇、正己烷、甲醇、环己烷、吐温-80、乙醚、正丙醇、吐温-20、乙酸乙酯、乙腈、石油醚、β-疏基乙醇、甘油、甲基叔丁基醚),底物和有机溶剂体积比为 9∶1,右旋糖酐T20终质量浓度为30 g/L,测定酶活力,以未加有机溶剂的底物对为照,计算相对酶活力。
1.2.5.6 右旋糖酐酶分子质量分析
通过SDS-PAGE电泳分析粗酶液中右旋糖酐酶的分子质量,采用浓缩胶浓度为5%,分离胶浓度为8%,分离胶中含5 g/L蓝色葡聚糖。电泳结束后,蛋白胶用考马斯亮蓝染色,复性胶浸入含有体积分数2.5% Triton X-100的20 mmol/L、pH 7.5的Tris-HCl缓冲液中,室温下30 min,然后,在不含Triton X-100的20 mmol/L、pH 7.5的Tris-HCl缓冲液中,37 ℃条件下,温浴至透明的条带出现。
1.2.5.7 水解产物高效液相色谱分析
采用高效液相色谱分析,色谱柱为waters sugar-pak1(6.5 mm×300 mm),流动相为去离子水,流速0.4 mL/min,柱温75 ℃。样品前处理:标准品糖分别称取5 mg溶于1 mL去离子水中,超声波处理30 min。配制30 g/L右旋糖酐T20底物,酶液与底物按照体积比1∶3混合,在30 ℃条件下分别反应0.5、1、2和3 h,煮沸5 min用微孔滤膜过滤后使用。
1.3 数据分析
实验均设置3个平行样,试验结果用平均值±标准偏差表示,采用Origin 2018作图。
2 结果与分析
2.1 菌株筛选及鉴定
2.1.1 菌株筛选
产右旋糖酐酶菌株可以水解蓝色葡聚糖形成透明圈,发酵后选择1株产右旋糖酐酶活性高的菌株,命名为RN22。该菌为革兰氏阴性杆菌,无鞭毛(图1-a),菌落边缘整齐光滑、菌落呈白色湿润(图1-b)。甲基红实验呈阴性,氧化酶反应、鸟氨酸、赖氨酸实验呈阳性,对糖的利用率较低,多数糖实验呈阴性。

a-扫描电镜形态(10.00 K); b-菌株RN22在含有蓝色葡聚糖平板上形成的透明区图1 RN22菌株形态特征Fig.1 Features of strain RN22
2.1.2 菌株鉴定
16S rRNA基因序列高度保守并广泛应用于细菌分类[14],在GenBank 数据库中Blast的结果与Pseudarthrobacter的同源性为99%,构建的系统进化树见图2。从进化树可以看出菌株RN22 与Pseudarthrobacterdefluvii亲缘关系最近,结合形态学和生理生化指标,初步鉴定菌株RN22 属于假节杆属。
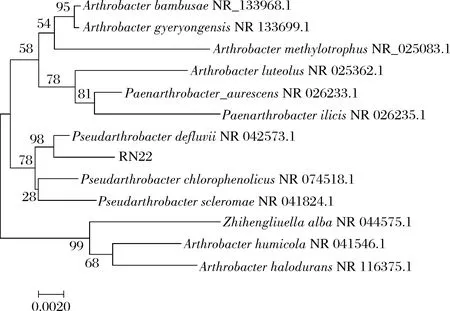
图2 菌株RN22的16S rRNA系统进化树Fig.2 Phylogenetic tree based on 16S rRNA gene sequences
2.2 菌株产酶条件优化
2.2.1 碳、氮源对菌株产酶的影响
碳、氮源是细菌产酶所需的主要营养物质和能量来源。如图3所示,不同碳源、氮源对菌株产酶活性存在着显著性的差异。菌株RN22在麸皮为碳源时产右旋糖酐酶最多(图3-a),其次是马铃薯淀粉和可溶性淀粉,相对酶活力均达到60%以上。
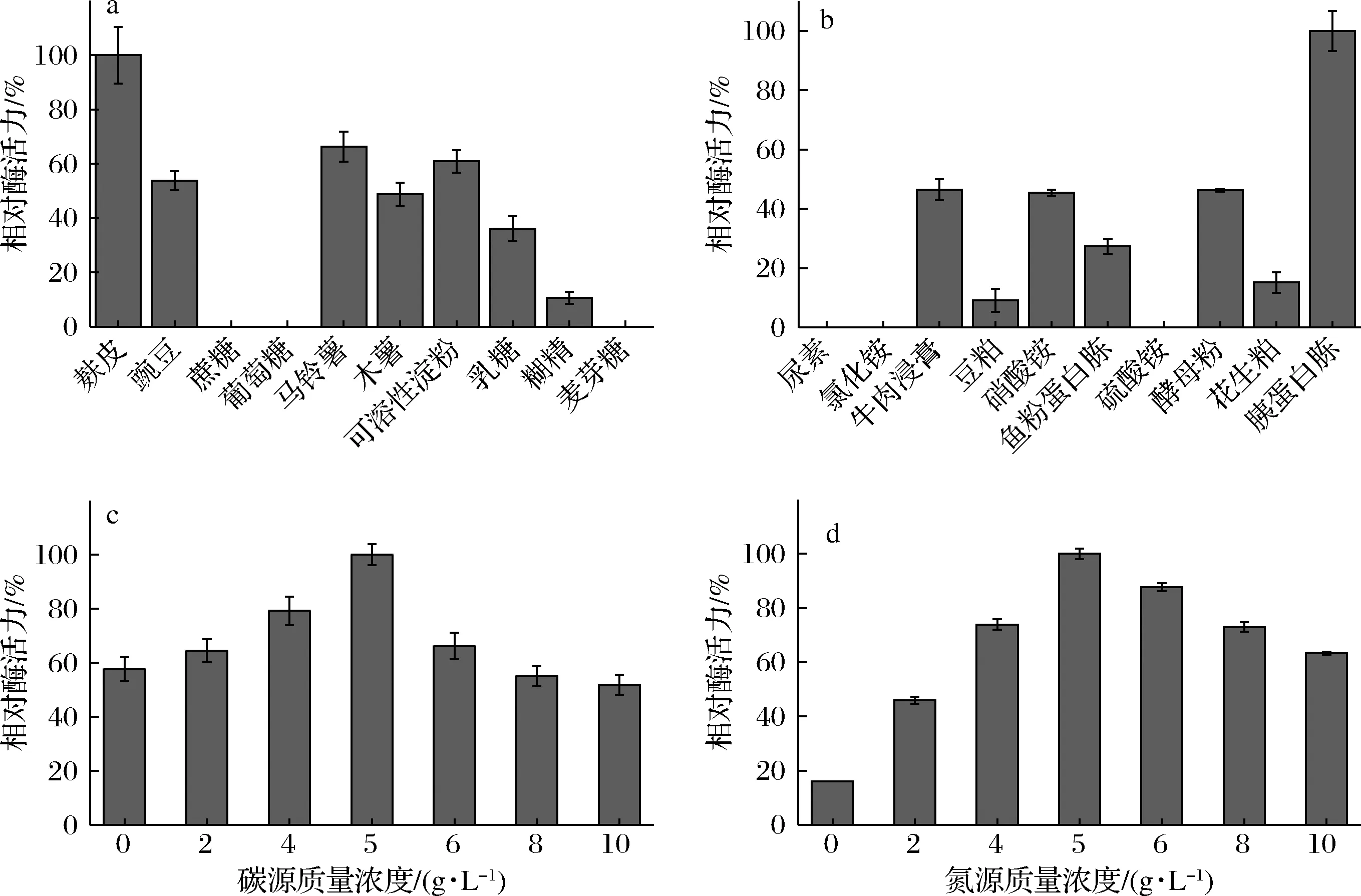
a-碳源;b-氮源;c-碳源质量浓度;d-氮源质量浓度图3 碳氮源对菌株RN22发酵产右旋糖酐酶的影响Fig.3 Effect of carbon and nitrogen sources on dextranase production by strain RN22
可溶性淀粉和马铃薯淀粉属于工业中精细加工的产品,麸皮廉价易得同时酶活力最高,非常适合作为最优碳源,而使用葡萄糖,麦芽糖,蔗糖为碳源时,检测不出酶活,与GARCIA 等[15]的实验结论相吻合。
氮源中胰蛋白胨可以很好地促进菌株RN22产右旋糖酐酶,而牛肉膏、硝酸铵和酵母粉为氮源时相对酶活力均未超过50%(见图3-b),由此,选择胰蛋白胨作为最优氮源。当麸皮作为最优碳源添加量为5 g/L时菌株产酶活力最高(见图3-c),5 g/L蛋白为菌株产酶的最佳质量浓度(见图3-d)。
2.2.2 发酵温度、培养基初始pH对菌株产酶的影响
由图4-a可知,30 ℃时最有利于菌株RN22产右旋糖酐酶,当温度高于35 ℃,低于25 ℃时菌株产酶能力下降;20 ℃以下和40 ℃以上时,菌株不产酶。发酵培养基的初始pH 值是影响微生物的生长繁殖和产物生成的关键因素,当发酵液pH 8时菌株产酶最高(图4-b),菌株最佳产酶pH 8接近海洋弱碱性环境。
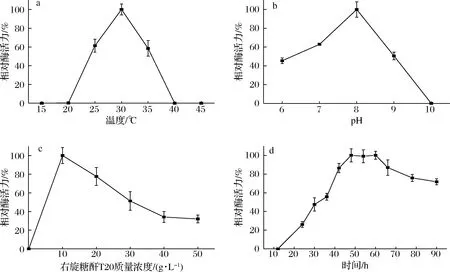
a-温度;b-初始pH;c-右旋糖酐质量浓度;d-发酵时间图4 不同发酵条件对菌株RN22发酵产右旋糖酐酶的影响Fig.4 Effect of different fermentation conditions on the production of dextranase by strain RN22
2.2.3 诱导剂质量浓度对菌株产酶的影响以及最佳产酶时间的确定
由图4-c可见,当右旋糖酐T20的质量浓度为10 g/L时,最利于菌株产酶;不加诱导剂时,菌株产酶量为0,当右旋糖酐质量浓度超过10 g/L时酶活力下降,因此将右旋糖酐T20的终质量浓度确定 10 g/L,右旋糖酐在低质量浓度促进菌株产酶,在高质量浓度会出现抑制,与LAI等[16]研究结果一致。如图4-d所示,当菌株发酵时间为48 h时,产酶达到最高,48~60 h内酶活力保持稳定,随后酶活力下降。与已报道的霉菌相比,菌株RN22的产酶达到最高酶活力时间短。拟青霉属(Paecilomyces)[17]需要8 d酶活力才能达到最高值,黄绿青霉(Penicilliumcitreoviride)[18]则需要13 d,细菌发酵产酶可以节约时间成本。
2.3 酶学性质
2.3.1 最适反应温度及热稳定性
在60 ℃时酶活力达到最高峰(图5-a),随后酶活力开始下降,酶在45~60 ℃之间的酶活力均在60%以上。细菌来源的右旋糖酐酶最适温度多在40~60 ℃[8,12]。图5-b显示酶在40 ℃保温5 h后剩余酶活力80%以上,根据文献报道,大多海洋细菌产的酶在高于50 ℃会丧失大部分的酶活力[19-20],在50 ℃保温2 h剩余酶活力80%以上,表明该菌株所产右旋糖酐酶热稳定较好。
2.3.2 最适反应pH及pH稳定性
图5-c显示该酶催化反应的pH值范围,在pH值5.0条件下相对酶活力检测不出,pH值>5.0后酶活力迅速升高,在pH 6.0~8.0范围内有70%以上的酶活力,其最适反应pH值为7.5(Tris-HCl),海洋细菌产生的酶具备一定的耐碱性[21]。目前所报道的右旋糖酐酶最适pH多在4.0~6.0[22-24]。该酶在pH 5.0~9.0下保存1 h后的剩余酶活力见图5-d,酶在pH 5稳定性差,保存后检测不到酶活力。但是酶在pH 5.5~9.0的条件下保存1 h后剩余活力均在60%以上,该酶在此pH值中性偏碱性范围内稳定性较好。
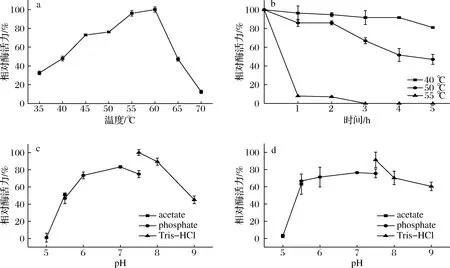
a-温度对右旋糖酐酶活影响;b-温度稳定性;c-pH对右旋糖酐酶活力的影响;d-pH稳定性图5 温度、pH对酶活力以及稳定性的影响Fig.5 Effects of temperature and pH on dextranase activity and stability
2.3.3 金属离子对酶活力的影响
在终浓度为1、5和10 mmol/L时,不同浓度的金属离子对右旋糖酐酶活性的影响如表2所示。Mg2+、Na+、Ba2、Si2+、K+可以提高酶的活性,Cd2+、Ni2+抑制酶活性,低浓度的Co2+对酶活力有促进作用,但浓度5、10 mmol/L时对酶活性有抑制。加入Cu2+、Zn2+、Fe3+可以使酶活性完全丧失,在HUANG等[25]和ZHANG等[26]的研究中,Cu2+、Zn2+、Fe3+对酶活力具有不同程度的抑制效果,其他金属离子在以上浓度对酶活力影响较小。
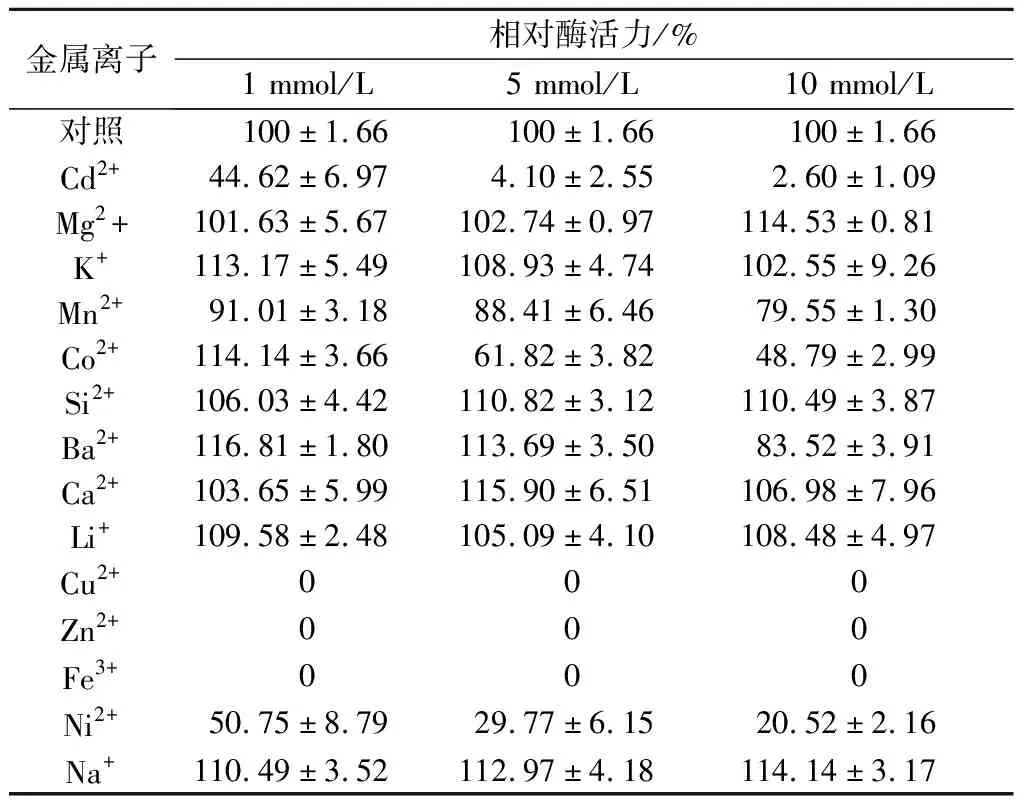
表1 金属离子右旋糖酐酶的影响Table 1 Effect of metal ion on dextranase
2.3.4 底物特异性及催化产物
如表2所示,该菌株所产右旋糖酐酶能特异水解由α-1,6糖苷键组成的不同分子质量的右旋糖酐,对由α-1,4和α-1,6糖苷键组成的可溶性淀粉仍有8.5%的催化活性,对只含有α-1,4糖苷键和β-1,4糖苷键组成的壳聚糖和普鲁兰均没有催化活力,从而可以得出结论,该酶只能够特异性水解含α-1,6糖苷键。

表2 酶的底物特异性研究Table 2 Substrate specificity of dextranase
2.3.5 有机溶剂对酶活力的影响
所用的有机溶剂对酶的活性均有不同程度的抑制作用(表3),其中甲基叔丁基醚、乙酸乙酯对酶活力抑制效果较弱,而正丙醇、吐温-20、乙醇对酶活力抑制效果最强,β-疏基乙醇加入后即有沉淀产生。
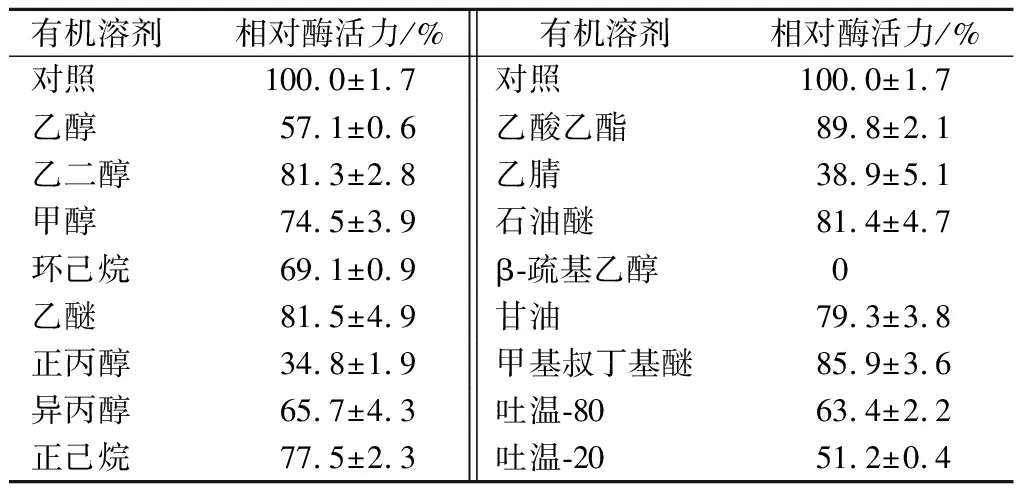
表3有机溶液对酶活力的影响Table 3 Effect of organic solution on dextranase activity
酶的表面电势、活性位点、结构受到有机溶剂的影响,对酶活力具有抑制作用[27]。
2.3.6 右旋糖酐酶蛋白SDS-PAGE电泳
右旋糖酐酶蛋白SDS-PAGE电泳结果如图6所示。经复性后出现1条透明带,是复性后右旋糖酐酶水解分离胶中的蓝色葡聚糖形成。对应位置条带在经考马斯亮蓝染色的凝胶蛋白maker 70 kDa处,说明该右旋糖酐酶的分子质量在70 kDa左右。

M-蛋白质分子质量标准;1-复性右旋糖酐酶条带;2-考马斯亮蓝染色图6 右旋糖酐酶粗酶SDS-PAGE分析Fig.6 SDS-PAGE analysis of crude dextranase
2.3.7 水解产物分析
麦芽七糖、麦芽六糖、麦芽五糖、麦芽四糖、麦芽三糖、麦芽二糖、葡萄糖等标准糖依次出峰,如图7-a所示。
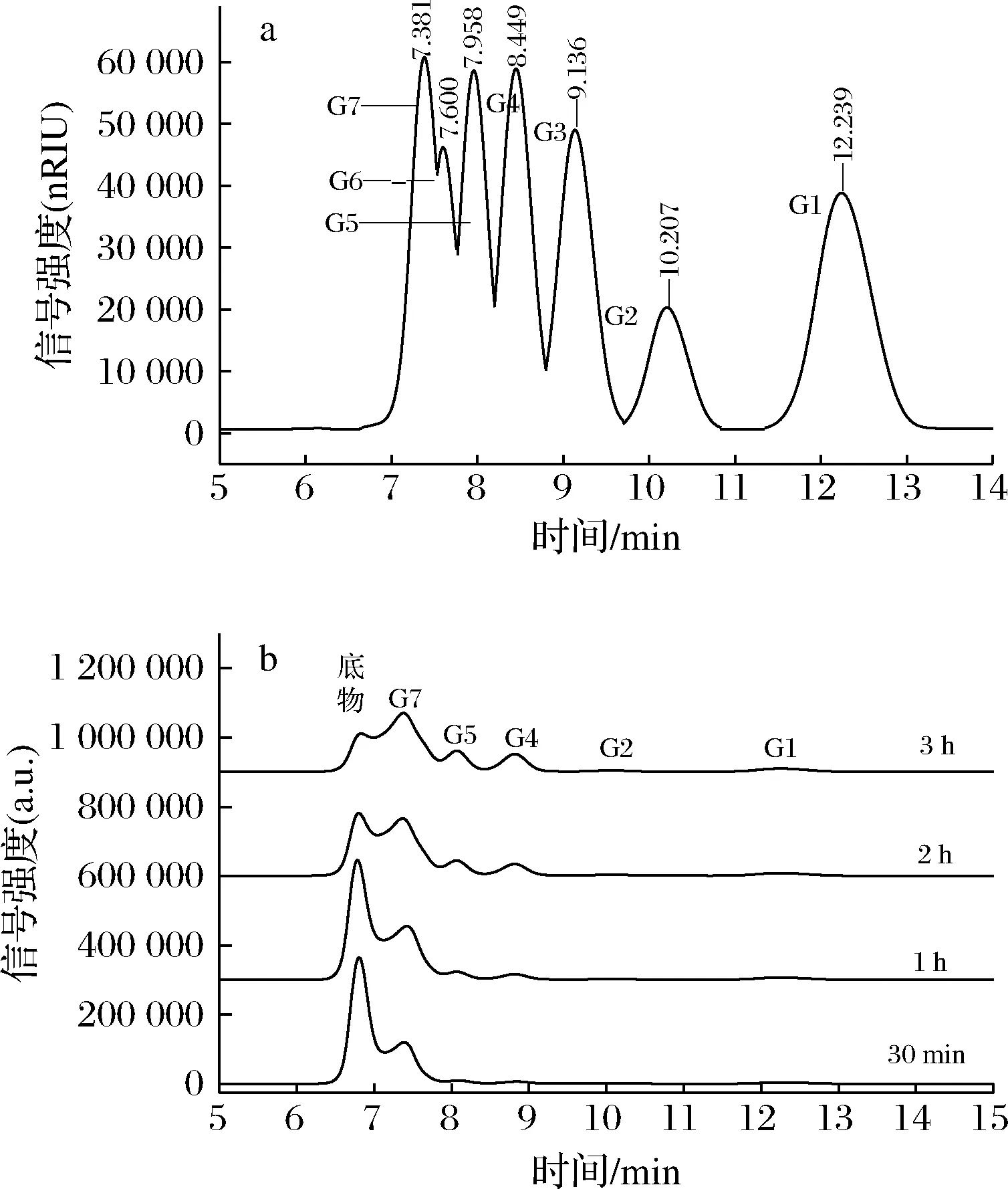
a-糖标品;b-不同反应时间图7 酶液水解右旋糖酐T20的水解产物高效液相色谱图Fig.7 High performance liquid chromatogram of hydrolysate of dextran T20 by dextranase
对照标准糖出峰时间可以看出右旋糖酐酶解产物主要产物为麦芽七糖,及少量的葡萄糖,麦芽二糖,麦芽四糖,麦芽五糖。结果表明,菌株RN22所产右旋糖酐酶为内切酶[28]。图7-b和表4显示,随着水解时间的增长,麦芽七糖峰面积逐渐增大,底物逐渐减少。葡萄糖和麦芽二糖在水解产物中所占的比例几乎不变,比例一直稳定在5%左右,麦芽四糖和麦芽五糖含量分别从3.08%和4.47%增加到12.27%和12.75%,麦芽七糖含量从85.67%减少到68.33%。该酶水解右旋糖酐后,得到单一寡糖(七糖)含量较高,对该酶的应用,以及酶结构的深入研究都具有重要意义。
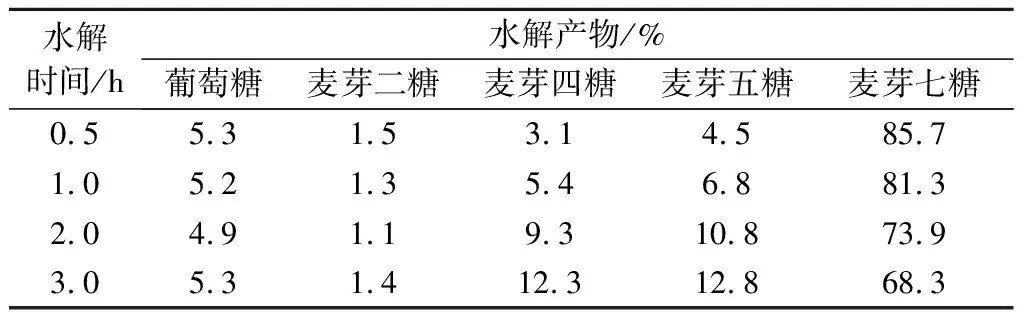
表4 右旋糖酐酶水解右旋糖酐T20产物含量Table 4 Content of dextran T20 hydrolyzed by dextranase
3 结论
筛选得到产右旋糖酐酶的菌株Pseudarthrobactersp.RN22,该菌株产酶条件为:碳氮源为麸皮和胰蛋白胨,均为5 g/L,右旋糖酐T20 10 g/L,陈海水,pH 8.0,温度30 ℃,最佳产酶时间48 h。该菌株产生的右旋糖酐酶的最适温度为60 ℃,最适pH7.5,该酶在30~70 ℃可保持较高酶活性,热稳定性较好,在pH 5.5~8.0稳定。分子质量约为70 kDa,Mg2+、Na+、K+等金属离子可以提高酶的活性,有机溶剂对酶活力具有不同程度的抑制效果,该酶是专一性水解α-1,6糖苷键的内切酶,水解产物主要为寡糖,值得关注的是麦芽七糖的含量达到80%以上,该酶在寡糖的生产上具有较好的应用前景。
