二甲双胍促进大鼠皮层神经元轴突生长的体外效应研究*
2021-09-16管徒晨郭贝贝
管徒晨,滕 龙,郭贝贝,刘 炎*
(南通大学 教育部/江苏省神经再生重点实验室/神经再生协同创新中心,南通 226001)
成年哺乳动物中枢神经系统(central nervous system,CNS)的轴突损伤后大多不能再生,CNS 损伤后轴突再生障碍常导致永久性功能障碍。因此,神经元再生受损轴突的能力对功能的恢复至关重要。目前对于CNS 损伤的治疗手段包括药物治疗、手术治疗、物理及康复治疗等[1-2],然而想要完全恢复却十分困难,同时高昂的治疗费用给家庭和社会带来沉重负担,发现可以用于临床治疗CNS 损伤的药物显得尤为重要。
二甲双胍(metformin,MET)是世界上最古老、最广泛使用的降血糖药物之一。它的医学使用史最早可以追溯到山茱萸提取物的使用,起初被用于治疗口臭和多尿,直到20 世纪30 年代,MET 才被报道用于治疗糖尿病症状[3]。多年来,除了改善血糖,MET已被证明对健康有越来越广泛的积极作用。MET 被发现对长期胰岛素血症的神经细胞中淀粉样蛋白β积聚和tau 蛋白过度磷酸化有保护作用[4]。此外,它还能减轻体外培养海马神经元的非诱导性凋亡[5],但是对神经元生长及再生能力的研究比较罕见。本研究通过体外培养大鼠皮层神经元,探讨了MET 对神经元轴突生长的效应。
1 材料与方法
1.1 实验仪器 CO2细胞培养箱(Thermo Fisher 公司);研究级体视显微镜(Olympus 公司);细胞操作超净台(安泰公司);荧光倒置显微镜(ZEISS 公司);多功能酶标仪(Biotek 公司)。
1.2 动物和试剂 怀孕18 d(E18)的SD 大鼠(南通大学实验动物中心);盐酸MET(MCE 公司);DMEM/F12 培养基、Neurobasal 培养基、B27 Supplement(Gibco 公司);青霉素和链霉素、Hank′s 解剖液、谷氨酰胺(碧云天公司);硫酸软骨素蛋白多糖(chondroitin sulfate proteoglycans,CSPGs)、多聚赖氨酸、Hoechst 33342(Sigma 公司);兔抗β-微管蛋白Ⅲ(Tuj1)抗体(Abcam 公司);Alexa fluor@488/Cy3 标记亲和纯化山羊抗兔IgG(H+L)(Jackson immunology 公司);细胞计数试剂盒8(cell counting kit-8,CCK-8)(Dojindo 公司)。本实验方案经南通大学实验动物伦理委员会批准。
1.3 原代皮层神经元的来源和培养 SD 孕鼠(E18)采用乙醚麻醉,处死后置入75%乙醇中完全浸泡1 min,将大鼠置于手术台,用手术剪剖开腹腔取出胎鼠并剪下头部,置于Hank′s 解剖液中清洗2~3 遍;在体视显微镜下分离出大脑皮层最顶端区域,放入15 mL 离心管中,用0.25%胰酶37 ℃消化12 min,每3 min 震荡1 次,充分消化后,500 r/min离心1 min,弃胰酶,用F12 完全培养基结束消化,并吹打5~10 次,分离出神经元;吸取上层液体,过筛网(400 目),1 000 r/min 离心5 min,弃上层液体,加5 mL DMEM/F12 完全培养基重悬细胞沉淀,待混匀后计算数量;以2×106/mL 细胞密度种入多聚赖氨酸预先包被好的大皿或以1×105/mL 密度种在24 孔板中包被有多聚赖氨酸的玻片上,4~6 h 后换液,用Neurobasal 培养基继续培养。
1.4 药物处理 原代培养皮层神经元更换Neurobasal 培养基同时加入指定浓度MET,继续培养24 h,观察对轴突生长的影响。原代培养皮层神经元24 h 后使用0.125%胰酶消化构建损伤模型,1 000 r/min 离心5 min,去除胰酶,用F12 完全培养基结束消化,以1×105/mL 密度将细胞种在24孔板中包被有多聚赖氨酸的玻片上,加入100 μmol/L MET继续培养48 h,观察对神经元生长的影响,CSPGs 处理组在检测前12 h 加入10 μg/mL CSPGs。
1.5 细胞免疫荧光 将12 mm 小圆玻片放入24 孔板,加多聚赖氨酸包被,细胞计数后接种至24 孔板并进行加药处理;弃培养基,加入37 ℃预温的磷酸缓冲盐溶液(phosphate buffered saline,PBS)轻洗1次,加入200 μL 固定液,室温固定30 min,吸掉固定液,用0.01 mol/L PBS 室温洗涤3 次,5 min/次;每孔加入200 μL 细胞封闭液,37 ℃封闭60 min,弃封闭液;孵育一抗4 ℃过夜。次日,室温复温20 min,PBS轻轻洗涤3 次,10 min/次;避光条件下室温孵育1 h 45 min,弃二抗,并加入Hoechst 33342(5 μg/mL)室温孵育15 min,0.01 mol/L PBS 洗3 次,5 min/次,荧光封片剂封片保存于暗盒内;荧光显微镜拍摄,实验重复3 次。
1.6 细胞活力检测 使用CCK-8 试剂盒检测细胞活性,按照说明书进行实验,将神经元以3×104/孔的密度接种于96 孔板中,培养12 h 后加入100 μmol/L MET 刺激24 h 或48 h,收样前2 h 每孔加入10 μL CCK-8 溶液孵育细胞,酶标仪检测OD450,实验重复3 次。
1.7 统计学方法 应用Imageproplus 软件统计细胞荧光强度,采用GraphPad Prism8 对实验数据进行单因素方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 MET对皮层神经元轴突生长的影响 原代皮层神经元体外培养加入不同浓度MET(10、100、500 μmol/L,1、5 mmol/L)处理24 h 后固定神经元,免疫荧光结果显示,100 μmol/L 浓度的MET 能够有效促进皮层神经元轴突的生长(P<0.05)(图1,见封二)。
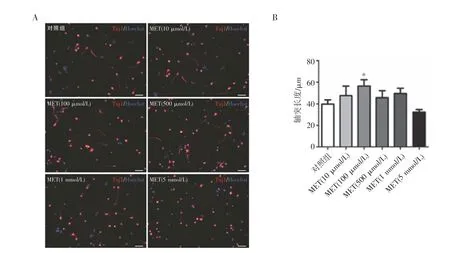
图1 不同浓度MET 对皮层神经元轴突生长的影响
2.2 MET 对皮层神经元轴突再生的影响 体外培养皮层神经元,运用低浓度胰酶进行二次消化构建体外神经元损伤模型。加入MET 刺激神经元,36 h后固定神经元进行细胞免疫荧光染色并对轴突长度进行统计,结果显示,100 μmol/L 的MET 能够有效促进皮层神经元轴突再生(图2,见封二)。
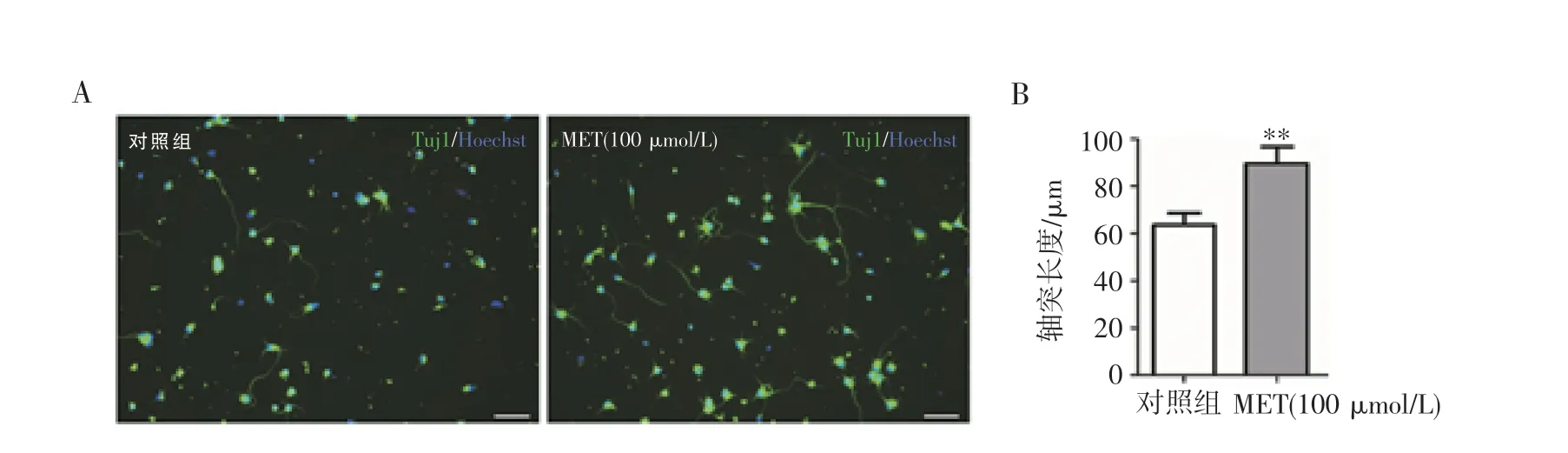
图2 MET 对皮层神经元轴突再生的影响
2.3 MET 有效提升细胞活力 体外培养E18 皮层神经元,加入100 μmol/L MET 分别处理24 h 和48 h,使用CCK-8 检测细胞活力,结果显示MET 可有效提升皮层神经元的细胞活力(图3)。

图3 MET 刺激神经元后CCK-8 统计图
2.4 MET 有效缓解CSPGs 对轴突生长的抑制作用CSPGs 可在CNS 损伤后显著上调并抑制轴突生长,因此在培养皿中加入CSPGs 模拟CNS 损伤环境,可以看出CSPGs 能够有效抑制皮层神经元轴突的生长,而MET 则能缓解这种抑制作用(图4,见封二)。

图4 MET 有效缓解CSPGs 对轴突生长的抑制作用
3 讨论
MET 作为2 型糖尿病的一线治疗药物能够有效降低血糖[6],主要通过有机阳离子转运蛋白(organic cation transpoters,OCTs)转运至多种细胞中[7]。多年来,除了具有改善血糖的作用外,MET 已被证明对治疗肥胖、代谢综合征、心血管疾病等有积极作用[8]。文献[9-10]提示MET 有助于改善外周神经系统神经性疼痛,并能促进缺血性脑损伤等CNS 疾病恢复。MET 能改善CNS 损伤后的功能恢复,部分原因是通过抑制神经元凋亡[11]。而本研究发现MET 能够促进皮层神经元的轴突生长及损伤后再生,这为MET 的应用提供了新的方向。
众所周知,CNS 损伤后神经元的再生能力较差。因此,探索促进轴突再生的途径具有重要意义。近年来,各种神经再生研究集中于提高神经元再生能力,以改善CNS 损伤后的功能恢复[12]。本研究表明,MET能够有效提升神经元活力,为神经元轴突生长提供支持。
轴突生长抑制因子是成年哺乳动物CNS 损伤后再生失败的重要因素[13],损伤部位胞外基质(如蛋白多糖)的表达抑制了轴突再生,CSPGs 家族是其中研究最广泛的家族之一[14]。本课题组以往研究[15]显示,轴突能够横跨CSPGs 环境的生长,往往是CNS再生的关键。这一现象提示,通过药物治疗研究CSPGs 存在的情况下对神经元生长的影响具有重要意义。因此在体外加入CSPGs 来模拟CNS 损伤后的抑制环境,并且发现CSPGs 对神经元轴突生长的抑制作用在MET 的影响下得到有效缓解。提示MET可能是CNS 损伤修复的潜在候选药物。MET 安全性高,轻微的胃肠道问题是常见的不良反应,仅有极少数的乳酸酸中毒报道[16],同时有研究[17]发现MET 能够穿过血脑屏障,而这使得它成为了CNS 损伤用药的有力竞争者。
MET 促进神经元轴突生长的效应是明确的,那么可能的作用机制是什么?研究[18-19]发现,MET 能够强烈影响细胞代谢,如通过激活AMPK、抑制线粒体呼吸链复合物Ⅰ和甘油磷酸穿梭刺激糖酵解,通过抑制线粒体甘油磷酸脱氢酶调整细胞氧化还原状态,降低内源性葡萄糖生成[19]。文献[20-22]提示,MET 可以降低多种细胞系三羧酸循环活性和线粒体呼吸。对于原代培养的星形胶质细胞,MET 能够增加糖酵解而降低氧化磷酸化通量[23-24]。因此,MET能够调整神经元的代谢状态。研究[25-26]发现神经祖细胞与分化后的神经元相比对氧化磷酸化的依赖性更小,并且从糖酵解到氧化磷酸化的转变与神经元分化密切相关。突触活动作为神经元轴突生长的重要诱因之一,通过调控葡萄糖转运体3 以及糖酵解限速酶的表达以提高葡萄糖摄取和代谢从而促进轴突的生长[27],糖酵解超过氧化磷酸化提供了神经元对增长的能量需求的快速响应[28]。这提示神经元供能由氧化磷酸化转向糖酵解对其轴突生长及再生具有重要作用。MET 可能通过调控神经元的代谢状态,为轴突的生长及再生提供能量支持和生物合成前体进而促进轴突的生长。
本研究发现MET 能够有效促进原代皮层神经元轴突生长及损伤轴突的再生,并显示了神经保护作用,体外实验也证实了MET 处理能有效缓解CSPGs 对皮层神经元生长的抑制作用。希望MET 刺激神经元轴突生长及再生的研究可以促进对神经元内在再生机制的进一步了解,为改善神经系统轴突再生提供理论依据及潜在靶点。
