基于网络药理学探讨复方茵丹汤治疗淤胆型肝炎的作用机制
2021-09-15徐萌孙凤霞李晓玲
徐萌 孙凤霞 李晓玲
摘要 目的:通过中药复方网络药理学对复方茵丹汤治疗淤胆型肝炎的作用机制进行系统分析。方法:通过中药系统药理学数据库与分析平台(TCMSP)、中医药综合数据库(TCMID)筛选复方茵丹汤中有效活性成分及其作用靶点;运用OMIM数据库以及GeneCards数据库获取淤胆型肝炎疾病相关靶点;将药物与疾病靶点取交集,获得潜在靶点;通过DisGenet数据库分析潜在靶点的蛋白类型;运用Cytoscape软件构建中药复方调控网络;通过STRING数据库建立蛋白质-蛋白质相互作用(PPI)网络并带入Cytoscape软件进行拓扑分析;采用R软件进行潜在靶点的基因本体(GO)富集分析以及富京都基因和基因组百科全书(KEGG)通路富集分析。结果:复方茵丹汤中有效活性成分所对应的靶点与淤胆型肝炎靶点取交集,共获得了83个潜在靶点;通过复方调控网络构建,预测茵陈、大黄、栀子等药物可能通过NOS2、ESR1、DPP4等靶点对淤胆型肝炎的治疗起到一定作用;通過PPI网络及拓扑分析,获得白细胞介素6、蛋白激酶、血管内皮生长因子A等11个核心靶点,可能在复方茵丹汤治疗淤胆型肝炎中起主要作用;通过GO富集分析结果,预测潜在靶点在淤胆型肝炎的肝脏损伤、炎症反应、细胞代谢功能以及免疫功能中发挥作用;通过KEGG富集分析结果,预测Thl7细胞分化通路、HIF-1信号通路可调节机体的代谢应激,抑制炎症介质。结论:复方茵丹汤对淤胆型肝炎的作用机制可能与其109个有效活性成分、11个核心靶点以及Thl7细胞分化、HIF-1等信号通路有关。
关键词 网络药理学;复方茵丹汤;淤胆型肝炎;作用机制;有效成分;核心靶点;信号通路
Study on the Mechanism of Compound Yindan Decoction in the Treatment
of Cholestatic Hepatitis Based on Network Pharmacology
XU Meng1,2, SUN Fengxia2, LI Xiaoling2
(1 Graduate School, Beijing University of Traditional Chinese Medicine, Beijing 100029, China; 2 Department of Infection,
Beijing Hospital of Traditional Chinese Medicine, Capital Medical University, Beijing 100010, China)
Abstract Objective:Through the network pharmacology, we analyzed the mechanism of compound Yindan Decoction in the treatment of cholestatic hepatitis systematically. Methods:We screened out the active components and their effective targets in compound Yindan decoction by TCMSP and TCMID database. We obtained the disease-related targets of cholestatic hepatitis relying on GeneCards and OMIM databases. We intersected the drug and disease targets to obtain potential targets. We analyzed the protein types of potential targets relying on DisGenet database. We constructed the regulatory network of Chinese medicinal through Cytoscape3.8.0 software. We established the Protein interaction network (PPI) through the STRING database and brought into Cytoscape3.8.0 software for topological analysis. We established gene ontology (GO) enrichment analysis of potential targets and the Kyoto Encyclopedia of Genes and Genomes(KEGG) pathway enrichment analysis through Cytoscape software. GO enrichment analysis of potential targets and KEGG pathway enrichment analysis were performed by using R software. Results:The targets corresponding to the active components of compound Yindan Decoction intersected with the targets of cholestatic hepatitis. And we obtaineda total of 83 potential targets. Through compound regulation network construction, it was predicted that Herba Artemisiae Scopariae (virgate wormwood herb, YC), Radix et Rhizoma Rhei (rhubarb root and rhizome, DH), Fructus Gardeniae(cape jasmine fruit,ZZ), may play roles in the treatment of cholestatic hepatitis through NOS2, ESR1, DPP4, etc. respectively relying on the construction of the compound regulatory network. Through the PPI interaction network and topological analysis, we found 11 core targets:Interleukin 6, protein kinase, vascular endothelial growth factor A. They may play major roles in the treatment of cholestatic hepatitis with compound Yindan Decoction. Through KEGG enrichment analysis, we predicted the role of potential targets in liver injury, inflammatory response, cellular metabolism and immune function of cholestatic hepatitis; The results of KEGG enrichment analysis predicted that Thl7 cell differentiation pathway and HIF-1 signaling pathway could regulate metabolic stress and inhibit inflammatory factors. Conclusion:The mechanism of compound Yindan Decoction in the treatment of cholestatic hepatitis may be related to its 109 active components, 11 core targets, Th17 cell differentiation, HIF-1 signaling pathways and etc.
Keywords Network pharmacology; Compound Yindan Decoction; CholestaticHepatitis; Action mechanism; Active components; Core targets; Signaling pathways
中图分类号:R575.1;R96文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.15.010
淤胆型肝炎是由胆汁的生成、分泌、排泄异常,胆汁酸积聚于肝脏而引发的肝脏病变,又名为胆小管型肝炎和胆汁淤积性肝炎,以黄疸和瘙痒为主要临床症状。其发病与病毒、药物、妊娠、乙醇、自身免疫等因素相关[1],肝细胞胆汁分泌与排泄障碍、胆管炎性病变为其主要发病机制[2]。临床中,以天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、血清碱性磷酸酶(ALP)、γ-谷氨酰转肽酶(GGT)等肝功能指标水平升高及高胆红素血症作为淤胆型肝炎的典型特征[3]。目前,患有淤胆型肝炎人群占比为黄疸型肝炎的2%~8%,若疾病转为慢性,可进展为重型肝炎及肝硬化,严重影响患者生命质量,预后较差[4]。因此提高淤胆型肝炎患者的临床疗效,减缓肝硬化及并发症的进程为目前待解决的问题。西医治疗以保肝、利胆、退黄药物为主,疗效不理想。因此,探索更优质的治疗方案势在必行。
淤胆型肝炎归属于中医“黄疸”范畴,基本病机为湿、热、毒、瘀,前期临床研究中将基本病机概括为“肝胆湿热,瘀血阻络”,以“清热化湿、凉血活血”作为基本治疗原则。研究结果发现,复方茵丹汤可有效改善急性淤胆型肝炎患者的临床症状,降低血清胆红素、ALP以及GGT水平,显著改善患者胆汁淤积[5]。前期基础研究发现,复方茵丹汤可以有效降低急性肝内胆汁淤积大鼠的血清胆红素水平、转氨酶以及胆管酶,保护肝脏功能,改善其肝脏组织学病变[6]。
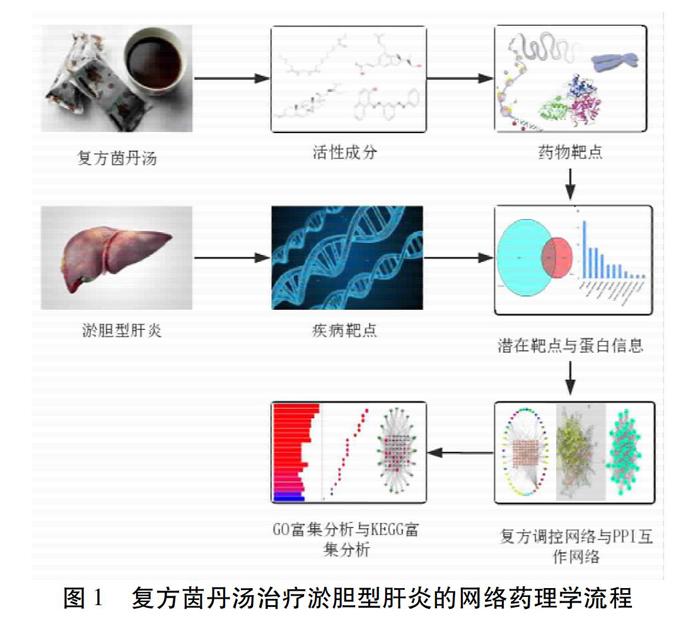
为了更好地反映复方茵丹汤多成分、多靶点以及多途径的特点,本研究应用网络药理学对药物和疾病构建了复杂网络,以求更加准确的预测其作用途径以及作用机制[7]。我们制定了复方茵丹汤治疗淤胆型肝炎的机制研究流程。见图1。
1 资料与方法
1.1 获取药物有效成分
通过中药系统药理学数据库与分析平台(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)检索复方茵丹汤中药物的活性成分,以口服生物利用度(OB)≥30%以及类药性(DL)≥0.18作为筛选标准。筛选出茵陈(Virgate Wormwood Herb,YC)、栀子(Cape Jasmine Fruit,ZZ)、大黄(Rhubarb Root and Rhizome,DH)、赤芍(Peony Root,CS)、牡丹皮(Ttree Peony Root Bark,MDP)、白术(Largehead Atractylodes Rhizome,BZ)、茯苓(Indian Bread,FL)七味药物的活性成分。由于TCMSP系统未曾收录生地黄(Unprocessed Rehmannia Root,SDH),利用中药综合数据库(TCMID,http://119.3.41.228:8000/tcmid/herb/4256/)检索生地黄活性成分,并一一带入TCMSP,仍以OB≥30%、DL≥0.18作为筛选标准。
1.2 获取药物与疾病潜在靶点以及靶点分类
从TCMSP中提取出YC、ZZ、DH、MDP、BZ、FL 7味药物的全部靶点,与药物有效成分取交集,得出药物有效靶点。通过搜寻生地黄有效成分,找到与其相匹配的靶点作为SDH的有效靶点。利用Uniprot数据库(www.Uniprot.org)将所有有效靶点的名称转换成genesymbol;以“Cholestatic hepatitis”为关键词在OMIM数据库(https://omim.org/)以及GeneCards数据库(http://www.genecards.org/)中查找淤胆型肝炎的作用靶点。利用R软件绘制韦恩图,获得复方茵丹汤与淤胆型肝炎的潜在靶点。利用DisGeNET数据库(www.disgenet.org/)分析药物与疾病潜在靶点蛋白类型。
1.3 构建复方调控网络以及蛋白质-蛋白质相互作用(PPI)网络
运用Cytoscape3.8.0软件构建中药复方调控网络。得到有效成分与靶基因的靶向关系。利用STRING数据库(https://string-db.org/)构建PPI网络。在数据库中选择Multiple Protein,導入复方茵丹汤与淤胆型肝炎的潜在靶点,设定物种为人(Homo Sapiens),设定所需的最低交互分数为0.400,得到PPI网络互作信息。并运用Cytoscape3.8.0软件中的CytoNCA插件对PPI网络进行拓扑分析。根据节点的中心度(Centrality)筛选基因,以排行50%top作为筛选标准,依次对点度中心性(Degree)、中介中心性(BC)、接近中心性(CC)3种参数进行拓扑分析,以评估靶基因的重要性。
1.4 获取基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)富集分析数据及KEGG网络构建
运用R语言软件包完成基因ID的转换,对复方茵丹汤治疗淤胆型肝炎的潜在靶点进行GO与KEGG富集分析,并实现可视化。设置P<0.05,Q<0.05。GO注释分为3大类,分别是:生物学过程(Biological Process,BP)、分子生物学功能(Molecular Function,MF)和细胞学组分(Cellular Components,CC)。通过这3个功能大类,对83个潜在靶点进行限定和描述,分析结果取前20个;通过KEGG通路富集分析,探讨重要通路在治疗淤胆型肝炎当中的相关机制,分析结果取前20个;将通路及靶基因相关信息导入Cytoscape3.8.0软件,构建KEGG关系网络,以Degree程度设置通路与基因的大小。更直观的观察到通路与基因之间的关系。
2 结果
2.1 复方茵丹汤有效成分分析 共筛选出苏丹Ⅲ(Sudan Ⅲ)、芦荟大黄素(Aloe-emodin)、芍药吉酮(Paeoniflorgenone)、植物甾醇(Beta-Sitosterol)、豆甾醇(Stigmasterol)等109个活性成分,分别为YC 13个、ZZ 15个、SDH 3个、DH 16个、CS 29个、MDP 11个、BZ 7个、FL 15个。见表1。
2.2 复方茵丹汤与淤胆型肝炎潜在靶点分析
通过TCMSP收集复方茵丹汤的有效靶点,去除重复靶点,共得到药物靶点208个;通过Genecard数据库以及OMIM数据库分别获取到737个、11个,去除重复靶点,共获得疾病相关靶点745个。见表2。将淤胆型肝炎疾病相关靶点与复方茵丹汤有效靶点进行匹配,构建中药复方与疾病靶点韦恩图,获得潜在靶点83个。见图2。从DisGeNET数据库中检索83个潜在靶点,获得相对应的蛋白分类信息,并进行频数统计。其蛋白主要分类有Enzyme、Kinase、Nuclearreceptor等。见图3。
2.3 构建复方调控网络以及PPI网络结果分析
如图4所示,有效成分以圆圈形式围绕靶基因,获得有效成分与基因之间的对应关系。得出YC、SDH、ZZ等药物的有效成分可能通过NOS2、ESR1、DPP4等靶点对淤胆型肝炎起到治疗作用。
如图5所示,网络由81个节点和1 080条边组成,2个节点之间的边越多,2个目标之间的关联程度越高。如图6所示,进行三次拓扑分析:Betweenness Centrality(BC),Closeness Centrality(CC),De-gree Centrality(DC),同样都以top50%作为纳入标准。通过筛选后依次获得41个节点和616条边、21个节点和202条边、11个节点和55条边。通过三次拓扑分析得到11个核心靶点。因Degree越大,代表该靶点的重要性越高,将靶基因按Degree从大到小排序依次为白细胞介素6(IL6,69)、蛋白激酶(AKT1,60)、血管内皮生长因子A(VEGFA,59)、表皮生长因子(EGF,55)、白细胞介素-1β(IL-1β,52)、有丝分裂原活化蛋白激酶(MAPK8,50)、前列腺素-内毒素合成酶2(PTGS2,49)、趋化因子2(CCL2,49)、丝裂原活化蛋白激酶1(MAPK1,49)、半胱氨酸天冬氨酸蛋白酶3(CASP3,49)、基质金属蛋白酶2(MMP2,45)。
2.4 GO富集分析与KEGG富集分析
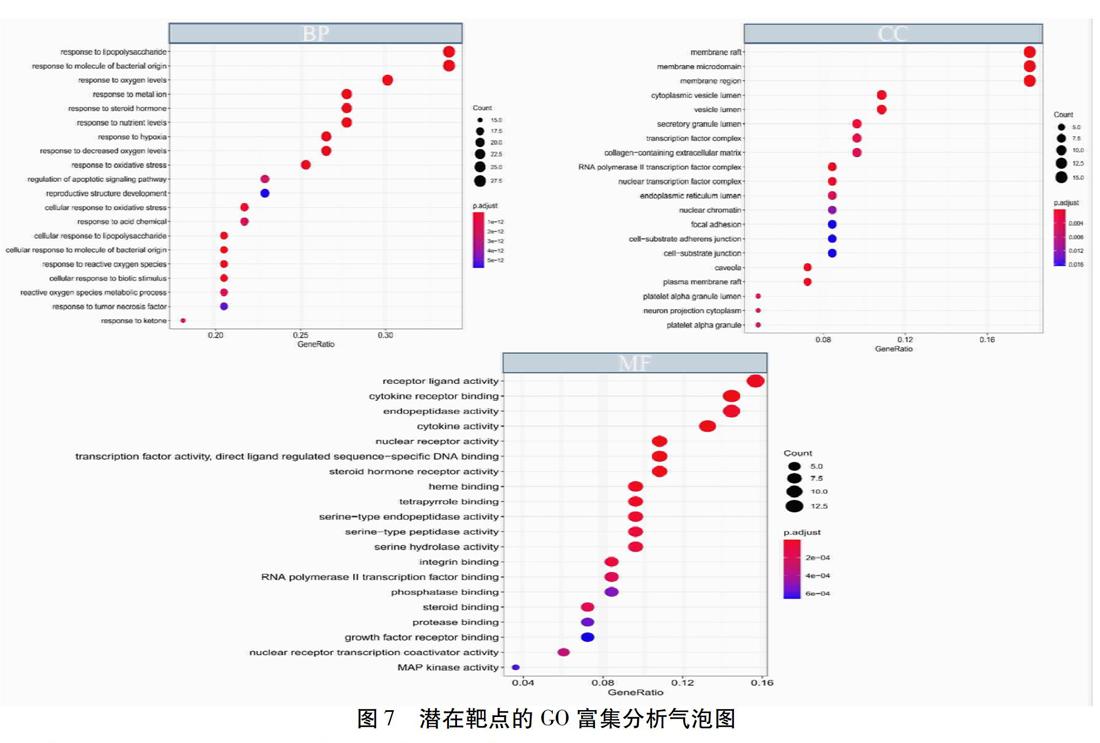
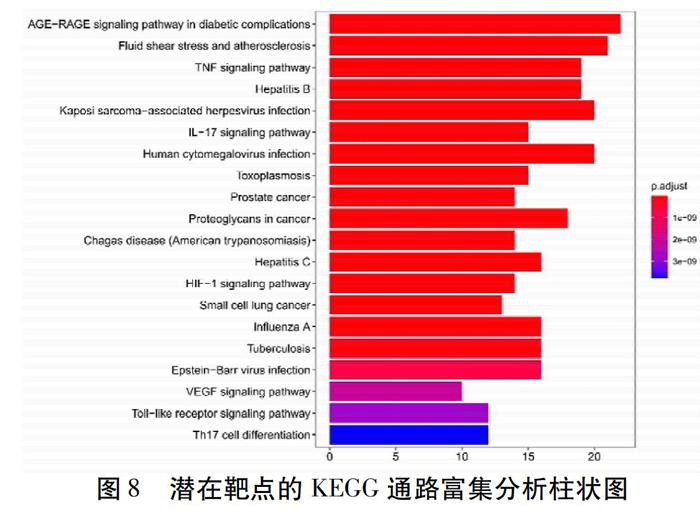
在GO富集分析中,生物学信息如图7所示。在BP方面,关键靶点主要与脂多糖的反应(Response to Lipopolysaccharide)、细菌源分子的反应(Response to Molecule of Bacterial Origin)、氧气水平的反应(Response to Oxygen Levels)等密切相关。在CC方面,关键靶点主要与膜筏(Membrane Raft)、膜微域(Membrane Microdomain)、膜区(Membrane Region)等密切相关。在MF方面,关键靶点主要与核受体活性(Nuclear Receptor Activity)、转录因子活性、直接配体调控序列-特异性结合(Transcription Factor Activity,Direct Ligand Regulated Sequence-specific DNA Bindin)、类固醇激素受体活性(Steroid Hormone Receptor Activi-ty)等密切相关;在KEGG富集分析中,基因富集情况如图8所示,主要富集在AGE-RAGE信号通路、TNF信号通路、卡波西肉瘤相关疱疹病毒感染信号通路等20个通路上,提示淤胆型肝炎与这些通路之间的紧密联系;KEGG关系网络如图9所示,网络中共有80个节点以及322条边,节点的大小反映了关键靶点与通路之间的关系。通过KEGG网络构建,可预测在复方茵丹汤治疗淤胆型肝炎中IL-17、HIF-1、Toll样受体等信号通路与CASP3、CASP8、IL1B、MAPK8、MMP3、CXCL2、CCL2、VEGFA、IL6、AKT1等密切相关。
3 讨论
中药复方可通过多途径、多靶点治疗淤胆型肝炎,通过网络药理学探索中药复方中的可能作用机制和规律,可获得相互作用的有效成分、靶点及通路,了解三者与疾病之间的分子关系。
运用中药复方治疗疾病时,其代谢过程尤为复杂。本研究借助TCMSP、TCMID、GeneCards数据库以及0MIM数据库获取了复方茵丹汤与淤胆型肝炎的潜在靶点,包括F7、ESR2、KDR、PRKCE、PCNA、MYC、IL1B等83个潜在靶点,为后续的机制研究奠定基础。
通过构建中药复方调控网络,形象直观地展示了每一味藥物的活性分子与靶点之间的相关性,得出YC、DH、ZZ、SDH、MDP、BZ、FL可能分别通过NOS2、ESR1、DPP4、PTGS2、CD14、ESR1、RXRA、PPARG等靶点对淤胆型肝炎的治疗起到一定作用,有待后续进一步研究。通过对靶蛋白类型的分析,预测复方茵丹汤可能通过Enzyme、Kinase、Nuclearreceptor等蛋白类型发挥治疗淤胆型肝炎的作用。
通过PPI网络构建以及拓扑分析,直观地展示了复方茵丹汤的调控网络以及治疗淤胆型肝炎的核心靶点,提示11个核心靶点可能为淤胆型肝炎治疗中的关键基因。IL-6与肝病风险及易感性显著相关[8];AKT1可通过释放免疫抑制性细胞因子增强免疫调节功能以及通过过继转移减轻肝组织损伤,帮助改善肝功能[9];VEGFA的表达与肝血管生成有关[10];EGF可促进肝脏干细胞分化,对淤胆型的肝硬化的治疗起到一定的作用[11];IL1B可能降低ALT、AST及TBIL肝功指标,减轻组织学严重程度[12];miR-433-3p作用于MAPK8,可对肝癌细胞MHCC97H的增殖和侵袭起到抑制作用[13];表皮生长因子受体(EGFR)和PTGS2的表达与肿瘤的发生和生长相关[14];CCl2自由基可诱导肝脏炎症损伤以及肝脏肿瘤[15];MAPK1可影响细胞的氧化应激与炎症反应[16];CASP3抑制可延缓肝纤维化以及肝损伤的进程[17];MMP 2可参与疾病早期细胞外基质与肝小叶的重建[18]。提示了核心靶点的可靠性,可为复方茵丹汤治疗淤胆型肝炎的后续研究提供思路。
淤胆型肝炎的发病与病毒、药物、妊娠、乙醇、自身免疫等因素相关,通过GO富集分析,获取其潜在靶点的生物学信息。生物学过程中,潜在靶点主要与脂多糖的反应、细菌来源分子的反应、氧气水平的反应等密切相关。这些反应与淤胆型肝炎的肝脏损伤、炎症反应、细胞代谢功能以及免疫功能有着紧密联系[19-21]。Cellular Components中,关键靶点主要与膜筏(Membrane Raft)、膜微域(Membrane Microdomain)、膜区(Membrane Region)等密切相关,说明淤胆型肝炎造成多细胞成分的损伤,提示淤胆型肝炎的复杂性;Molecular Function中,关键靶点主要与核受体活性(Nuclear Receptor Activity)、转录因子活性(Transcription Factor Activity)、直接配体调控序列-特异性结合(Direct Ligand Regulated Sequence-specific DNA Binding)、类固醇激素受体活性(Steroid Hormone Receptor Activity)等密切相关,说明疾病发展与如上分子功能相关。
通过KEGG富集分析,得出20条复方茵丹汤治疗淤胆型肝炎的相关通路。综合富集结果,得出复方茵丹汤治疗淤胆型肝炎的药理机制可能包括参与细胞增殖与凋亡、调节血液流动、抑制炎症反应、调节转录、调节机体免疫功能、参与氧调节、介导内皮细胞增殖和迁移等。综合研究结果与文献信息检索,对富集通路进行分析。其中Thl7细胞分化通路调节可能通过CASP3、IL1B等基因对炎症介质的产生有一定影响[22]。HIF-1信号通路对于缺氧具有敏感性,其可能通过VEGFA、AKT1等基因影响代谢应激、炎性生长因子和细胞外基质分子的相关反应[23]。因Thl7细胞分化通路、HIF-1信号通路与疾病相关性较强,且尚未检索到二者与淤胆型肝炎的相关研究,因此可作为下一步的研究方向。此外,Okada等[24]研究发现,原发性胆汁性胆管炎(PBC)小鼠肝脏中的Toll样受体3分子表达量明显上升,提示其肝脏内Toll样受体信号通路发生活化。TNF-α为内皮细胞、巨噬细胞以及库普弗细胞释放的细胞因子,是TLR4信号通路中的主要调节因子,Whiting等[25]研究发现注射LPS的小鼠,肝脏膽汁流量明显下降,但应用抗TNF-α抗体阻断后,其胆汁流量分泌减少,提示TNF-α与TLR4信号通路诱导的胆汁淤积有关;miR-377-5p可能下调VEGF信号通路,从而抑制肝脏癌细胞的增殖与侵袭[26];奥美沙坦可能抑制AGE/RAGE/p-JNK通路,起到抗炎、抗氧化作用[27];TNF信号通路可能调节机体免疫以及激活巨噬细胞[28];HCMV信号通路可能与全身免疫调节相关[29]。
综上所述,通过网络药理学构建中药与疾病网络,预测其相应的活性成分、靶点信息以及主要通路,可直观观察复方茵丹汤的成分-靶点-途径的作用特点。中药治疗相比西医单靶点治疗占据了独特优势。本研究可为进一步临床与实验提供研究方向,并将复方茵丹汤更加合理准确的应用于临床实践。因研究中通过网络信息获取药物化合物成分,未涉及煎煮及剂量过程的相关反应所带来的干扰,以及对于相关治疗靶点以及通路的预测未被证实,因此还需进一步实验,验证研究成果的可靠性。
参考文献
[1]尹延重,邵铭.淤胆型肝炎的病因病机及诊疗概况[J].中国肝脏病杂志(连续型电子期刊),2014,6(1):96-99.
[2]Jiang YM,Jiang XL,Zou Y,et al.Clinical Study on Treatment of Chronic Severe Intrahepatic Cholestatic Hepatitis with Liu Xi Decoction[J].Int J Chin Med,2019,3(4):59-63.
[3]Vinken M,Landesmann B,Goumenou M,et al.Development of an adverse outcome pathway from drug-mediated bile salt export pump inhibition to cholestatic liver injury[J].Toxicol Sci,2013,136(1):97-106.
[4]陈曦,刘钊,杨世忠.淤胆型肝炎中西医治疗概况[J].吉林中医药,2005,25(3):59-60.
[5]孙凤霞,王建美,刘龙.复方茵丹汤治疗急性淤胆型肝炎30例临床观察[J].中国中西医结合杂志,2015,35(3):310-313.
[6]李晓玲,孙凤霞,王晓静,等.复方茵丹汤对大鼠急性肝内胆汁淤积的干预作用[J].中国中西医结合消化杂志,2014,22(9):497-500.
[7]钱程,成鹏,郑维维,等.基于网络药理学探讨山海丹颗粒治疗勃起功能障碍的潜在作用机制[J].中国药理学通报,2020,36(6):864-870.
[8]Wang X,Yan Z,Ye Q.Interleukin-6 gene polymorphisms and susceptibility to liver diseases:A meta-analysis[J].Medicine(Baltimore),2019,98(50):e18408.
[9]Zhou L,Liu S,Wang Z,et al.Bone Marrow-Derived Mesenchymal Stem Cells Modified with Akt1 Ameliorates Acute Liver GVHD[J].Biol Proced Online,2019,21:24.
[10]Jin X,Aimaiti Y,Chen Z,et al.Hepatic stellate cells promote angiogenesis via the TGF-β1-Jagged1/VEGFA axis[J].Exp Cell Res,2018,373(1-2):34-43.
[11]王健,康权,罗庆,等.胆汁淤积性肝硬化来源的微环境因子对肝脏干细胞分化的影响[J].中国细胞生物学学报,2018,40(4):490-498.
[12]朱晨岑,郑滢,肖欣怡,等.重组人白细胞介素-1受体拮抗剂对急性肝衰竭小鼠肝脏保护作用的评价[J].中国医药工业杂志,2019,50(3):320-324.
[13]万智双,熊丁,曹宸.miR-433-3p靶向MAPK8对肝癌细胞MHCC97H增殖、凋亡和迁移的调控作用[J].中国免疫学杂志,2020,36(1):57-62.
[14]Goos JA,Hiemstra AC,Coupé VM,et al.Epidermal growth factor receptor(EGFR) and prostaglandin-endoperoxide synthase 2(PTGS2) are prognostic biomarkers for patients with resected colorectal cancer liver metastases[J].Br J Cancer,2014,111(4):749-755.
[15]Filliol A,Schwabe RF.FoxM1 Induces CCl2 Secretion From Hepatocytes Triggering Hepatic Inflammation,Injury,Fibrosis,and Liver Cancer[J].Cell Mol Gastroenterol Hepatol,2020,9(3):555-556.
[16]姜海慧,唐凯,张化为,等.基于网络药理学研究南五味子对肝损伤的保护作用机制分析[J].天然产物研究与开发,2020,32(5):759-768.
[17]Thapaliya S,Wree A,Povero D,et al.Caspase 3 inactivation protects against hepatic cell death and ameliorates fibrogenesis in a diet-induced NASH model[J].Dig Dis Sci,2014,59(6):1197-1206.
[18]李德旭,杨镇,邱新光,等.猪胆汁性肝纤维化的形成机制研究[J].中华实验外科杂志,2003,20(1):16-17.
[19]Zhao L,Chen F,Zhang Y,et al.Involvement of P450s and nuclear receptors in the hepatoprotective effect of quercetin on liver injury by bacterial lipopolysaccharide[J].Immunopharmacol Immunotoxicol,2020,42(3):211-220.
[20]Lee SR,Lee SY,Kim SY,et al.Hydroxylation and sulfation of sex steroid hormones in inflammatory liver[J].J Biomed Res,2017,31(5):437-444.
[21]Ménégaut L,Thomas C,Jalil A,et al.Interplay between Liver X Receptor and Hypoxia Inducible Factor 1α Potentiates Interleukin-1β Production in Human Macrophages[J].Cell Rep,2020,31(7):107665.
[22]郭靜雅,邱玉华.Th17细胞的分化调控与自身免疫性疾病[J].国际免疫学杂志,2010,33(4):249-252.
[23]Surazynski A,Donald SP,Cooper SK,et al.Extracellular matrix and HIF-1 signaling:the role of prolidase[J].Int J Cancer,2008,122(6):1435-1440.
[24]Okada C,Akbar SM,Horiike N,et al.Early development of primary biliary cirrhosis in female C57BL/6 mice because of poly I:C administration[J].Liver Int,2005,25(3):595-603.
[25]Whiting JF,Green RM,Rosenbluth AB,et al.Tumor necrosis factor-alpha decreases hepatocyte bile salt uptake and mediates endotoxin-induced cholestasis[J].Hepatology,1995,22(4 Pt 1):1273-1278.
[26]杨晋,贺凯,张孟瑜,等.miR-377-5p通过下调HIF-1α及其相关VEGF信号通路抑制肝细胞癌HepG2细胞的增殖和侵袭[J].中国肿瘤生物治疗杂志,2020,27(3):248-254.
[27]Abo El-Nasr N,Saleh DO,Mahmoud SS,et al.Olmesartan attenuates type 2 diabetes-associated liver injury:Cross-talk of AGE/RAGE/JNK,STAT3/SCOS3 and RAS signaling pathways[J].Eur J Pharmacol,2020,874:173010.
[28]de Oliveira DC,Hastreiter AA,Mello AS,et al.The effects of protein malnutrition on the TNF-RI and NF-κB expression via the TNF-α signaling pathway[J].Cytokine,2014,69(2):218-225.
[29]浮苗,田可港,郑晓群.人巨细胞病毒潜伏感染相关基因研究进展[J].中国病原生物学杂志,2014,9(12):1134-1138.
(2020-07-22收稿 责任编辑:魏庆双,徐颖)
基金项目:国家自然科学基金面上项目(81573897)
作者简介:徐萌(1991.05—),女,硕士研究生在读,研究方向:中医药防治肝病研究,E-mail:444725873@qq.com
通信作者:孙凤霞(1969.08—),女,博士,教授,博士研究生导师,研究方向:肝病研究,E-mail:sunfengxia01969@163.com
