实时荧光跨越式滚环等温扩增技术检测食品中的志贺氏菌
2021-09-12王立娟郭威张先舟马晓燕张伟
王立娟,郭威,张先舟,马晓燕,张伟,2,3*
(1.河北农业大学食品科技学院,河北 保定 071001;2.河北农业大学生命科学学院,河北 保定 071001;3.河北农业大学理工学院,河北 沧州 061100)
食源性疾病是全世界关心的重要公共卫生问题,志贺氏菌病占其中很大一部分[1],它是由志贺氏菌引发的一种急性肠胃疾病[2],临床特征包括发烧、腹部疼痛、中度到重度水样腹泻[3]。一旦治疗不及时,可能会导致肠道炎、脱水甚至死亡,严重危害身体健康,特别是儿童和免疫缺陷人群[4]。志贺氏菌主要存在于手工加工的蔬菜沙拉、鲜奶制品或煮熟后的肉制食品中[5],常引起食物中毒。因此,志贺氏菌的检测在食品安全领域具有重要意义[6],建立一种新的快速、灵敏、特异性高的检测方法,对于及时检出食品中的志贺氏菌至关重要。
志贺氏菌的检测方法大致分为三大类,即传统培养方法、免疫学方法和分子生物学方法[7]。传统培养方法以GB 4789.5—2012《食品安全国家标准食品微生物检验志贺氏菌检验》方法为主[8],该方法是鉴定志贺氏菌的现行标准,检测准确度高且稳定。但是传统方法检测志贺氏菌操作繁琐,耗时费力且每次处理的样品数量很少,不能满足快速检测的需求。免疫学方法以酶联免疫吸附技术(enzyme-linked immunosorbent assays,ELISA)[9]、胶体金免疫层析技术(immune colloidal gold technique,GICT)[10]较为常见。免疫学方法虽然大大缩短了检测时长[11],但灵敏度较低[12]。分子检测技术主要包括聚合酶链式反应(polymerase chain reaction,PCR)[13]、环介导等温扩增方法(loop mediated isothermal amplification,LAMP)[14]、滚环扩增技术(rolling circle amplification,RCA)[15]等。PCR 和实时荧光定量PCR检测技术与传统方法和免疫学方法相比,虽然有许多优点,但是其相对于等温扩增技术LAMP、RCA等扩增效率和灵敏度较低。LAMP和RCA技术可高效扩增DNA,但是LAMP需要4条~6条引物,这些引物的设计和反应体系复杂,引物之间易相互作用,产生非特异性结果,且无法通过对扩增产物测序,判断扩增结果的正确性。RCA技术扩增线性DNA则需要锁式探针和连接酶[16],且需要探针环化,操作过程复杂,耗时长约4 h。
近年来,跨越式滚环等温扩增(saltatoryrollingcircle amplification,SRCA)技术被用于多种病原菌检测[17-20],该方法克服了等温扩增技术的缺点,仅需要2条引物,在Bst DNA聚合酶的作用下,不需人为环化,即可实现线性DNA的扩增[21]。本研究以期在SRCA方法的基础上,根据志贺氏菌特异性基因ipaH设计筛选引物,建立一种高效、灵敏的实时荧光跨越式滚环等温扩增(real-time fluorescence saltatory rolling circle amplification,RF-SRCA)方法对志贺氏菌进行检测,以有效检出病原菌,保障食品安全和消费者健康。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
本研究采用32株菌进行RF-SRCA方法特异性检测,其中志贺氏菌13株,非志贺氏菌19株。菌株名称及其来源如表1所示。

表1 试验菌株Table 1 The strains list in this study
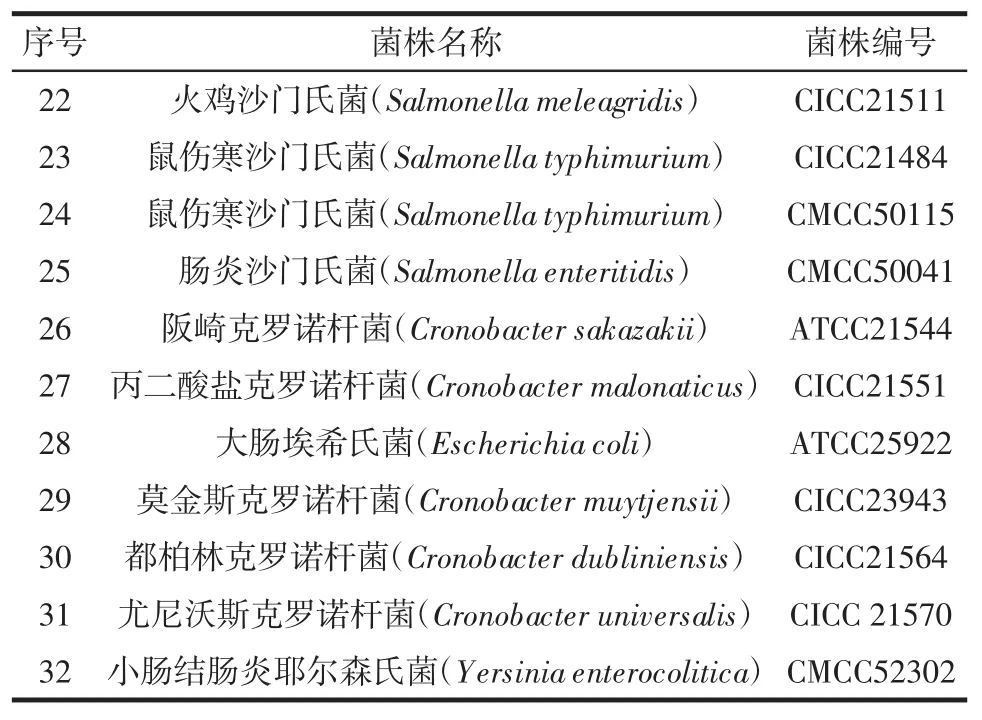
续表1 试验菌株Continue table 1 The strains list in this study
1.1.2 样品与试剂
试验所用60种食品样品:当地各超市和农贸市场随机购买。
细菌DNA提取试剂盒:天根生化科技有限公司(北京);RF-SRCA引物:北京华大基因有限公司;Eva-Green染料:安诺伦生物科技公司(北京);Bst DNA聚合酶(large fragment)(8 000 U/mL):美国 NEB 有限公司;Luria-Bertani液体培养基、木糖赖氨酸脱氧胆酸盐(xylose lysine desoxycholate agar,XLD)琼脂:陆桥技术股份有限公司(北京)。
1.1.3 主要仪器设备
Archimed实时荧光定量PCR仪:鲲鹏基因科技公司(北京);Nanodrop 2000蛋白质核酸分析仪:美国Thermo Scientific公司;BINDA2020D凝胶成像仪:北京宾达英创有限公司;DYY-8C型电泳仪:北京市六一仪器厂;DK-8D三孔电热恒温水槽:上海一恒科学仪器有限公司。
1.2 试验方法
1.2.1 引物的设计
在NCBI中选取同源性最高的志贺氏菌特异性基因ipaH的基因序列,利用Primer premier 6.0和DNAMAN进行引物的筛选与设计。引物由北京华大基因有限公司合成,引物信息如表2所示。
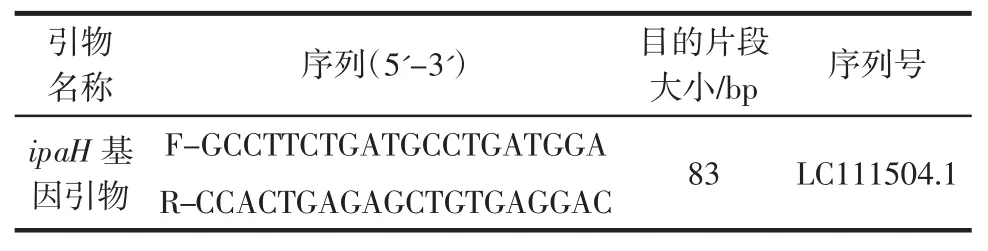
表2 RF-SRCA和SRCA方法的引物Table 2 Primers of RF-SRCA and SRCA methods
1.2.2 菌株培养和DNA提取
将志贺氏菌菌株(ATCC12022)划线于XLD琼脂培养基中,37℃培养20 h~48 h,挑取单菌落接种于Luria-Bertani液体培养基中培养12 h,取1 mL菌液使用提取细菌DNA试剂盒进行DNA提取。使用Nanodrop 2000蛋白质核酸分析仪测定提取的DNA纯度和浓度。表1中其它菌株同上操作,提取的DNA于-20℃保存备用。另取1 mL志贺氏菌菌液用9 mL无菌生理盐水10倍梯度稀释,选取可计数范围内的3个稀释度菌液,每个稀释度3个平行,用平板计数的方法进行初始菌落计数。
1.2.3 反应体系与反应条件
RF-SRCA 的反应体系:dNTPs(2.5 mmol/L)添加量为 4.5 μL,Bst DNA 聚合酶添加量为 1.0 μL,Bst DNA聚合酶反应缓冲液添加量为2.5 μL,20×EvaGreen染料添加量为1.0μL,MgSO4(20mmol/L)添加量为2.0μL,正反向引物(10 μmol/L)添加量各为 1.0 μL,模板 DNA添加量为1.0 μL,无菌双蒸水补足体积到20 μL。阴性对照用无菌双蒸水代替模板DNA。
RF-SRCA的反应条件:首先将模板DNA在PCR仪中94℃预变性3 min,4℃冷却2 min。预变性后的模板与 dNTPs、MgSO4、10 × Thermo Pol Reaction Buffer、引物、Bst DNA聚合酶和无菌双蒸水添加到200 μL离心管中,并于避光环境下加入1 μL EvaGreen(20×)染料,最后放入实时荧光定量PCR仪中。实时荧光定量PCR仪程序为64℃进行15 s,64℃进行1 min,每次循环结束采集一次信号,循环40次。结果以扩增曲线为“S”型且循环阈值(cycle threshold,Ct值)在 5~30之间为阳性,否则为阴性。对扩增后的产物进行64℃~96℃的熔解曲线分析,熔解曲线为单峰且熔解温度(melt temperature,Tm值)在80℃~90℃之间说明引物特异性较好,扩增产物单一。
SRCA反应体系如上述RF-SRCA反应体系,反应过程使用水浴锅64℃加热60 min;82℃灭酶活2 min以终止反应。将SRCA反应扩增产物用浓度为2.0%的琼脂糖凝胶进行电泳验证,凝胶电泳图出现清晰的梯形条带为阳性,否则为阴性。
1.2.4 RF-SRCA方法特异性试验
本研究使用32株菌株对RF-SRCA方法进行特异性验证,其中包括13株志贺氏菌和19株非志贺氏菌。实时荧光曲线法确定RF-SRCA的特异性。
1.2.5 RF-SRCA方法灵敏度试验
经测定,1.2.2中提取的志贺氏菌DNA纯度A260/A280为1.858,浓度为5.97×107fg/μL。将其使用无菌DNA稀释液进行10倍梯度稀释至5.97×10-1fg/μL。分别使用RF-SRCA和SRCA方法进行检测,根据实时荧光曲线法测定RF-SRCA方法灵敏度,凝胶电泳图测定普通SRCA灵敏度,将RF-SRCA的灵敏度同SRCA方法进行比较。
1.2.6 RF-SRCA方法检出限试验
取1 mL 1.2.2中过夜培养的志贺氏菌菌液(8.6×109CFU/mL)加入到9 mL灭菌后的牛奶中,混匀后从中取1 mL加入9 mL无菌牛奶中连续10倍梯度稀释至8.6×10-1CFU/mL。使用试剂盒提取DNA,各取1 μL作为反应模板,分别进行RF-SRCA和SRCA试验,将RF-SRCA的检出限同SRCA方法进行比较。
1.2.7 RF-SRCA方法对实际样品的检测与评估
为了评估RF-SRCA方法检测志贺氏菌的适用性,在当地各超市和农贸市场采集60份食品样品,包括25份蔬菜和蔬菜沙拉、20份牛奶、15份肉制品。将样品均质后于37℃培养8 h,取1 mL的均质液使用试剂盒提取DNA。以提取的DNA为模板,以GB/T 47895—2012《食品安全国家标准食品微生物学检验志贺氏菌检验》为参考,用SRCA方法和RF-SRCA方法进行实际样品检测。并用敏感性、特异性和符合率对RF-SRCA方法评估,计算公式参考文献[22]。
2 结果与分析
2.1 RF-SRCA方法特异性分析
RF-SRCA方法引物的设计筛选决定检测方法的特异性。本研究选择32株菌株进行RF-SRCA反应,包括13株志贺氏菌和19株沙门氏菌、金黄色葡萄球菌、李斯特杆菌等非志贺氏菌。RF-SRCA方法的特异性结果见图1。
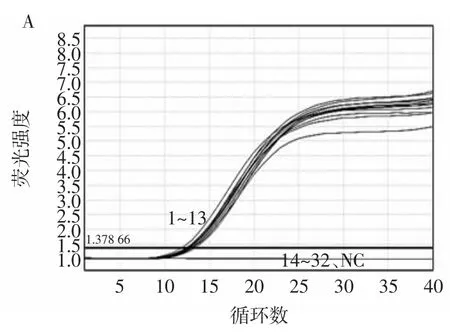
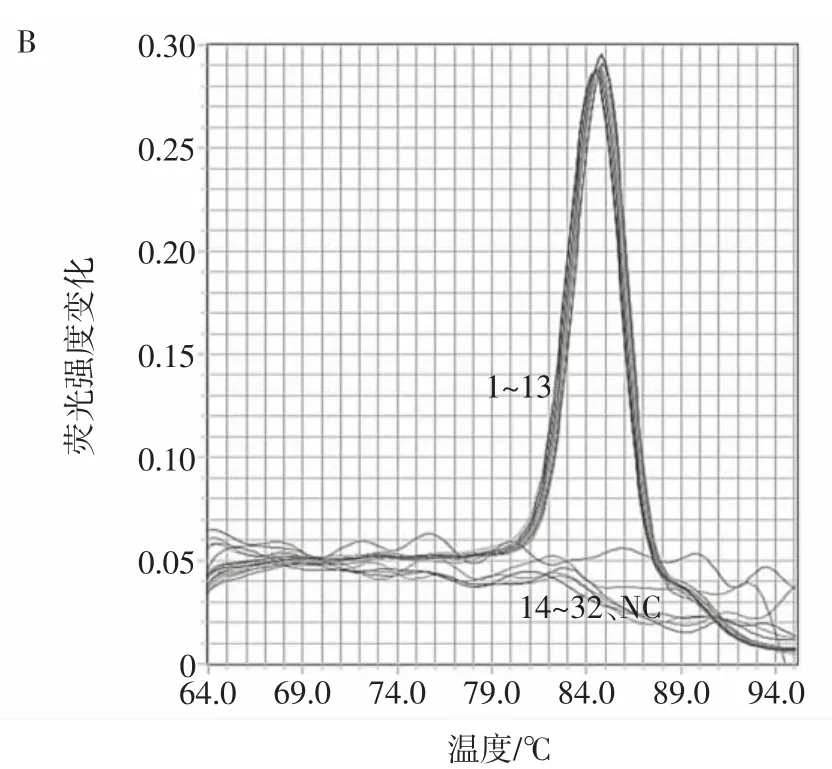
图1 RF-SRCA方法的特异性结果Fig.1 Specificity results of RF-SRCA method
如图1A所示1~13号志贺氏菌Ct值在13左右且曲线为“S”型,故确定为阳性结果,而14~32号非志贺氏菌没有扩增为阴性结果。图1B所示1~13号志贺氏菌的熔解曲线呈单峰Tm值在85℃左右,14~32号非志贺氏菌无单峰出现,证明该方法的特异性良好。
2.2 RF-SRCA方法灵敏度分析
按照1.2.3方法进行RF-SRCA和SRCA反应,灵敏度扩增结果见图2。
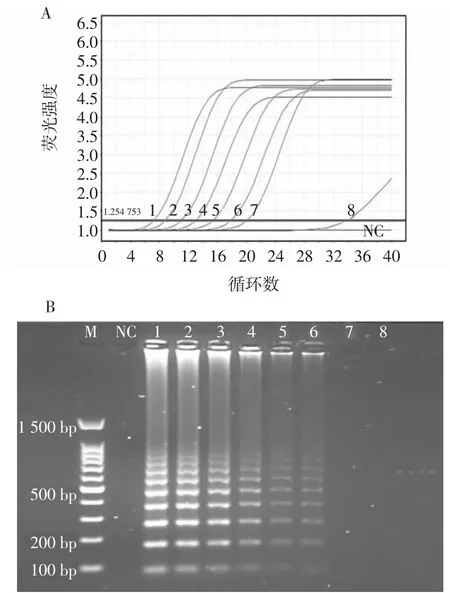
图2 RF-SRCA和SRCA灵敏度扩增结果Fig.2 RF-SRCA and SRCA sensitivity amplification results
RF-SRCA扩增曲线如图2A,DNA浓度为5.97×106fg/μL~5.97 × 100fg/μL(曲线 1~7)扩增曲线呈“S”型为阳性结果;DNA浓度为5.97×10-1fg/μL(曲线8)时为阴性结果。故RF-SRCA扩增曲线方法检测志贺氏菌的灵敏度为5.97×100fg/μL。普通SRCA扩增产物通过凝胶电泳进行判断,由图2B可知凝胶电泳条带随着模板浓度变低条带亮度变暗,在DNA浓度小于5.97×101fg/μL(图 2B 序号 7、8)时没有条带产生,故可知SRCA凝胶电泳的灵敏度为5.97×101fg/μL。由此可知,RF-SRCA的灵敏度比普通SRCA反应灵敏度高10倍。
2.3 RF-SRCA方法检出限分析
RF-SRCA方法检测人工污染志贺氏菌的牛奶检出限,由平板计数法测得志贺氏菌纯培养物的活菌数为8.6×109CFU/mL,进行10倍梯度稀释至8.6×10-1CFU/mL。RF-SRCA和SRCA检出限扩增结果见图3。
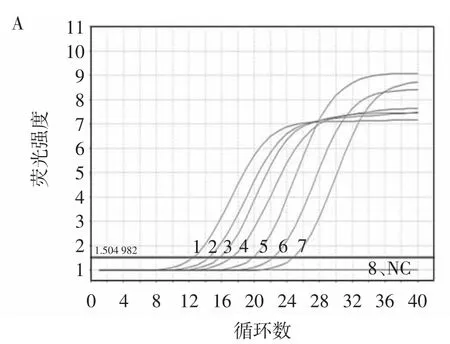
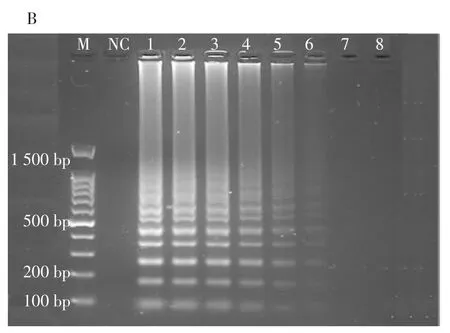
图3 RF-SRCA和SRCA检出限扩增结果Fig.3 RF-SRCA and SRCA detection limit amplification results
如图3A所示,牛奶中志贺氏菌浓度小于8.6×100CFU/mL时(曲线8)为阴性结果,故RF-SRCA检测牛奶中的志贺氏菌的检出限为8.6×100CFU/mL。SRCA方法检出限结果如图3B,当人工污染牛奶中的志贺氏菌浓度小于8.6×101CFU/mL(序号7、8)时,没有出现梯形条带,故判定为阴性。因此,普通SRCA凝胶电泳检测人工污染的牛奶检出限为8.6×101CFU/mL。经过比较RF-SRCA检出限比普通SRCA低10倍。
2.4 实际样品检出率分析
RF-SRCA、SRCA和国标法检测60份实际样品结果如表3所示。
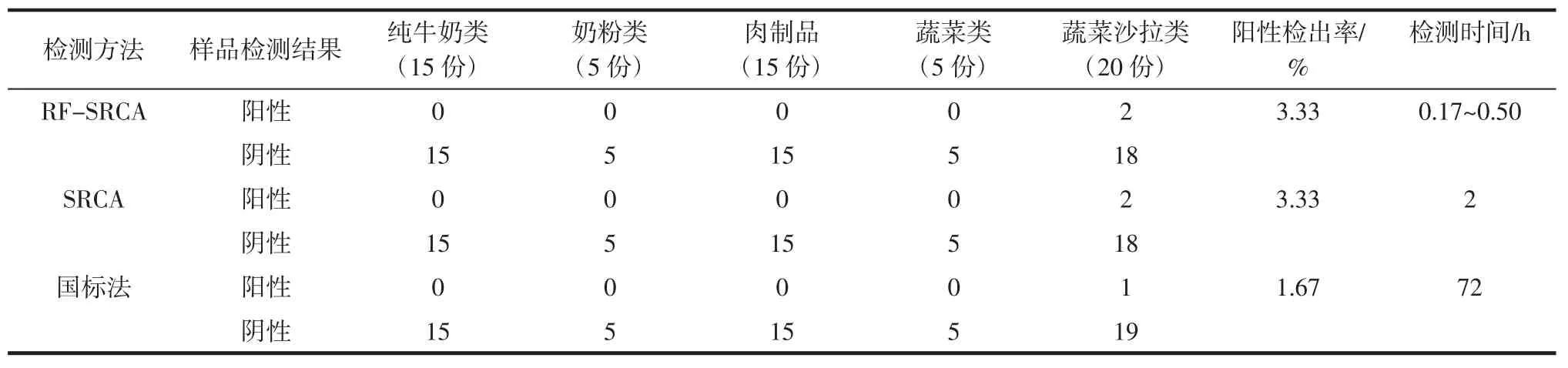
表3 3种方法60份实际样品检出率比较Table 3 Comparison of detection rates of 60 samples of three methods
RF-SRCA和传统SRCA方法阳性样品检出率和检出样品一致。RF-SRCA一般反应0.17 h~0.50 h即可出现扩增结果,而传统SRCA反应1 h后进行凝胶电泳确定扩增结果,需要2.0 h左右,RF-SRCA比SRCA的检出时间更短。RF-SRCA和SRCA方法检测60份食品样品中的志贺氏菌结果相同,检出的阳性样品是蔬菜沙拉,而经过高温灭菌的熟食和牛奶中没有检出。
以GB/T 4789.5—2012《食品安全国家标准食品微生物学检验志贺氏菌检验》为参考,RF-SRCA比其多一份阳性,没有假阴性,可得阳性检出率为3.33%,敏感性为100%,特异性为98.31%,符合率为98.33%。可能是该方法灵敏度较高或样品中存在活的但不可培养(viable but non-culturable,VBNC)状态的志贺氏菌。综上,RF-SRCA方法满足实际样品检测的需要,灵敏度高且检测时间较短。
3 结论与讨论
本研究针对志贺氏菌特异性基因ipaH设计了一对引物,进行RF-SRCA扩增反应。对RF-SRCA法进行特异性检测:志贺氏菌为阳性检测结果,其它非志贺氏菌为阴性结果,证明该方法特异性良好。RF-SRCA的灵敏度为 5.97×100fg/μL,检出限为 8.6×100CFU/g,灵敏度比普通SRCA方法高10倍,检出限比普通SRCA低10倍。RF-SRCA方法检测实际样品比国家标准方法检出率高1.66%,进一步说明该方法灵敏度较高。
根据文献报道qPCR方法和实时荧光LAMP(realtime fluorescence LAMP,RF-LAMP) 检测志贺氏菌,检出限均为102CFU/mL数量级[23-24]。RF-SRCA与其相比,检出限在数量级上低100倍。与实时荧光重组酶聚合酶扩增技术(real-time fluorescence recombinase polymerase amplification,RF-RPA)[25]相比,RF-SRCA 只需要Bst DNA聚合酶参与反应,而RF-RPA需要重组酶和聚合酶完成扩增反应,检测成本较高。因此,RFSRCA检测方法灵敏度高、简便经济、准确高效。
综上,本研究建立检测志贺氏菌的RF-SRCA方法是一种操作简单、高特异性、高灵敏度、低检出限的快速检测方法,在致病菌检测方面具有很广阔的应用前景,为致病菌检测提供了新的思路,在食品检验领域具有较高的应用价值。
