PCR-DGGE分析即食鲍鱼加工过程中菌群变化
2021-09-09郑瑞生吴银凤赵云峰王巧燕杨贵仁郑宗平
郑瑞生,吴银凤,赵云峰,王巧燕,杨贵仁,郑宗平
(1 泉州师范学院海洋与食品学院 福建泉州 362002 2 盐城工学院分析测试中心 江苏盐城 224051 3 安记食品股份有限公司 福建泉州 362000)
鲍鱼是一种原始的海洋单壳软体动物,属腹足纲(Gastropoda)、鲍科(Haliotidae)、鲍属(Haliotis)[1]。它也是中国传统的名贵食材,位居四大海味之首。然而,鲍鱼养殖过程容易受到外界环境中微生物的污染[2],如果生食容易引起致病菌感染。有研究在鲜鲍鱼菌群中检测到5 种病原体:乳酸乳球菌 (Lactococcus garvieae)、耶尔森菌(Yersinia kristensenii)、腐生葡萄球菌(Staphylococcus saprophyticus)、华氏链球菌(S.warneri)和表皮葡萄球菌(S.epidermidis),在鲜鲍鱼储存过程检测到副溶血性弧菌 (Vibrio parahemolyticus)[3]。Cai等[4]研究发现副溶血弧菌、希瓦氏菌(Shewanella)是九孔鲍幼虫的主要致病菌。此外,鲍鱼加工过程由于受热不均、杀菌不彻底等因素的影响,也容易导致熟制后的鲍鱼出现黑变、流汁、恶臭等现象,造成产品的腐败变质,产品的保质期短[5-6]。有研究认为大多数腐败食品中只有特定微生物参与腐败过程[7]。刚加工完的食品微生物菌群中特定腐败菌数量少,然而在贮藏过程中其生长速度较其它微生物快,并且腐败菌活性增强[8]。对鲍鱼加工过程中的微生物群进行分析可有效预防即食鲍鱼的腐败变质,减少误食引起中毒的风险,有助于更好地指导鲍鱼的加工生产。
聚合酶链式反应-变性梯度凝胶电泳 (PCRDGGE)技术可直接检测样品中细菌多样性,定性分析水产品中总菌相变化,确定微生物种类及丰度,避免传统分离培养技术对难以培养或不可培养微生物研究的局限性[9]。应用PCR-DGGE 技术对即食鲍鱼加工前、后微生物种类及数量进行动态监测,分析其菌群变化规律及残留的特定腐败菌,有针对性地采取控制措施,对保证即食鲍鱼产品的安全性具有十分重要的意义。
1 材料与方法
1.1 材料与试剂
皱纹盘鲍(Haliotis discus hannai),单粒重约(38.2±5.4)g,购自福建泉州某鲍鱼养殖加工场。调味料有:调和油、香油,益海嘉里食品公司;酱油、料酒,海天调味食品公司;食用盐,闽盐食品公司;白砂糖,太古糖业公司;味精,安记食品公司。
SK8233 土壤基因组快速抽提试剂盒、细菌16S rDNA 片段的特异引物,上海生工生物公司;DNA Ligation Kit (Mighty Mix)、Taq DNA 聚合酶、限制性内切酶Msp I、Hae Ⅲ、dNTP、10×PCR Buffer,宝生物工程(大连)有限公司;DNA 纯化回收试剂盒,天根生化(北京)科技有限公司;其余试剂均为分析纯级试剂。
1.2 主要仪器与设备
PCR 反应扩增仪,美国BIO-RAD 公司;SWCJ-1D 洁净工作台,江苏苏洁净化设备厂;DK-8D型电热恒温水槽,太仓市科教器材厂;DYY-8 型稳压稳流电泳仪,北京六一生物科技公司;H6-1微型电泳槽,上海精益有机玻璃制品仪器厂;凝胶成像系统,上海山富科学仪器公司;YXJ-2 离心机,常州环宇科学仪器厂;移液器(范围100~1 000 μL,20~200 μL,0.5~10 μL),BBI 生命科技公司。
1.3 试验方法
1.3.1 样品的采集
1)即食鲍鱼加工工艺流程 鲜活鲍鱼→去壳、取内脏(S1)→取鲍鱼腹足部分(S2)→清洗→沥干→拌料调味→低温腌制→高温烘烤熟制→低温冷却(S3)→真空包装→成品贮藏(S4)→贮藏期间出现腐败鲍鱼(S5)。
2)取样编号及所代表样品 S1:鲍鱼内脏,即先用无菌小刀去除鲜活鲍鱼的外壳,再用灭菌医用剪刀剪取鲜活鲍鱼内脏;S2:鲍鱼腹足,即无菌小刀去除鲍鱼内脏后的腹足部位;S3:熟制鲍鱼,即经过高温熟制及低温冷却的熟制鲍鱼;S4:成品鲍鱼,即经过上述完整即食鲍鱼加工工艺制成的即食鲍鱼产品;S5:腐败鲍鱼,即常温贮藏过程出现腐败变质的即食鲍鱼产品。
1.3.2 鲍鱼样品DNA 的制备 按照土壤基因组快速抽提试剂盒(生工SK8233)的说明书提取基因组。
1.3.3 16 S rRNA V3 区扩增 所用引物为细菌16S rDNA V3 高变区 F338 (5'-ACTCCTACGGGAGGCAGCAG-3')和R518(5'-ATTACCGCGGCTGCTGG-3'),长度230 bp 左右,反应体系50 μL,ddH2O 41.25 μL,10×Buffer (含2.0 mmol/L MgCl2)5 μL,dNTP (10 mmol/L)1 μL,F338-GC (10 μmol/L)1 μL,R518 (10 μmol/L)1 μL,Taq 酶(5 U/μL)0.25 μL,模板DNA 0.5 μL。反应程序:94 ℃,4 min 预变性;94 ℃,0.5 min;56 ℃,1 min;72 ℃,0.5 min,30 个循环;72 ℃延伸7 min。取PCR 产物各3 μL,1.5%琼脂糖凝胶电泳,1×TAE 缓冲液,120 V 稳压电泳30 min,成像仪拍照。
1.3.4 变性梯度凝胶电泳(DGGE) 取400 ng 各样品的V3 区PCR 产物,采用D-Code 突变检测系统对样品进行DGGE 分析。所用的聚丙烯酰胺凝胶质量分数为8%(m丙稀酰胺∶m双丙稀酰胺=37.5∶1),变性剂质量分数范围为30%~60%(100%的变性剂为7 mol/L 尿素和质量分数40%甲酰胺)。在60 V 电压、60 ℃恒温、1×TAE 条件下电泳16.0 h。电泳完毕后,用超纯水冲洗胶,然后将胶放进含溴化乙锭(EB)的染液中,置于摇床上染色30 min 后在UVI 成像系统拍照。
1.3.5 DGGE 条带回收 选取较有代表性的条带,用洁净的手术刀片将目标DGGE 条带完整的切下并装入1.5 mL 离心管中,按SK8131 试剂盒方法回收、备用。
1.3.6 PCR 扩增及产物回收 PCR 反应体系与程序同1.3.3 节,PCR 产物按SK8131 试剂盒方法进行胶回收,并送生工生物工程(上海)股份有限公司进行目的片断TA 克隆、测序。
1.3.7 鲍鱼微生物多样性及数据分析 利用DNAman 和CHROMAS 软件将DNA 序列进行人工校对,并将所有校对后的序列方向统一为正向,在EZbiocloud (http://eztaxon-e.ezbiocloud.net)进行BLAST 检索,根据比对结果获得序列对应的细菌种属信息。利用MEGA X 分析软件对DGGE 图谱进行聚类和相似性分析,构建系统发育树,采用PRIMER 5 软件进行数理统计及多样性分析。计算公式如下[10]:
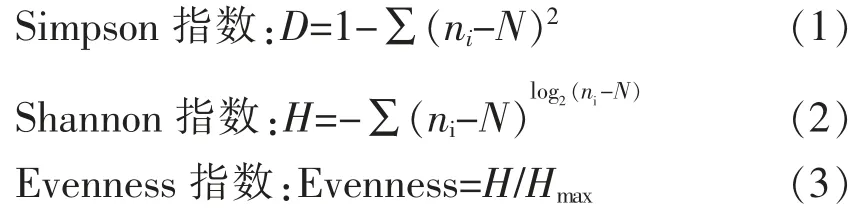
式中,ni——第i 种的个体数;N——所在群落的所有种的个体数之和;H——Shannon 指数;Hmax——最大Shannon 指数,大小为log2(S),S 为物种数目。
2 结果与分析
2.1 16S rDNA V3 片段的PCR 扩增
以GC-338F 和518R 为引物扩增16S rDNA序列V3 可变区、经2%的琼脂糖凝胶电泳检测,获得约200 bp 的DNA 片段(图1),用于DGGE分析。

图1 PCR 扩增的16S rDNA V3 产物的琼脂糖凝胶电泳图Fig.1 Agarose gel electrophoresis of 16S rDNA V3 sequence amplified by PCR
2.2 PCR-DGGE 指纹图谱分析
由图2可知,即食鲍鱼加工过程中各采样点的V3 高变区序列类型较为丰富,由表1群落多样性特征数据可知,S1 鲍鱼内脏及S5 腐败鲍鱼的细菌多样性指数相对较低,分别为2.565 和2.485;而S2、S3、S4 相对丰富,均达到2.773。均匀性指数E 均为1。而丰度指数S 变化趋势则与多样性指数H 基本对应,S1 与S5 丰度较低,分别为13 和12;S2、S3、S4 均为16,说明即食鲍鱼加工过程受外界环境影响,可能带入一些外界微生物,导致菌群分布较广,而在腐败鲍鱼中,由于受到优势腐败菌的影响,其它群菌的生长受到抑制。

表1 不同鲍鱼样品细菌群落特征Table 1 Characteristics of bacterial community in different abalone samples

图2 鲍鱼样品的细菌16S rDNA-PCR 产物DGGE 图谱Fig.2 DGGE atlas of bacterial 16Sr DNA-PCR product of abalone samples
由图3可知,S2、S3、S4、S5 相似性较高,尤其是S2 与S3 进化树距离最近,相似性最高,而S1样品与其它样品进化距离较远。S1 样品为鲍鱼内脏,存在的细菌群落特征与鲍鱼腹足部位存在一定差异。S2 到S5 相似性较高,说明加工过程鲍鱼菌群构成存在一定差异,但变化不大。
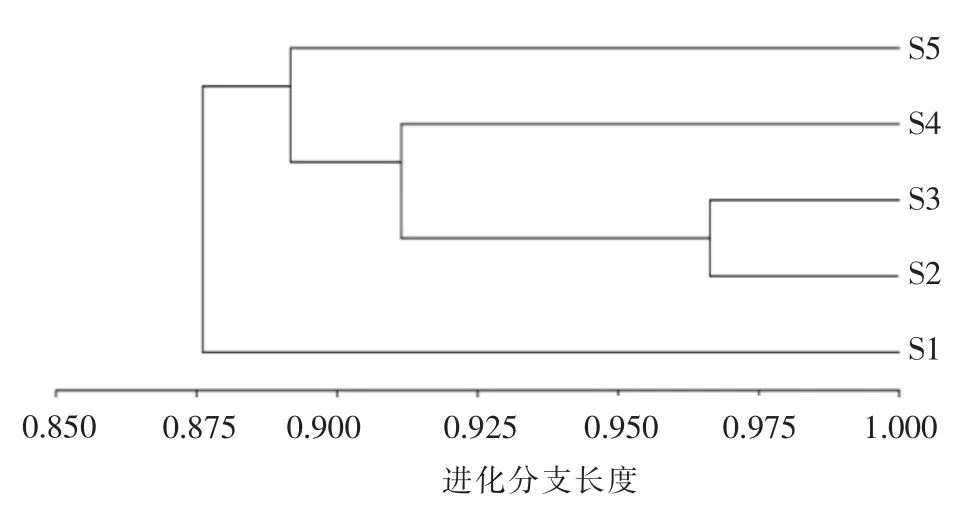
图3 不同鲍鱼样品进化树Fig.3 Evolutionary trees of different abalone samples
2.3 DGGE 凝胶条带回收测序及序列分析
对图2中编号1~19 的条带进行收回、序列克隆测序,将序列结果提交到GenBank 数据库,进行同源性比较,获得最相似菌株的16S rDNA 序列(表2)。根据这些DGGE 带谱所代表的微生物可判定即食鲍鱼加工过程细菌群落的组成状况。结果表明:19 个条带与4 个菌门相似度较高,分别是疣微菌门 (Verrucomicrobia),拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)。与7 个菌纲相似度较高,分别是疣微菌纲(Verrucomicrobiae)、黄杆菌纲(Flavobacteriia)、芽胞杆菌纲(Bacilli)、噬几丁质杆菌纲(Chitinophagia)、梭菌纲 (Clostridia)、拟杆菌纲(Bacteroidia)、γ-变形菌纲(Gammaproteobacteria)。普遍认为,16S rDNA 序列同源性大于99%,可以认为属于同一种;大于95%可认为同一属[11]。从比对结果可知,5 组鲍鱼样品的菌群与12 个菌属较为相似,分别为:红色杆菌属(Rubritalea)、金黄杆菌属 (Chryseobacterium)、稳杆菌属(Empedobacter)、葡萄球菌属(Staphylococcus)、栖水菌属(Hydrobacter)、瘤胃梭菌属(Ruminiclostridium)、普雷沃菌属(Prevotella)、埃希氏菌属(Escherichia)、芽孢杆菌属 (Bacillus)、寡养单胞菌属(Stenotrophomonas)、沙雷氏菌属(Serratia)及黄杆菌属(Flavobacterium)等。根据条带亮度可判断不同处理鲍鱼样品优势菌略有不同,鲍鱼内脏优势菌有:埃希氏菌、普雷沃菌、沙雷氏菌、稳杆菌等。鲍鱼腹足优势菌有:红色杆菌、埃希氏菌、普雷沃菌、稳杆菌、沙雷氏菌等。而到了熟制鲍鱼优势菌变为埃希氏菌、稳杆菌、寡养单胞菌、沙雷氏菌等。成品即食鲍鱼的优势菌有:埃希氏菌、稳杆菌、寡养单胞菌、沙雷氏菌等。腐败的鲍鱼中存在的优势菌为芽孢杆菌、稳杆菌、埃希氏菌、沙雷氏菌等,尤其检出大量蜡样芽孢杆菌。5 组鲍鱼样品的共同优势菌有埃希氏菌、稳杆菌、沙雷氏菌。而腐败鲍鱼中检出大量的芽孢杆菌在即食鲍鱼前期处理阶段并非优势菌。
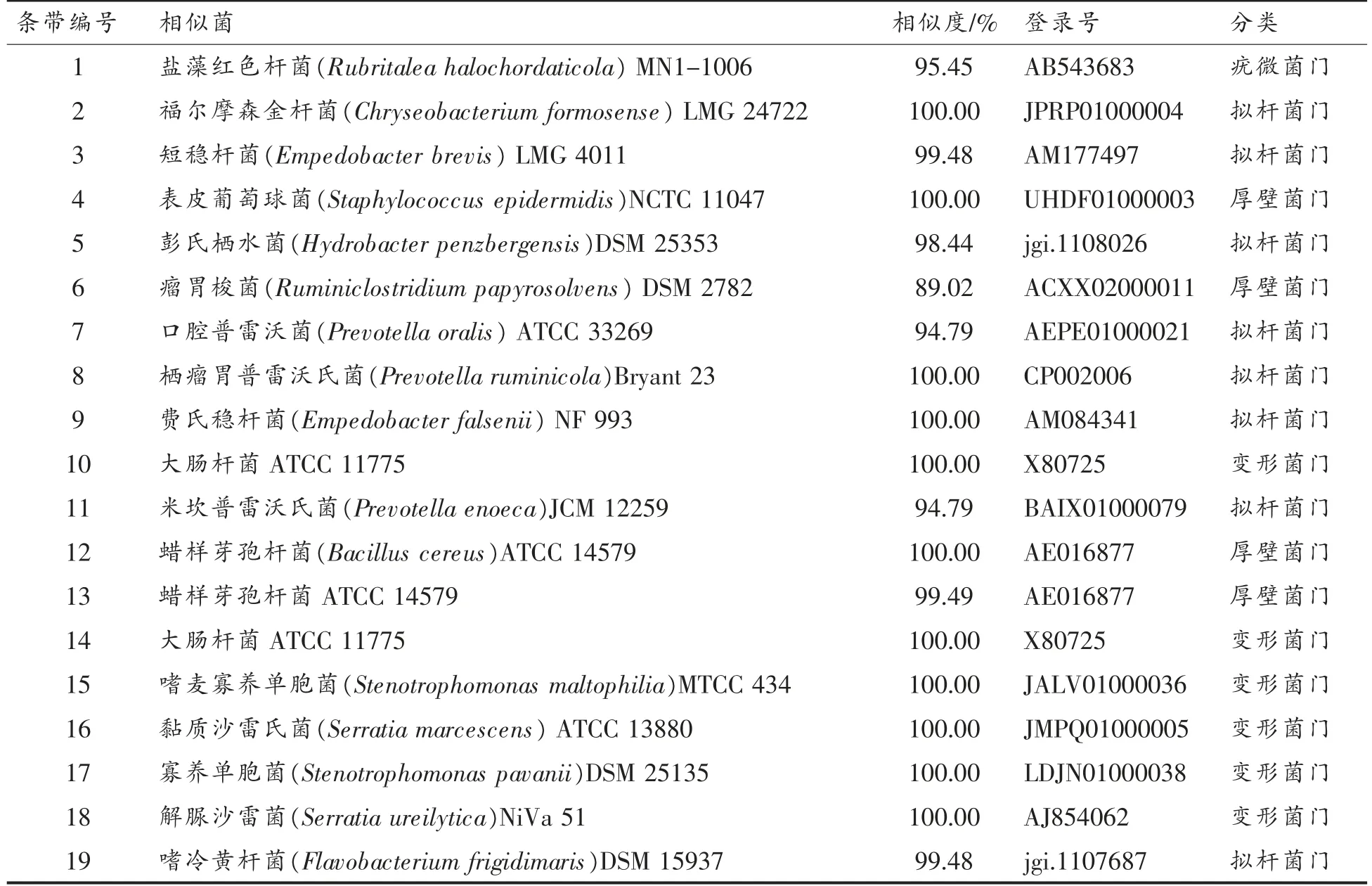
表2 DGGE 凝胶条带回收序列分析结果Table 2 Sequence analysis results of DGGE gel bands
红色杆菌是革兰氏阴性、兼性厌氧菌,存在于深海水产品中[12],金黄杆菌为革兰氏阴性、非发酵菌,多数为吲哚产生菌[13]。稳杆菌为非发酵菌黄杆菌属,是革兰氏阴性、无芽胞杆菌,常存在于水、土壤和植物中[14],也存在于食品、乳制品和蔬菜中[15]。有报道称短稳杆菌存在于北豆腐中可致其腐败变质[16]。葡萄球菌为革兰氏阳性球菌,多数为非致病菌,有些也会引起部分海产品感染病变。如Ali等[17]从白鲷肌肉,尾巴,眼睛和心脏血液的病变样本中回收了15 种表皮葡萄球菌。栖水菌为兼性厌氧发酵型革兰氏阴性杆菌下的弧菌科。Eder 等[18]曾从纯净水中分离出彭氏栖水菌(Hydrobacter penzbergensis gen.nov.),氧化酶和过氧化氢酶阳性细菌。普雷沃菌是常见无芽孢革兰氏阴性厌氧杆菌,最常见的产黑普雷沃氏菌(Prevotella melaninogenica)是引起口腔化脓性疾病重要的病原体[19]。埃希氏菌是易引发人类感染的重要病原菌之一,大肠埃希氏菌(Escherichia)是水产品加工过程常见的腐败菌及致病菌[20],该菌不仅可通过粪便污染周围环境,还可通过海鲜加工中废水或下脚料等来污染食品。尤其是在加工后期,净化级别不够的加工环境可能引起大肠杆菌的污染,需要引起重视。Prakasan 等[21]曾从18 种鱼类和21 种贝类样品中分离出368 株大肠杆菌。Roschanski等[22]从德国零售蛤和虾中分离出45 株肠杆菌科细菌。芽孢杆菌为革兰氏阳性菌,是加工水产品常见的残留菌之一,在腐败的鲍鱼中检出大量蜡样芽孢杆菌,这可能是因为芽孢杆菌具有耐高温、耐盐等特性,杀菌不彻底导致其在成品即食鲍鱼中残留。Osimani 等[23]分析发现煮熟、干燥和腌制的即食昆虫食品中主要由产孢子的芽孢杆菌和梭状芽胞杆菌为主。Rahmati 等[24]在347 个零售的新鲜和加工过的海鲜样品中检测出蜡状芽孢杆菌,它是引起海鲜制品食源性疾病的重要菌株(特别是产生肠毒素的基因型)。高鹏等[25]研究发现引起肘花胀袋的微生物是芽孢杆菌 (Bacillus subtilis,Bacillus licheniformis)和寡养单胞菌(Stenotrophomonas maltophilia,Stenotrophomonas pavanii)。寡养单胞菌属革兰氏阴性细菌,嗜冷微生物,广泛存在于水、土壤和动物体内,为条件致病菌及腐败菌,会引起一些冷藏食品变质[26]。沙雷氏菌是革兰氏阴性、兼性厌氧,其模式菌株-黏质沙雷氏菌会产生红色色素。它们的新陈代谢具有发酵作用,在腐烂的动植物材料上具有腐生性[27]。Wang 等[28]研究表明黏质沙雷氏菌容易引起冷藏鸡肉变质腐败。黄杆菌属是革兰氏阴性杆状细菌,在土壤和淡水中都发现了黄杆菌,已知个别菌种会引起淡水鱼疾病[29]。
2.4 鲍鱼优势条带序列的系统发育分析
将测序所得16S rDNA 序列与核酸序列数据库中已知序列进行比对,选取相似性高的菌株,利用MEGA 7.0 构建不同处理阶段鲍鱼样品的菌株系统发育树,显示它们在系统发育过程中的亲缘关系。由图4可知,19 个条带检出的相似细菌分布在4 个菌门和12 个菌属。条带2,3,5,7,8,9,11 和19 在亲缘关系上较近,聚为一大支,即为拟杆菌门。条带10,14,15,16,17 和18 聚为一支,表示具有较近的亲缘关系,即为变形菌门。条带4,6,12,13 在亲缘关系上较近,聚为一支,即为厚壁菌门。条带1 与其它菌在亲缘关系较远,单独为一支,即为疣微菌门,其仅存在于鲜鲍鱼中,在即食鲍鱼加工中后期未再出现。12 个菌属分别为:普雷沃菌属(条带7,8,11)、栖水菌属(条带5)、黄杆菌属(条带19)、金黄杆菌属(条带2)、稳杆菌属(条带3 和9),寡养单胞菌属(条带15 和17),沙雷氏菌属(条带16 和18),埃希氏菌属(条带10和14),红色杆菌属(条带1),瘤胃梭菌属(条带6),葡萄球菌属(条带4),芽孢杆菌属(条带12 和13)。厚壁菌门(条带4,6,12,13)与其它菌亲缘关系较远,其在熟制鲍鱼、成品鲍鱼和腐败鲍鱼样品中均有出现,说明从鲍鱼加工后期带入的可能性极大。
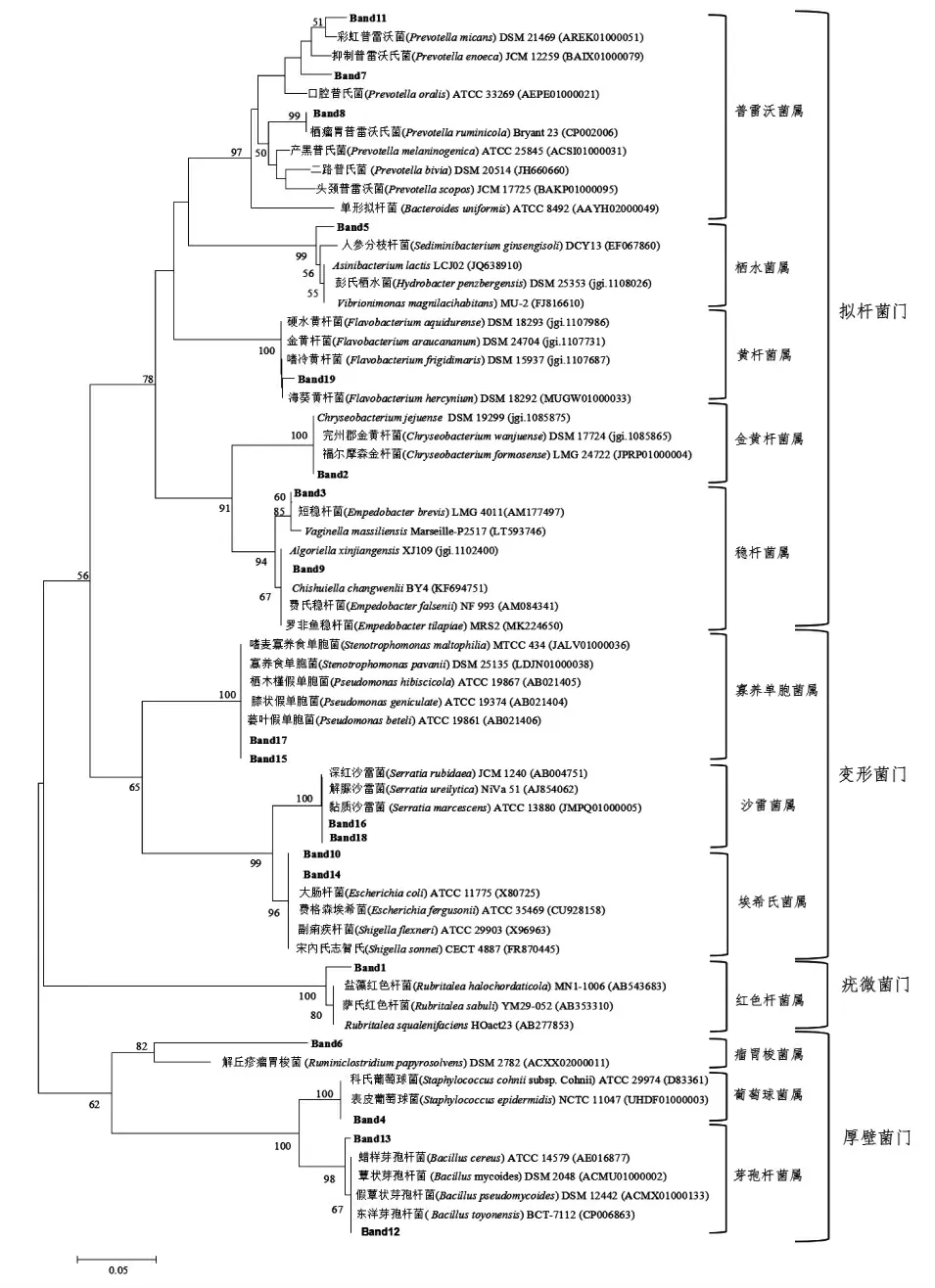
图4 细菌菌株的系统发育树Fig.4 Phylogenetic tree of bacterial strains
3 结论
本研究采用PCR-DGGE 法对不同处理阶段鲍鱼样品的残留细菌菌群进行了分析,发现不同加工过程鲍鱼细菌种类较为丰富,19 个条带中与4 个菌门相似度较高,分别是疣微杆菌门,拟杆菌门、厚壁菌门、变形菌门。与12 个菌属较为相似,分别为:普雷沃菌属、栖水菌属、黄杆菌属、金黄杆菌属、稳杆菌属,寡养单胞菌属,沙雷氏菌属,埃希氏菌属,红色杆菌属,瘤胃梭菌属,葡萄球菌属和芽孢杆菌属。
不同处理鲍鱼样品优势菌株略有不同,但5组鲍鱼样品的共同优势菌有埃希氏菌、稳杆菌、沙雷氏菌。在腐败鲍鱼中检出大量的蜡样芽孢杆菌,具有较高的耐受性。因此,建议鲍鱼加工过程中应严格控制加工后期冷却及包装环境,密切关注设备及环境卫生的控制,降低芽孢杆菌、埃希氏菌、稳杆菌、沙雷氏菌等腐败菌对即食鲍鱼的加工、运输、保藏过程所造成的安全危害。
志谢:本论文在系统发育树的构建上得到泉州师范学院黄兆斌副教授的指导,在此表示感谢!
