黑菊芋对小鼠肠道菌群及其短链脂肪酸产生的影响
2021-09-09姬妍茹张正海杨庆丽滕春波魏连会
姬妍茹,张正海,杨庆丽,滕春波,董 艳,石 杰,刘 玉,魏连会
(1 黑龙江省科学院大庆分院 黑龙江大庆 163319 2 东北林业大学生命科学学院 哈尔滨 150040)
鲜菊芋(Jerusalem artichoke),又称洋姜,属菊科多年生草本植物,原产于北美温带地区,现今在我国西北地区广泛种植[1]。菊芋块茎中富含菊粉,约占其干重的80%,由2~70 个果糖聚合而成,具有促进机体矿物质吸收,降低胆固醇,调节免疫功能,对抗肥胖等生理功能[2-3]。作为一种具有益生元特性的膳食纤维,果聚糖的聚合度对菊粉的益生功能起决定性的作用,聚合度越小,活性越高[4]。一方面,低聚果糖通过刺激肠道双歧杆菌等有益菌生长,有助于抑制肠道感染,维持肠道菌群健康[5]。另一方面,在结肠内,低聚果糖经细菌发酵,产生的短链脂肪酸可以增加粪便含水量及膨胀能力,促进肠道蠕动,提高肠动力[6]。
鲜菊芋口感较差且不耐贮存,多用于腌制酱菜,而黑菊芋是以鲜菊芋为原料,在高温、高湿条件下经自然发酵制作的新型功能食品,拥有独特的味道和口感,深受众多品尝者的欢迎[7-8]。研究发现,菊芋经热加工后,总酚、酚酸、有机酸、脂肪酸和糖的种类和含量发生变化,其中尤以糖类的变化最为明显[8-9],果聚糖聚合度显著降低。研究发现,膳食补充黑菊芋后,小鼠肠道α-葡萄糖苷酶活性得到提高[10],然而其对益生活性的影响尚需探讨。
本研究以KM 小鼠为研究对象,基于16S rDNA 高通量测序技术,分析黑菊芋对小鼠肠道菌群的影响并采用气相色谱-质谱技术检测小鼠盲肠内容物中短链脂肪酸含量,探究黑菊芋的益生活性,为进一步开发和利用黑菊芋提供新的数据支持。
1 材料与方法
1.1 材料与试剂
鲜菊芋,“庆芋2 号”品种,由黑龙江省农科院大庆分院提供;黑菊芋,以“庆芋2 号”为原料,采用变温熟成技术制备,具体方法参考文献[8]。
低聚果糖(FOS),山东保龄宝生物股份有限公司;粪便基因组提取试剂盒,德国凯杰(QIAGEN)公司;乙酸、丙酸、异丁酸、丁酸、异戊酸和正戊酸标准品,德国Dr.Ehrenstorfer 公司;其它试剂均为国产分析纯级。
1.2 实验动物及饲养环境
SPF 级雌性KM 小鼠,购于长春市亿斯实验动物技术有限责任公司【生产许可证:SCXK(吉)-2018-0007】,体质量(20±2)g。小鼠饲养于东北林业大学生命科学学院动物实验室,环境条件为温度(25±2)℃、湿度(50±5)%、12 h 光照和12 h 黑夜的环境中,自由取食、进水。
1.3 仪器与设备
黑菊芋熟成加工设备,黑龙江省科学院大庆分院自主研发;P-100S 超声清洗机,深圳市洁盟清洗设备有限公司;VFD-4500 型冷冻干燥机,北京博医康实验仪器有限公司;MiSeq 高通量测序系统,美国Illumina 公司;CT15RT 型离心机,上海天美科技有限公司;ISQ 系列LT 单四极杆气质联用仪,美国赛默飞世尔科技公司。
1.4 试验方法
1.4.1 黑菊芋提取液的制备 黑菊芋[11]切片,称取0.1 kg,加入0.5 L 蒸馏水浸泡16 h,匀浆后超声30 min,过滤并冻干,蒸馏水调整至所需给药浓度,4 ℃冰箱保存备用。
1.4.2 小鼠肠道菌群试验 随机将50 只健康KM雌性小鼠分为5 组,即空白对照组(无菌生理盐水,CK)、阳性对照组 (0.83 g/kg bw 低聚果糖,FOS)、黑菊芋低剂量组(0.05 g 黑菊芋,BL)、黑菊芋中剂量组(0.1 g 黑菊芋,BM)、黑菊芋高剂量组(0.2 g 黑菊芋,BH),灌胃剂量为0.2 mL/10 g bw,试验期为15 d,分别于第1 天和第15 天称量小鼠体质量。第14 天,停止饲喂10 h,再给予相应日粮,解剖小鼠后切取盲肠于无菌离心管中,置于液氮中保存,用于粪便菌群分析和短链脂肪酸(SCFA)含量的检测[12]。
1.4.3 16 S rDNA 文库构建与高通量测序 根据粪便基因组提取试剂盒说明书提取小鼠粪便中微生物总DNA。采用末端连接测序接头的细菌通用引物对V3~V4 区进行PCR 扩增和纯化,构建测序文库。测序试验由北京百迈客生物科技有限公司完成,并根据97%的序列相似度使用QIIME 工具包进行分类操作单元(Operational taxonomic units,OTUs)分类。
1.4.4 小鼠粪便短链脂肪酸含量的测定 取0.3 g 样品加入2.0 mL 磷酸水溶液(V磷酸∶V水=1∶3),涡旋振荡2 min,加入1.0 mL 乙醚萃取10 min,以4 000 r/min 在0 ℃条件下离心20 min。重复萃取1 次,合并上清液,浓缩至1.0 mL 以内,用0.22 μm 微孔膜过滤后进样分析。气相质谱分析采用TG WAXMS(30 m×0.25 mm×0.25 μm)毛细管柱;色谱柱温度设定程度:初始柱温100 ℃,持续5 min,再以5 ℃/min 升至150 ℃,随后以30 ℃/min的速率升至240 ℃,持续30 min;载气:99.99%高纯氦气;载气流量:1.0 mL/min;进样口温度:240℃;进样方式:分流进样;分流比:75∶1;进样量:10 μL;电子轰击离子源(EI)能量:70 eV;单离子扫描模式:定量离子60,73;离子源温度:200 ℃;传输线温度:250 ℃。

图1 短链脂肪酸混合标准品气相色谱-质谱总离子流图Fig.1 GC-MS total ion current chromatogram of mixed standard of short-chain fatty acid
1.4.5 统计学分析 试验结果采用Graphpad Prism 7.0 软件处理并绘制,One-way ANOVA 进行单因素方差分析,并进行Turkey 事后检验,P<0.05 时认为具有显著性差异,P<0.01 时认为具有极显著性差异。

表1 6 种短链脂肪酸标品的标准曲线Table 1 The standard curves of six short-chain fatty acid
2 结果与分析
2.1 灌胃黑菊芋对KM 小鼠体质量的影响
如图2所示,各组小鼠体质量在15 d 后均有所增加,FOS 组体质量增加最多 (5.630 g),CK 组最低(4.063 g),BL 组和BM 组与CK 组差异不显著,但极显著低于FOS 组(P<0.01);BH 组极显著高于CK 组(P<0.01),但与FOS 组差异不显著(P>0.05),表明黑菊芋对小鼠的正常生长无不良影响。
2.2 序列长度分布
通过Illumina Miseq 测序统计数据处理各阶段样品序列数目,评估数据质量。如图2所示,经质控过滤后,优化序列平均长度为420.33 bp,可覆盖细菌16S rDNA V3~V4 区序列全长。
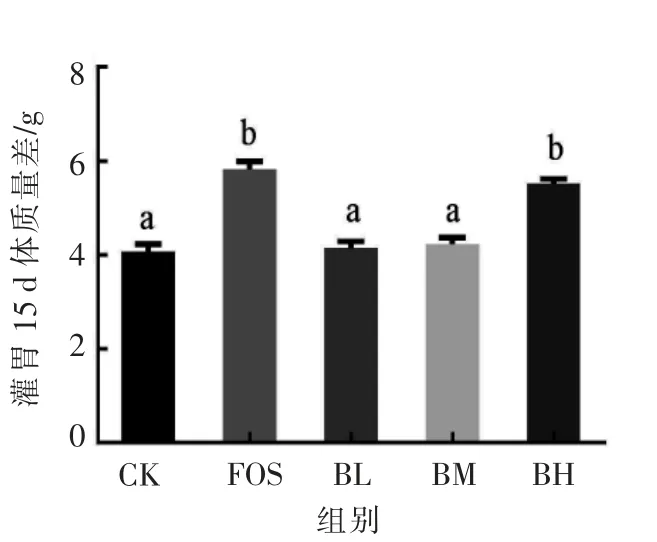
图2 灌胃前、后各组小鼠体质量差Fig.2 Changes in body weight of mice before and after intragastric administration
2.3 OTU 划分和分类地位鉴定
采用QIIME[12](Version 1.8.0)软件,统计各样本OUT 数量,分析肠道微生物组成。筛选除去原始OTU 聚类结果中极低丰度的OTU(丰度小于0.005%),共获得335 个OUT,包括1 界、10 门、14纲、19 目、32 科、79 属、80 种。
2.4 α 多样性分析及曲线绘制

图3 高质量序列长度分布图Fig.3 High quality distribution of sequence length
利用Mothur (Version v.1.30.)软件对样本α多样性进行评估,并绘制稀释性曲线(Rarefaction curve),香农指数曲线(Shannon Index)和等级丰度曲线(Rank Abundance Curve)。如图4所示,各组稀释性曲线均趋于平缓,说明更多的测序数据量只可能产生少量的新物种;OUT 等级丰度曲线有足够的宽度和平坦度,说明物种的组成丰富,均匀程度高;香农指数曲线随着测序深度的增加已经基本达到饱和,可见当前测序深度足够大,OUT可以反映样本中绝大多数的微生物物种信息。

图4 α 多样性指数曲线Fig.4 Alpha diversity index curves
2.5 β 多样性分析
利用距离热图,对样本间物种群落多样性差异程度进行量化分析。如图5所示,CK 组样本与其它组样本距离较远,说明经黑菊芋和FOS 干预后,确实改变了小鼠肠道微生物的群落结构。
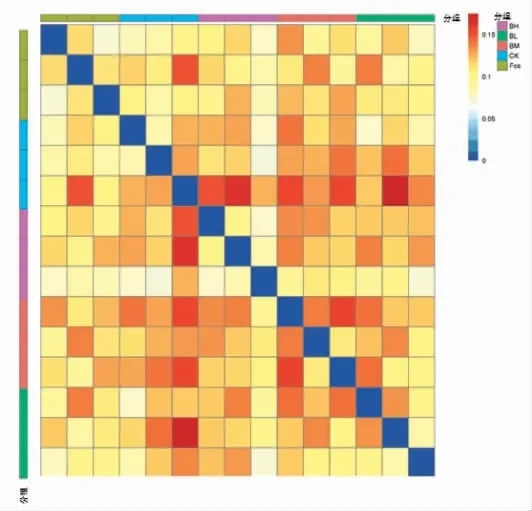
图5 样品间距离热图Fig.5 Heatmap of the distance between samples
2.6 黑菊芋对小鼠肠道菌群组成的影响
图6直观呈现出各样本中微生物在门和属水平的相对丰度。门水平上,各组小鼠肠道菌群构成主要包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、脱铁杆菌门(Deferribacteres)、变形菌门(Proteobacteria)和髌骨细菌门(Patescibacteria)菌等,其中厚壁菌门和拟杆菌门占比超过80%,为优势菌群。与CK 组相比,BL 和BH 组菌群表现为厚壁菌门丰度下降,拟杆菌门丰度上升。有研究表明,肥胖与体内厚壁菌门丰度升高和拟杆菌门丰度下降密切相关[13],拟杆菌门拥有更广泛的多糖降解酶和碳水化合物代谢通路,因此适量食用黑菊芋可能会有助于控制小鼠体脂含量。
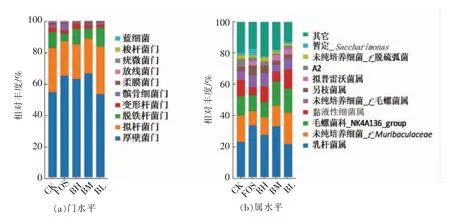
图6 物种分布柱形图Fig.6 Column diagram of species distribution
黑菊芋干预组的脱铁杆菌门菌群丰度高于CK 组,Li 等[14]发现与正常小鼠相比,肠癌模型组小鼠的脱铁杆菌丰度由1.9%降至0.9%,党参治疗后恢复到1.2%,这种趋势提示黑菊芋可能通过提高脱铁杆菌的丰度降低肠癌的发生。黑菊芋干预组和FOS 组的髌骨细菌门菌群数量均显著低于CK 组,而且呈现随灌胃剂量增加,菌群数量减少的趋势。髌骨细菌门的细菌在缺氧环境中被发现,目前在实验室中尚未实现离体培养,研究人员认为髌骨细菌门的细菌属于新的超级类群,该类群包含小基因组菌总门,Parcubacteria 和纤细菌门[15],对髌骨细菌门细菌的基因组进行系统发育分析,发现其基因组通常小于1 Mb,代谢能力严重下降,无潜在的附着和黏附蛋白,缺乏生物合成能力和DNA 修复能力说明髌骨细菌门的细菌是其它生物体的外共生生物或寄生生物[16],迄今为止鲜有在小鼠体内发现髌骨细菌门的细菌以及关于髌骨细菌门的细菌对小鼠肠道功能影响的相关报道。黑菊芋干预组的放线菌门菌群丰度呈现随灌胃剂量增加而增加的趋势,然而均低于CK 组,而FOS 组则高于CK 组。变形菌门中包含大肠杆菌、沙门氏菌、铜绿假单胞杆菌、胃幽门螺旋杆菌等多类致病菌,与CK 组相比,BM 和BH 组的变形菌门含量略有升高,具体原因有待进一步研究。
在属水平上,以乳酸菌属(Lactobacillus),拟杆菌科的未纯培养菌f Muribaculaceae 属、毛螺菌科的NK4A136 group 属、黏液性细菌属(Mucispirillum)等为肠道优势菌群。除BM 组外,各组的乳酸菌数量均少于CK 组,正常情况下,FOS 有促进乳酸菌增殖的作用,而本研究中结果刚好相反,具体原因尚不明确。Muribaculaceae 以往也被称作S24-7,具有促进肠道代谢的功能,在相关研究中被发现以有益菌状态存在[16-17]或与肠道黏膜免疫系统相关[18]。除BH 组外,黑菊芋干预组小鼠肠道中毛螺菌丰度明显高于CK 组(P<0.05)。毛螺菌科的NK4A136 group 属于厚壁菌门,是肠道有益菌,该门的普拉氏梭杆菌(F.prausnitzii)和人源罗氏菌(Roseburia hominis)等多数细菌可以通过产生抗炎性丁酸盐,为肠黏膜提供营养,维持肠黏膜免疫功能[19]。有研究表明黏液性细菌属可拮抗沙门氏菌毒性,从而保护小鼠免受结肠炎感染[20]。本研究中除CK 组外,各组的黏液性细菌丰度均有大幅度下降,具体原因尚待探究。
2.7 黑菊芋对小鼠盲肠中短链脂肪酸的影响
短链脂肪酸(SCFA)被称为“肠道菌群的功能性核心类群”,是连接膳食纤维和肠道菌群与肠道健康的关键代谢物,在肠道内稳态的建立和维持中起着关键作用。短链脂肪酸由肠道细菌发酵低聚果糖等膳食纤维产生,主要包括乙酸、丙酸、丁酸和戊酸等,SCFA 的含量变化间接反映出肠道微生物的活性情况[21]。
由表2可见,小鼠经黑菊芋干预后,黑菊芋干预组的乙酸含量降低(与CK 组相比),这点与肠道菌群中乳酸菌含量降低相吻合;BM 和BH 组的丙酸含量显著高于CK 组 (P<0.05 或P<0.01),然而与FOS 组差异不显著,推测黑菊芋通过调节小鼠肠道菌群中拟杆菌含量,增加了丙酸盐产生的潜力;黑菊芋干预组的正戊酸含量显著高于CK组和FOS 组(P<0.05 或P<0.01);黑菊芋干预组的正丁酸含量显著高于CK 组(P<0.01),其中BH 组的正丁酸含量还显著高于FOS 组 (P<0.01);Van den Abbeele 等[22]发现菊粉能促进益生菌增殖,降解黏蛋白并产生丁酸和丙酸等有益的代谢产物,防止促炎因子侵入,进而提高肠道屏障功能,改善宿主肠道健康。

表2 小鼠盲肠内容物短链脂肪酸含量Table 2 Contents of short chain fatty acids in mice cecum
3 结论
KM 小鼠灌胃黑菊芋后,肠道菌群结构发生改变,其中0.05~0.1 g 黑菊芋在不影响乳酸菌丰度的前提下,可以显著增加拟杆菌目未纯培养细菌f Muribaculaceae 菌和毛螺菌科NK4A136 group菌的丰度,显著降低黏液性细菌丰度;灌胃黑菊芋可以显著增加小鼠肠道中丙酸,正丁酸和正戊酸的含量,对改善小鼠的肠道健康,增强抗炎能力有所帮助。本研究为揭示黑菊芋的保健功能提供了理论依据和基础数据。
