桦褐孔菌不同多糖组分的体内、外抗氧化活性
2021-09-09王箴言张久亮
王箴言,夏 晴,王 玉,杨 扬,张久亮
(华中农业大学食品科学与技术学院 武汉 430070)
桦褐孔菌 (Inonotus obliquus),又名白桦茸、桦树茸,属担子菌亚门、层菌纲、非褐菌目、多孔菌科、褐卧孔菌属[1-2]。其外表有不规则沟痕,硬而脆,是一种生长在寒带的木腐菌[3]。它被赞誉为“西伯利亚灵芝”,是一种非常珍稀而名贵的药食两用真菌,生长在温度相对较低的俄罗斯西伯利亚地区的原始森林中,不能人工栽培,颜色呈现深栗色,常在树皮破损及伤节处形成肉瘤状菌核,菌块的形状为近球形或不定形块状。桦褐孔菌主要含有多糖类化合物、芳香物质、叶酸衍生物、多酚类化合物、甾体类化合物和三萜类化合物等多种活性成分,具有抗肿瘤、降血压、抗病毒、抗氧化、延缓衰老和防治糖尿病等多种活性[4-5]。
氧化应激是由活性氧 (Reactive oxygen species,ROS)的产生与抗氧化系统之间平衡失调引起的,这种不平衡会破坏重要的生物分子和器官,并对整个生物体造成潜在影响[6]。大部分ROS 是在线粒体呼吸链中产生的,其产生速率主要是由呼吸链复合物的电子流动速率来决定。需氧细胞中一类氧的生物还原会产生ROS,例如羟自由基 (·OH)、超氧阴离子 (O2·-)、过氧化氢(H2O2)和有机过氧化物,这些自由基的过量产生会氧化并破坏蛋白质、核酸和脂质[7]。自由基损伤可能会引发诸如炎症、免疫失调、动脉粥样硬化、恶性肿瘤、心脑血管疾病及衰老等多种疾病[8]。具有抗氧化活性的物质可以清除过量的自由基,缓解由它们引起的氧化应激损伤,预防疾病的发生。近20年来,评价和筛选具有强抗氧化活性的天然资源已成为生物学、医学和食品科学研究的新趋势[9]。
本文旨在评价桦褐孔菌不同多糖组分的体内、外抗氧化活性,筛选出最佳抗氧化组分,用于食品和制药工业,缓解机体氧化应激损伤。采用水提醇沉法制备桦褐孔菌水提物——IOP40、IOP50、IOP60、IOP70 和IOP80;通过测定其对DPPH 自由基、羟自由基和ABTS+自由基的清除率,初步评价其体外抗氧化能力;采用体内试验进一步探究桦褐孔菌不同多糖组分对自然衰老小鼠抗氧化的影响。
1 材料与方法
1.1 材料与仪器
1.1.1 样品 桦褐孔菌,购于东莞市神龟生物科技有限公司。
1.1.2 实验动物 SPF 级雄性昆明种小鼠,4 周龄小鼠(体重18~22 g)9 只,12月龄小鼠 (体重47~66 g)36 只,许可证号为SCXK(鄂)2015-0018,购自湖北省疾病预防控制中心实验动物中心。
1.1.3 试剂 抗坏血酸(VC)、DPPH、ABTS,默克生命科学 (上海)有限公司;葡萄糖、甘氨酸,上海源叶生物科技有限公司;总蛋白(TP)测定试剂盒、过氧化氢酶(CAT)测定试剂盒、总超氧化物歧化酶(SOD)测定试剂盒、总抗氧化能力(T-AOC)测定试剂盒、谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒、丙二醛(MDA)测定试剂盒、乳酸脱氢酶(LDH)测定试剂盒,南京建成生物工程研究所;其它试剂均为国产分析纯级。
1.1.4 仪器与设备 DK-98-2 恒温水浴锅,上海科尔仪器设备有限公司;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂;BTP-8ZL00X 冷冻干燥机,美国微垂丝公司;HYP-308 消化炉、KDN-102C 定氮仪,上海纤检仪器有限公司;BSA124S 分析天平,赛多利斯科学仪器(北京)有限公司;Eppendorf centrifuge 5804 高速冷冻离心机,德国艾本德股份公司;DHG-9240A 恒温培养箱,上海一恒科技有限公司;Thermo Multiskan GO 全自动酶标仪,上海赛默飞世尔科技有限公司。
1.2 方法
1.2.1 桦褐孔菌不同多糖组分的制备 桦褐孔菌子实体经机械破碎后称取100 g,分别加入20 倍、15 倍量的蒸馏水,在90 ℃下浸提2 次,每次2 h,离心、抽滤后将上清液合并,倒入旋蒸仪中减压浓缩至200 mL。向旋蒸液中加入95%乙醇,使液体中乙醇含量达到40%,4 ℃下醇沉过夜,离心取沉淀,冻干封存得IOP40。IOP50、IOP60、IOP70、IOP80 用上述方法可依次得出,并按公式(1)计算提取率。

1.2.2 多糖含量的测定 采用NY/T 1676-2008《食用菌中粗多糖含量的测定》中的方法,以葡萄糖为标准品制作标准曲线,测定提取的桦褐孔菌多糖的含量。
1.2.3 DPPH 自由基清除试验 根据文献[10-11]的方法测定桦褐孔菌多糖的DPPH 自由基清除能力,并进行了一些修改。精确配制0.12 mmol/L 的DPPH 溶液(甲醇溶),避光放置,现配现用。用蒸馏水配制质量浓度梯度为 0.0625,0.0125,0.025,0.5,1,1.5 mg/mL 的样品和VC 溶液,取不同质量浓度的待测溶液各0.1 mL 加入含有2.9 mL DPPH 溶液的试管中,37 ℃条件下避光搅拌30 min,在波长517 nm 处测定吸光度,并按公式(2)计算DPPH 自由基清除率。(每个样品质量浓度测定3 组平行,蒸馏水和VC 分别作为空白和阳性对照,下同)。

式中,A0——空白对照的吸光度值;A1——样品或阳性对照的吸光度值。
1.2.4 羟自由基清除试验 根据文献[12-13]的方法测定桦褐孔菌多糖的羟自由基清除能力,并进行了一些修改。用蒸馏水配制成0.0625,0.0125,0.025,0.5,1,2 mg/mL 的样品和VC 溶液,将1 mL待测液、1 mL 6 mmol/L 的硫酸铁水溶液、1 mL 6 mmol/L 的水杨酸-乙醇溶液和1 mL 6 mmol/L 的过氧化氢水溶液混合,摇匀,37 ℃下静置30 min,离心分离(10 000 r/min,10 min),最后得上清液混合物,在波长510 nm 处测量反应混合物的吸光度值,并按公式(3)计算羟自由基清除率。

式中,A0——空白对照的吸光度值;AX——样品或阳性对照的吸光度值;AX0——待测液和无过氧化氢水溶液(蒸馏水代之)的吸光度值。
1.2.5 ABTS+自由基清除试验 根据文献[14-15]的方法测定桦褐孔菌多糖的ABTS+自由基清除能力,并进行了一些修改。取25 mL 2.45 mmol/L 的过硫酸钾溶液与25 mL 7 mmol/L 的ABTS 溶液混匀,避光静置12~16 h 后用乙醇溶液稀释至吸光度为0.7±0.02(734 nm),经试验得稀释31 倍可得ABTS+工作液。用蒸馏水配制成0.0125,0.025,0.05,0.1,0.2,0.4 mg/mL 的样品和VC 溶液,将0.2 mL 待测液与2.4 mL 的ABTS+工作液振摇混匀,避光静置10 min,于波长734 nm 处测定吸光度值,并按公式(4)计算ABTS+自由基清除率。

式中,A0——表示空白对照的吸光度值;A1——样品或阳性对照的吸光度值;A2——待测液与无ABTS+工作液(蒸馏水代之)的吸光度值。
1.2.6 实验动物分组与饲养 老龄鼠饲养环境温度为(25±1)℃,自然昼夜,自由进食、进水,适应性喂养7 d 后按其体重随机分成4 组:衰老模型组、水提物组、IOP40 组、IOP50 组,每组9 只;另取9只4 周龄雄性昆明小鼠作为少龄对照组,饲养条件同上。实验过程中,小鼠自由进食、进水,其中少龄对照组和衰老模型组每天灌胃生理盐水,灌胃量为0.1 mL/10 g;3 个给药组每天灌胃等体积对应的样品,灌胃浓度均为200 mg/kg·bw,连续喂养28 d,记录各组小鼠的每日体重。
1.2.7 测定指标 28 d 后,对全部小鼠断食不断水12 h,眼眶取血,在4 ℃下3 000 r/min 离心10 min 后取血清,-20 ℃保存待用,按照试剂盒的操作测定T-AOC、LDH、GSH-PX、MDA 指标。
断颈处死小鼠,解剖肝脏、肾脏、脾脏和胸腺,-20 ℃保存待用,并按公式(5)计算脏器指数。

准确称取肝脏质量,按m肝脏∶V生理盐水=1∶9 比例加入生理盐水,冰水浴条件下,制备成10%的肝匀浆,2 500 r/min 离心10 min,取上清,-20 ℃保存待用,按照试剂盒的操作测定TP、T-AOC、CAT、SOD、GSH-PX、MDA 指标。
1.2.8 数据分析 采用Microsoft Excel 2010、IBM SPSS Statistics 21.0、GraphPad Prism 7 软件处理试验结果,单因素方差分析(ANOVA)检验后进行Duncan 检验,进行组间统计学显著性差异分析,所有数据以x±s 表示,P<0.05 表示有显著性差异。
2 结果与分析
2.1 桦褐孔菌多糖提取率及含量测定
如图1所示,葡萄糖标准曲线的回归方程为Y=6.2747X-0.003,相关系数R2=0.9979,根据标准曲线计算桦褐孔菌各提取物中的多糖含量。
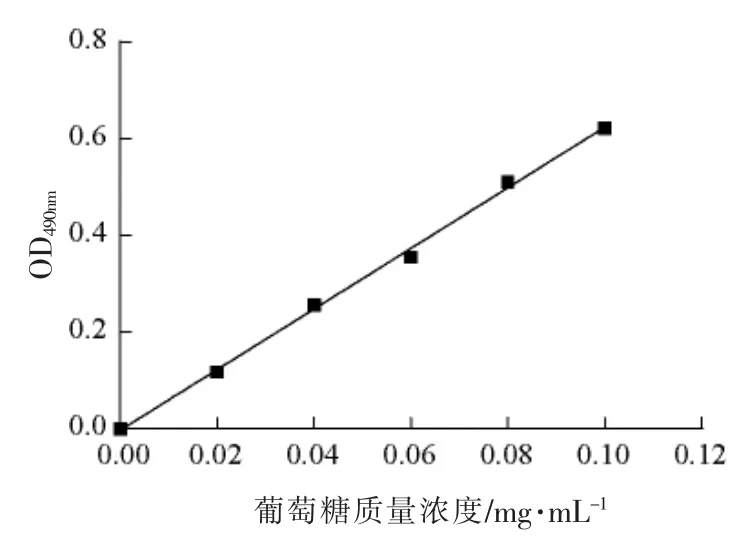
图1 葡萄糖标准曲线Fig.1 The standard curve of glucose
通过水提醇沉法从桦褐孔菌中获得了水提物和5 个多糖组分——IOP40、IOP50、IOP60、IOP70和IOP80,其提取率分别为(13.91±0.01)%、(0.23±0.02)%、(0.10±0.01)%、(0.55±0.01)%、(3.42±0.02)%和(7.49±0.01)%。由表1可知,桦褐孔菌不同多糖组分中,多糖含量由高到低IOP50>水提物>IOP60>IOP40>IOP80>IOP70,其中IOP50 的多糖含量最高,可达(21.10±0.06)%,IOP70 的多糖含量最低为(9.18±0.01)%。

表1 桦褐孔菌多糖提取率及含量Table 1 Extraction rate and content of polysaccharide from Inonotus obliquus
2.2 体外抗氧化试验
2.2.1 DPPH 自由基清除试验 DPPH 自由基是一种稳定的脂质自由基,当有自由基清除剂存在时,紫色逐渐褪变为稳定的黄色,其褪色程度与接受的电子数量成定量关系[16]。如图2所示,在0.0625~1.5 mg/mL 的质量浓度范围,所有样品对DPPH 自由基的清除能力都随着质量浓度的升高而上升,但均低于VC。由表2可知,水提物、IOP40、IOP50、IOP60、IOP70、IOP80 和VC 的IC50值分别为1.014,0.916,0.837,0.948,4.339,2.273 mg/mL 和0.129 mg/mL,即DPPH 自由基清除能力大小为IOP50>IOP40>IOP60>水提物>IOP80>IOP70,可以看出IOP40 和IOP50 的抗氧化效果较好。
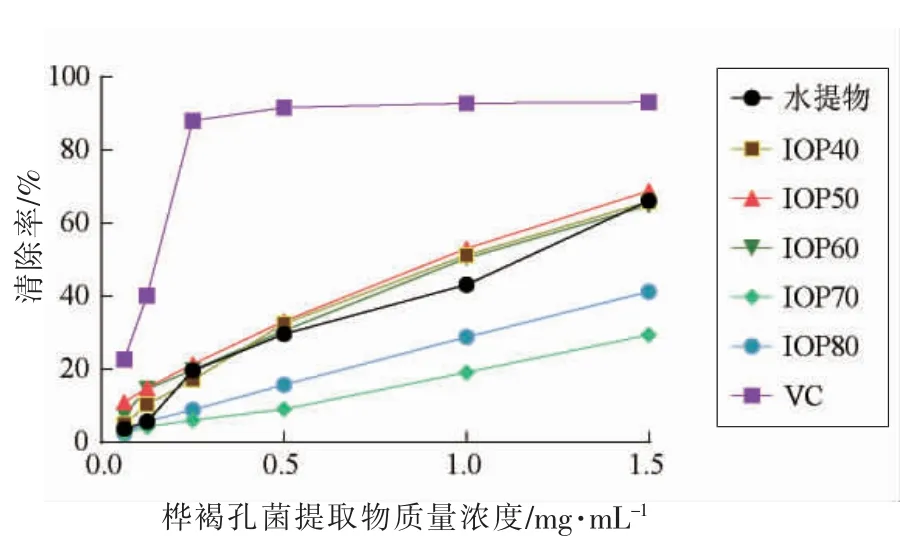
图2 桦褐孔菌提取物DPPH·清除能力Fig.2 DPPH· clearing ability of Inonotus obliquus extract
2.2.2 羟自由基清除试验 羟自由基是ROS 中反应性最强的一种自由基,可能直接或间接造成组织损伤,诱发包括癌症在内的多种人类疾病并促进衰老[17]。如图3所示,在0.0625~2.0 mg/mL 的质量浓度范围,所有样品对羟自由基的清除能力都随着质量浓度的升高而上升,但均低于VC。由表2可知,水提物、5 个IOP 和VC 的IC50值分别为 1.035,0.660,0.837,0.870,1.677,2.709 mg/mL和0.139 mg/mL,即羟自由基的抗氧化活性为IOP40>IOP50>IOP60>水提物>IOP70>IOP80,说明IOP40 和IOP50 的抗氧化效果较好。
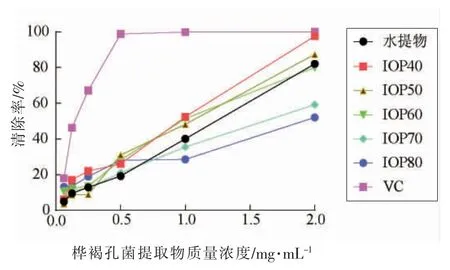
图3 桦褐孔菌提取物·OH 清除能力Fig.3 ·OH clearing ability of Inonotus obliquus extract
2.2.3 ABTS+自由基清除试验 ABTS 法由于操作简便、结果重复性较好,因此被广泛用于生物活性物质体外抗氧化能力的评价[18]。如图9所示,在0.0125~0.4 mg/mL 质量浓度范围,所有样品对ABTS+自由基的清除能力都随着质量浓度的升高而上升,但均低于VC。由表2可知,水提物、5 个IOP 和VC 的IC50值分别为1.014,0.091,0.108,0.113,0.239,0.220 mg/mL 和0.129 mg/mL,即ABTS+自由基清除能力为IOP40>IOP50>IOP60>IOP80>IOP70>水提物,说明IOP40 和IOP50 的抗氧化效果较好。
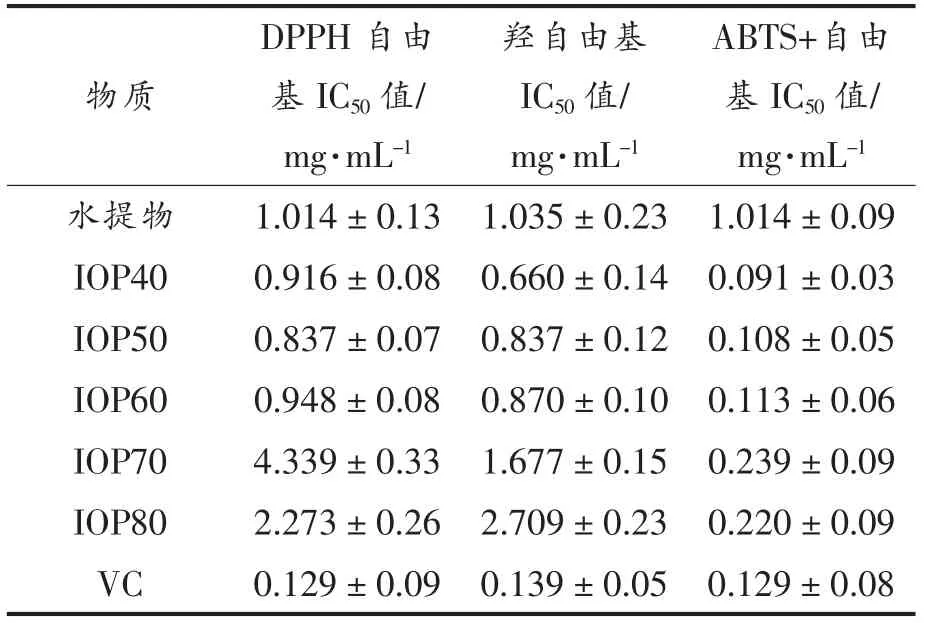
表2 自由基清除试验中桦褐孔菌提取物和VC 的IC50 值Table 2 IC50 values of Inonotus obliquus extract and VC in antioxidant properties
2.3 体内抗氧化试验
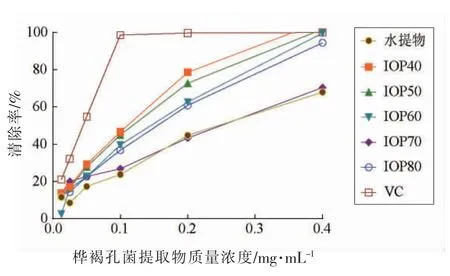
图4 桦褐孔菌提取物ABTS+自由基清除能力Fig.4 ABTS+· clearing ability of Inonotus obliquus extract
2.3.1 桦褐孔菌提取物对老龄鼠体质量和脏器指数的影响 小鼠体质量会随着年龄增长而增加,由表3可知,老龄鼠体质量显著高于少龄小鼠组体质量(P<0.05),而给药组与衰老模型组小鼠的体质量差异不明显(P>0.05),说明桦褐孔菌提取物对老龄鼠的体质量没太大影响。肝脏是最大的内分泌器官,参与食物消化和排毒,同时产生大量的自由基;肾脏是维持机体自由基平衡的重要器官[19];胸腺和脾脏是主要的免疫器官,能反映衰老过程中的氧化损伤水平[20]。随年龄增长,小鼠体内器官逐渐衰竭,功能活性呈下降趋势。如表3所示,衰老模型组小鼠的脏器指数均降低,其中肝脏、肾脏和胸腺指数显著降低(P<0.05);与衰老模型组比,给药组的肝脏、肾脏、脾脏和胸腺指数均呈上升趋势,但无显著性差异(P>0.05),说明桦褐孔菌提取物可以延缓老龄鼠体内脏器的萎缩,通过提高小鼠的脾脏和胸腺指数,进而增强小鼠的免疫力。

表3 桦褐孔菌提取物对老龄鼠体重及脏器指数的影响Table 3 Effects of Inonotus obliquus extract on body weight and organ index of naturally aged mice
2.3.2 桦褐孔菌提取物对老龄鼠肝脏抗氧化性的影响 抗氧化酶系统对维持生物体内ROS 的平衡具有非常重要的作用,可以有效保护细胞免受氧化损伤[21]。SOD 能促使超氧化物自由基发生歧化反应,保护细胞免受自由基攻击[22];MDA 含量通常表征脂质过氧化程度[23];GSH-PX 可以清除由水平氧等诱发的脂质过氧化物,其主要生物学作用是保护机体免受氧化损伤[24];CAT 是生物体中最常见的一种酶,其对过氧化氢的周转率较高[25]。由表4可知,与少龄对照组比,衰老模型组小鼠肝脏中的T-AOC、SOD、CAT 活性明显降低 (P<0.05),MDA 含量明显升高,说明随着年龄增长,小鼠脏器功能活性减弱。与衰老模型组比,水提物组小鼠的T-AOC 和CAT 的活性显著升高,MDA 含量显著降低(P<0.05);IOP40 和IOP50 两组小鼠的TAOC、SOD、CAT 和GSH-PX 的活性较衰老模型组显著升高,MDA 含量显著降低(P<0.05);IOP50 组小鼠各抗氧化指标均优于IOP40,其中T-AOC 和SOD 水平更为显著(P<0.05),说明桦褐孔菌提取物可以提高老龄鼠抗氧化能力,起到延缓衰老的作用,IOP50 作用更明显。

表4 桦褐孔菌提取物对老龄鼠肝脏抗氧化性的影响Table 4 Effects of Inonotus obliquus extract on the antioxidant capacity of liver in naturally aged mice
2.3.3 桦褐孔菌多糖对老龄鼠血清抗氧化性的影响 由表5可知,与少龄对照组比,衰老模型组小鼠血清中的T-AOC、GSH-PX 活性明显降低 (P<0.05),MDA 含量和LDH 活性明显升高,说明随着年龄增长,小鼠机体抗氧化能力减弱。与衰老模型组比,给药组小鼠肝脏中的LDH 活性显著降低(P<0.05),GSH-PX 的活性显著升高,说明桦褐孔菌提取物可以有效提高老龄鼠体内的GSH-PX 活性,降低LDH 活性,从而发挥体内抗氧化水平;与衰老模型组比,IOP40 组和IOP50 组小鼠肝脏中的T-AOC 活性显著升高 (P<0.05),MDA 含量显著下降,说明IOP40 和IOP50 较水提物更能提高老龄鼠抗氧化能力,起到延缓衰老的作用。

表5 桦褐孔菌提取物对老龄鼠血清抗氧化性的影响Table 5 Effect of Inonotus obliquus extract on the antioxidant activity of serum in naturally aged mice
3 结论
采用NY/T 1676-2008《食用菌中粗多糖含量的测定》 中的方法测得桦褐孔菌各提取物中多糖含量由高到低为IOP50>水提物>IOP60>IOP40>IOP80>IOP70。体外试验结果表明,桦褐孔菌水提物及不同多糖组分的DPPH 自由基、羟自由基、ABTS+自由基清除能力随质量浓度增加而升高,且根据IC50值可看出IOP40 和IOP50 的抗氧化能力更佳。体内抗氧化试验数据显示,桦褐孔菌多糖可延缓老龄小鼠肝脏和肾脏的萎缩、提高小鼠的胸腺指数、提高小鼠肝脏组织中T-AOC、SOD、CAT和GSH-PX 活性、降低肝脏组织中MDA 含量、提高小鼠血清中T-AOC 和GSH-PX 活性、降低血清中MDA 和LDH 的水平,其中IOP50 较IOP40 和水提物抗氧化活性更强。本研究可为桦褐孔菌多糖在抗氧化方面的开发与利用提供一定的理论基础,除此之外,IOP50 的化学特性与抗氧化的关系将成为下一步研究的内容。
