低剂量、亚慢性下黄曲霉毒素B1和微囊藻毒素LR诱导雄性野生型C57BL/6小鼠肝损伤/肝癌联合效应研究
2021-09-09孙秀兰王加生
李 耘,孙秀兰,王加生*
(1 江南大学食品学院 江苏无锡 214122 2 中国农业科学院农业质量标准与检测技术研究所 北京 100081 3 江南大学食品科学与技术国家重点实验室 江苏无锡 214122)
肝癌(Hepatocellular carcinoma,HCC)是威胁全球公众健康最严重的恶性肿瘤之一,每年大约60 万人死于HCC[1-2]。在我国,HCC 死亡率高达14.56%[3-4]。HCC 前兆首先是肝损伤、肝炎症以及肝功能异常(Abnormal liver function,ALF)等,其诱因也非常复杂。根据流行病学调查证实乙型肝炎感染、吸烟与嗜酒等不良习惯以及通过膳食途径摄入多种真菌毒素等是主要原因,其中通过膳食途径摄入多种真菌毒素诱发联合风险(协同效应)常常被忽略[5],经口摄入黄曲霉毒素B1(Aflatoxin B1,AFB1)污染的食品以及微囊藻毒素LR(Microcystin LR,MC-LR)污染的饮用水及水产品尤为突出[6]。
尽管有研究证实AFB1+MC-LR 之间存在肝毒性协同效应[7],然而相关报道还非常缺乏。本研究基于雄性野生型C57BL/6 小鼠,采用CI 模型模拟结合合理外推,预测低剂量、亚慢性下AFB1+MC-LR 诱发小鼠肝癌的联合风险,同时结合5 项典型生化靶标,评价AFB1+MC-LR 诱发早期肝损伤联合效应及其差异性,阐述膳食暴露场景下AFB1+MC-LR 诱导联合肝毒性趋势及阈值空间,结果对合理制修订残留限量标准及风险管控等提供科学依据。
1 材料与方法
1.1 试剂与仪器
小鼠碱性磷酸酶(AKP)试剂盒、谷丙转氨酶(ALT/GPT)试剂盒、谷草转氨酶(AST/GOT)试剂盒、小鼠甲胎蛋白(AFP)试剂盒,南京建成生物工程研究所;总胆红素(TBIL)试剂盒,上海润裕生物科技有限公司。
灌胃针(6202),日本Fuchigami 公司;ES-J 电子天平(精度0.1 mg),天津D&T 传感技术有限公司;D1008/D1008E 台式离心机,美国Scilogex 公司;Infinite 200 M/F Pro 酶标仪,瑞士TECAN 公司。
1.2 实验动物
由于雄性鼠较雌性鼠对肝毒性表达更为敏感[8-9],本研究以3 周龄野生型雄性C57BL/6 小鼠为研究载体。体重差异不超过20%,重量为(17.5±3.5)g,每次给药后1~3 h,进行整笼观察并记录临床症状。C57BL/6 小鼠购自北京维通利华实验动物技术有限公司,同时饲养和给药试验均在该公司完成(动物实验许可证号:SYXK (京)2019-0033)。
1.3 试验方法
1.3.1 共暴露组设计
1)等发生率比组 共暴露组为AFB1+MCLR,将其设计为相对高、中和低3 组,分别为AFB1低+MC-LR低、AFB1中+MC-LR中、AFB1高+MC-LR高;以及AFB1低、AFB1中、AFB1高和MC-LR低、MC-LR中、MC-LR高等6 个单一组,共9 组,每组3 个平行,共27 只;
2)非等发生率比组 设计i=AFB1,j=MC-LR;剂量=i+j (i,j=低,中,高),共9 个共暴露组,每组3 个平行,共27 只。
每只小鼠最大给药体积为0.4 mL/10 g 体重,试验周期为经口灌胃21 d。
1.3.2 试验剂量设计
本研究遵循原则:1)依据中位等毒性法CI模型对剂量反应数据要求,以诱导肝癌二分类质效应ED50为参考值;2)在低剂量范围内再设定相对高、中、低剂量等3 组,其中相对高剂量为诱导小鼠肝癌的ED5,相对中剂量为ED1,相对低剂量为粮油食品中AFB1最大残留限量(MRL)(表1);3)共暴露组的剂量比依据CI 模型等发生率比(Constant ratio model)原则和非等发生率比(Non-constant ratio model)设计。

表1 共暴露组的剂量设计方案(基于AFB1)Table 1 Experimental dose design of mycotoxin mixture
1.3.2.1 相对高、中剂量设计 基于Toxnet 数据库检索小鼠经口暴露AFB1和MC-LR 的LD50分别为9.0~9.5 mg/kg 体重和5 mg/kg 体重[10],Chen等[11]研究发现针对新生B6C3F1 转基因小鼠连续在出生4,7 d 和10 d 时腹腔注射2 mg/kg 体重(共6 mg/kg 体重),肝癌发生率为70%;连续在小鼠出生120,123 d 和126 d 时腹腔注射2 mg/kg体重 (共6 mg/kg 体重),肝癌发生率为55%。Jeannot 等[12]发现7日龄C57BL/6J 雄性野生型小鼠经口暴露AFB1,12 个月后诱导肝癌ED22.5大致为6.0 mg/kg 体重。Jeanne 等[13]研究发现雌性C57BL/6 野生型小鼠经口灌胃50 mg/kg 体重,5日后患肝癌率为12%。综上选择与本研究同类模式小鼠及其给药方式,并折中考虑中间剂量ED22.5=6.0 mg/kg 体重为最终参考依据。利用Hill 方程推测AFB1诱导野生型C57BL/6 雄性小鼠肝癌ED1和ED5的剂量:

式(1)中,R 表示诱发肝癌的发生率;ECmax——可诱导最大发生率;EC——导致R 发生率时含量水平,mg/kg 体重;m——剂量反应关系曲线形状参数;δ——背景发生率,一般默认为0。C57BL/6 野生型雄性小鼠诱导肝癌的ED50按下式计算:
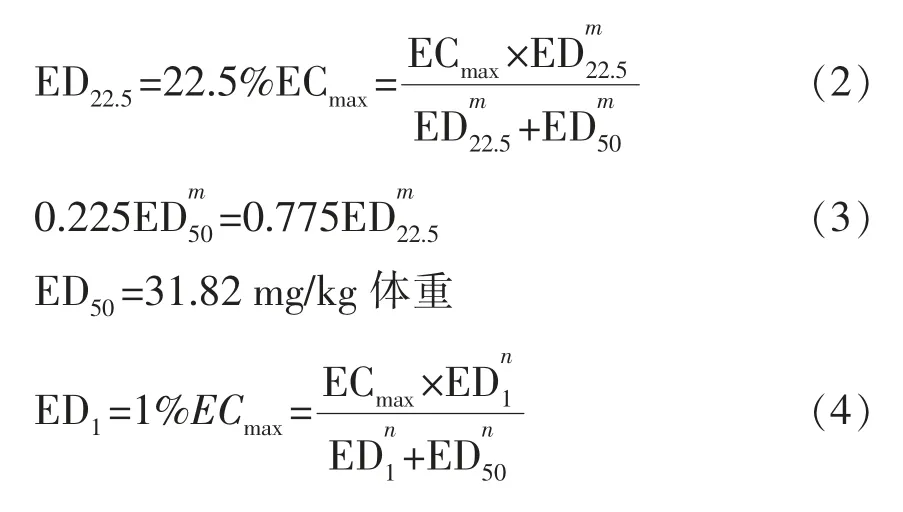

即ED1为0.32 mg/kg 体重,ED5为1.69 mg/kg体重,分别作为研究联合诱导肝癌发生的相对高和相对中剂量。
1.3.2.2 相对低剂量设计 据文献报道,Jha 等[14]和Feitah 等[15]模拟膳食暴露场景,小鼠暴露AFB1剂量依据粮油的MRL 设定,为44 μg/kg 体重。Mrdjen 等[16]采用MC-LR 的亚慢性试验剂量为2 000 μg/kg·d。综上,AFB1最终取44 μg/kg 体重。
1.3.3 灌胃试验及样本采集 对每只小鼠唯一标识,试验前2 周小鼠预适养1 周,21 d 试验结束,通过吸入异氟醚麻醉对小鼠实施安乐死。采集血液滴入EP 管并离心,然后将小鼠用大头针固定解剖盘中,剪开腹腔,生理盐水冲洗后用镊子捏住边缘膜系结构完整连同胆囊一并取出肝脏组织,放至干燥的EP 管中。
1.3.4 基于酶联免疫法测定小鼠肝脏和血清中TBIL、ALT、AST、AKP 和AFP 水平 TBIL、ALT、AST、AKP 和AFP 测定步骤参考试剂盒使用说明书进行。
1.4 统计方法
肝癌联合效应预测和估计采用CI 模型,等发生率比和非等发生率比共暴露组的生化指标差异性分析基于配对比较 (Paried comparison)的Tukey 检验(P<0.05),其中P<0.05 被认为具有统计学意义;非等发生率比共暴露组中单一组剂量对共暴露组生化指标影响的差异性分析采用Two-way ANOVA 检验的Tukey(P<0.05);等高图绘制首先采用Random 的Renka Cline 算法对获取的阵列数据进行XYZ 的10 倍数据插值,然后进行平滑转换后绘制并生成;上述统计分析均采用Origin 2019b 软件(OriginLab Corporation,USA)进行分析。
CI 模型主要由Chou[17]提出,CI 模型也称为CHOU 模型,模型如下:

式中,n(CI)x——AFB1+MC-LR 体系整体达到诱肝癌的发生率x%的联合毒性效应系数;(Dx)1-n——共暴露体系达到x%发生率下所具有的理论浓度,单位mg/kg 体重;表示体系诱导x%肝癌反应率下毒素含量配比(Dm)j[(fax)j/1-(fax)j]1/mj表示单一毒素以单一组分存在下实现x%发生率的含量水平,单位mg/kg 体重;Dm——中位效应;fax——x%发生率,单位;m——中位效应的斜率。当CI<1,=1 以及>1 时分别表示协同、拮抗和加和效应。结果通过CompuSyn Software 2.0 软件中等发生率比模型(Constant ratio model)进行模拟分析。
2 结果与讨论
2.1 相对高、中剂量单一及共暴露AFB1+MCLR 诱导肝癌联合风险风险预测
模拟数据构造原则:1)依据CI 模型等发生率比原则;2)考虑误差及不确定度,考察ED5和ED1相邻的发生率的数据作为模拟空间组合(即ED1<ED2;ED4<ED5<ED6),剔除加和作用模式组合(如单一与联合效应均一致情况),并尽量涵盖可能的极限暴露情况,剂量及组合见表2和表3。

表2 模拟选择剂量区间范围Table 2 Interval range of simulated selected dose
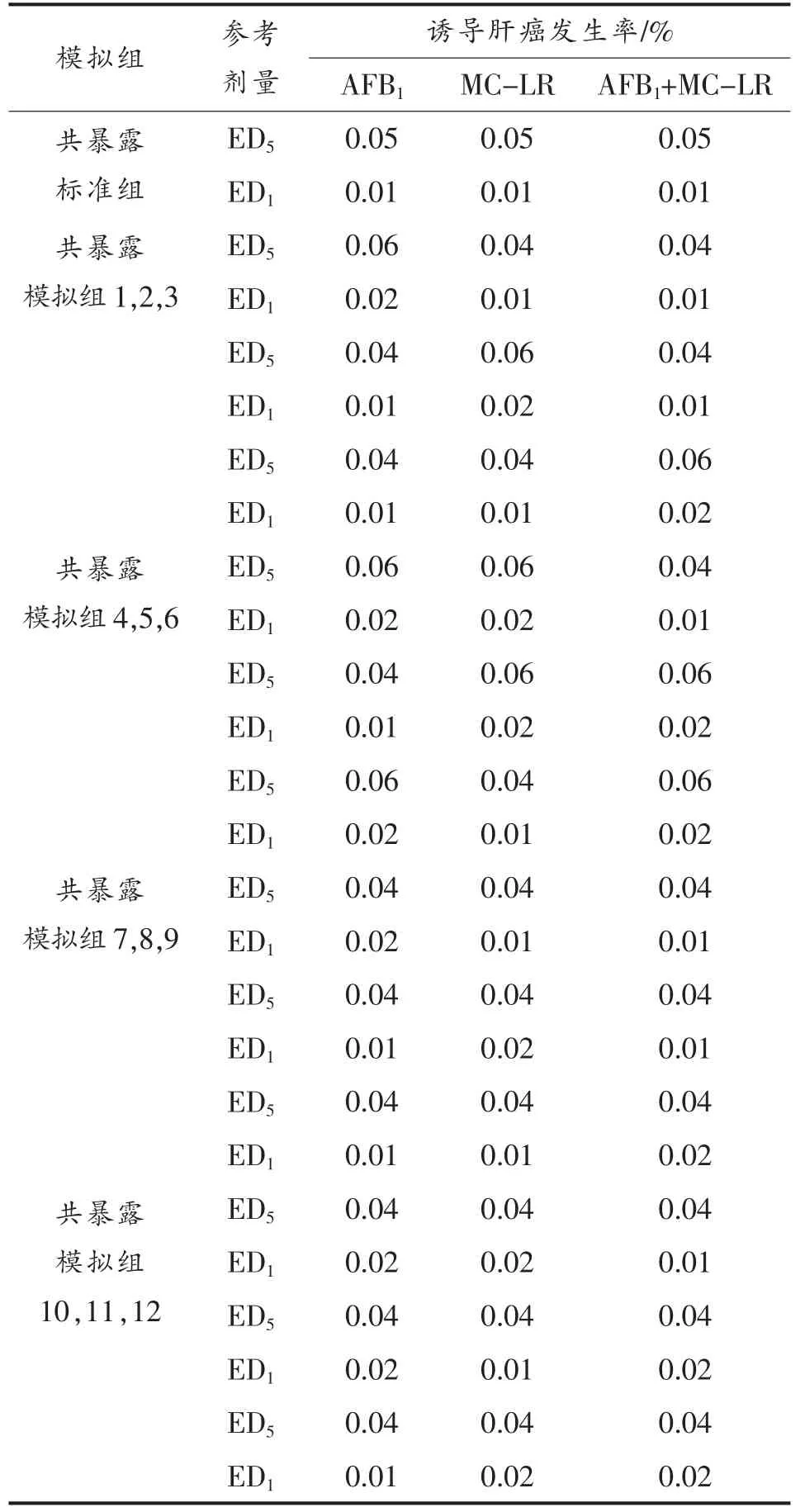
表3 模拟组合数据集Table 3 Data set of simulation combination
联合效应评价最初应用于药物筛选及耐药性阻控,旨在筛选可减少联用药物剂量,降低毒性、削减耐药性还可增强药效的用药方式。衡量并判定该效应的关键参数为剂量减少指数(Dose-reduction index,DRI),此处定义为表达等同毒性效应,为单一组分在共暴露体系中的水平与单一存在条件下该组分水平的倍数。AFB1和MC-LR 的DRI 方程可分别表述为公式(7)和公式(8):

式中,DRIAFB1——AFB1剂量减少指数;DRIMC-LR——MC-LR 剂量减少指数;Dm——形状参数;fa——诱导肝癌的发生率。
如图1中所示,在0.05<fa<0.5 区间,标准组与模拟组4,7,8 和10 的DRI 均大于1;fa≤0.05低水平情况下,除模拟组10 组外,其DRI 均大于1。通过模拟预测,AFB1+MC-LR 可更快且有效地通过肝损伤、炎症反应、肝功能障碍(ALF)或免疫应激等在诱导肝癌上发挥主导作用,或提升关键作用靶点或受体结合的速率(fv)、电解离常数(pKa)等,而在相对高fa区间进入阻滞期。作为有害化学物,当模拟结果表现为DRI>1,定义为有害效应,另外即使肝癌/肝损伤联合效应不呈现显著协同性,而表现为加和或弱拮抗效应,肝癌/肝损伤有害效应依然可能呈现叠加。
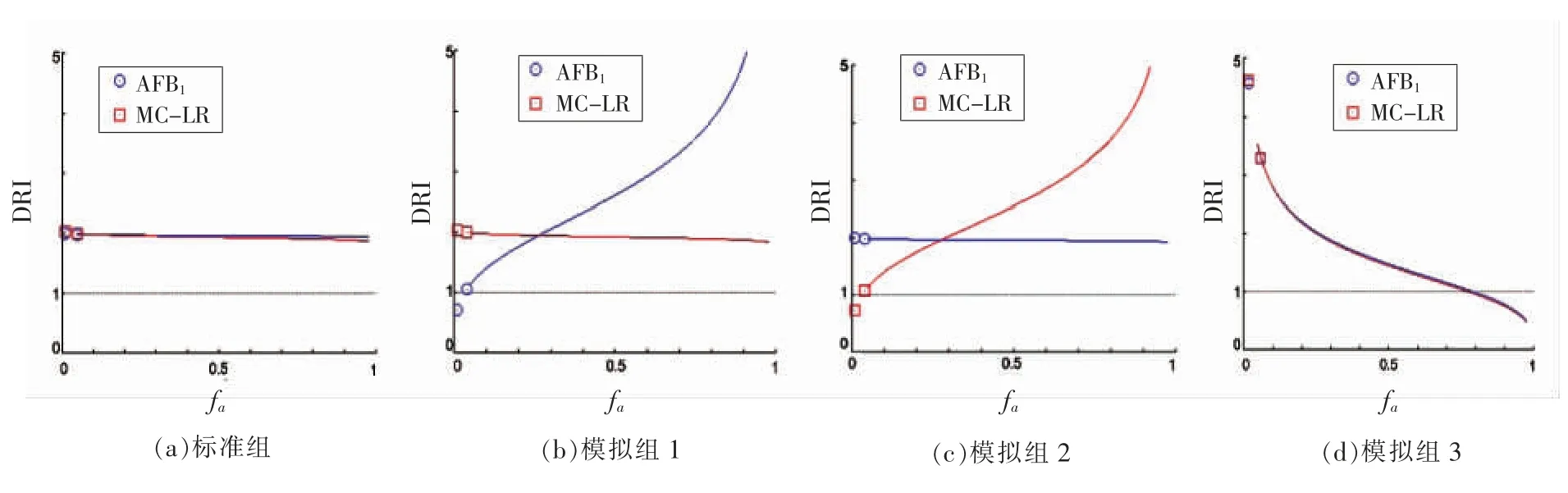
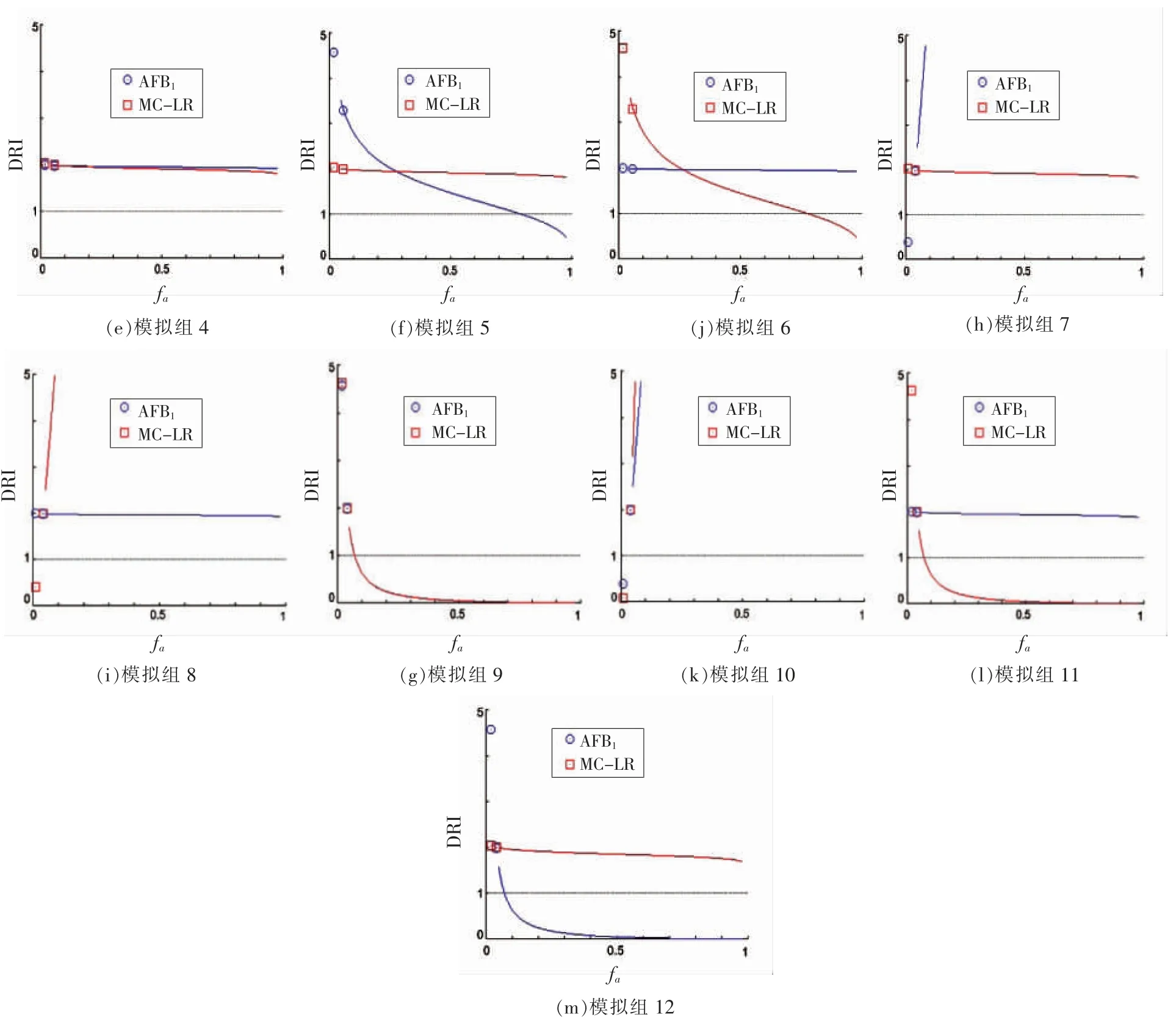
图1 不同组合的DRI 值Fig.1 DRI values of different combinations
图2可见,在fa=0.5 水平下,包括标准组及所有模拟组大多为弱协同、弱拮抗或加和效应;在fa=0.75 水平下,标准组和模拟组1,2,4,7,8,9,10,11,12 大多呈现加和或弱协同效应,而模拟组3,5,6 呈现弱拮抗或拮抗效应;在fa=0.9 水平下,除标准组和模拟组4 和6 表现为拮抗效应,模拟组1 和2 表现为协同效应,所有组合主要呈现加和效应。因此共暴露组在不同剂量水平下呈现不同联合效应属性及趋势,此与fa-DRI 的表达结果一致。
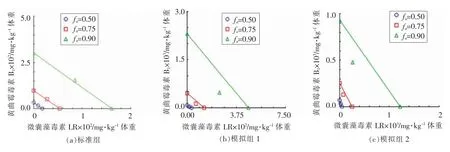

图2 不同组合的等值线图Fig.2 Isobologram of different combinations
根据图3所示,联合剂量发生概率最高集中于0~20 mg/kg 体重区间,而CI 值概率最高出现在0~1.5 区域。因此,常规暴露水平下,联合效应主要呈现为弱拮抗、弱协同或加和效应,而表现为强拮抗或强协同效应可能性极低。另外,结合图1中DRI 结果分析,即使肝癌/肝损伤联合效应不呈现明显协同性,但表现为弱协同或加和联合效应的概率依然相对较高。
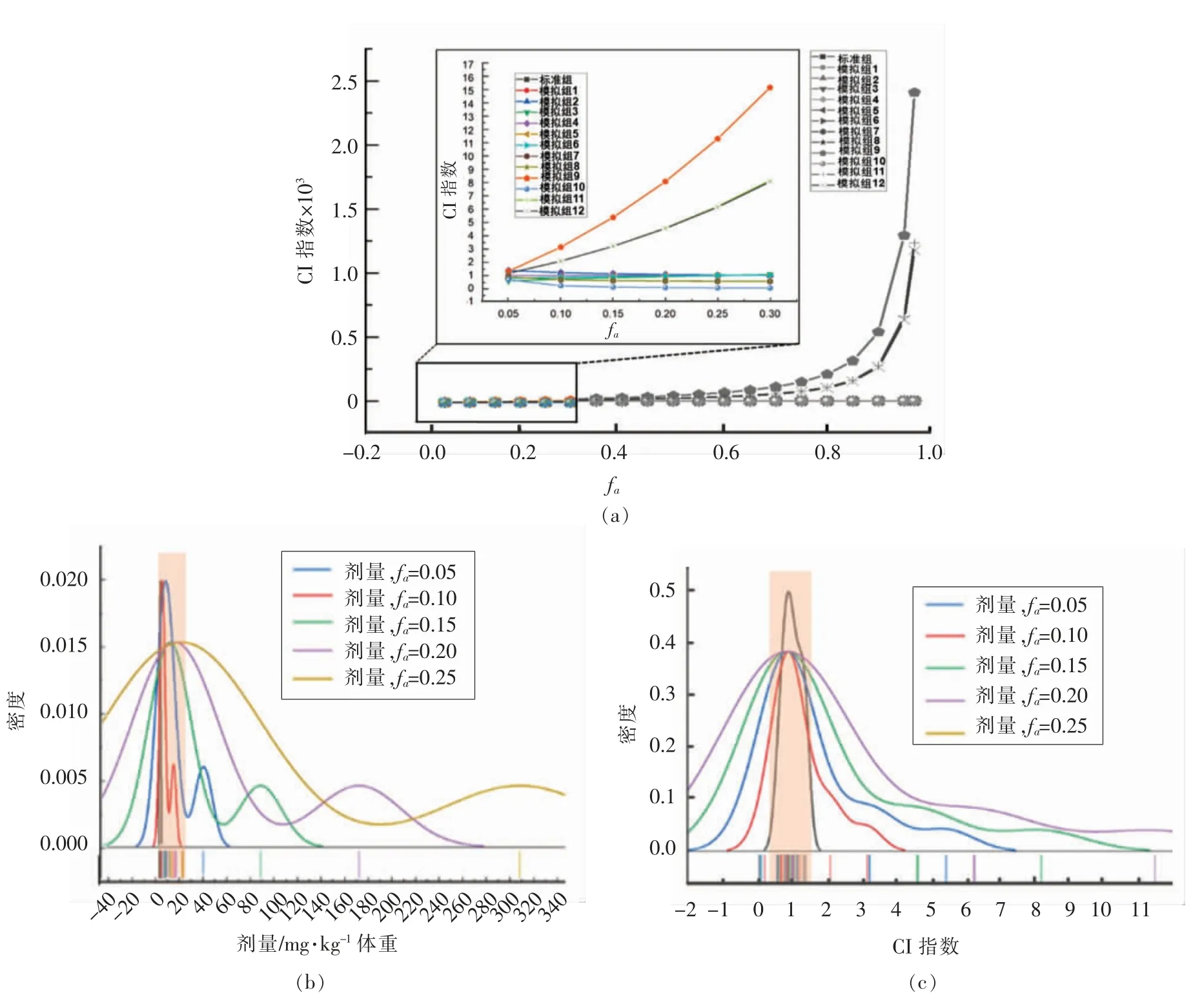
图3 AFB1+MC-LR 标准组与模拟组复合诱导小鼠肝癌/肝损伤的联合效应情况Fig.3 Combined effects of AFB1+MC-LR standard group and simulation group on mice liver cancer/liver injury
2.2 等发生率比下单一及共暴露AFB1+MC-LR诱导肝损伤差异性分析
等发生率比下AFP、ALT、AST、AKP 和TBIL在AFB1+MC-LR 单一及共暴露组表达差异性见表4和表5。结果显示,随暴露剂量增加,生化指标表达水平上升。除AKP 外,肝脏中生化指标的表达水平大多均高于血清中表达水平(P<0.05)。
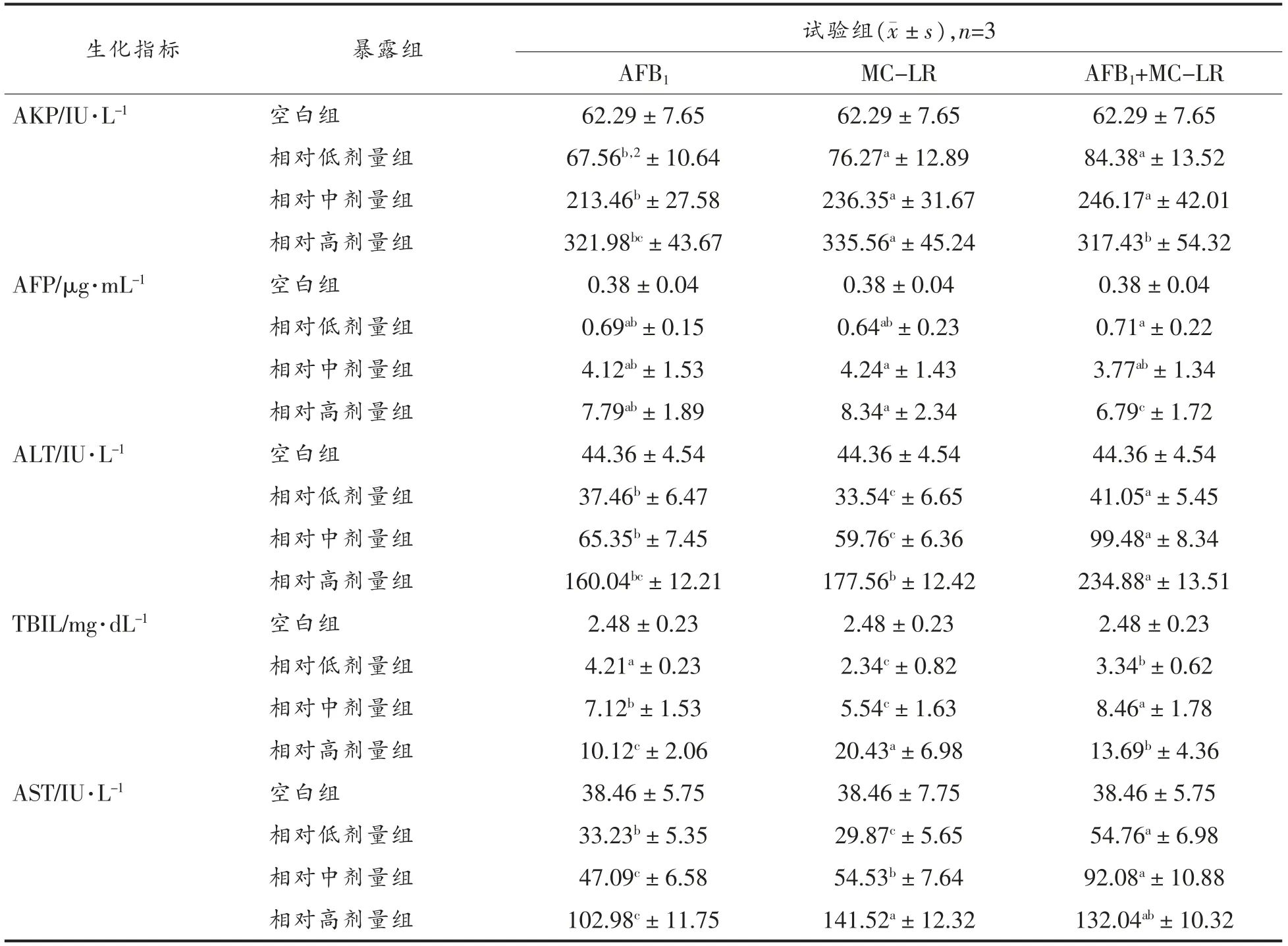
表4 单一及共暴露组血清中生化指标表达水平Table 4 Expression levels of biochemical indexes in serum induced by single and mixture mycotoxin
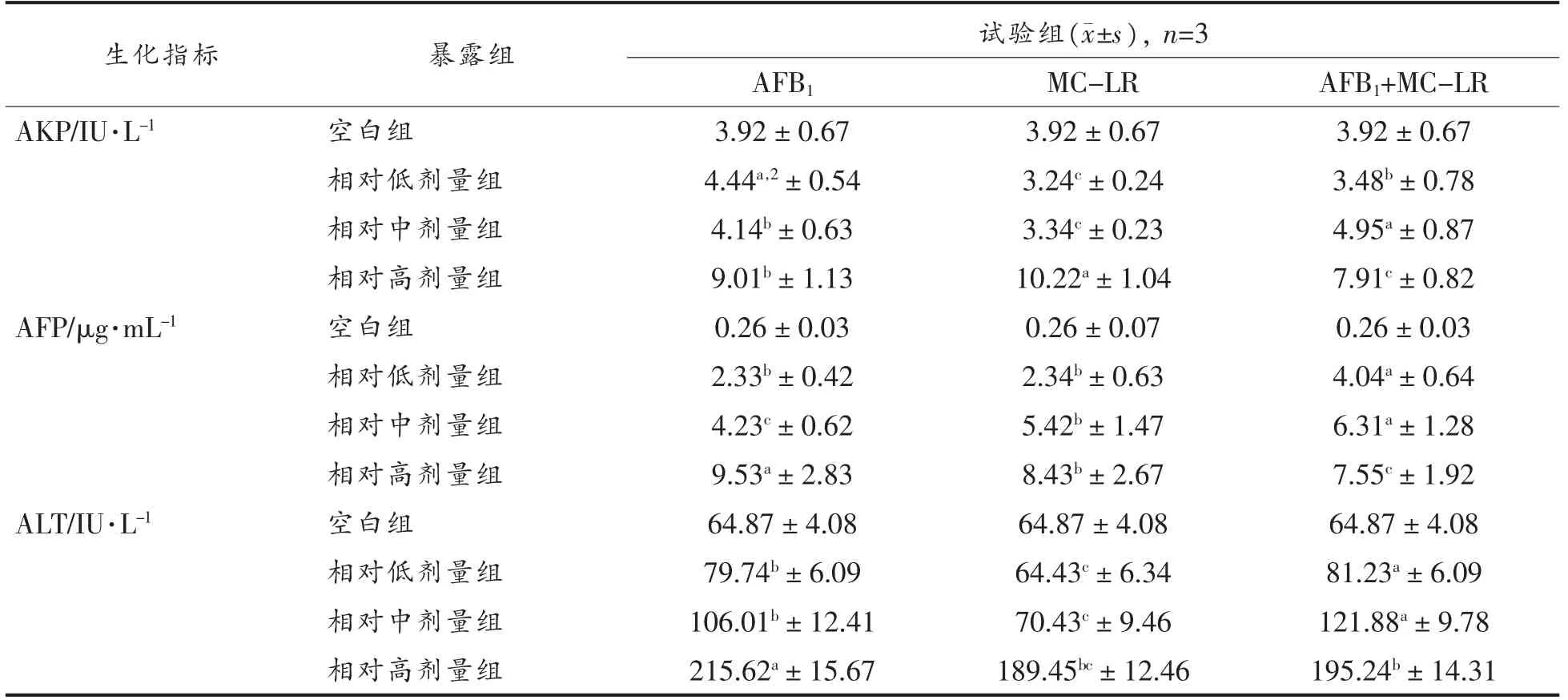
表5 单一及共暴露组肝脏中生化指标表达水平Table 5 Expression levels of biochemical indexes in liver induced by single and mixture mycotoxin

(续表5)
如5 项生化指标总体可代表每个样本肝损伤效应,总体结果显示:1)共暴露组表达水平在MC-LR 和AFB1、空白对照组之间,结果解读为弱加和、弱协同或加和效应;2)由于血清及肝脏中CP1 均为低剂量下AKP 表达水平,据此,相对低剂量下呈现加和或弱拮抗效应可能性较高,总体结论与采用CI 模拟分析结果基本一致,即所有共暴露组呈现加和或弱协同效应概率更高。生化靶标可反映肝损伤,AFB1+MC-LR 暴露时间及剂量水平决定了“时-量-效”响应,有研究证明机体暴露低剂量AFB1后会抑制适应性/获得性免疫(Cell-mediated immunity,CMI)[18],因此相对低剂量下暴露21 d,共暴露组表现为弱拮抗效应可能由于CMI 占主导优势,而相对高剂量下CMI 被抑制,机体脆弱性增加,联合效应转为协同趋势(图4)。
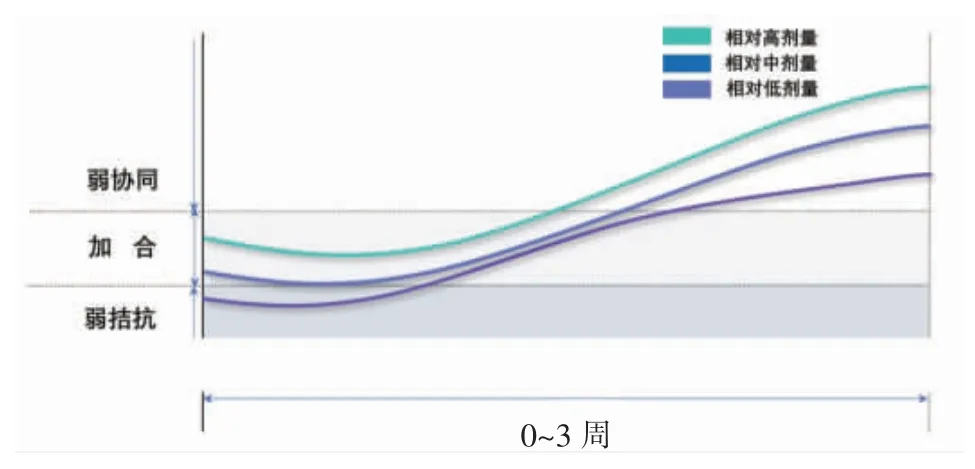
图4 不同联合暴露组随时间表达联合效应趋势示意图Fig.4 Schematic diagram of joint effects of different combined groups with time

表6 血清和肝脏中生化指标的主成分分析总方差Table 6 Interpretation of total variance of physiological & biochemical indexes in serum and liver using principal component analysis
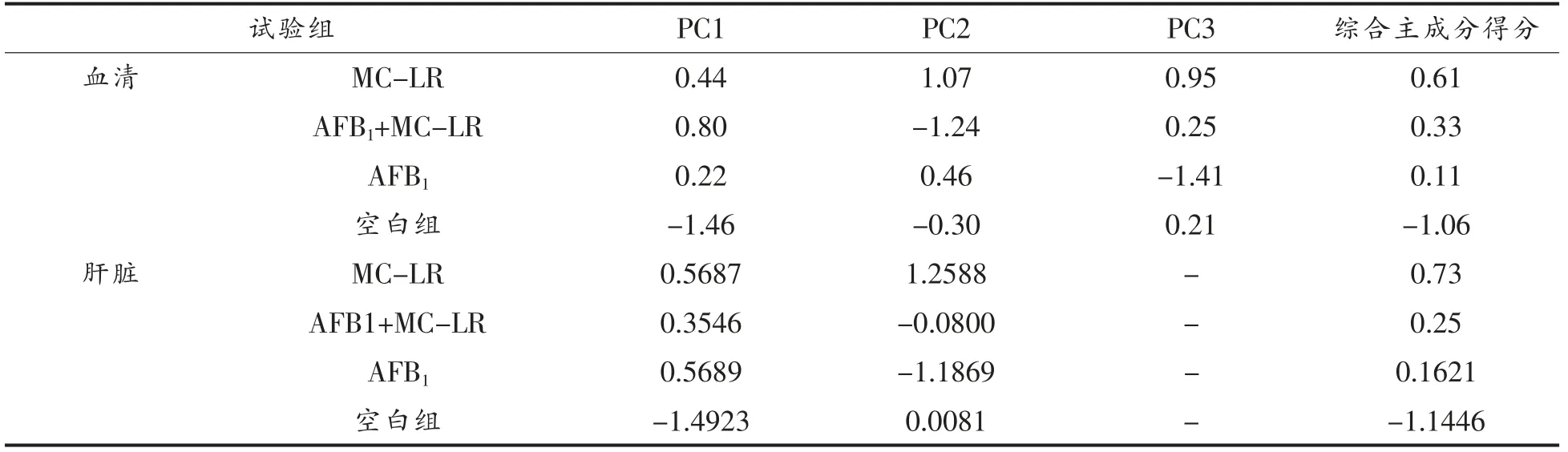
表7 单一及共暴露组血清和肝脏主成分得分排序Table 7 Ranking of scores of serum and liver principal components
2.3 非等发生率比共暴露组血清及肝脏中肝损伤联合效应差异性分析
为规避CI 模型对非等发生率比共暴露组联合效应考察的不足,设计棋盘式联合暴露试验考察5 项生化指标在血清及肝脏中表达差异性,探明AFB1和MC-LR 单一组分对共暴露组贡献差异性及其权重趋势。

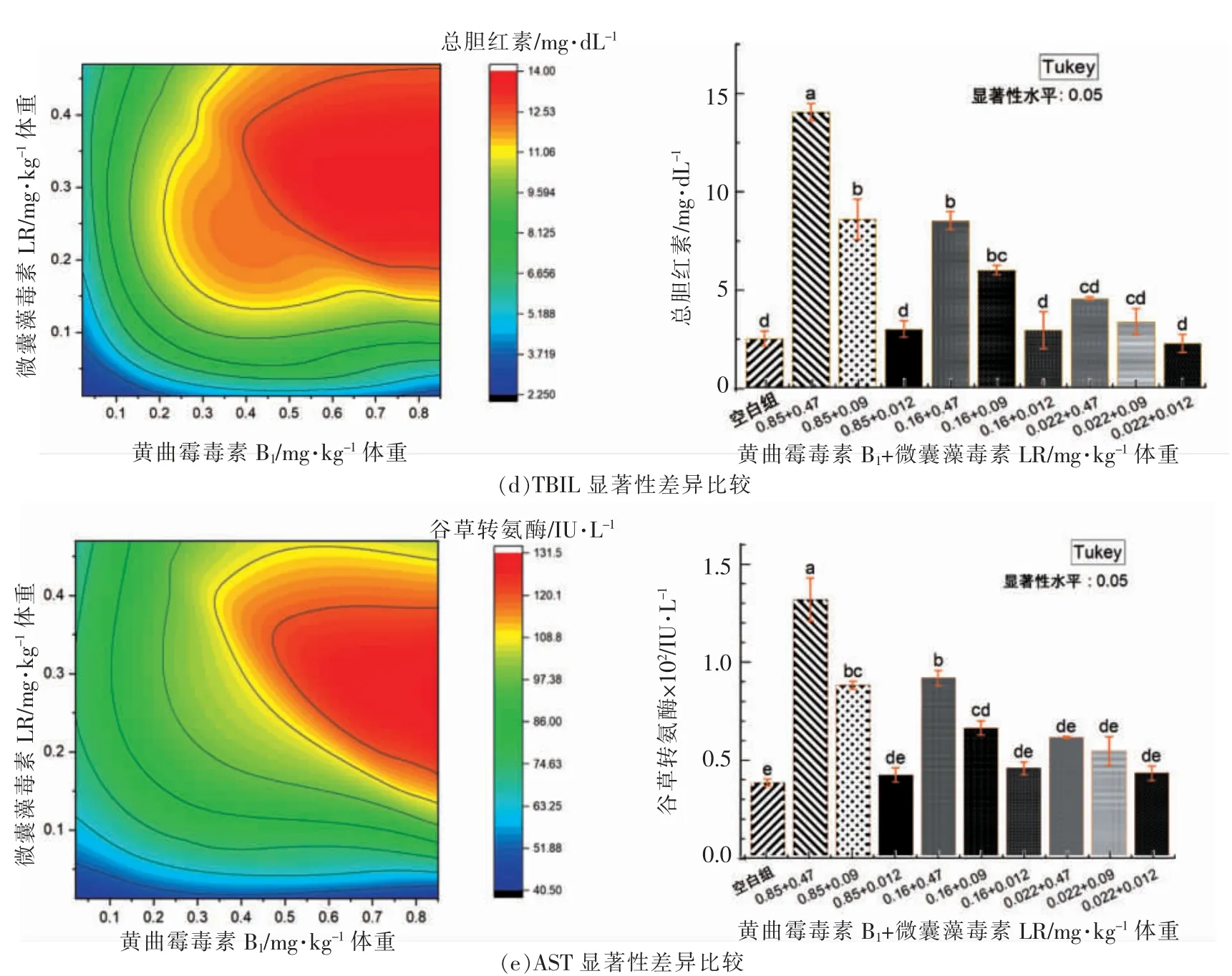
图5 小鼠血清中生化指标表达水平Fig.5 The expression level of biochemical indexes in the serum of mice
根据图6和图7所示:1)几乎所有生化指标表达量均随组合剂量浓度水平提高而升高,最高剂量暴露组AFB1+MC-LR=0.85+0.47 mg/kg 体重与其它共暴露组,包括空白对照组大多具有显著性差异(P<0.05),肝脏中表达水平大多高于或略高于血清中表达水平;2)表达量与共暴露组剂量水平递增的趋势大多呈现一致;3)相对低剂量组与空白对照组大多呈现差异不显著或无显著性差异。4)文献提示小鼠血清中ALT 和AST 活力均值正常范围分别为16~42 IU/L 和1.32×102IU/L,TBIL 均值及范围为0.15 mg/dL (0.1~0.3),Mrdjen等[19]报道CD-1 雄性小鼠血清中AST、ALT 和TBIL 正常对照组表达量分别为(49.00±2.15),(39.10±3.34)U/L 以及(0.15±0.01)mg/dL,本研究中空白对照分别为(39.21±1.34)mg/dL、(63.95±4.53)IU/L 和(2.54±0.22)mg/dL,可能由于品种差异性导致。
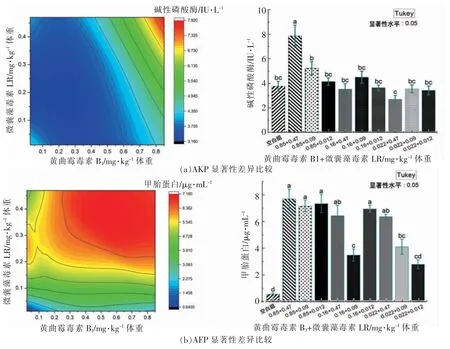

图6 小鼠肝脏中生化指标表达水平Fig.6 The expression level of biochemical indexes in the liver of mice

图7 非等发生率比下共暴露组中AFB1 和MC-LR 单一含量对其生化指标影响的显著性分布Fig.7 Significant distribution of single concentration of AFB1 and MC-LR in the combined exposure group under the unequal effect ratio
根据表8所示:1)血清中5 项生化指标,除TBIL 和AFP 外,暴露组中AFB1和MC-LR 单一剂量变化对TBIL 结果影响无显著性差异(分别为P=0.108 和P=0.116),MC-LR 剂量变化同样对AFP 结果影响无显著性差异(P=0.277),其余指标中,共暴露组中AFB1或MC-LR 任意剂量变化,会对另外单一组诱导生化指标表达产生显著性影响;2)对于肝脏样本,共暴露组中任意单一剂量变化对最终共暴露组表达结果不具有显著相关性,此结果与血清表达情况差别较大,即两种真菌毒素剂量调整与肝脏中AKP、AFP、ALT、TBIL 和AST 表达量无太多相关性,但共暴露组中AFB1与MC-LR 任意单一组剂量变化,会极显著影响另外一组作用于共暴露组的表达。
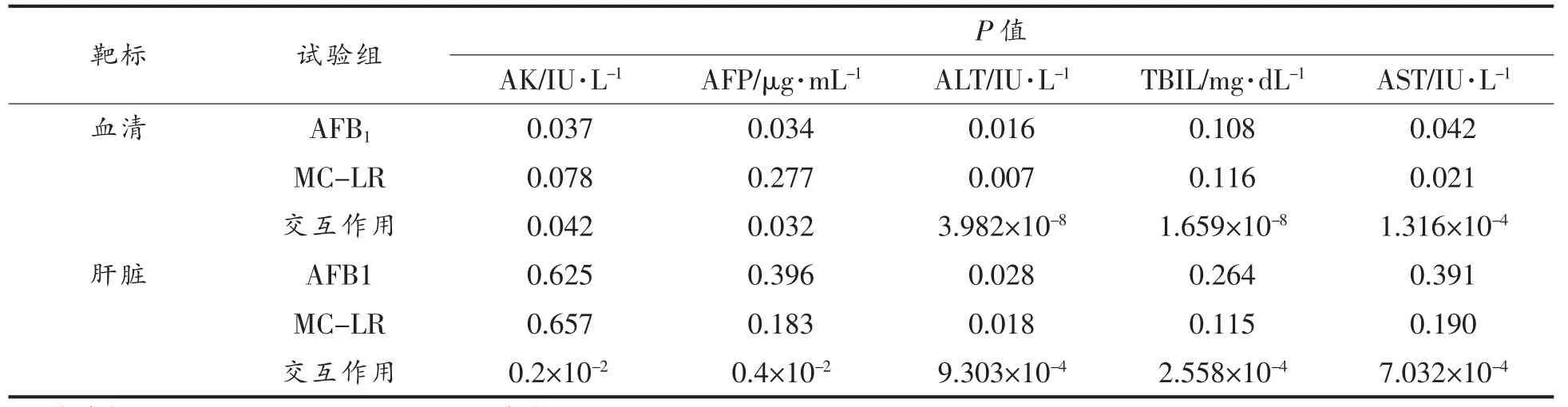
表8 非等发生率比下共暴露组中AFB1 或MC-LR 对其生化指标影响的显著性分析Table 8 Significance analysis of the influence of single concentration of AFB1 and MC-LR on biochemical indexes in the combined exposure group under unequal effect ratio
AKP 是一种膜结合酶,大多血清中AKP 病理性升高,主要由肝脏和胆道疾病引起,主要为胆管阻塞,因为AKP 需经过肝脏,然后由胆汁排出,当排泄过程出现异常,引起AKP 偏高[20]。当肝脏受到损伤或障碍时经淋巴道和肝窦进入血液,同时由于肝内胆道胆汁排泄障碍,反流入血而引起血清AKP 明显升高。AKP 升高较ALT 表达量升高快更可佐证此结论[21]。血清中AKP 在正常人水平大致为20~1.4×102U/L[22-23],本研究中小鼠空白水平为(62.29±7.65)IU/L,低剂量联合暴露组为(84.38±13.52)IU/L,肝脏表达极低,空白为(3.92±0.67)IU/L,低剂量联合暴露组为(3.48±0.78)IU/L。所有小鼠组织理论均含有显著AKP 活性,而BALB/c、FVB/N WT 小鼠肝脏检出极低水平AKP,而ICR小鼠未检出,因此小鼠之间、小鼠与人体之间具有差异。AFP 来源于胚胎内胚层组织细胞,成人血清中AFP 含量低主要是由于成熟肝细胞合成AFP能力丧失,而转化后的肝癌细胞可恢复合成AFP能力,70%肝癌患者均检出AFP 异常高表达[24]。同时,外源性AFP 不仅可促进肝癌细胞增殖及肿瘤血管形成,还能增强癌细胞的抗凋亡作用[25-28]。ALT 在肝脏中特异性高表达,因此在肝脏细胞质中理论含量最高,不同肝损伤和炎症反应导致肝细胞膜通透性增加,促使ALT 从细胞质中释放进入血液中,引起ALT 升高,故血清中检出ALT 升高表征肝脏受损。AST 主要存在肝细胞线粒体和胞浆,肝细胞受损后AST 从胞浆和线粒体内释放至血液中。ALT/AST 超过正常值说明肝细胞受损,然而转氨酶的升高不一定代表肝细胞损伤。有研究发现小鼠同工酶ALT1 基因在大肠、肝脏、脂肪组织、肌肉和心脏等组织中由高至低广泛分布和表达,而ALT2 基因表达受限制较多,主要分布在肝、肌肉、脑和白色脂肪组织中,同时雄性大鼠肝脏ALT2 蛋白大约是雌性大鼠的4 倍[29]。Haorah等[30]利用Leprdb/J 小鼠分别暴露于50 μg/kg 和100 μg/kg 的MC-LR,15 d 和20 d 取样发现ALT水平未见特异性升高,而暴露100 μg/kg 的MCLR 小鼠血清中ALP 水平升具有非常显著性的差异(P<0.01),并在肝组织中观察到炎性细胞浸润和脂肪空洞。因此,ALT 被认为是肝组织损伤的有效生物标志物。MC-LR 为主要攻击肝脏靶器官的活性单环七肽,Tang 等[33]研究MC-LA 时发现,对C57BL/6 野生型小鼠腹腔注射50 μg/kg 腹腔注射会引起急性肝毒性,血清中ALT 和AST 表达明显上升,分别高达1.0×104IU/L 和1.25×104IU/L 左右。MC-LR 膜穿透能力较弱,其在器官中的全身分布取决于血液灌流程度、OATP 携带者的类型和表达水平。经MC-LR 处理的野生型小鼠,其肝脏出现广泛的出血性坏死,血清ALT 和ALP 水平升高,而OATP1B2 缺失小鼠表现出完全抵抗MCLR 诱导的肝毒性。TBIL 降解产物已被证实具有抗氧化性能,大鼠随TBIL 水平升高,在其生理浓度范围内,可能抑制HSC 的激活,因此TBIL 可延缓肝脏纤维化进程[34]。
AFB1在不同物种中敏感性具有差异性,其中猴子、鸡和小鼠被认为抗AFB1物种,同时报道小鼠LD50具有差异性,范围为9~60 mg/kg 体重。有研究表明营养良好人群可降低AFB1诱导肝损伤概率[34],因此肝损伤联合效应还会受到营养因素和品种和差异等因素影响。
3 结论
低剂量、亚慢性下共暴露组AFB1+MC-LR 诱导的肝癌及肝损伤联合效应主要表现为弱协同、弱拮抗或加和作用,其中弱协同效应发生概率更高。同时在肝脏中,共暴露组中任意单一毒素的剂量变化会显著影响另一毒素对共暴露组联合效应的表达。综上,肝脏是AFB1和MC-LR 共同的作用靶点,其呈现的协同效应可能与肝损伤及肝癌结局发生具有相关性,在真菌毒素残留限量标准修订、风险阻控和消费引导上应给予关注。
