角膜胶原交联中核黄素浓度检测方法的研究进展
2021-09-07严梦迪黄锦海王勤美高蓉蓉
严梦迪 黄锦海 王勤美 高蓉蓉
作者单位:温州医科大学附属眼视光医院 325027
角膜胶原交联术(Corneal collagen cross-linking,CXL)开始研究已有20余年的历史,是目前临床上控制圆锥角膜进展的主要方法之一,找到相较于传统去上皮方案更安全的跨上皮CXL方案已成为当前研究热点。核黄素作为光敏剂在角膜中的浓度影响到CXL的疗效和安全性,也是新型跨上皮CXL方案评估的重要指标之一。目前,不同文献中报道的CXL过程中核黄素浓度存在较大差异,所用检测方法也不尽相同。笔者将阐述核黄素的理化性质及其在CXL中的作用机制,及角膜中核黄素浓度检测的重要性和检测方法。
1 核黄素的理化性质和CXL的应用
核黄素又称维生素B2,是一种重要的维生素,其分子式为C17H20N4O6,分子量376,由异四氧嘧啶环和核醇链组成(见图1),微溶于水。
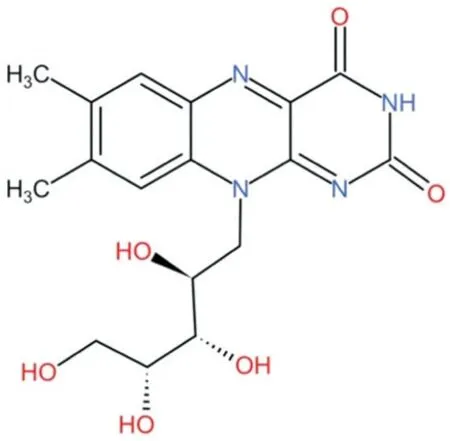
图1.核黄素的结构式Figure 1.Structural formula of riboflavin.
CXL于2003 年出现以来,用于治疗进展期圆锥角膜,可明显增强角膜的生物力学性能,也用于治疗感染性角膜炎[1,2]、角膜溶解[3]和角膜基质水肿[4]等眼部病变。CXL以核黄素为光敏剂,在365 nm波长的紫外线-A(Ultraviolet A,UVA)照射下,核黄素从UVA中吸收能量,激发为三线态核黄素,CXL包括I型和II型机制:对于II型机制,三线态核黄素通过与三线态氧(3O2)的作用,产生活跃的单线态氧(1O2),可以与胶原的羰基相互作用;如果3O2耗尽,则I型机制占主导地位,即三线态核黄素直接作用于底物(胶原蛋白和蛋白聚糖)[5]。核黄素微溶于水,临床上常用的是更易溶于水的核黄素-5'-磷酸,可被角膜中的酶转化成为核黄素[6]。
2 角膜中核黄素浓度检测的重要性
核黄素在CXL中具有2个重要功能:①作为光化学交联反应的光敏剂,促进底物交联;②作为UVA吸收剂保护角膜内皮、晶状体和视网膜等结构免受UVA过度照射的伤害。
在UVA照射之前角膜基质中核黄素的浓度,以及其在照射期间核黄素的有效消耗是保证CXL疗效的2 个主要因素[7]。CXL过程中,在3 mW/cm2的辐照度下,核黄素以每分钟1%~2%的速率发生光降解[8],按每分钟降解约2%计算,如果不补充核黄素,30 min后将降解约60%,因此照射过程中需要补充核黄素。O'Brart等[9]用不同浓度的核黄素溶液进行猪眼快速CXL后进行抗胃蛋白酶溶解实验,发现20 d后0.3%浓度组干重明显大于0.05%浓度组,即核黄素浓度越高,抗溶解越好;他们还认为基质内较高的核黄素浓度可导致前基质UVA吸收增加,并在理论上减少角膜内皮细胞的UVA辐射量,用于治疗较薄的角膜。核黄素稀溶液的UVA吸收系数与其浓度呈线性相关,且在核黄素浓度达到0.1%时到达平台期[10],区别于先前研究中的0.04%[11]。对于目前临床采用的UVA辐照量,最合适的基质核黄素浓度尚有待研究。
3 角膜中核黄素浓度的检测方法
核黄素的激发光波长范围为440~500 nm,发射光波长范围为510~550 nm[12]。通过检测样品内核黄素的荧光强度,利用荧光强度与其浓度呈正比,结合标准曲线得到核黄素浓度,可进行定量分析。目前角膜中核黄素浓度的检测方法大部分是基于这一特性,主要包括使用荧光显微镜进行核黄素荧光强度分析、高效液相色谱法(High performance liquid chromatography,HPLC)、分光光度法、无创性实时检测、眼前节裂隙灯显微镜观察法等。检测核黄素浓度的另一种原理是基于检测质谱中的特定峰,即基质辅助激光解吸/电离质谱成像技术(Imaging mass spectrometry by matrix assisted laser desorption/ionization,MALDI-IMS)。
3.1 利用荧光显微镜检测角膜冰冻切片的核黄素浓度
目前大部分研究中检测核黄素浓度是通过使用荧光显微镜对角膜进行荧光成像,研究采用的共聚焦荧光显微镜激发光波长为488 nm或458 nm、发射光波长范围为505~565 nm不等,双光子荧光显微镜(Two-photon microscopy,TPM)激发光波长范围为760~890 nm不等,发射光波长范围为505~650 nm不等。荧光显微镜检测的优点是能检测角膜全层的荧光强度以反映不同基质深度的核黄素浓度,缺点是冰冻切片制作过程中包埋剂会溶解,在切片表面易发生核黄素的弥散迁移[13]。在冰冻切片制作完成后,应尽快进行荧光显微镜的拍摄,还可以用无荧光浸油覆盖于切片表面以减少扩散[13]。
有研究使用共聚焦荧光显微镜检测CXL前后兔角膜基质内的核黄素浓度,发现浸润20 min和30 min后去上皮组核黄素浓度为0.036%和0.049%,跨上皮组浓度低于0.010%,CXL术后1 d,去上皮组角膜荧光强度下降约100%,跨上皮组下降约60%[14]。Gore等[13]对35 μm厚的兔角膜冰冻切片进行TPM荧光成像,发现不同跨上皮核黄素制剂的基质穿透能力均不如传统去上皮方案,前基质中,去上皮组、MedioCross TE组和Ricrolin组的核黄素浓度分别为0.090%、0.054%和0.031%,300 μm基质深度处分别为0.075%、0.018%和0.016%。他们还用此方法比较了不同离子导入方案的核黄素渗透性,发现使用MedioCross TE溶液进行2个周期的离子导入(即1 mA电流离子导入5 min—浸泡5 min—1 mA电流离子导入5 min—浸泡5 min),在离体兔眼中可达到与去上皮相似的渗透量[15]。Lanzini等[16]使用共聚焦荧光显微镜对5 μm厚的人供体角膜冰冻切片进行成像,发现采用离子导入浸润法与传统去上皮方案有相似的效果。
3.2 利用荧光显微镜检测完整角膜的核黄素浓度
对完整角膜进行成像可以避免核黄素在切片表面的扩散,从而更准确地对不同基质深度的核黄素浓度进行检测。Sondergaard等[17]将去上皮后的完整猪眼角膜直接置于载玻片上,内皮面朝向共聚焦荧光焦显微镜的物镜,通过光学切片以10 μm的间隔记录测量整个角膜的荧光强度,观察到荧光强度在前50 μm内达到峰值,然后急剧下降,在200 μm处降低至基线,并且随着浸润时间由10 min延长至20 min,荧光强度明显增强,而由20 min延长至30 min,荧光强度无明显变化,且当核黄素浓度由0.1%增加到0.2%时,前基质中的荧光强度明显增加,但其深度分布不受时间和浓度的影响。Laggner等[18]使用共聚焦荧光显微镜观察去上皮浸润5、10、20 min后人供体角膜内核黄素浓度,发现20 min组浓度明显高于另2组。Seiler等[19]使用TPM检测核黄素溶液去上皮浸润10 min后人供体角膜的核黄素浓度,测得后基质浓度为0.035%,内皮水平的浓度为0.015%,低于先前理论计算的0.025%[20]。Kampik等[21]使用TPM显示,核黄素浸润去上皮的猪角膜中30 min后基质荧光信号呈空间均匀分布。有研究使用TPM测得在核黄素浸润去上皮的猪角膜40 min后,角膜条带横截面的荧光信号已接近均匀,浸润60 min后荧光信号随深度呈线性下降,因此信号的降低是由于信号衰减而非核黄素浓度的空间变化,校正信号衰减后,核黄素浓度随着浸润时间的延长而增加,浸润30min后最大组织浓度为0.094%(1.36 mg/ml),300 μm基质深度处的平均浓度为0.086%(1.25 mg/ml),浸润50 min后整个基质浓度达到均匀[22]。
在跨上皮评估方面,Zhang等[23]以完整胚胎鸡角膜为对象,通过共聚焦荧光显微镜观察到肽NC-1059 对核黄素的跨上皮扩散有明显作用,且作用呈浓度和时间依赖,NC-1059为100 μmol/L浓度组的基质内荧光强度明显高于50 μmol/L浓度组,30 min后接近去上皮组。Arboleda等[24]使用共聚焦荧光显微镜研究离子导入对核黄素跨大鼠角膜上皮的作用,发现不含右旋糖酐的核黄素-磷酸盐溶液在离子导入下可以跨上皮,但仍不如去上皮组,且此过程呈时间依赖性,认为右旋糖酐的高分子量和高黏度阻碍了核黄素的跨上皮浸润。
3.3 利用HPLC检测角膜溶解液的核黄素浓度
HPLC的过程是将角膜在特定溶液里完全溶解,得到溶解液作为流动相被高压输液系统泵入含固定相的色谱柱,溶质在两相间的分配系数、亲和力、吸附力或分子大小不同,引起不同的排阻作用,因而使核黄素得以分离,进入检测器得到其浓度。HPLC可以单独分离出核黄素,减少了其他物质可能的干扰,相较于其他方法有更高的精准度(可达到ng级别),但只能检测角膜中平均核黄素浓度,不能直观地描述核黄素的空间分布,而且由于不能将角膜表面的核黄素完全冲洗干净而高估核黄素浓度[25]。
有研究使用HPLC测得5、15、30 min后保留上皮浸润组供体人角膜中核黄素平均浓度分别为91.88、95.60、94.92 ng/g,而去上皮组分别为14.42、20.92、24.06 mg/g,表明角膜上皮阻碍了核黄素的浸润[25]。Cassagne等[26]通过HPLC比较离子导入法与传统去上皮法的兔眼角膜基质和房水中的核黄素浓度,发现离子导入组均低于去上皮组[角膜基质:(936±313)ng/mlvs.(1 708±908)ng/ml,房水:(68±70)ng/mlvs.(1 497±1 168)ng/ml)]。Mastropasqua等[27]使用飞秒激光对核黄素浸润后的人角膜分层并进行HPLC,发现表层基质中,传统去上皮组的核黄素浓度为离子导入组的2倍,为保留上皮组的4倍浓度,3组浓度均随深度增加而明显下降,在中、后基质中无明显差异。Ostacolo等[28]通过HPLC在离体猪角膜中观察到d-α-生育酚聚乙二醇1 000琥珀酸酯(Vitamin E-tocopherylpolyethylene glycol succinate,VE-TPGS)对核黄素的跨上皮穿透具有影响作用,在核黄素溶液内加入0.5% VE-TPGS,浸润20 min后角膜内核黄素浓度可以接近去上皮方案。
3.4 利用紫外可见光分光光度计检测完整角膜的核黄素浓度
物质中的分子和原子吸收入射光中的某些波长的光能量,发生相应的分子振动能级跃迁和电子能级跃迁。每种物质的分子、原子构成和空间结构各异,因此具有独特的吸收光谱曲线,曲线上的特征波长处的吸光度可用于定性和定量分析该物质的含量。紫外可见光分光光度计相较其他方法操作更简单,但不能提供核黄素随深度变化的趋势。Iselin等[29]使用该方法(激发光谱420~490 nm、吸收光谱530~630 nm)检测到15 min内人工前房中核黄素平均浓度从5 ng/mL增加到903 ng/mL,30 min后达到1 089 ng/mL,证明核黄素可以穿透人供体角膜。有研究同时联合应用TPM和分光光度法测量人供体角膜CXL过程中基质内核黄素浓度,浸润30 min后,在100~250 μm基质深度平均峰值浓度为0.020%±0.001%,在250~240(320±53)μm的基质深度范围浓度几乎恒定,然后向内皮方向逐渐降低,后基质中浓度为0.016%±0.001%,常规UVA照射和快速UVA照射后,浓度分别均匀下降87%±2%和67%±3%[30]。另一研究使用此方法测得核黄素纳米制剂跨上皮浸润和标准溶液去上皮浸润后,人供体角膜基质中核黄素平均浓度分别为0.008%±0.003%和0.017%±0.001%,UVA照射后,2组平均消耗量分别为52%±13%和67%±2%[31]。Lombardo等[32]使用分光光度法测得含促渗剂的低渗核黄素可通过完整的人角膜上皮渗入基质,平均浓度为0.004%,但不如去上皮组(0.012%),在加入15%右旋糖酐后,核黄素不能通过完整角膜上皮,认为可能是因为右旋糖酐的高分子量和高黏性。
3.5 利用自行研发的仪器无创实时检测角膜的核黄素浓度
CXL治疗结果的不确定性与患者的角膜组织有关,例如渗入角膜基质的核黄素量和照射过程中核黄素的消耗等可能存在个体差异,目前缺少针对每例患者的个性化治疗。如果在治疗过程中能实时监测患者角膜内核黄素浓度,则有可能实现个性化CXL。Lombardo等[7]研发了一台仪器,能非侵入实时监测治疗过程中的基质内核黄素浓度,他们利用17片人供体角膜进行CXL,UVA照射期间通过分光光度法测量得到实时吸光度值,根据校准曲线得到基质内核黄素浓度,发现浸润30 min后基质中平均浓度为0.014%±0.003%,UVA照射30 min后降为0.003%±0.001%,并且角膜生物力学增强的程度与照射前基质内核黄素量以及照射时核黄素的消耗量明显相关。Lombardo[33]设计了一个由UVA光源、红-绿-蓝照相机(用于治疗过程中获取角膜的荧光图像,相机的绿色信号与核黄素的荧光光谱重叠)和一台计算机(用于管理整体操作和原始数据处理)组成的设备,用于无创性地实时测定人供体角膜中核黄素平均浓度,浸润30 min后,基质内平均浓度为0.015%±0.003%,2种UVA照射方案(3 mW/cm2×30 min和9 mW/cm2×10 min)的基质内总的核黄素浓度均呈指数下降,消耗动力学曲线无明显差异。然而,上述研究无法提供核黄素浓度随角膜深度变化的规律,且处于离体实验阶段,准确性和重复性有待进一步研究。
3.6 利用眼前节裂隙灯显微镜观察法检测在体角膜的核黄素浓度
Rubinfeld等[34]使用眼前节裂隙灯显微镜观察法评估兔眼角膜内核黄素含量,并制定了分级方案:0级为不可见绿色,1级为刚刚可见的淡绿色,2级为强于1级的可见绿色,3级为明显的绿色,4级为明亮的绿色,5级为强而明亮的绿色,该方法结果与HPLC高度相关(R2=0.940),但是结果依赖于检查者的主观评估,重复性和再现性尚未得到验证,未得到普遍应用。
3.7 利用MALDI-IMS检测角膜冰冻切片的核黄素浓度
MALDI-IMS是一种相对较新的技术,MALDI离子源由具有紫外发射的氮激光形成,激光将能量提供给基质晶体引起解吸和电离,质谱分析仪收集并检测基质和分析物(离子形式)质谱中的特定峰(组织学分辨率约50 μm),从而识别化合物或其代谢物,已用于眼部的药代动力学研究。Vinciguerra等[35]使用MALDI-IMS评估传统去上皮法、离子导入法和保留上皮法在兔角膜和人供体角膜中核黄素的浓度和分布,将20 μm厚的冰冻角膜切片干燥2 h后涂上MALDI基质,进行高分辨MALDI质谱仪分析,前2组在角膜各深度和角膜缘处均检测到核黄素信号,但离子导入组最深层的浓度稍低于去上皮组,而保留上皮组的核黄素信号极微弱。
4 总结
角膜内核黄素浓度及其分布的准确检测对于CXL安全性和有效性的评估,新型跨上皮CXL方案的评估以及个性化手术方案的设计均至关重要。目前研究中不同测量方法得出的结果差异较大,可能与测量原理、采用的组织和样品的制备有关。核黄素的无创实时检测方面已有少量的离体研究,但仍处于初步探索阶段,迫切需要在体的检测技术以满足基础和临床应用需求,并提供可靠的工具。
利益冲突申明本研究无任何利益冲突
作者贡献声明严梦迪:收集文献资料并归纳分析;撰写论文;根据修改意见进行论文修改。黄锦海、王勤美:对论文的知识性内容作批评性审阅。高蓉蓉:参与选题设计;指导资料的分析和解释;参与论文的修改
