盐碱胁迫下香椿幼苗光合及抗逆生理特性
2021-09-04巩志勇辛建华商小雨郭晓明王延平
巩志勇,辛建华,商小雨,郭晓明,王延平*
(1 黄河下游森林培育国家林业局重点实验室,山东泰安 271018;2 山东农业大学林学院,山东泰安 271018;3 山东省菏泽市林业局,山东菏泽 274011)
土壤盐碱化对农业生产构成重大威胁,培育和引种能适应盐碱环境的优良植物材料是盐碱地绿色开发的迫切需要[1-2]。中国盐碱地面积约3600万hm2,盐碱地的开发利用已上升为国家战略[3-4]。近年来,研究者对盐碱条件下植物的形态结构[5-7]、生理特征[8-9]以及生物量分配[10-11]等方面进行了研究,筛选出一些盐碱地适生的植物种类[12]。但是,盐碱地植物选择不但应注重良好生态适应性,还应注重经济效益发挥。采用经济型树种资源更有助于提升盐碱地开发综合效益。
香椿(Toonasinensis)是楝科(Meliaceae)香椿属(Toona)落叶乔木,其嫩芽可食,是中国著名的“树上蔬菜”[13];此外,其木材材性好,又有“中国桃花心木”之称,也是中国特有的珍贵树种[14]。香椿在中国已有两千多年的栽培历史,随着市场经济的发展,高效益多功能的香椿被认为是一种极具发展潜力的生态经济型树种[15]。香椿耐干旱瘠薄[16],但对其耐受盐碱能力的研究鲜见报道。本研究模拟黄泛沙地盐渍化土壤环境[17],通过设置中性盐和碱性盐混合的盐碱胁迫梯度处理,探究盐碱胁迫对香椿幼苗光合及抗逆生理指标的影响,揭示盐碱胁迫下香椿幼苗生理响应机制,以期定量评估香椿对盐碱胁迫的耐受能力,从而为今后开展盐碱地香椿栽培技术研究提供科学依据。
1 材料和方法
1.1 试验材料
供试香椿种源来自于山东省济南市章丘区盆崖村。经前期对比,该种源香椿椿芽产量高,香味浓郁,种子发芽率高,是较理想的菜用香椿资源。课题组于2019年10月中旬在该地区采集香椿母树种子,翌年4月经催芽处理后播于山东农业大学林学试验站温室中,常规养护管理,以当年香椿幼苗进行盆栽试验。
1.2 混合盐碱胁迫处理
盐碱土由盐化土壤和碱化土壤组成,盐化主要由 NaCl 和 Na2SO4引起,碱化主要由 Na2CO3和 NaHCO3引起[17]。因此,本试验选用2种中性盐NaCl、Na2SO4和2种碱性盐NaHCO3、Na2CO3按一定比例混合制成处理液,通过基质浇灌模拟盐碱土环境。其中,碱性盐设置AⅠ(pH=7.16)、AⅡ(pH=8.47)、AⅢ(pH=9.91) 3个水平,同时各碱水平内设置S50(50 mmol/L)、S100(100 mmol/L)、S150(150 mmol/L)、S200(200 mmol/L) 4个盐浓度,总计12个混合盐碱处理组合;以无盐无碱土壤作为对照(CK)。将上述配制的处理液浇灌香椿幼苗并计算土壤含盐量 (表1)。由于组内pH值变化不大,采用各处理组的pH平均值表示各组的碱水平。
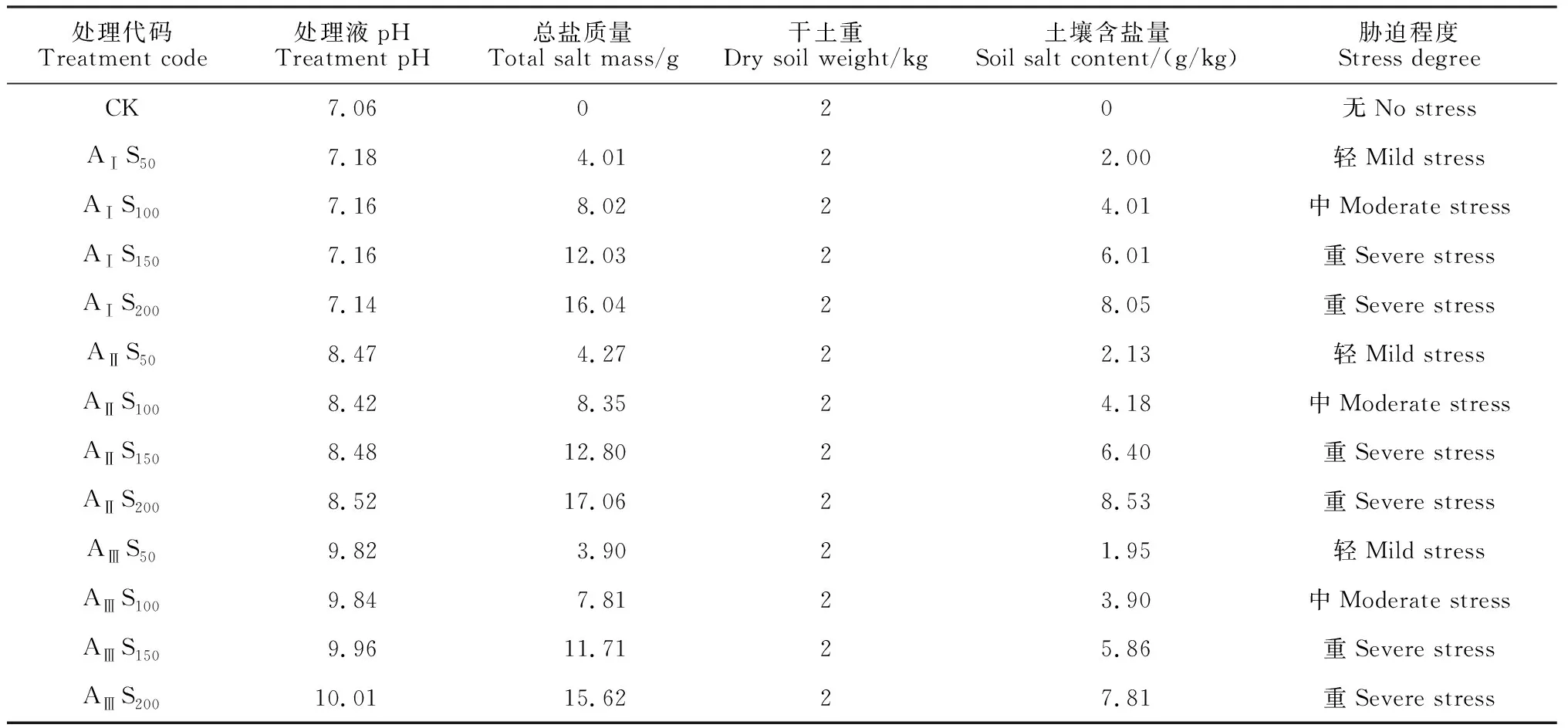
表1 盐碱混合各处理组盆栽土壤盐碱概况
称取2.0 kg自然晾干栽培基质(壤土、细沙、蛭石按照体积比2∶1∶1混合土壤,容重1.307 g/cm3,pH 7.09,肥力中等)放入花盆中(盆直径 25 cm,高 25 cm,盆底套上塑料盆防止盐分流失)。量取上述各处理溶液800 mL,平均分为2份,连续2 d 加入基质中(为防止一次性加入盐溶液质量分数过高导致植物出现烧苗现象)。其后,将各处理盆栽称重,后期每天18:00前进行称重补水,尽力保证盆栽土壤盐碱水平稳定,胁迫持续35 d后进行相关指标的测定。
1.3 测定指标及方法
1.3.1 光合指标使用LI-6800 便携式光合仪(LI-Cor Inc 美国),于上午 9:00~11:00取幼苗中上部相同部位3片叶,在饱和光强下(1 200 μmol·m-2·s-1,流速 500 mL·min-1,CO2浓度为400 μmol·mol-1,叶室温度为28 ℃)测定净光合速率(Pn)、气孔导度(Gs)、胞间 CO2浓度(Ci) 、蒸腾速率(Tr) 等指标。每处理重复测3次,并计算得到瞬时水分利用效率(WUEi=Pn/Tr)。
1.3.2 光响应曲线选取幼苗中部生长良好的叶片为测定对象,采用光合仪自动模式进行测定,光照强度设置为 1 400、1 200、1 000、800、600、400、200、150、100、50、0 μmol·m-2·s-1。每次测定前进行一次匹配。净光合速率(Pn)对光强的响应进程用叶子飘[18]报道的双曲线修正模型进行拟合。根据拟合光响应曲线,计算最大净光合速率(Pnmax)、光饱和点(LSP)、光补偿点(LCP)、暗呼吸速率(Rd)。
1.3.3 生理生化指标每盆采集香椿幼苗复叶3片,将同处理的小叶混合成待测样品。参照李合生的方法[19],95%乙醇浸提法测定叶绿素含量,氮蓝四唑比色法测定超氧化物歧化酶(SOD)活性,愈创木酚比色法测定过氧化物酶(POD)活性,酸性茚三酮比色法测定脯氨酸(Pro)含量,考马斯亮蓝 G-250 比色法测定可溶性蛋白含量,蒽酮比色法测定可溶性糖含量,硫代巴比妥酸法测定丙二醛(MDA) 含量。
1.4 数据处理
采用 Excel 和 SPSS软件进行数据分析,用Origin软件绘制统计图。
2 结果与分析
2.1 盐碱胁迫对香椿幼苗地上部形态特征的影响
由图1可看出,在S50盐浓度下,各碱水平处理的香椿幼叶叶片舒展、浓绿,植株整体长势良好,与对照差异不明显;在S100盐浓度下,随碱水平的逐渐增加,植株叶尖逐渐发黄、干枯,但总体长势尚可;而在S150、S200两个盐浓度下,各碱水平处理的香椿叶片大部分发黄、枯萎甚至开始脱落,植株长势较差,尤其在AⅡ和AⅢ碱水平处理下,叶片大量脱落。上述地上部形态特征说明,盐碱胁迫对香椿幼苗生长具有显著影响,其中,香椿幼苗地上部生长对碱水平的响应强于盐胁迫,且随胁迫程度增加盐碱交互效应越明显。

图1 盐碱胁迫下香椿幼苗地上部形态特征Fig.1 Aboveground morphological characteristics of T. sinensis seedlings under saline-alkali stress
2.2 盐碱胁迫对香椿幼苗叶片光合气体交换参数的影响
随着盐碱浓度的增加,香椿幼苗叶片净光合速率、蒸腾速率、气孔导度和瞬时水分利用效率总体呈现出下降趋势,而胞间二氧化碳浓度有上升趋势(图 2)。其中,AⅠS50处理下,香椿幼苗叶片净光合速率、蒸腾速率、气孔导度、水分利用效率与对照相比无显著差异(P> 0.05),而胞间二氧化碳浓度显著低于对照(P< 0.05);但随碱水平增加,AⅡS50和AⅢS50处理香椿净光合速率比对照分别显著下降36.5%和24.6% (P< 0.05),而它们的蒸腾速率、胞间二氧化碳浓度、瞬时水分利用效率与对照相比仍没有显著差异(P> 0.05)。在AⅠS100处理中,除胞间二氧化碳浓度显著增加外,香椿幼苗叶片各光合指标与对照均没有显著差异(P> 0.05);但随碱水平增加,AⅡS100和AⅢS100处理香椿叶片净光合速率、气孔导度、瞬时水分利用效率均显著低于对照(P< 0.05);而蒸腾速率和胞间二氧化碳浓度在AⅡ碱水平下与对照无显著差异(P> 0.05),而在AⅢ碱水平下差异达显著水平(P<0.05)。在S150和S200两个盐浓度下,各碱水平下的香椿叶片光合参数与对照相比均显著下降(P<0.05)。可见,碱水平对香椿幼苗叶片光合参数影响更大,其次是盐浓度水平。
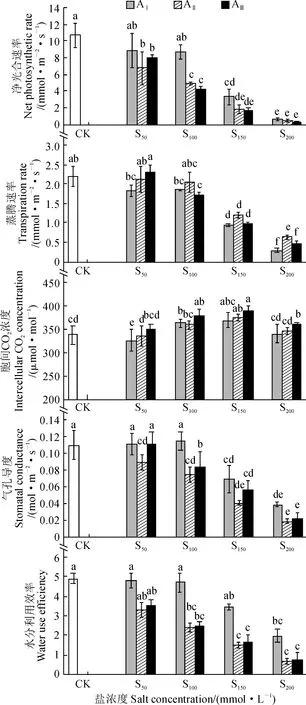
图中数据为平均值 ± 标准差,不同小写字母表示在0.05水平差异显著(P<0. 05),下同图2 盐碱胁迫下香椿叶片光合参数的变化The data are mean ± standard deviation. The different lowercase letters on the error bar mean significant difference between treatments and CK at 0.05 level (P<0. 05). The same as belowFig.2 The changes of photosynthetic parameters in leaves of T. sinensis seedling under saline-alkali stress
2.3 盐碱胁迫下香椿幼苗的光响应特征
利用直角双曲线模型分别对不同盐碱胁迫下香椿幼苗的光合-光响应曲线进行拟合,各方程的拟合系数均在 0.97以上(表2),能较好地反映不同盐碱胁迫条件下香椿叶片的光响应过程。各盐碱胁迫处理香椿幼苗叶片Pn随光合有效辐射 (PAR)的增加均逐渐上升,当PAR增加到一定程度(达到光饱和点)后开始下降(光抑制)并逐渐趋于平稳(图3)。其中,在AⅠ-ⅢS50、AⅠS100处理下,随PAR的增加,香椿幼苗叶片Pn上升速率较快且最大净光合速率高,其光合能力未受显著影响;而在AⅡ-ⅢS150、AⅠ-ⅢS200处理下,随着PAR的增加,叶片Pn上升速率变慢且最大净光合速率趋近于0,幼苗的光合效率极低。
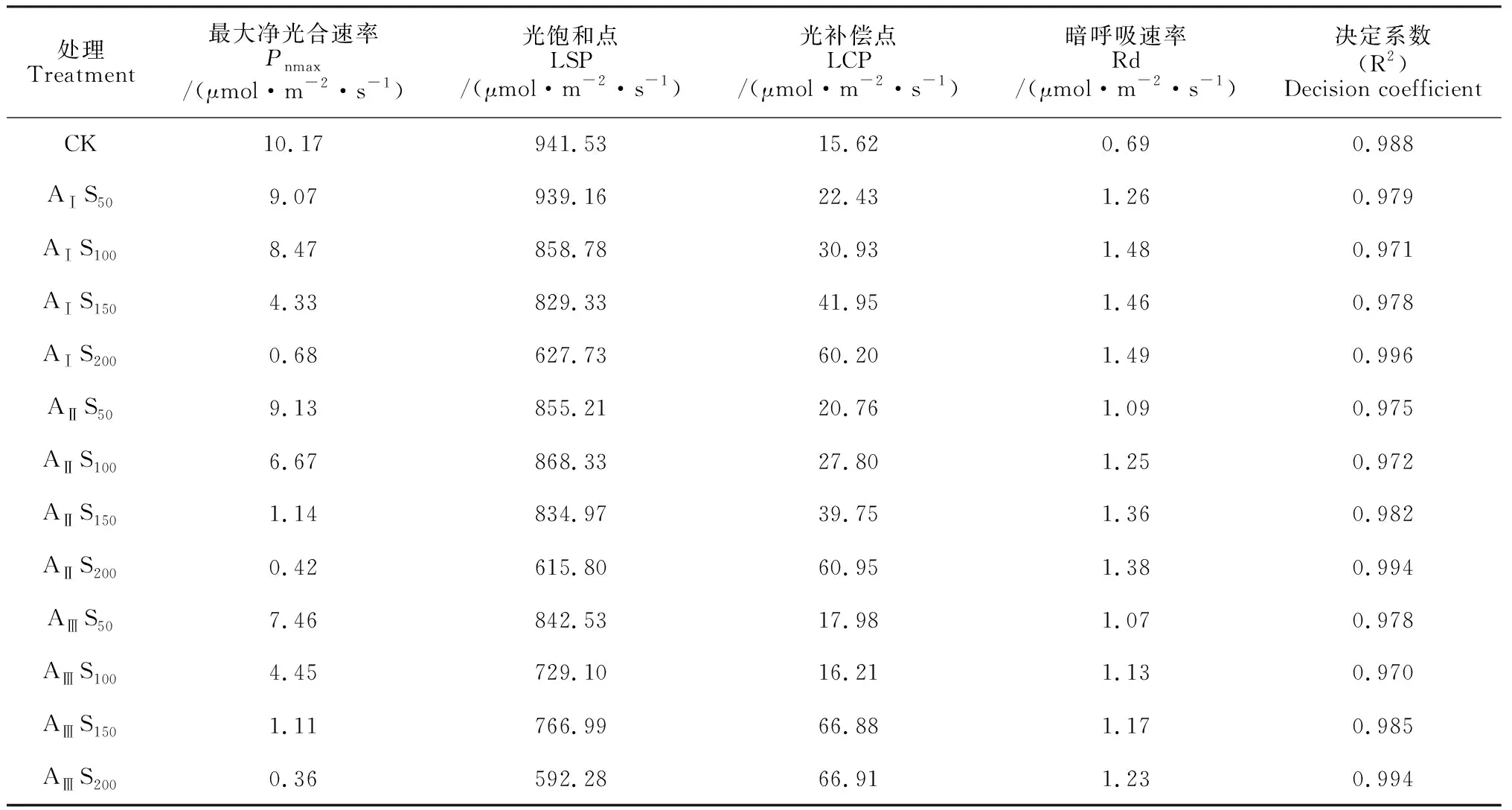
表2 不同盐碱胁迫下光响应模型拟合的特征参数
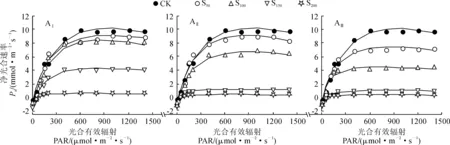
图3 盐碱胁迫下香椿净光合速率随光合有效辐射的变化Fig.3 Changes of net photosynthetic rate with photosynthetically active radiation under saline-alkali stress
同时,从表2可知,随着盐碱胁迫程度的逐渐增加,香椿幼苗的最大净光合速率(Pnmax)、光饱和点(LSP)均呈现出不同程度的下降,而其光补偿点(LCP)、暗呼吸速率(Rd)总体呈上升趋势。其中,在AⅠ碱水平下,AⅠS50和AⅠS100处理叶片Pnmax分别低于对照10.84%、16.68%,LSP分别低于对照0.25%、8.79%,总体上保持着较高的光能利用率;在AⅡ碱水平下,仅AⅡS50处理叶片Pnmax低于对照10.23%,LSP未见明显下降;而在AⅢ碱水平时,只有AⅢS50处理香椿幼苗叶片Pnmax和LSP比对照分别降低26.65%和10.51%,还维持较高的光能利用率。以上结果说明香椿幼苗光能利用效率随盐碱胁迫的加重而逐渐降低。
2.4 盐碱胁迫对香椿叶片叶绿素含量的影响
表3显示,在AⅠ碱水平下,香椿幼苗叶片各叶绿素含量总体上随着盐胁迫程度的增加而呈现出先升高后降低的趋势,并均在S100时达到最大值;叶绿素a、叶绿素b及叶绿素总含量在盐浓度为S100时分别比对照显著增加4.46%、133.80%和44.73%,叶绿素a和叶绿素总含量在S200时分别比对照显著降低38.22%和24.56%,各叶绿素含量在其余盐浓度胁迫下均与相应对照无显著差异。在AⅡ碱水平下,各叶绿素含量均随着盐浓度的增加而逐渐降低,在盐浓度为S50和S100时均不同程度地高于对照,且S100时叶绿素总含量增幅达到显著水平;在盐浓度达到S150和S200时均不同程度地低于对照,并在S200时降幅均达到显著水平,分别为39.49%、54.93%和48.68%。在AⅢ碱水平下,各叶绿素含量均随着盐浓度的增加而基本呈逐渐降低趋势,在盐浓度为S50时均不同程度地高于对照,且叶绿素a和叶绿素总含量均达到显著水平;在其余盐浓度处理下,各叶绿素含量均显著低于对照(P< 0.05)。可见,香椿幼苗叶片叶绿素含量总体呈现对碱胁迫较为敏感,叶绿素a含量的变化幅度又大于叶绿素b。
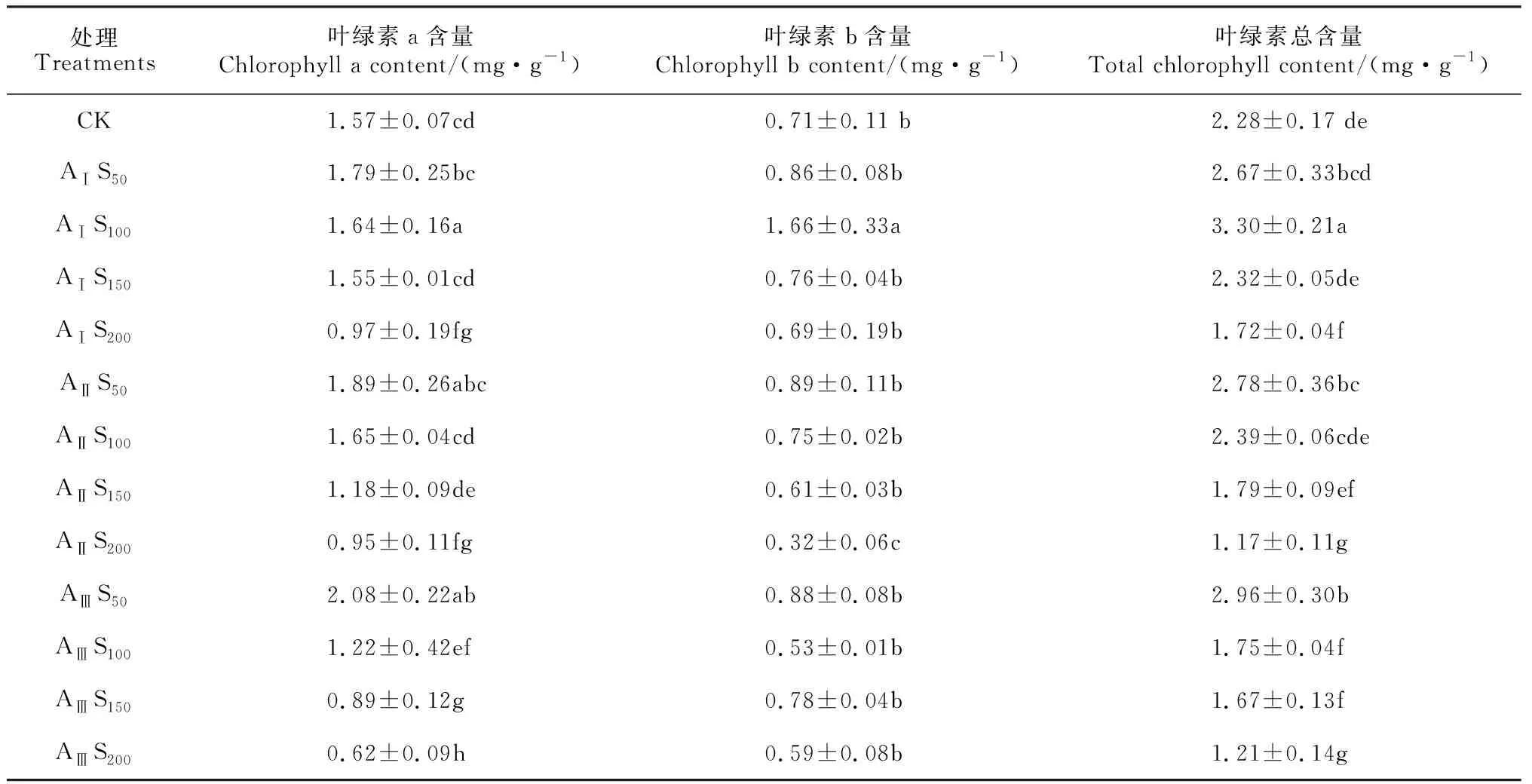
表3 盐碱胁迫下香椿叶片叶绿素含量的变化
2.5 盐碱胁迫对香椿幼苗细胞膜透性、丙二醛含量及抗氧化酶活性的影响
从图4可以看出,各盐碱处理香椿幼苗叶片相对电导率均显著高于对照;在相同碱水平下,随着盐浓度的增加,香椿叶片相对电导率逐渐增大;各碱水平下的叶片相对电导率在S50、S100盐浓度处理时均低于40%,而在S150、S200盐浓度处理时均高于60%。香椿幼苗叶片丙二醛(MDA)含量在S50盐浓度处理时随碱水平的增加而逐渐降低,但在AⅠ碱水平下显著高于对照;在S100、 S150、S200三个盐浓度处理下,叶片MDA含量随碱水平增加逐渐升高并显著高于对照(P< 0.05)。上述结果说明,盐碱胁迫容易导致香椿叶片细胞膜受损进而可能影响正常细胞代谢功能。

图4 盐碱胁迫下香椿幼苗叶片相对电导率及丙二醛含量的变化Fig.4 Relative electrical conductivity and MDA content in leaves of T. sinensis seedlings under saline-alkali stress
另外,随着盐浓度增加,各碱水平处理香椿幼苗叶片的超氧化物歧化酶(SOD)活性呈先上升后下降的趋势(图5),并分别在S100(AⅠ)和S50(AⅡ、AⅢ)达到最大值;除AⅢS150处理叶片SOD活性与对照相近,以及AⅠ-ⅢS200处理叶片SOD活性显著低于对照外,其余盐碱处理SOD活性均显著高于对照(P< 0.05);AⅠS100处理叶片SOD活性在各盐碱处理中最高,显著高于对照71.7%(P< 0.05)。同时,隔各盐碱处理香椿幼苗叶片过氧化物酶(POD)活性随着盐(碱)浓度的增加均呈现逐渐上升的趋势,并均显著高于对照(P< 0.05)。说明香椿叶片SOD活性在中低盐胁迫水平受到显著诱导,而在高盐浓度下(S200)受到抑制,而叶片POD活性各盐碱胁迫下都得到显著增强,即香椿幼苗可以通过调控抗氧化酶活性来适应盐碱胁迫环境。
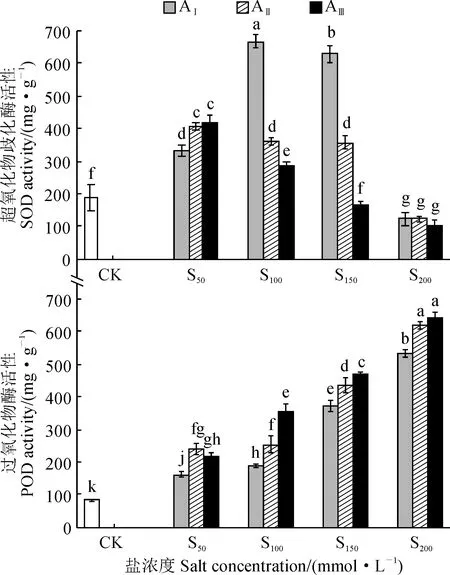
图5 盐碱胁迫下香椿幼苗抗氧化酶活性的变化Fig.5 The antioxidant enzyme activity in leaves of T. sinensis seedlings under saline-alkali stress
2.6 盐碱胁迫对香椿幼苗渗透调节物质含量的影响
图6显示,随盐碱胁迫浓度的增加,香椿幼苗叶内脯氨酸含量逐渐增加,而叶片可溶性蛋白和可溶性糖含量均先升高后下降,并均在盐浓度为S100或者S100时达到最大值。其中,香椿幼苗叶内脯氨酸的含量在各盐碱处理下均显著高于对照(P< 0.05);各碱水平下的叶片可溶性蛋白含量均在盐浓度S100处理时达到最大值且显著高于对照(P< 0.05),AⅠ、AⅡ、AⅢ碱水平增幅分别为63.18%、55.93%、58.04%;各碱水平下叶片可溶性糖含量在S50、S100、S150盐浓度处理时也均显著高于对照(P< 0.05)。以上结果说明香椿幼苗在盐碱胁迫时仍可以通过调控渗透调节物质含量来适应盐碱胁迫环境。
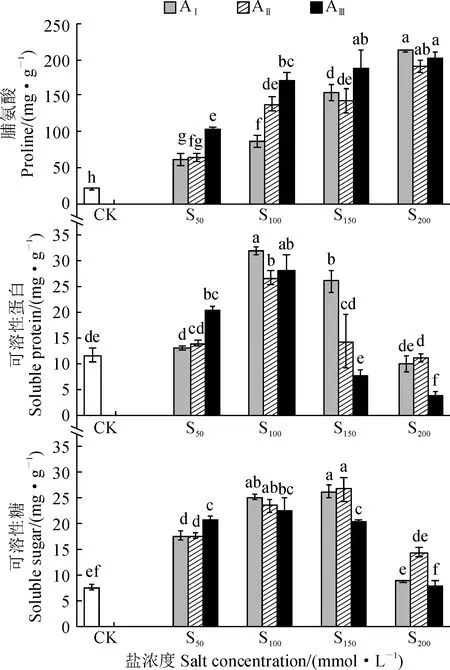
图6 盐碱胁迫下香椿幼苗渗透调节物质含量的变化Fig.6 The content of osmotic regulation substances in leaves of T. sinensis seedlings under saline-alkali stress
3 讨 论
3.1 香椿对盐碱胁迫的光合响应
光合作用对植物体生长发育和生态适应均具有重要意义[20-21],叶片光合参数是衡量植物光合效率的重要指标[22]。通常情况下,盐碱逆境通过渗透胁迫、离子毒害等过程影响植物光合能力[23]。研究表明,高盐碱胁迫下植物叶片净光合速率、气孔导度、蒸腾速率等光合参数都会下降[24]。其中,气孔导度的下降意味着植物从环境中吸收CO2的能力降低,从而引起光合碳同化能力减弱[25];而蒸腾速率下降可以减缓植物对盐分离子的吸收。本研究发现,香椿幼苗光合参数净光合速率、蒸腾速率、水分利用效率、最大净光合速率等在盐浓度为S50处理下受碱水平的胁迫影响较小,其光合效率较高;而当盐浓度为S100时,AⅠ水平下叶片光合效率仍然较高,而AⅡ和AⅢ水平下光合效率明显下降,这说明随着盐浓度逐渐增加,香椿幼苗叶片光合参数受碱胁迫的影响加大,盐碱交互胁迫开始逐渐增强,香椿幼苗的光合能力受到明显抑制。这与刘建新等[26]在燕麦幼苗上的研究结果一致。此外,有研究表明,影响植株Pn降低的因素分为气孔因素(净光合速率、气孔导度及胞间二氧化碳浓度同时下降)和非气孔因素(净光合速率、气孔导度下降,胞间二氧化碳浓度增加)[27-28],从本研究结果来看,在盐碱胁迫条件下,非气孔因素可能是影响香椿幼苗光合能力下降的主导因素。
叶绿素是植物进行光合作用的重要光合色素,参与光合作用中光能的吸收、传递和转化功能,其含量的多少能够直接反映叶片光合能力的强弱[29]。盐碱胁迫会破坏叶片叶绿体结构,打破叶绿素合成与降解的动态平衡,从而导致光合作用受抑制[30-31]。本研究发现,在碱水平为AⅠ时,香椿幼苗叶片内叶绿素含量在盐浓度为S150处理中仍然保持着较高水平,而当碱水平继续逐渐升高时,叶绿素含量明显下降。这可能是由于较高的pH值破坏了土壤中离子的稳态,使与叶绿素合成有关离子如 Fe2+、Cu2+、Mg2+等沉淀,进而打破了叶绿素合成与分解的动态平衡,从而导致叶绿素含量降低。此外,当碱度较低时,叶绿素 b 含量开始下降的盐浓度值要低于叶绿素 a,说明叶绿素 a对盐碱混合胁迫的敏感性高于叶绿素 b。
3.2 香椿幼苗在盐碱胁迫下的抗逆生理生化特征
细胞膜承担着调节和控制细胞内外正常的物质运输和交换的任务,主要由磷脂和蛋白质组成,具有选择透过性[32]。盐碱胁迫导致细胞膜结构受损,膜透性增大,细胞内的电解质外渗,继而导致电导率升高。因此,相对电导率可表征植物受盐碱胁迫伤害的程度,即相对电导率越大,则细胞膜透性越大[33]。此外,植物细胞膜系统在遭受盐碱胁迫后还会引起膜脂过氧化反应[34],其中丙二醛(MDA)作为膜脂过氧化反应的主要产物之一,其含量的多少在一定程度上反映出膜损伤程度的大小[35]。本研究中,随着盐碱胁迫增加,香椿叶片相对电导率、MDA含量逐渐上升,但当盐浓度为S50和S100处理时,各碱水平下的相对电导率、MDA与对照相比增加较少且含量较低;而当盐浓度增加到S150和S200处理时,二者的含量明显增加。这说明当盐浓度较低时,香椿叶片细胞膜的损伤程度较小,随着盐浓度继续增加,膜结构严重受损。
同时,逆境胁迫下植物体内抗氧化酶活性会增强或维持较高的水平,这对于植物适应逆境和减少伤害起着重要作用[36]。其中,SOD有助于将氧自由基团转变为H2O2和O2,减轻自由基对植物体细胞的危害;而POD 则具有去除H2O2和酚类等毒性物质的重要功能[37-38]。本研究中,随着盐浓度增加,各碱水平下香椿叶片SOD活性呈先上升后下降的趋势,POD活性亦呈上升的趋势。这说明香椿可通过自身调节,诱导增强SOD和POD活性来保护细胞膜免受伤害。
另外,植物在代谢过程中通过脯氨酸、可溶性蛋白、可溶性糖等渗透调节物质的合成和积累来缓解胁迫对植物造成的伤害[39-40]。其中,脯氨酸可以作为细胞质的渗透调节物质和防脱水剂,参与维持细胞的含水量和膨压,增强细胞结构的稳定性[41-42]。可溶性糖和可溶性蛋白是植物在逆境下重要的渗透调节物质[43],当植物受到逆境胁迫时,进行渗透调节从而减轻植物的受伤害程度。通常情况下,因植物种类不同,参与渗透调节的物质以及调节强度会产生差异[44]。本研究表明,可溶性糖、可溶性蛋白随着盐碱胁迫增大,其含量先增加后降低。其中,在盐浓度为S100处理时,各碱水平下的可溶性蛋白含量均达到最大值,可溶性糖含量在S50、S100、S150盐浓度处理时,各碱水平下的含量也均显著高于对照。这说明说明香椿幼苗可在一定程度上通过积累可溶性蛋白,可溶性糖等大分子物质来抵御盐碱胁迫。
综上所述,在本试验条件下,香椿幼苗对碱胁迫表现出比盐胁迫更强的敏感性;当土壤pH <8.4,盐含量<4.0 g/kg时,香椿幼苗地上部整体长势良好,叶片组织内的抗氧化酶活性、渗透调节物质仍能高效的发挥作用,光合效率也维持在较高水平。因此,香椿能够耐受一定程度的盐碱,具备在盐碱地上栽培的潜能。
