混合盐碱胁迫对醉马草种子萌发及幼苗生理特性的影响
2021-03-22陈雅琦苏楷淇陈泰祥李春杰
陈雅琦,苏楷淇,陈泰祥,李春杰
(兰州大学草地农业生态系统国家重点实验室,兰州大学草地农业农村部草牧业创新重点实验室,兰州大学草地农业教育部工程研究中心,兰州大学草地微生物研究中心,兰州大学甘肃省西部草业技术创新中心,兰州大学草地农业科技学院,甘肃兰州730020)
醉马草(Achnatherum inebrians)为禾本科芨芨草属多年生禾草,属冷季型禾草,在我国新疆、甘肃、青海、陕西等地均有分布[1]。Bruehl 等[2]于 1994 年发现醉马草草种内携带内生真菌(Epichloë gansuensis),且携菌高达 95%以上[2-3]。研究表明,醉马草生长快、竞争强,内生真菌的侵染提高了醉马草对低温[4]、干旱[5]、病虫[6-7]、盐碱等逆境的耐受性[8-9];此外,内生真菌产生的有毒生物碱吲哚二帖(indole-diterpenes)、麦角生物碱(ergot alkaloids)使醉马草在成坪期间免受啃食[10-12]。因此,醉马草具有成为西北地区优良草坪草种的巨大潜力。我国西北地区的自然环境为醉马草的选育和栽培提供了适宜条件,但因当地降水量少且蒸发量大而发生的轻微淋溶反应使土壤环境呈现碱性[13-14]。此外,在地势较低或地下水位较高的地区,长期缺水或过量灌溉会使土壤盐分通过毛管作用在耕作层积聚,造成次生盐渍化危害,影响植物的正常生长发育,限制农牧业的发展[15]。研究盐碱胁迫对醉马草生长的影响,对栽培和选育适宜西北地区耐盐碱草坪草种,缓解土地资源紧张,生态恢复等方面具有重要意义。
关于草坪草对盐胁迫的响应,前人研究多涉及中性盐如NaCl 等盐胁迫对种子萌发、生长发育、抗氧化酶特性、光合特征等方面[16-18],并将渗透调节与Na+单盐毒害效应归为盐胁迫危害的主因,而对兼有碱盐胁迫的研究鲜有报道[19]。事实上,自然环境下的土壤盐碱成分通常颇为复杂,盐化和碱化常同时发生。西北地区盐化土地面积已达全国总面积的69.03%[20],其中大部分属复合型盐碱地,主要由中性盐NaCl、Na2SO4和碱性盐NaHCO3、Na2CO3组成。研究表明,相较NaCl 等中性盐,兼有NaHCO3及Na2CO3等碱性盐的混合盐碱土地具有更高的pH值,而高pH 往往会破坏土壤结构引发土壤板结[21]。此外高pH 土壤环境易使植物体内Ca2+、Mg2+和H2PO4-等离子沉淀析出,致使植物体内离子失衡,严重抑制植物生长[22-23]。种子萌发及幼苗生长是植物生长发育重要且敏感的时期[24-25],也是醉马草建植成功的关键。因此,本研究利用NaCl、Na2SO4、Na2CO3和NaHCO3按照一定比例混合以模拟西北盐碱土壤环境,以明确混合盐碱胁迫对醉马草种子萌发和幼苗抗氧化酶等生理特性的影响,为醉马草耐盐品种的选育及其在西北盐碱地区的成功建植提供理论依据。
1 材料与方法
1.1 试验材料
供试醉马草草种于2019 年8 月采自甘肃省甘南藏族自治州夏河县(自然条件详见表1),镜检法[26]测定其带菌率为100%,参考李娜娜等[27]的方法将1/2的醉马草种子浸泡在有效成分70%的甲基托布津药剂中2 h 以灭除内生真菌,灭菌后镜检测定,直至确认带菌率为0,以获得E-醉马草种子。
为避免种子污染,将覆有双层滤纸的培养皿(直径为12 cm)高温(150 ℃)消毒20 min 备用。

表1 采样地自然气象条件Table 1 The meteorological condition of sites
1.2 试验方法
依据西北地区盐碱土壤组成[28],并参考赵颖等[29]的方法模拟混合盐碱胁迫环境,选取中性盐(NaCl、Na2SO4)和碱性盐(NaHCO3、Na2CO3)按照一定摩尔比例混合,并以碱性盐比例递增的顺序设置5 个处理组,依次为A、B、C、D、E(表 2),其混合盐碱处理液总浓度均设为50、100、150、200 mmol·L-1,蒸馏水作对照组CK。选取饱满、大小均一且无病害的成熟草种,用质量分数为2%的次氯酸钠消毒10 min,用蒸馏水冲洗5 遍后用于后续萌发及幼苗生长试验。两组醉马草内生真菌处理(带菌E+和不带菌E-)共计40 个处理,每个处理重复3 次,共120 皿。每皿30 粒,加入相应浓度的混合盐碱处理液,每日更换。培养温度为25 ℃,光照时数为8 h·d-1。每24 h 观察记录一次种子萌发状况,第20 天取幼苗测定其生长指标及抗氧化酶活性,并根据相关指标综合评定E+和E-醉马草的耐盐性。

表2 各处理盐碱组分和摩尔比例及pH 值Table 2 Salts composition,molar ratio and pH value of mixed saline-alkali treatment
以胚芽突破种皮且超过种子本身长度1/2 时作为萌发标准,种子萌发指标及计算公式如下:


式中:Gi为不同培养天数发芽种子数,Dt为相应的培养天数。
发芽结束后,每个处理随机取样10 株,分别测量幼苗高度(S)和胚根长(radicle length,RL);称重法测定幼苗地上部分干重及胚根鲜重,不足10 株则全部测量,取其平均值。幼苗生长指标及计算公式如下:

测定幼苗生理特性指标:采用愈创木酚法测定过氧化物酶活性(peroxidase,POD)[30];氮蓝四唑法测定超氧化物歧化酶活性(superoxide dismutase,SOD)[31];紫外吸收法测定过氧化氢酶活性(catalase,CAT)[32];磺基水杨酸法测定脯氨酸含量(proline)[33];硫代巴比妥酸法测定丙二醛含量(malondialdehyde,MDA)[32]。
1.3 综合耐盐碱性评价指标
1.3.1 模糊隶属函数综合评价法 采用模糊隶属函数法分别计算E+和E-醉马草种子萌发阶段及幼苗生长阶段的耐盐隶属函数值,并据此对E+和E-醉马草的耐盐性进行综合评价[33]。计算公式如下:

式中:μ(Xj)代表第j个指标的隶属函数值;Xj代表第j个指标值;Xmin代表第j个指标的最小值;Xmax代表第j个指标的最大值;耐盐性与指标成正相关时采用公式(1)计算,呈负相关时则采用公式(2)进行计算。
1.3.2 单项指标主成分分析 为筛选醉马草耐盐性的主要对比指标,参照文献[34]对E+和E-醉马草的各单项指标的耐盐系数ω分别进行主成分分析,其计算公式如下:

1.4 数据分析
利用Microsoft Excel 2010 进行数据输入和整理,采用SPSS 20.0 统计软件对数据分析,以Duncan’s 新复极差法进行多重比较。
2 结果与分析
2.1 不同混合盐碱胁迫对醉马草种子萌发的影响
2.1.1 不同混合盐碱胁迫对醉马草种子发芽率和发芽势的影响 由表3 可知,在任一混合盐碱胁迫处理下,E+和E-醉马草种子的发芽率均随盐浓度的升高呈下降趋势,其中E+醉马草在A 处理50 mmol·L-1盐浓度下的发芽率略高于E+的对照组且无显著差异,表明A 处理下的轻度盐碱胁迫对E+醉马草种子萌发无显著影响。除50 mmol·L-1盐浓度下的B 处理E+醉马草发芽率大于D 处理外,不同混合盐碱处理下,同一盐浓度的E+醉马草发芽率从大到小依次为:A>D>B>C>E。其中50 mmol·L-1盐浓度下的A 与B、B 与C、C 与D 处理间无显著差异,E 处理与其余混合盐碱处理间均为显著差异;100 mmol·L-1盐浓度下,除B 处理下结果呈显著差异,其余混合盐碱处理间均无显著差异;150 mmol·L-1盐浓度下的B、C 间无显著差异;200 mmol·L-1盐浓度下的B、C、D、E 间无显著差异。由此可知,随盐浓度的升高,各混合盐碱处理间E+醉马草发芽率差异减小且在高浓度下(≥150 mmol·L-1)显著低于E+对照组。表明高盐浓度(≥150 mmol·L-1)下,不同混合盐碱胁迫均对E+醉马草的种子萌发具有显著抑制作用。除50 mmol·L-1盐浓度下的B 处理E+醉马草种子发芽率大于D 处理和100 mmol·L-1盐浓度下的B 和C 处理大于D 处理外,不同混合盐碱处理下,随盐浓度的升高,E-与E+醉马草种子发芽率变化趋势相似,各混合盐碱处理间E-醉马草种子发芽率差异减小且在中高浓度下(≥100 mmol·L-1)显著低于E+对照组。表明中高盐浓度(≥100 mmol·L-1)下,不同混合盐碱胁迫均对E-醉马草的种子萌发具有显著抑制作用。与E+对照组相比,A 处理下的E+醉马草在高盐浓度(≥200 mmol·L-1)时发芽率显著降低,降低49.33%;B 处理下的E+醉马草在中高盐浓度(≥100 mmol·L-1)时发芽率显著降低,较对照组分别降低50.67%、76.00%、89.33%;C 处理下的E+醉马草在中高盐浓度(100 mmol·L-1)发芽率显著降低,分别降低77.33%、82.67%、93.33%;在盐浓度50 mmol·L-1及以上时,D 处理下的E+醉马草发芽率显著降低,分别降低20.00%、30.67%、44.00%、86.67%;在盐浓度50 mmol·L-1及以上时,E 处理下的E+醉马草发芽率显著降低,分别降低66.67%、90.67%、90.67%,在200 mmol·L-1时,种子停止萌发。由此可知,A 处理下,高盐浓度可显著抑制E+醉马草种子萌发;中盐浓度可显著抑制种B、C 处理下E+醉马草种子萌发;低盐浓度可显著抑制D、E 处理下E+醉马草种子萌发。A 处理下的E-醉马草较E-对照组,其发芽率在中盐浓度(100 mmol·L-1)时显著降低,分别下降21.84%、59.77%;B 处理下的E-醉马草在中盐浓度(≥100 mmol·L-1)时发芽率显著降低,分别降低59.77%、73.56%、79.31%;在盐浓度50 mmol·L-1及以上时,C 处理下的E-醉马草发芽率显著降低,分别降低45.98%、62.07%、82.76%、94.25%;盐浓度50 mmol·L-1及以上时,D 处理下的E-醉马草发芽率显著降低,分别降低51.72%、56.32%、68.97%、97.70%;在盐浓度50 mmol·L-1及以上时,E 处理下的E-醉马草发芽率显著降低,分别降低85.06%、91.95%、91.95%,在200 mmol·L-1时,种子停止萌发。中盐浓度可显著抑制A、B 处理下E-醉马草种子萌发;低盐浓度可显著抑制C、D、E 处理下E-醉马草种子萌发。此外,不同混合盐胁迫下的E+醉马草发芽率高于E-,且当两者处于A、B 处理的中高盐浓度时,E+醉马草发芽率显著高于E-;两者处于C、D、E 处理的低盐浓度时,E+醉马草发芽率显著高于E-。
由表3 可知,在任一盐碱混合胁迫下,E+和E-醉马草的发芽势均随着胁迫浓度的升高呈现下降的趋势,其中E+醉马草在混合盐碱A 处理下的50 mmol·L-1的发芽势高于CK 组且无显著差异,表明A 处理下的50 mmol·L-1盐浓度轻微盐碱胁迫对E+醉马草发芽势无显著影响。除50 mmol·L-1处理下的C 处理E+发芽势大于B 处理和150 mmol·L-1处理下的D 处理E+醉马草发芽势大于A 处理外,同一浓度的E+醉马草的发芽势从大到小依次为:A>D>B>C>E。其中50 mmol·L-1盐浓度下的B 与C、C 与 D 处理间无显著差异,A、E 处理与其余混合盐碱处理间均显著差异;除100 mmol·L-1盐浓度下的B 与C,A 与D 间无显著差异外,其余混合盐碱处理间均为显著差异;150 mmol·L-1盐浓度下的 A、B、D 间无显著差异;200 mmol·L-1盐浓度下的 B、C、D、E 间无显著差异。由此可知,随盐浓度的升高,各混合盐碱处理间E+醉马草发芽势差异减小且在高浓度下(≥150 mmol·L-1)显著低于E+对照组。表明高盐浓度(≥150 mmol·L-1)下,不同混合盐碱胁迫均对E+醉马草的种子萌发具有显著抑制作用。E-醉马草在混合盐碱A 处理下的50 mmol·L-1的发芽势高于CK 组且无显著差异,不同混合盐碱处理下,随盐浓度的升高,E-醉马草发芽势呈下降的趋势。其中A、B 处理下低中盐浓度间E-醉马草发芽势无显著差异,各混合盐碱处理间E-醉马草发芽势差异减小且在中高浓度下(≥100 mmol·L-1)显著低于E-对照组CK,表明中高盐浓度(≥100 mmol·L-1)下,不同混合盐碱胁迫均对E-醉马草的种子萌发具有显著抑制作用。与E+对照组相比,A 处理下的E+醉马草在高盐浓度(≥100 mmol·L-1)时发芽势显著降低,较对照组分别降低27.42%、48.39%、56.45%;B 处理下的E+醉马草在中高盐浓度(盐浓度≥100 mmol·L-1)时发芽势显著降低,较对照组分别降低64.52%、72.58%、87.10%;C 处理下盐浓度≥100 mmol·L-1的E+醉马草在盐浓度处理下发芽势显著降低,分别降低75.81%,83.87%、91.94%;在盐浓度100 mmol·L-1及以上时,D 处理下的E+醉马草发芽势显著降低,分别降低27.42%、38.71%、83.87%;在盐浓度50 mmol·L-1及以上时,E 处理下的E+醉马草发芽势显著降低,分别降低70.97%、88.71%、88.71%,在200 mmol·L-1时,种子停止萌发。由此可知,A、B、C处理下,高盐浓度可显著抑制E+醉马草种子萌发;低盐浓度可显著抑制D、E 处理下E+醉马草种子萌发。A 处理下的E-醉马草较E-对照组,其发芽势在中高盐浓度(≥150 mmol·L-1)时显著降低,分别下降60.00%、66.67%;B 处理下的E-醉马草在中盐浓度(盐浓度≥100 mmol·L-1)时发芽势显著降低,分别降低57.33%、73.33%、76.00%;在盐浓度50 mmol·L-1及以上时,C 处理下的E-醉马草发芽势显著降低,分别降低40.00%、64.00%、80.00%、96.00%;盐浓度50 mmol·L-1及以上时,D 处理下的E-醉马草发芽势显著降低,分别降低42.67%、60.00%、64.00%、90.67%;在盐浓度50 mmol·L-1及以上时,E 处理下的E-醉马草发芽势显著降低,分别降低82.67%、90.67%、90.67%,在200 mmol·L-1时,种子停止萌发。中盐浓度可显著抑制A、B 处理下E-醉马草种子萌发;低盐浓度可显著抑制C、D、E 处理下E-醉马草种子萌发。此外,不同混合盐胁迫下的E+醉马草发芽势高于E-,且当两者处于A、B 处理的中高盐浓度时,E+醉马草发芽势显著高于E-;两者处于C、D、E处理的低盐浓度时,E+醉马草发芽势显著高于E-。
综上可知,不同混合盐碱胁迫下,E+醉马草的种子萌发状况优于E-。相较中性盐(NaCl、Na2SO4)比例较高的 A、B、D 组,碱性盐(NaHCO3、Na2CO3)比例较高的 C、E 组对种子萌发的抑制作用尤为明显,其中碱性盐Na2CO3对种子萌发的危害最为严重。
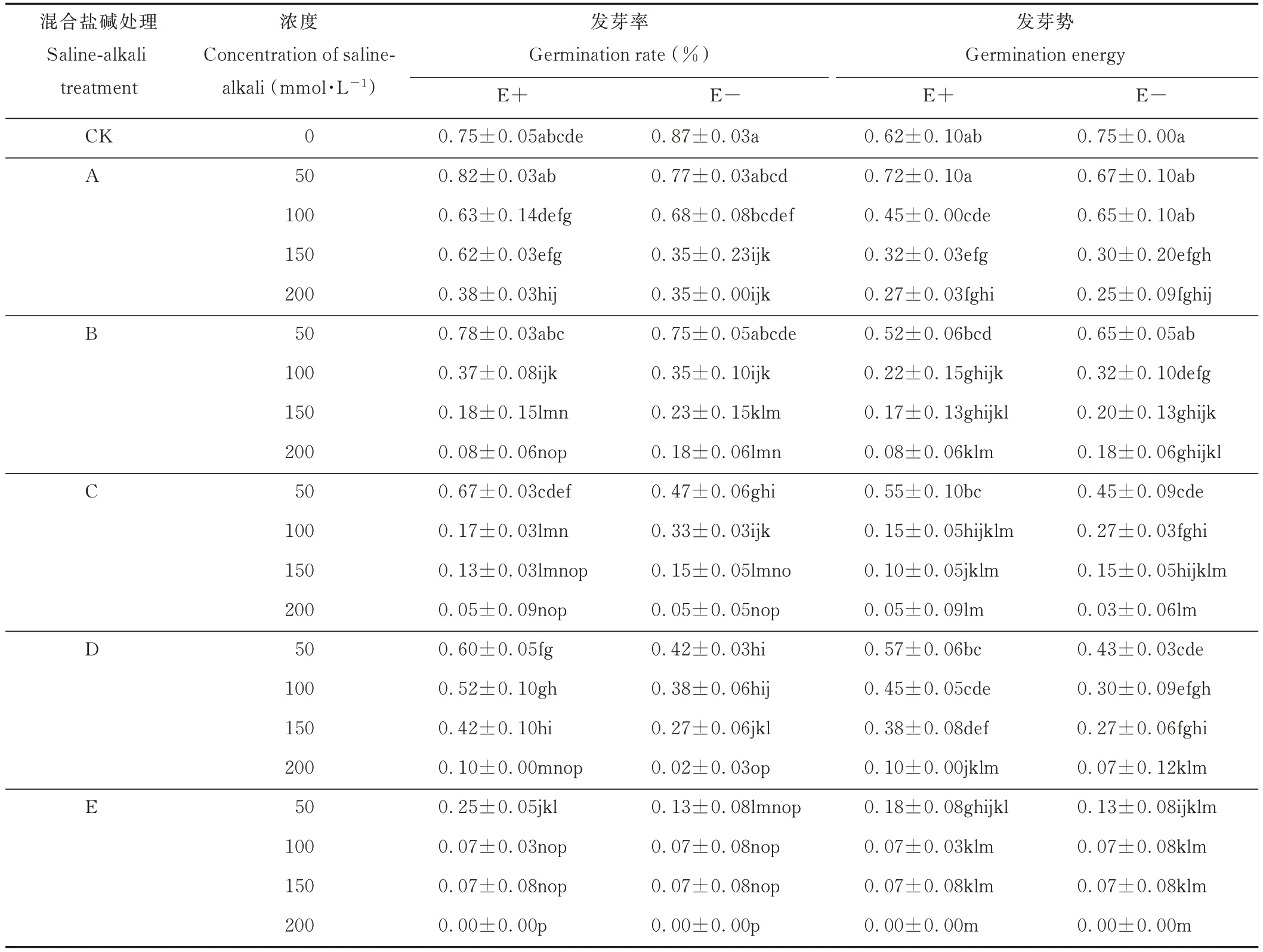
表3 混合盐碱胁迫对种子发芽率和发芽势的影响Table 3 The effect of complex saline-alkali treatment on seed germination rate and germination energy
2.1.2 不同混合盐碱胁迫对醉马草种子发芽指数和活力指数的影响 由表4 可知,在任一混合盐碱胁迫处理下,E+和E-醉马草种子的发芽指数均随盐浓度的升高呈下降趋势。除50 mmol·L-1盐浓度下的B 处理E+醉马草发芽指数大于D 处理外,不同混合盐碱处理下,同一盐浓度的E+醉马草发芽指数从大到小依次为:A>D>B>C>E。E+醉马草在混合盐碱A、B 处理下的50 mmol·L-1的发芽指数高于CK 组且无显著差异,50 mmol·L-1盐浓度下的 B、C 处理间无显著差异;100 mmol·L-1盐浓度下,A 与 D、B、C、E 间无显著差异;150 mmol·L-1盐浓度下的 A 与 D,B、C 与 E 间无显著差异;200 mmol·L-1盐浓度下的B、C、D、E 间无显著差异。由此可知,随盐浓度的升高,各混合盐碱处理间E+醉马草发芽指数差异减小且在高浓度下(≥150 mmol·L-1)显著低于E+对照组。表明高盐浓度(≥150 mmol·L-1)下,不同混合盐碱胁迫均对E+醉马草的种子萌发具有显著抑制作用。E-醉马草在混合盐碱A、B 处理下的50 mmol·L-1的发芽指数高于CK 组且无显著差异。且在不同混合盐碱处理下,随盐浓度的升高,E-醉马草发芽指数呈下降的趋势,除50 mmol·L-1时C>D,E-醉马草发芽指数从大到小依次为:A>B>D>C>E。50 和100 mmol·L-1盐浓度下A、B 处理间呈现出显著差异;150 mmol·L-1浓度下A、B、C 与D 之间无显著性差异;200 mmol·L-1浓度下除A 与B 之间,其他处理均呈现出显著差异。表明中低盐浓度对E-醉马草发芽指数无显著抑制,而高盐浓度(≥150 mmol·L-1)下,不同混合盐碱胁迫均对E-醉马草的种子萌发具有显著抑制作用。与E+对照组相比,A 处理下的E+醉马草在高盐浓度(≥100 mmol·L-1)时发芽指数显著降低,较对照组分别降低27.92%、42.69%、68.86%;B 处理下的E+醉马草在中高盐浓度(≥100 mmol·L-1)时发芽指数显著降低,较对照组分别降低57.46%、70.76%、91.08%;C 处理下(≥100 mmol·L-1)的E+醉马草在中高盐浓度处理下发芽指数显著降低,分别降低79.68%、83.92%、95.47%;在盐浓度50 mmol·L-1及以上时,D处理下的E+醉马草发芽指数显著降低,分别降低33.63%、36.26%、61.11%、88.30%;在盐浓度50 mmol·L-1及以上时,E 处理下的E+醉马草发芽指数显著降低,分别降低74.56%、93.13%、93.27%,在200 mmol·L-1时,种子停止萌发。由此可知,A、B、C 处理下,中高盐浓度可显著抑制E+醉马草种子萌发;低盐浓度可显著抑制D、E 处理下E+醉马草种子萌发。A 处理下的E-醉马草较E-对照组,其发芽指数在中高盐浓度(≥150 mmol·L-1)时显著降低,分别下降62.20%、69.44%;B 处理下的E-醉马草在中盐浓度(≥100 mmol·L-1)时发芽指数显著降低,分别降低55.50%、68.50%、86.73%;盐浓度在100 mmol·L-1及以上时,C 处理下的E-醉马草发芽指数显著降低,分别降低71.98%、82.44%、96.92%;盐浓度50 mmol·L-1及以上时,D 处理下(盐浓度≥50 mmol·L-1)的E-醉马草发芽指数显著降低,分别降低54.02%、60.46%、69.71%、91.82%;在盐浓度50 mmol·L-1及以上时,E 处理下的E-醉马草发芽指数显著降低,分别降低79.49%、91.02%、92.23%,在200 mmol·L-1时,种子停止萌发。中盐浓度可显著抑制A、B、C 处理下E-醉马草种子萌发;低盐浓度可显著抑制D、E 处理下E-醉马草种子萌发。此外,不同混合盐胁迫下的E+醉马草发芽指数高于E-,且当两者处于A、B、C 处理的中高盐浓度时,E+醉马草发芽指数显著高于E-;两者处于D、E 处理的低盐浓度时,E+醉马草发芽指数显著高于E-。
由表4 可知,在任一混合盐碱胁迫处理下,E+和E-醉马草种子的活力指数均随盐浓度的升高呈下降趋势。除50 mmol·L-1盐浓度下的B 处理E+醉马草活力指数大于D 处理外,不同混合盐碱处理下,同一盐浓度的E+醉马草活力指数从大到小依次为:A>B>D>C>E。E+醉马草在混合盐碱A、B 处理下的50 mmol·L-1的活力指数高于CK 组且无显著差异;在50 mmol·L-1浓度下,除A 与 B 之间,其余处理均呈显著性差异;100 mmol·L-1盐浓度下,除B 与D 之间,其余处理均呈显著性差异;150 和200 mmol·L-1盐浓度下,各处理之间均呈现显著性差异。E-醉马草在混合盐碱A、B 处理下的50 mmol·L-1的活力指数高于CK 组且无显著差异,不同混合盐碱处理下,随盐浓度的升高,E-醉马草活力指数呈下降的趋势,且E-醉马草活力指数同E+。与E+对照组相比,A 处理下的E+醉马草在高盐浓度(≥150 mmol·L-1)时活力指数显著降低,较对照组分别降低40.61%、78.70%;B处理下的E+醉马草在中高盐浓度(≥100 mmol·L-1)时活力指数显著降低,较对照组分别降低67.57%、84.33%、96.01%;C 处理下的E+醉马草在中高盐浓度(≥100 mmol·L-1)处理下活力指数显著降低,分别降低85.70%、91.69%、98.89%;盐浓度在50 mmol·L-1及以上时,D 处理下的E+醉马草活力指数显著降低,分别降低56.45%、66.52%、87.01%、97.64%;盐浓度在50 mmol·L-1及以上时,E 处理下的E+醉马草发活力指数显著降低,分别降低88.22%、98.63%、98.27%,在200 mmol·L-1时,种子停止萌发。由此可知,A 处理下,高盐浓度可显著抑制E+醉马草种子萌发;中盐浓度可显著抑制B、C 处理下E+醉马草种子萌发;低盐浓度即可显著抑制D、E 处理下E+醉马草种子萌发。A 处理下的E-醉马草较E-对照组,其活力指数在中高盐浓度(≥150 mmol·L-1)时显著降低,分别下降65.56%、70.98%;B 处理下的E-醉马草在中盐浓度(≥100 mmol·L-1)时活力指数显著降低,分别降低64.87%、79.21%、93.38%;盐浓度在50 mmol·L-1及以上时,C 处理下的E-醉马草活力指数显著降低,分别降低76.35%、80.25%、91.17%、98.76%;盐浓度在100 mmol·L-1及以上时,D 处理下的E-醉马草活力指数显著降低,分别降低78.44%、88.84%、97.55%;盐浓度在50 mmol·L-1及以上时,E 处理下的E-醉马草活力指数显著降低,分别降低94.26%、97.79%、98.23%,在200 mmol·L-1时,种子停止萌发,活力指数降至0。中盐浓度可显著抑制A 处理下E-醉马草种子萌发;低盐浓度可显著抑制B、C、D、E 处理下E-醉马草种子萌发。此外,不同混合盐胁迫下的E+醉马草活力指数高于E-,且当两者处于A、B 处理的中高盐浓度时,E+醉马草活力指数显著高于E-;两者处于C、D、E 处理的低盐浓度时,E+醉马草活力指数显著高于E-。
综上可知,不同混合盐碱胁迫下,E+醉马草的种子活力状况优于E-。相较中性盐(NaCl、Na2SO4)比例较高的 A、B、D 组,碱性盐(NaHCO3、Na2CO3)比例较高的 C、D 组对种子活力的抑制作用尤为明显,其中碱性盐Na2CO3对种子活力的危害最为严重。
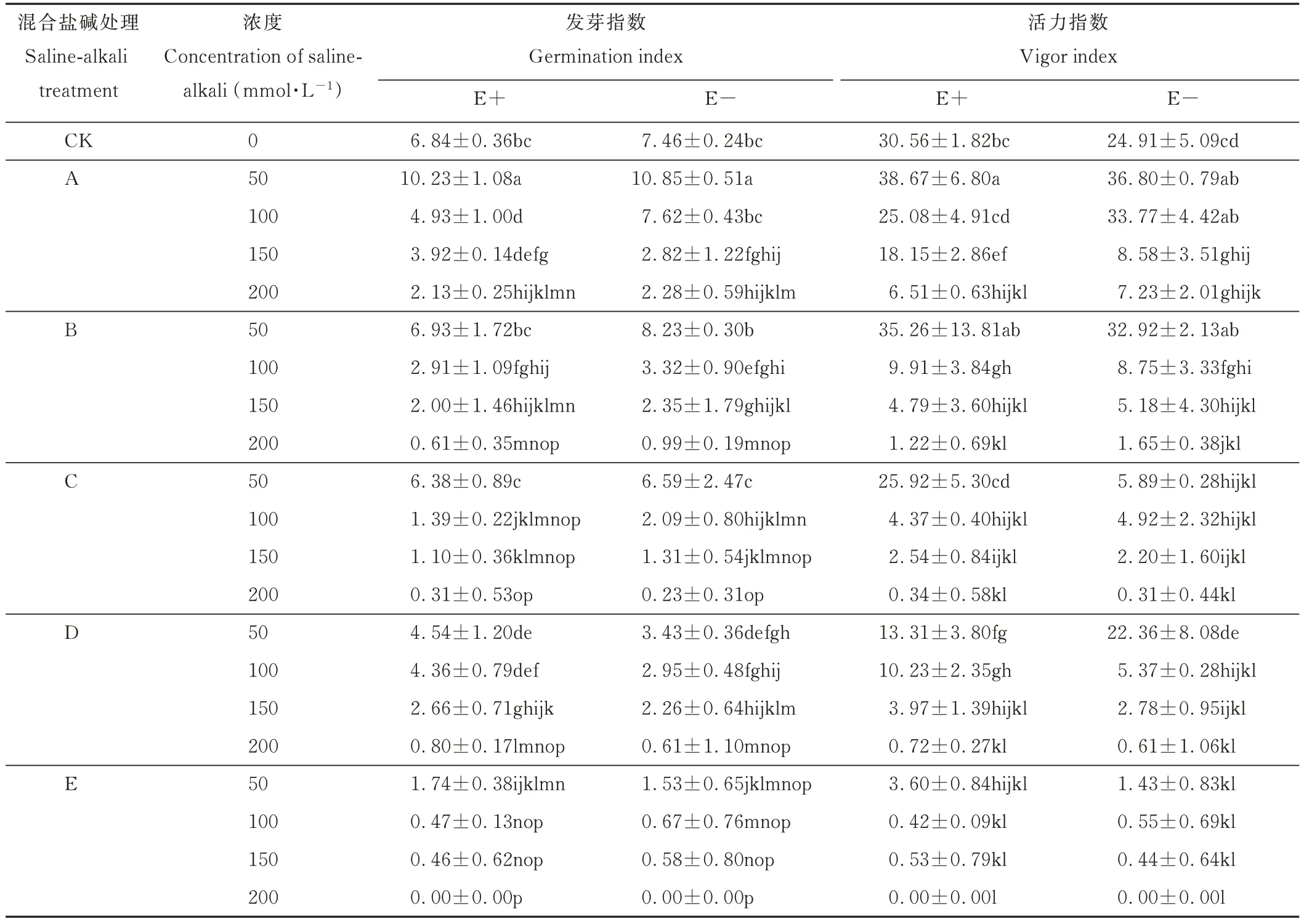
表4 混合盐碱胁迫对种子发芽指数和活力指数的影响Table 4 The effect of complex saline-alkali treatment on seed germination index and vigor index
2.1.3 不同混合盐碱胁迫对醉马草种子平均发芽时间的影响 由图1 和图2 可知,任一混合盐碱胁迫处理下,E+和E-醉马草种子的平均发芽时间均随盐浓度的升高呈上升趋势。与发芽率、发芽势相反,不同混合盐碱胁迫处理下,同一盐浓度的E+和E-醉马草平均发芽时间从大到小依次皆为:E>C>D>B>A。除E+醉马草的100 mmol·L-1中盐浓度及E-醉马草的150 mmol·L-1中高盐浓度外,其余盐浓度下碱性盐比例较高的C、E 组其平均发芽时间皆显著高于中性盐比例较高的A、B、D 组。综上可知,无论携菌与否,相较中性盐比例较高的A、B、D 组,碱性盐比例较高的C、E 组对醉马草种子萌发的抑制作用更为明显,其中碱性盐Na2CO3对种子萌发的抑制最为强烈。
2.2 不同混合盐碱胁迫对醉马草幼苗生长的影响
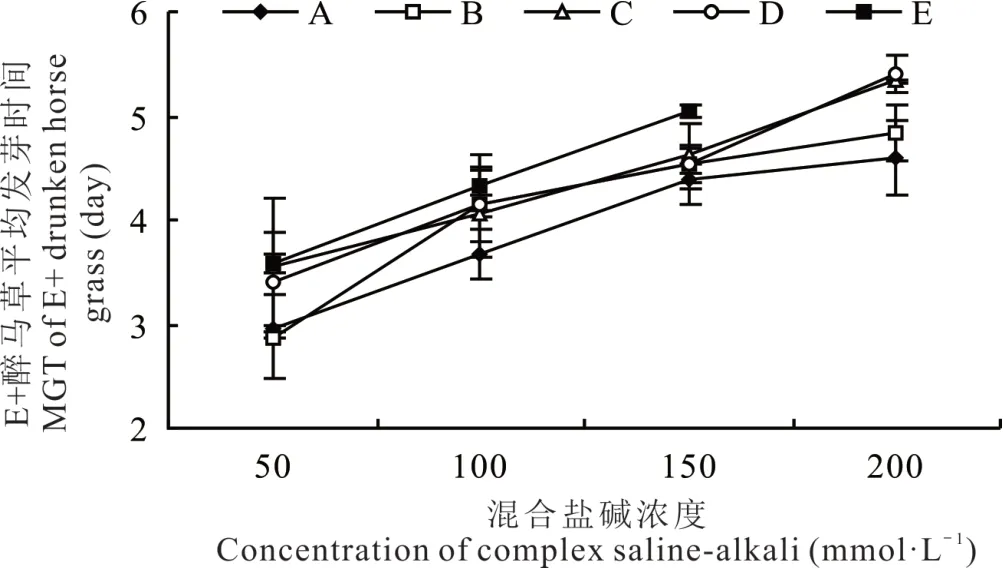
图1 混合盐碱胁迫对E+醉马草种子平均发芽时间的影响Fig. 1 The effect of complex saline-alkali treatment on MGT of E+ drunken horse grass
由表5 可知,在任一混合盐碱胁迫处理下,E+和E-醉马草幼苗长度和胚根长度均随盐浓度的升高呈下降趋势。E+/E-醉马草在混合盐碱A 处理下的50 mmol·L-1的幼苗长度高于CK 组且无显著差异;E-醉马草长度同E+随着浓度的上升而下降且长度从大到小同E+醉马草。与E+对照组相比,A 处理下的E+醉马草在高盐浓度200 mmol·L-1时幼苗长度显著降低,较对照组降低31.32%;B 处理下的E+醉马草在盐浓度50 mmol·L-1时幼苗长度显著降低,较对照组分别降低15.66%、23.94%、48.55%、55.26%;C 处理下盐浓度50 mmol·L-1及以上的E+醉马草在盐浓度处理下幼苗长度显著降低,分别降低34.68%、47.87%、67.11%、80.31%;盐浓度在100 mmol·L-1及以上时,D 处理下的E+醉马草幼苗长度显著降低,分别降低29.08%、48.32%、91.72%;盐浓度在50 mmol·L-1及以上时,E 处理下的E+醉马草幼苗长度显著降低,分别降低53.69%、79.64%、85.23%,在200 mmol·L-1时,幼苗停止生长。由此可知,A 处理下,高盐浓度可显著抑制E+醉马草幼苗生长;低盐浓度可显著抑制B、C、D、E 处理下E+醉马草幼苗生长。A 处理下中高浓度处理的E-醉马草较E-对照组,其幼苗长度无显著差异;B 处理下的E-醉马草在中盐浓度(≥100 mmol·L-1)时幼苗长度显著降低,分别降低22.62%、36.31%、50.60%;在盐浓度50 mmol·L-1及以上时,C 处理下的E-醉马草幼苗长度显著降低,分别降低36.31%、49.70%、63.39%、90.18%;盐浓度在100 mmol·L-1及以上时,D 处理下的E-醉马草幼苗长度显著降低,分别降低31.55%、54.46%、64.29%;盐浓度在50 mmol·L-1及以上时,E 处理下的E-醉马草幼苗长度显著降低,分别降低72.92%、84.82%、86.90%,在200 mmol·L-1时,幼苗停止生长。中盐浓度可显著抑制B 处理下E-醉马草幼苗生长;低盐浓度可显著抑制C、D、E 处理下E-醉马草幼苗生长。此外,不同混合盐胁迫下的E+醉马草幼苗生长高于E-,且当两者处于A、B 处理的中高盐浓度时,E+醉马草苗长显著高于E-;两者处于C、D、E 处理的低盐浓度时,E+醉马草幼苗生长显著高于E-。
与E+对照组相比,A 处理下的E+醉马草在中高盐浓度150 mmol·L-1及以上时胚根长度显著降低,较对照组降低26.79%;B 处理下的E+醉马草在盐浓度150 mmol·L-1及以上时胚根长度显著降低,较对照组降低35.71%、55.95%;C 处理下盐浓度50 mmol·L-1及以上的E+醉马草胚根长度显著降低,分别降低40.48%、43.45%、51.79%、75.60%;盐浓度在100 mmol·L-1及以上时,D 处理下的E+醉马草胚根长度显著降低,分别降低23.81%、27.38%、80.36%;盐浓度在50 mmol·L-1以上时,E 处理下的E+醉马草胚根长度显著降低,分别降低62.50%、80.36%、91.07%,在200 mmol·L-1时,幼苗停止生长。由此可知,A、B 处理下,高盐浓度可显著抑制E+醉马草胚根生长;低盐浓度可显著抑制C、D、E 处理下E+醉马草胚根生长。A 处理下的E-醉马草较E-对照组,其胚根长度在高浓度(200 mmol·L-1)时显著下降32.76%;B 处理下的E-醉马草在中盐浓度(≥50 mmol·L-1)时胚根长度显著降低,分别降低54.02%、58.05%、62.07%;盐浓度在100 mmol·L-1及以上时,C 处理下的E-醉马草胚根长度显著降低,分别降低63.79%、79.31%、91.95%;盐浓度在100 mmol·L-1及以上时,D 处理下的E-醉马草胚根长度显著降低,分别降低41.95%、58.62%、59.20%;盐浓度在50 mmol·L-1及以上时,E 处理下的E-醉马草胚根长度显著降低,分别降低73.56%、84.48%、91.38%,在200 mmol·L-1时,幼苗停止生长。中盐浓度可显著抑制B、C 处理下E-醉马草胚根生长;低盐浓度可显著抑制D、E 处理下E-醉马草胚根生长。此外,不同混合盐胁迫下的E+醉马草胚根生长高于E-,且当两者处于A、B 处理的中高盐浓度时,E+醉马草胚根长度显著高于E-;两者处于C、D、E 处理的低盐浓度时,E+醉马草胚根生长显著高于E-。由表5 可知,在任一混合盐碱胁迫处理下,E+和E-醉马草种子的根冠比均随盐浓度的升高呈下降趋势。E-醉马草在混合盐碱A、B 处理下的 50 mmol·L-1的胚根长高于 CK 组且无显著差异,除 150 mmol·L-1浓度下的 C 处理 E-醉马草胚根长大于D 处理外,不同混合盐碱处理下,随盐浓度的升高,E-醉马草胚根长呈下降的趋势。

表5 混合盐碱胁迫对幼苗长度、胚根长度和根冠比的影响Table 5 The effect of complex saline-alkali treatment on the length of seedling,the length of radicle and root-shoot ratio
与E+对照组相比,A、B 处理下的E+醉马草根冠比无显著差异;C 处理下高盐浓度200 mmol·L-1的E+醉马草根冠比显著降低55.56%;在盐浓度150 mmol·L-1时,D 处理下的E+醉马草根冠比显著降低94.44%;在盐浓度150 mmol·L-1及以上时,E 处理下的E+醉马草根冠比显著降低63.89%,在200 mmol·L-1时,幼苗停止生长。由此可知,A、B 处理下盐浓度对醉马草根冠比无显著影响,C、D、E 处理下,高盐浓度可抑制E+醉马草根冠比。A、B 处理下的E-醉马草较E-对照组,其根冠比无显著差异;在盐浓度150 mmol·L-1时,C 处理下的E-醉马草根冠比显著降低72.50%;盐浓度200 mmol·L-1时,D 处理下的E-醉马草根冠比显著降低87.50%;在盐浓度100 mmol·L-1及以上时,E 处理下的E-醉马草根冠比显著降低,分别降低55.00%、60.00%,在200 mmol·L-1时,幼苗停止生长。由此可见,A、B 处理下的盐浓度对E-醉马草根冠比无显著影响,C、D、E 处理下高盐浓度可显著抑制E-醉马草根冠比。此外,不同混合盐胁迫下的E+醉马草根冠比高于E-,且当两者处于C、D、E 处理的高盐浓度时,E+醉马草根冠比显著高于E-。
综上可知,不同混合盐碱胁迫下,E+醉马草的幼苗生长状况优于E-。相较中性盐(NaCl、Na2SO4)比例较高的 A、B、D 组,碱性盐(NaHCO3、Na2CO3)比例较高的 C、D 组对幼苗生长的抑制作用尤为明显,其中碱性盐Na2CO3对幼苗生长的危害最为严重。相较于A、B 处理下,C、D、E 处理下高盐浓度对E+和E-胚根影响比幼苗影响更为显著。
2.3 不同混合盐碱胁迫对醉马草幼苗生理特性的影响
2.3.1 不同混合盐碱胁迫对醉马草POD 活性的影响 由图3 和图4 可知,任一混合盐碱胁迫处理下,E+醉马草POD 活性高于E-,且除E 处理外,E+和E-醉马草POD 活性均随盐浓度的升高呈上升趋势。推测是由于随盐浓度升高,E 处理严重破坏醉马草幼苗的生理活动,致使其POD 表达量降低。此外,除50 mmol·L-1盐浓度下的 A 处理醉马草 POD 活性外,其余处理下的醉马草POD 活性均显著高于对照。与E+对照组相比,A 处理中高盐浓度下的E+醉马草POD 活性显著升高,分别上升9.59%、16.28%、13.66%;在盐浓度 50 mmol·L-1及以上时,B 处理下的E+醉马草POD 显著增加,较对照组分别升高14.53%、21.80%、23.26%、30.23%;与B 处理相同,C、D、E 处理在盐浓度 50 mmol·L-1及以上时其 POD活性显著上升,C 处理分别上升20.00%、23.04%、35.17%、38.66%;D 处理分别上升30.52%、42.44%、60.47%、65.99%;E 处理分别上升34.59%、24.13%、18.96%。与E-对照组比,A 处理中高盐浓度下的E-醉马草POD 活性显著升高,分别上升6.76%、12.75%、15.07%;B、C、D、E 处理均在盐浓度 50 mmol·L-1及 以 上 时 其 POD 活性显著升高,B 处理较对照组分别增加 10.43%、16.52%、22.03%、28.12%;C 处理分别上升23.19%、28.41%、31.88%、33.62%;D 处理分别上升17.86%、17.86%、31.01%、29.57%;E 处理分别上升26.09%、22.61%、23.19%。
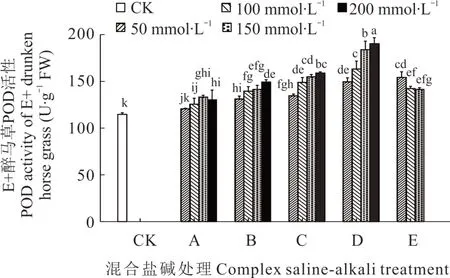
图3 混合盐碱胁迫对E+醉马草POD 活性的影响Fig. 3 The effect of complex saline-alkali treatment on POD activity of E+ drunken horse grass
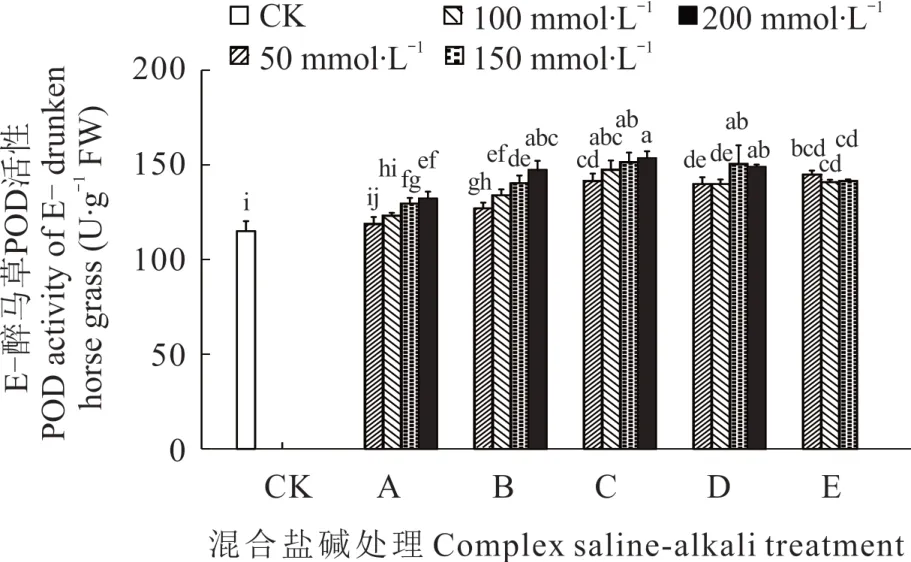
图4 混合盐碱胁迫对E-醉马草POD 活性的影响Fig. 4 The effect of complex saline-alkali treatment on POD activity of E- drunken horse grass
2.3.2 不同混合盐碱胁迫对醉马草SOD 活性的影响 由图5 和图6 可知,任一混合盐碱胁迫处理下,E+醉马草SOD 活性高于E-,且除E 处理外,E+和E-醉马草SOD 活性均随盐浓度的升高呈上升趋势。推测是由于随盐浓度升高,高pH 处理严重破坏醉马草幼苗的生理活动,致使其SOD 表达量降低。此外,除50 mmol·L-1盐浓度下的A 处理E-醉马草SOD 活性外,其余处理下的醉马草SOD 活性均显著高于对照。与E+对照组相比,A处理下的E+醉马草SOD 活性升高,分别上升2.53%、4.64%、4.64%、7.17%;盐浓度在100 mmol·L-1及以上时,B 处理下的E+醉马草SOD 活性显著增加,较对照组分别升高10.97%、14.34%、10.97%;C、D、E 处理在盐浓度50 mmol·L-1及以上时其SOD 活性显著上升,C 处理分别上升6.75%、11.39%、16.46%、18.99%;D 处理分别上升10.97%、20.25%、25.32%、25.32%;E 处理分别上升13.50%、9.28%、10.97%。与E-对照组比,A处理在盐浓度100 mmol·L-1及以上的E-醉马草SOD 活性升高,分别上升1.67%、5.00%、2.92%;B 处理下除盐浓度50 mmol·L-1外,其余浓度的E-醉马草SOD 活性较CK 组呈上升趋势,分别上升0.83%、4.16% 和4.58%,150 mmol·L-1盐浓度下的醉马草较CK 组呈现明显上升,上升6.66%。C 处理在50 mmol·L-1盐浓度及以上的E-醉马草SOD 活性均呈现明显上升趋势,分别上升3.75%、7.92%、12.92%、10.00%;D 处理下所有浓度的E-醉马草SOD 活性较CK 组都呈现显著上升趋势,分别上升5.83%、13.33%、20.00%、30.63%;E 处理下除150 mmo·lL-1盐浓度的E-醉马草SOD 活性较CK 组都呈现显著上升趋势,分别上升9.17%、8.13%和3.13%。

图5 混合盐碱胁迫对E+醉马草SOD 活性的影响Fig. 5 The effect of complex saline-alkali treatment on SOD activity of E+ drunken horse grass
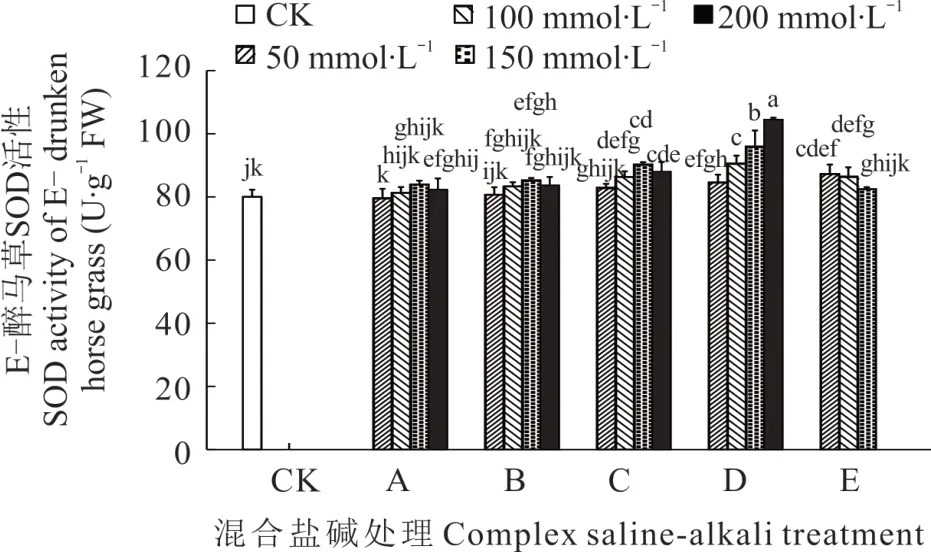
图6 混合盐碱胁迫对E-醉马草SOD 活性的影响Fig. 6 The effect of complex saline-alkali treatment on SOD activity of E- drunken horse grass
2.3.3 不同混合盐碱胁迫对醉马草CAT 活性的影响 由图7 和图8 可知,任一混合盐碱胁迫处理下,E+醉马草CAT 活性高于E-,且除E 处理外,E+和E-醉马草SOD 活性均随盐浓度的升高呈上升趋势。同时,任一处理任一浓度下的醉马草CAT 活性均显著高于对照。与E+对照组相比,A 处理下中高盐浓度(≥150 mmol·L-1)的E+醉马草CAT 活性显著升高,分别上升14.58%、12.88%;B 处理下任一盐浓度的E+醉马草CAT 活性显著增加,较对照组分别升高12.88%、21.36%、27.80%、23.39%;C、D、E 处理在盐浓度50 mmol·L-1及以上时其CAT 活性显著上升,C 处理分别上升23.05%、31.53%、41.69%、52.03%;D 处理分别上升34.24%、40.68%、49.50%、39.66%;E 处理分别上升38.64%、43.73%、34.75%。与E-对照组比,A 处理盐浓度的E-醉马草CAT 活性显著升高,分别上升17.88%、23.73%、28.10%、26.28%;与A 处理相同,B 处理下盐浓度的E-醉马草CAT 活性较CK 组呈现明显上升趋势,分别上升18.98%、26.64%、34.67%、37.59%。C 处理下任一盐浓度的E-醉马草CAT 活性均呈现明显上升趋势,分别上升30.66%、45.26%、47.75%、47.81%;D 处理下任一浓度的E-醉马草CAT 活性较CK 组都呈现显著上升趋势,分别上升43.80%、55.11%、57.66%、40.69%;E 处理下中高盐浓度(≥100 mmol·L-1)的E-醉马草CAT 活性较CK 组都呈现下降趋势,分别下降0.73%和5.84%;150 mmol·L-1浓度的E 处理的E-醉马草CAT 活性显著降低,下降9.67%。
综上可知,除E 组外,盐浓度的升高可提高A、B、C、D 处理下醉马草的POD、SOD、CAT 抗氧化酶的活性。并且带菌(E+)醉马草内POD、SOD、CAT 活性高于不带菌(E-)。
2.3.4 不同混合盐碱胁迫对醉马草MDA 的影响 由图9 和图10 可知,任一混合盐碱胁迫处理下,E+醉马草MDA 含量低于E-,并且任一处理任一浓度下的醉马草MDA 含量均显著高于对照。与E+对照组相比,A 处理下的E+醉马草MDA 含量升高,分别上升18.24%、34.46%、41.55%、46.62%;与A 处理相同,B 处理下的E+醉马草MDA 含量显著增加,较对照组分别升高25.33%、36.49%、56.76%、76.35%;C、D、E 处理在盐浓度50 mmol·L-1及以上时其 MDA 含量显著上升,C 处理分别上升 34.29%、46.28%、65.88%、79.90%;D 处理分别上升60.81%、79.39%、98.99%、109.80%;E 处理分别上升64.53%、91.22%、111.82%。与E-对照组比,除50 mmol·L-1盐浓度外,A 处理盐浓度100 mmol·L-1及以上的E-醉马草MDA 含量显著升高,分别上升13.33%、27.78%、30.00%;与A 处理相同,B 处理下盐浓度100 mmol·L-1的E-醉马草MDA 含量较CK 组呈现明显上升趋势,分别上升20.56%、33.06%和50.00%。C 处理下任一盐浓度的E-醉马草MDA 含量均呈现明显上升趋势,分别上升25.83%、46.67%、50.28%、55.56%;D 处理下任一浓度的E-醉马草MDA 含量较CK 组都呈现显著上升趋势,分别上升40.56%、56.11%、70.28%、78.75%;E 处理下所有盐浓度的E-醉马草SOD 活性较CK组都呈现显著上升趋势,分别上升58.89%、77.08%和84.17%。

图7 混合盐碱胁迫对E+醉马草CAT 活性的影响Fig. 7 The effect of complex saline-alkali treatment on CAT activity of E+ drunken horse grass
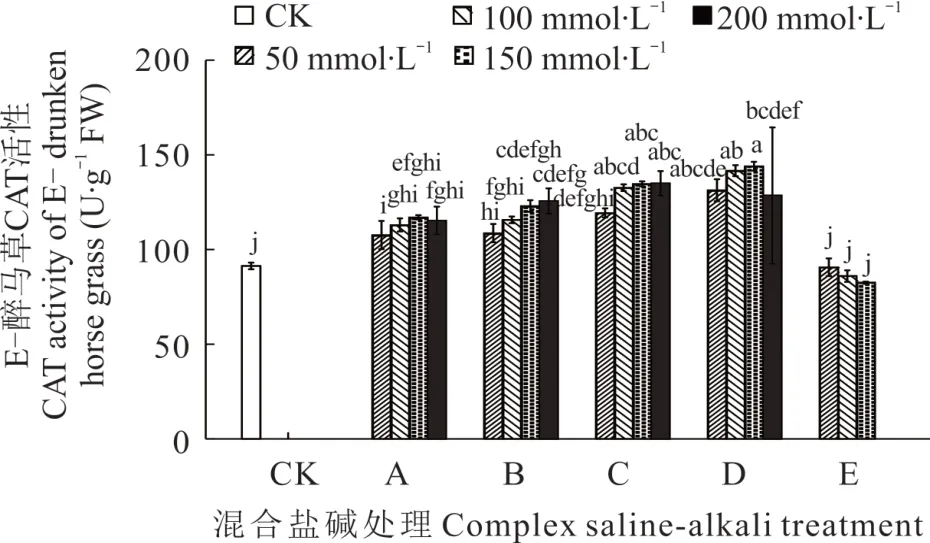
图8 混合盐碱胁迫对E-醉马草CAT 活性的影响Fig. 8 The effect of complex saline-alkali treatment on CAT activity of E- drunken horse grass
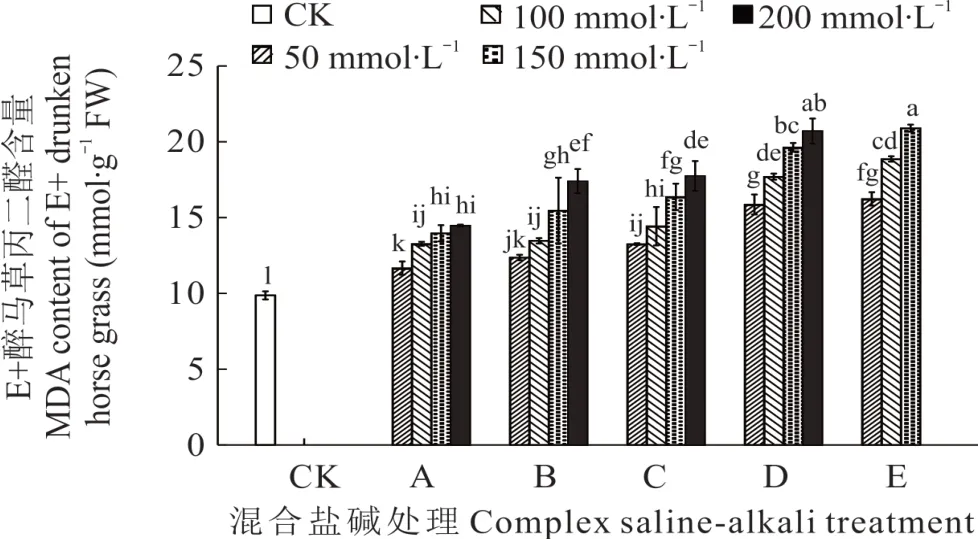
图9 混合盐碱胁迫对E+醉马草MDA 含量的影响Fig. 9 The effect of complex saline-alkali treatment on MDA content of E+ drunken horse grass
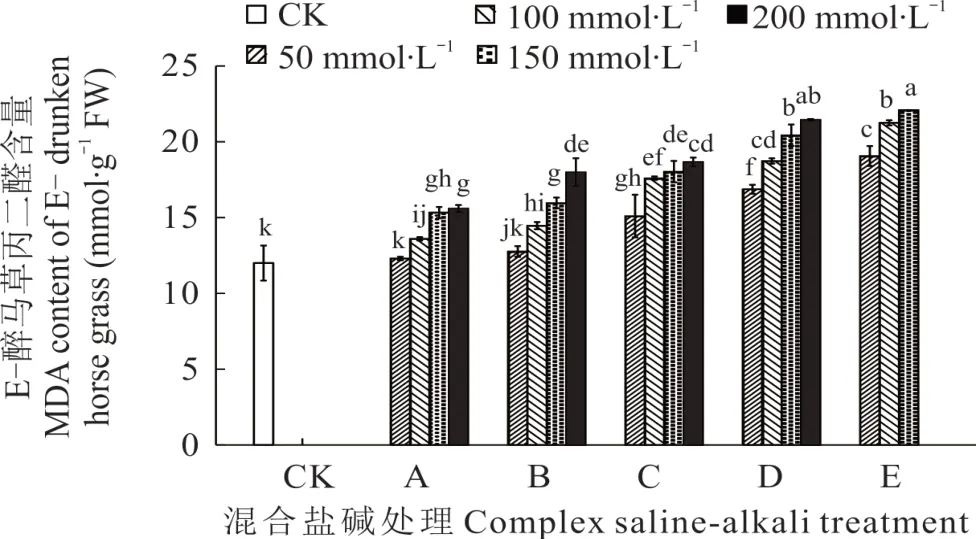
图10 混合盐碱胁迫对E-醉马草MDA 含量的影响Fig. 10 The effect of complex saline-alkali treatment on MDA content of E- drunken horse grass
2.3.5 不同混合盐碱胁迫对醉马草脯氨酸的影响 由图11 和图12 可知,任一混合盐碱胁迫处理下,E+醉马草脯氨酸含量高于E-,除D、E 处理下,A、B、C 处理下脯氨酸的含量随着盐浓度的增加而增加。与E+对照组相比,A 处理下的E+醉马草脯氨酸含量显著升高,分别上升38.18%、43.18%、50.26%、57.50%;与A 处理相同,B处理下的E+醉马草脯氨酸含量显著增加,较对照组分别升高46.55%、52.00%、57.94%、60.18%;C 处理同A、B,在任一盐浓度下其脯氨酸含量显著上升,分别上升70.32%、78.61%、89.97%、103.16%;D 处理下低浓度和E处理下低中盐浓度的E-醉马草脯氨酸含量较CK 组呈现显著上升趋势,分别上升15.03%、14.45%、12.68%和16.76%、14.52%。与E-对照组比,A 处理盐浓度的E-醉马草脯氨酸含量显著升高,分别上升44.49%、47.56%、55.75%、59.31%;与A 处理相同,B 处理下的E-醉马草脯氨酸含量较CK 组呈现明显上升趋势,分别上升51.92%、54.92%、58.82%和59.34%。与A、B 处理相同,C 处理下任一盐浓度的E-醉马草脯氨酸含量均呈现明显上升趋势,分别上升71.23%、78.66%、87.45%、89.96%;除150 mmol·L-1盐浓度,D 处理下其他浓度的E-醉马草脯氨酸含量较CK 组都呈现显著上升趋势,分别上升16.00%、8.68%和5.23%;E 处理下各盐浓度的E-醉马草脯氨酸含量较CK 组都呈现显著上升趋势,分别上升9.24%、10.63%和10.15%。
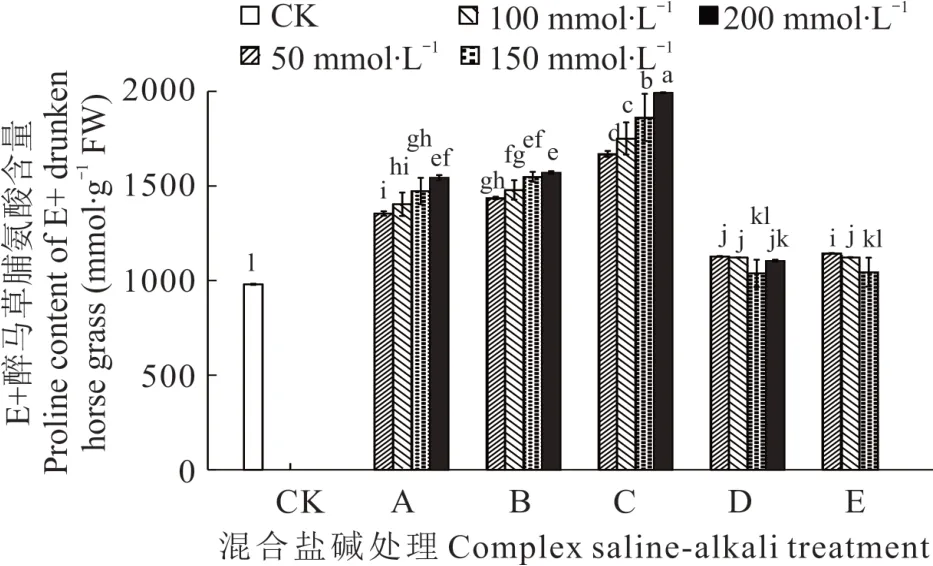
图11 混合盐碱胁迫对E+醉马草脯氨酸含量的影响Fig. 11 The effect of complex saline-alkali treatment on proline content of E+ drunken horse grass
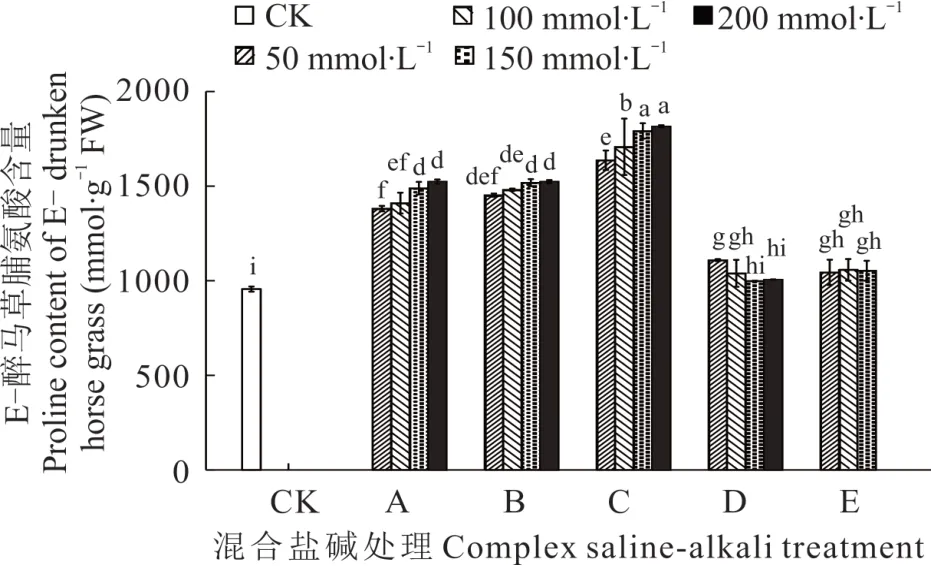
图12 混合盐碱胁迫对E-醉马草脯氨酸含量的影响Fig. 12 The effect of complex saline-alkali treatment on proline content of E- drunken horse grass
2.4 不同混合盐碱胁迫下醉马草的隶属函数值排序及耐盐性综合评价
模糊隶属函数法可综合各耐盐性指标,依据其隶属函数值排序综合评价混合盐碱胁迫下醉马草的耐盐性,可避免单一指标评价所带来的片面性从而更加客观真实[34]。由表6 和表7 可知,不同混合盐碱胁迫下E+和E-醉马草的隶属函数值排序及耐盐性从大到小依次为:A>D>B>C>E。表明醉马草对中性盐比例较高的A、B、D组耐受性较高,而对碱性盐比例较高的C、E 组耐受性较低。此外,除A 处理外,同一混合盐碱胁迫下E+醉马草的隶属函数值及耐盐性均大于E。综上可知,相较中性盐,醉马草碱性盐耐受性较低。此外,E+醉马草耐盐性优于E-。
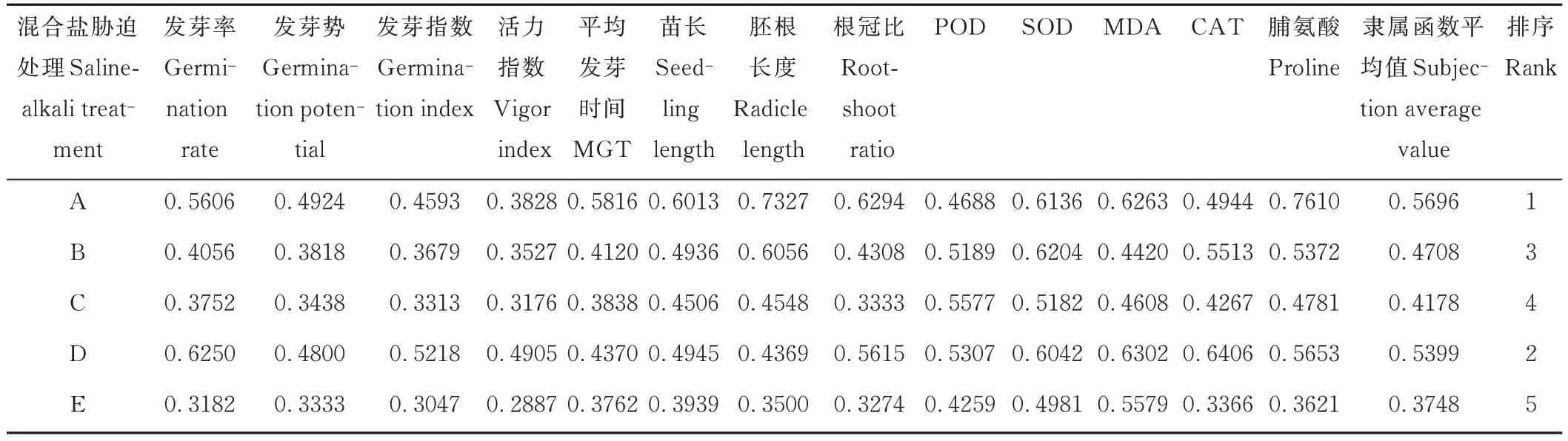
表6 不同混合盐碱胁迫下E+醉马草的隶属函数值及耐盐性综合评价Table 6 Subjection values and comprehensive evaluation of salt tolerance order of E+ drunken horse grass under complex salinealkali treatments
2.5 不同混合盐碱胁迫下醉马草的耐盐性指标主成分分析
由表8 可知,E+醉马草耐盐性指标主成分分析的第Ⅰ主成分特征值λ1=8.395,贡献率为64.576%,耐盐性指标所对应的特征向量中,胚根长度和活力指数性状数值较大,分别为0.344 和0.341,主要反映出盐胁迫下E+醉马草的种子活力和幼苗根系生长状况;第Ⅱ主成分特征值λ2=2.174,贡献率为16.720%,对应的特征向量中,苗长和脯氨酸数值较大,分别为0.563 和0.454,主要反映出盐胁迫下幼苗的生长和渗透调节作用;第Ⅲ主成分特征值λ3=1.762,贡献率为13.556%,对应的特征向量中,POD 和SOD 性状数值较大,均为0.482,主要反映出盐胁迫下E+醉马草的抗氧化酶状况。
由表9 可知,E-醉马草耐盐性指标主成分分析的第Ⅰ主成分特征值λ1=9.198,贡献率为70.754%,对应的特征向量中,活力指数和胚根长度性状数值较大,分别为0.325 和0.323,主要反映出盐胁迫下E-醉马草的种子活力和幼苗根系生长状况;第Ⅱ主成分特征值λ2=1.960,贡献率为15.075%,对应的特征向量中,平均发芽时间和脯氨酸数值较大,分别为0.501 和0.475,主要反映出盐胁迫下种子发芽速度和幼苗渗透调节作用;第Ⅲ主成分特征值λ3=1.141,贡献率为8.779%,对应的特征向量中,SOD 和发芽率数值较大,分别为0.568 和0.442,主要反映出盐胁迫下E+醉马草种子发芽状况和幼苗抗氧化酶状况。
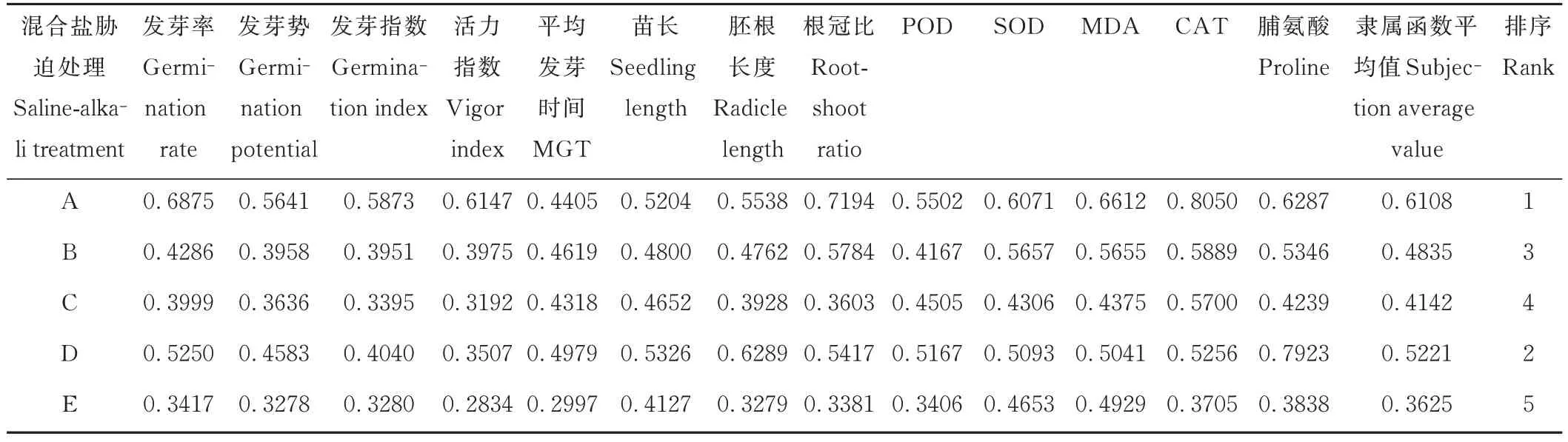
表7 不同混合盐碱胁迫下E-醉马草的隶属函数值及耐盐性综合评价Table 7 Subjection values and comprehensive evaluation of salt tolerance order of E- drunken horse grass under complex salinealkali treatments
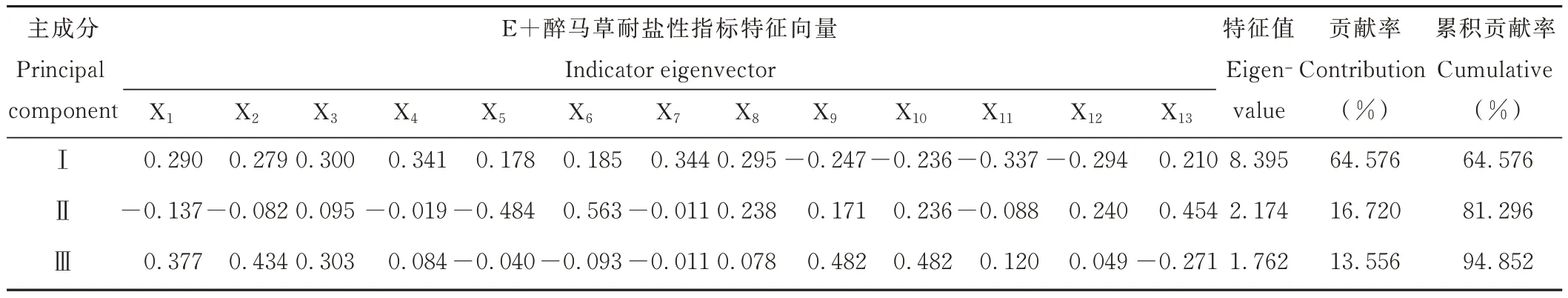
表8 E+醉马草耐盐性指标的主成分分析Table 8 Principal component analysis of salt tolerance index of E+ drunken horse grass
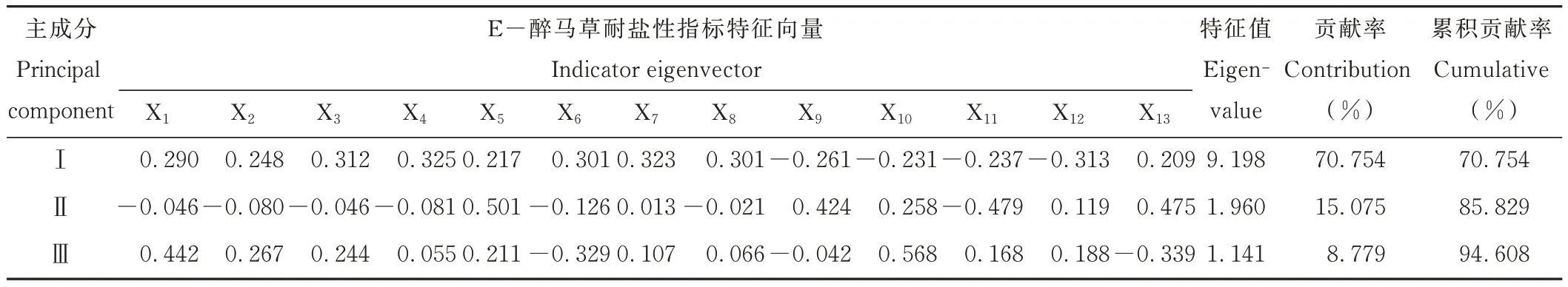
表9 E-醉马草耐盐性指标的主成分分析Table 9 Principal component analysis of salt tolerance index of E- drunken horse grass
综上可知,Ⅰ~Ⅲ主成分分别反映了E+和E-醉马草13 个耐盐性指标94.852%和94.608%的信息,对醉马草耐盐性综合评价的指示意义较大。因此,活力指数、苗长、胚根长、POD、SOD、脯氨酸可作为E+醉马草耐盐性综合评价的主要指标;发芽率、活力指数、平均发芽时间、胚根长、POD、SOD、脯氨酸为E-醉马草耐盐性综合评价的主要指标。
3 讨论
3.1 混合盐碱胁迫对醉马草种子萌发的影响
种子萌发和幼苗生长是植物生长发育及适应逆境的基础,同时也是盐胁迫下最为敏感及易遭受危害的阶段。处于盐碱胁迫下的种子常表现出发芽率降低、活力下降、幼苗及胚根生长受抑等现象,甚或严重时种子直接死亡。该现象主要是由于盐胁迫及碱胁迫常伴随出现而带来的水分胁迫、离子失调与土壤板结等引起的[35-37]。故本试验对醉马草种子萌发和幼苗生长时期进行盐碱胁迫,以选育西北盐碱地区耐盐草种。研究表明,任一混合盐碱胁迫下醉马草的发芽率、发芽势、发芽指数、活力指数均随盐浓度的上升呈下降趋势。平均发芽时间则随盐浓度的上升而延长。仅有A、B 处理低盐浓度下E+醉马草的发芽率、发芽指数等随盐浓度的上升而升高,这可能是由于种子水势较低而盐浓度水势高,故从外界吸水使种子水分充盈而促进其萌发[35]。结果表明,相较对照组,E+醉马草处于A、B、C 处理组高盐浓度环境时,其种子萌发被显著抑制;而D、E 处理下的低盐浓度环境即可显著抑制其草种萌发。与E+醉马草相比,A、B 处理组的中盐浓度环境可显著抑制E-醉马草种子的萌发;低盐浓度显著抑制C、D、E 处理下E-醉马草种子萌发。此外,任一混合盐胁迫下的E+醉马草发芽率、发芽势等种子萌发指标均高于E-,平均发芽时间低于E-,尤其是当两者处于碱性盐比例较高的D、E 处理时,E+醉马草的种子萌发状况显著优于E-。并且当醉马草处于碱性盐Na2CO3比例最高的D 组时,其种子在200 mmol·L-1高盐浓度胁迫下停止萌发。由此可知,E+醉马草盐碱胁迫下的种子萌发状况及耐盐性优于E-,说明内生真菌可有效提高草种耐盐性。推测是其体内内生真菌促进细胞渗透调节作用及提高抗氧化酶活性(如POD、SOD 等)保持其细胞完整性及水分充足,从而保证其种子萌发阶段的正常进行[35]。此外,与中性盐相比,碱盐(NaHCO3、Na2CO3)对种子萌发的抑制作用尤为强烈,其中以Na2CO3对种子萌发的抑制最为严重。如藜麦(Chenopodium quinoa)[29]、小麦(Triticum aestivum)[38]、辣椒(Capsicum annuum)[39]等作物研究均得出相同的结论。该现象可能是高 pH 环境下,种子体内淀粉酶活性降低,种子萌发所需营养物质严重流失所致[40]。
3.2 混合盐碱胁迫对醉马草幼苗生长的影响
幼苗及胚根长度下降是植物幼苗生长阶段对盐碱胁迫最直观的响应特征且胚根突破种皮是植物正常生长发育的关键所在[41]。研究表明,与种子萌发阶段相同,醉马草幼苗生长阶段亦受盐碱胁迫所抑制,任一混合盐碱胁迫下,其苗长、胚根长度及根冠比均随着盐浓度的上升呈下降趋势。Hernandez 等[42]和高凯等[43]的研究表明,盐碱胁迫会造成幼苗和胚根生长迟缓甚至停滞、生物量下降等危害。此外,与种子萌发阶段一致,E+醉马草盐碱胁迫下的幼苗生长状况及耐盐性同样优于E-,再次证明了内生真菌可有效提高醉马草对盐碱逆境的耐受能力。较中性盐,醉马草幼苗生长阶段的碱性盐危害作用同样更为强烈,碱性盐中Na2CO3对幼苗生长的阻碍作用最为强烈。曲元刚等[44]关于玉米(Zea mays)的研究得出了相似的结论,推测这可能与高pH 环境下的植物蛋白酶合成受抑有关。吴薇等[45]的研究结果表明盐碱逆境不是简单的两种环境的叠加,而是具备交互效应。混合盐碱环境下,pH 较低时,其胁迫对植物生长发育的影响主要由盐浓度决定,即盐分胁迫居主导作用;pH 较高时,则由碱胁迫居主导地位。值得一提的是,根冠比下降说明盐碱胁迫对于胚根生长的抑制程度高于幼苗,这可能是由于胚根更早接触盐碱溶液并接收到盐碱胁迫信号所致[46]。
3.3 混合盐碱胁迫对醉马草幼苗生理特性的影响
逆境胁迫常迫使植物体内产生过多的活性氧(超氧自由基、过氧化氢、羟基自由基等),致使自由基累积过量及膜脂过氧化现象加剧、细胞内重要酶类与蛋白质失活分解、甚至DNA 解旋等一系列不良反应的发生,从而危及植物的生长发育[47-49]。过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等作为植物体内重要和有效的活性氧(ROS)清除剂及保护酶,则将细胞内过多的活性氧转化为H2O 等无害物质,以保护植物生长不受逆境严重侵害[50-51]。研究表明,POD、SOD、CAT 三者活性均在除E 处理外的任一混合盐胁迫下,随盐浓度的上升而升高,而在碱性盐Na2CO3比例较高的E 处理下,三者活性则随盐浓度的升高呈下降趋势。刘海波等[52]对甜高粱(Sorghum bicolor)和春小麦抗氧化酶活性的研究得出了相似的结论。推测这可能是过高的pH 环境严重阻碍细胞内酶类合成及降低酶类活性所致。此外,除E-醉马草的CAT 活性外,A 处理中低盐浓度下的醉马草POD、SOD、CAT 活性均与对照组无显著差异,说明醉马草在中性盐的低盐浓度下可能主要通过渗透调节作用维持其膜系统稳定,保护其不受盐逆境侵害。除A 处理低盐浓度下的POD 活性外,SOD、CAT 活性均在A 处理中高浓度下较对照组无显著差异,说明醉马草在中性盐的中高浓度下,主要依靠POD 酶发挥作用,响应盐逆境,清除醉马草体内过多自由基以使膜系统免受伤害。除B 处理低盐浓度下的E+醉马草SOD 活性及B 处理下的E-醉马草SOD 活性外,醉马草POD 及CAT 活性均在B 处理下显著高于对照组,其中E-醉马草CAT 活性在任一处理下均显著高于对照,说明在中性盐比例较高而碱性盐比例较低时,主要由醉马草的POD 和CAT 酶发挥协同作用以抵御盐害。除此之外,各盐碱胁迫在任一盐浓度下的POD、SOD、CAT 活性均显著高于对照,说明此时三者协同作用以减缓盐害对于膜系统的伤害。此外,混合盐胁迫下的E+醉马草POD、SOD、CAT 活性均高于E-,本研究结论与缑小媛[8]在2007 得出的一致,并做出了内生真菌可有效提高醉马草幼苗内抗氧化酶活性的推断。
丙二醛(MDA)为膜脂过氧化过程最重要的产物之一,它的出现将加剧膜系统损伤并加速细胞衰老[53]。因此,MDA 常作为植物抗逆生理研究的重要指标,用以反映植物受逆境损伤程度及植物抗逆性能。研究结果表明,除A 处理低盐浓度下的E+醉马草MDA 含量外,随盐浓度的提高,任一盐胁迫下的醉马草MDA 含量均呈上升趋势且显著高于其对照组,并呈E>D>B>C>A 的大小排列。表明随盐浓度的升高,幼苗受膜脂过氧化作用伤害的程度加重,且碱性盐Na2CO3比例越高,MDA 含量越高,对生物膜结构及膜透性的损伤也就越大。此外,不同混合盐胁迫下的E+醉马草MDA 含量均低于E-,说明内生真菌的存在可有效降低醉马草幼苗细胞膜的损伤从而提高醉马草耐盐性,这与Wang 等[54]的研究结论一致。
盐分逆境对植物的危害常表现为水分胁迫,外界与细胞间不当的渗透差迫使细胞失水,严重时甚至发生质壁分离、细胞死亡等现象。植物细胞则通过积累渗透调节物质(如脯氨酸、可溶性糖等)以保持适宜细胞渗透势,消除不当渗透差,防止细胞过度失水及植物萎蔫,从而达到减缓盐害的目的[55]。脯氨酸作为其中最重要和有效的渗透调节物质,具有响应迅速、存在稳定等优点。此外,其还可与胞内化合物形成聚合物,类似亲水胶体以防水分散失;亦可作为分子伴侣,稳定细胞蛋白结构并保持膜系统的完整性[56]。研究表明,任一盐胁迫下的醉马草脯氨酸含量均显著高于对照。此外,A、B、C 处理下的醉马草脯氨酸含量随盐浓度的上升而升高。D、E 处理下的脯氨酸含量则随盐浓度的上升无显著差异甚至呈下降趋势。这可能是与高pH 环境严重降低了细胞活性使其渗透调节物质合成受抑有关。盐胁迫下E+醉马草的脯氨酸含量高于E-,说明内生真菌的存在可提高脯氨酸含量,促进渗透调节作用,增强其植物耐盐性。这与李珍等[34]的研究结论相一致。
3.4 不同混合碱盐胁迫下醉马草的隶属函数值排序及耐盐性综合评价
植物耐盐性是由多种因素间的交互影响及协同作用而决定的,因此,选取单一指标进行耐盐种质材料的筛选与评定具有相当的局限性。因此本研究采用模糊隶属函数及主成分分析法综合评定醉马草耐盐性。隶属函数值排序表明,醉马草在不同混合盐碱胁迫下的耐盐性为A>D>B>C>E,且除B 处理外,任一盐胁迫下的E+醉马草隶属函数值及耐盐性均高于E-。表明醉马草对碱性盐,尤其是Na2CO3的耐受程度低于中性盐,内生真菌可提高醉马草耐盐性。此外,主成分分析表明,评价E+醉马草耐盐性的主要指标为活力指数、苗长、胚根长度、POD、SOD、脯氨酸;评价E-醉马草耐盐性的主要指标为发芽率、活力指数、平均发芽时间、胚根长度、POD、SOD、脯氨酸。
4 结论
对带菌(E+)醉马草和不带菌(E-)醉马草的种子萌发和幼苗生长时期采用不同浓度混合盐碱溶液进行处理,采用模糊隶属函数和主成分分析,表明活力指数、胚根长度、POD、SOD、脯氨酸是评价醉马草耐盐性高低的主要指标。碱性盐,尤其是Na2CO3对醉马草种子萌发及幼苗生长的抑制作用强于中性盐。此外,E+醉马草抗盐性优于E-。内生真菌可有效提高醉马草幼苗抗氧化酶活性与脯氨酸含量、降低MDA 含量,增强其渗透调节与活性氧清除能力,降低膜质过氧化提高醉马草抗盐性。
