雏麻鸡死后脑组织中DNA电泳观察
2021-08-31苑凤婷
苑凤婷,孙 斌
(黑龙江八一农垦大学动物科技学院,黑龙江大庆 163319)
细胞核DNA 是相对稳定的遗传活性物质,在生物体细胞核中具有恒定性和保守性的特点[1]。在动物死后一段时间,细胞核DNA 会发生降解、减少,直至消失[2]。本实验以断颈处死的31日龄雏麻鸡为实验动物模型,采取脑组织,提取DNA 做琼脂糖凝胶电泳。根据电泳图谱,观察禽死后脑组织DNA变化的规律与特征。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
健康雏麻鸡6 只,31日龄,雌雄不限,实验动物均为大庆市让胡路区某养殖场提供。
1.1.2 主要试剂
PBS 液、液氮、裂解液、缓冲液GA、缓冲液GB、缓冲液GD、RNaseA 溶液、蛋白酶K、无水乙醇、漂洗液PW、洗脱缓冲液TE、吸附柱CB3、收集管、5×TBE 电泳缓冲液、6×电泳载样缓冲液、溴化乙锭(EB)溶液母液、琼脂糖、橡皮膏。
1.1.3 主要器材
平皿、常规解剖器械、眼科剪、恒温箱、滤纸、研钵、EP 管、离心机、锥形瓶、微波炉、样品梳子、移液器、水平电泳槽、水浴锅、凝胶成像系统。
1.2 方法
1.2.1 取材
将13 只雏麻鸡适应性饲养12 天,同时断颈处死,置室温为14.5℃有暖气的解剖室。
取材部位:全脑组织
取材方法:于雏麻鸡处死后立即进行开颅取脑一次作为对照组(0 min),之后的12 个对照组(1 min、5 min、10 min、30 min、1 h、3 h、5 h、12 h、24 h、3 d、5 d、10 d)采取相同方法采取脑组织,每组1 只雏麻鸡。
取材处理:取材依次编号放入无菌培养皿中置于-4℃的恒温箱中,等待进行DNA 含量测定。
取材分组:同时间采集的一个样品记录为一组,共计组别为13 组。
1.2.2 脑组织研磨
称取雏麻鸡脑组织取材2.5 g,用冰PBS 液清洗去除血迹,滤纸吸干,放入已经预先置于保温箱内的研钵中,保温箱能尽量减少液氮的挥发使温度恒定。用眼科剪剪碎组织后,开始研磨,边研磨边添加液氮(在液氮没有挥发尽时添加)研磨成粉末,之后待液氮挥发尽立即加入裂解溶液,裂解液加入后组织悬液会冻成冰块,继续研磨直至融化成液态的悬液,此时研磨充分,将研磨的细胞悬液收集于EP 管内,待用。
1.2.3 脑组织基因组DNA 提取
(1)将研磨好的细胞悬液倒入离心管中以10 000 rpm 时间1 min,弃除上清,放入缓冲液GA200 μL,振荡法使其完全悬浮,添加RNaseA(100 mg/ml)溶液4 μL,振荡15 s,静置在室温内5 min,除RNA。
(2)滴加20 μL 蛋白酶K 溶液20 μL,充分混匀,56℃静置,每20 min 颠倒混匀样品1 次,组织溶解后,轻微离心使盖内壁水珠去除。
(3)滴加GB200 μL,混匀彻底,70℃10 min放置,溶液清亮,轻微离心使盖内壁水珠去除。
(4)滴加无水乙醇200 μL,振荡15 s 混匀,轻微离心使盖内壁水珠去除。
(5)将第四步的絮状沉淀以及溶液全加入吸附柱CB3 里,吸附柱置于收集管内,30 s,1 2000 rpm离心,弃废液,取吸附柱CB3 放回收集管。
(6)加500 μL 缓冲液GD 在吸附柱CB3中,30 s,1 2000 rpm 离心,弃除废液,取吸附柱CB3 放回收集管。
(7)加600 μL 漂洗液PW 于吸附柱CB3 中,30 s,1 2000 rpm 离心,弃除废液,取吸附柱CB3放回收集管。
(8)重复上一步。
(9)2 分钟1 2000 rpm 离心,弃除废液。吸附柱CB3 室温数分钟,充分晾干吸附物中剩余漂洗液。
(10)把吸附柱CB3 置于干净离心管内,对吸附膜中间位置悬滴洗脱缓冲液TE50 ~200 μL,3 min 左右室温静置,2 min2 000 rpm 离心,收集溶液于离心管。
1.2.4 电泳及材料配置
1.2.4.1 0.5×TBE 稀释缓冲液的配置
取5×TBE 缓冲液20 ml 加水至200 ml,配制成0.5×TBE 稀释缓冲液,待用。
1.2.4.2 琼脂糖凝胶液的制备
称0.4 克琼脂糖放入200 ml 锥形瓶,再倒入0.5×TBE 稀释缓冲液50 ml,微波炉内加热直至琼脂糖充分融化,取出摇匀备用。
1.2.4.3 琼脂糖凝胶板的制备
使用橡皮膏充分封住有机玻璃胶槽两端,插入样品梳子,梳子齿下缘距胶槽底1 mm 左右。待琼脂糖胶液温度降至60℃左右时滴加溴化乙锭(EB)溶液使得终浓度为0.5 μg/ml。待琼脂糖溶液凝固后将琼脂糖倒入胶槽里,形成均匀胶层。待凝胶充分凝固后在不损坏底部的情况下取出梳子,加0.5×TBE 稀释缓冲液于槽内使得液面刚刚没过胶板的表面。
1.2.4.4 加样
取10 μLDNA 样品与2 μL6×上样液混匀,用微量移液枪小心地加入样品槽中,避免损坏凝胶或将样品槽底部凝胶刺穿,但总体积不可超过样品槽容量。
1.2.4.5 电泳
加样完成合上电泳槽盖,立即接通电源。电压保持在60 ~80 V,电流在40 mA 以上,待溴酚蓝条带移动到距凝胶前沿约2 cm 时,停止电泳。
1.2.4.6 染色
未加EB 凝胶板在电泳完毕后移入0.5 μg/ml的EB 溶液中,室温下染色20 ~25 min。
2 结果
琼脂糖凝胶电泳显示,各组条带呈现连续的弥散型条带,与预期结果相符合,用凝胶成像系统照像(见图1)。
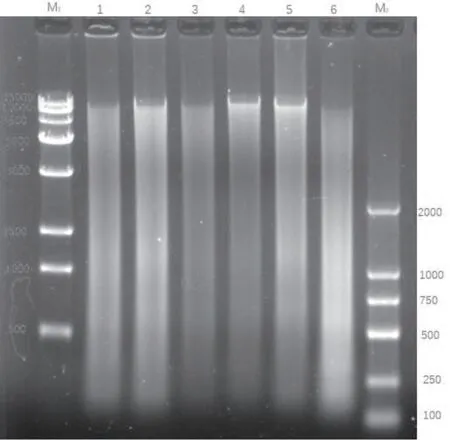
图1 雏麻鸡死后不同时间段DNA 的电泳条带
M1:15 000 DNA 分子质量标准;M2:2 000 DNA分子质量标准;
1:死后1 min;2:死后10 min;3:死后1 h;4:死后3 h;5:死后12 h;6:死后72 h
3 讨论
本实验结果显示,死后雏麻鸡脑组织DNA 凝胶电泳呈现连续的弥散性条带,说明雏鸡死后脑组织中的DNA 在不断连续的降解,图像特征与坏死的DNA降解相似。说明正常死亡后细胞和坏死细胞降解相同,为随机破坏,理由如下:凋亡细胞和坏死细胞在电泳后条带有较大区别,处理后的凋亡细胞常规方法进行分离提纯DNA,经琼脂糖凝胶电泳和溴化乙锭染色后,在凋亡细胞群里能观察到典型的梯形电泳图谱[3]。然而,细胞坏死过程中染色质不会发生凝集现象,不会出现200 bp 的DNA 降解片段,而是被随机降解,琼脂糖凝胶电泳时呈现弥散性分布的现象,俗称“拖尾”。由此可以实验所得结论成立。
在本实验中电泳图谱的第三、第四条带从时间上降解含量显示不是很成功,但是毫不影响本实验结论。希望在下一次实验中能够做到更好。
4 结论
通过琼脂糖凝胶电泳实验,观察到条带是弥散型连续性条带,从而可以证明DNA 的降解是连续的,同时也能说明正常死亡组织和坏死组织降解过程相似。
