不同产地三文鱼的稳定同位素指纹特征及原产地溯源
2021-08-31周秀雯陈海泉靳保辉谢丽琪林光辉
吴 浩,周秀雯,2,陈海泉,靳保辉,颜 治,赵 旭,谢丽琪,赵 燕,林光辉
(1.深圳海关食品检验检疫技术中心,广东 深圳 518054;2.中国计量大学生命科学学院,浙江 杭州 310018;3.中国农业科学院农业质量标准与检测技术研究所,北京 100081;4.清华大学深圳国际研究生院,广东 深圳 518055;5.清华大学地球系统科学系,北京 100013)
“三文鱼”是一种商业名称,包括鳟鱼(三文鳟、金鳟)和鲑鱼(大西洋鲑,太平洋鲑,北极白点鲑和银鲑)等[1]。我国进口的“三文鱼”主要是指大西洋鲑鱼(Salmo salar)[2]。随着我国经济的发展,国民对进口水产品的消费量逐年提高,三文鱼市场需求量也随之日益增加,预计2025年中国大西洋鲑鱼的消费量将会达到24万 t[3]。市场上大西洋鲑鱼由于主要以切片的形式出售,因此无法获取准确的来源信息。因此,开发进口水产品产地识别技术,开展污染水产品的溯源研究,对提高进口口岸的水产风险管控能力以及回应舆论关注都具有重要意义。
稳定同位素技术是目前食品真实性和产地判别研究的主要技术之一[4]。稳定同位素具有指示、整合以及示踪的能力,可实现不同类型食品的原产地识别,具有广阔的应用前景[5]。目前的稳定同位素技术在三文鱼产品领域主要集中在对其生活史溯源、有机和非有机产品的鉴别等[6]。Doucett等[7]于1996年采用碳、氮稳定同位素发现养殖的三文鱼幼年时期85%左右的食物来源于外来环境,成年后三文鱼的营养等级比幼年时高了2.5 个营养级。Johnson等[8]的研究比较了不同品种三文鱼的食物来源,从而判断三文鱼栖息地的食物结构。Turchini等[9]也报道了采用氧稳定同位素可以判断三文鱼的养殖水域。另外,Molkentin等[10]报道用同位素区分野生和养殖三文鱼。以上研究结果都表明,稳定同位素技术可对三文鱼食物来源、水源地和生产方式进行有效识别。
我国对大西洋鲑鱼的产地真实性目前没有明确的鉴别标准。对三文鱼产地的研究最早采用电子标签溯源。欧盟2002年颁布了关于鱼类溯源的法规“Regulation 178/2002”[11],该法规定义了“从农田到餐桌”的溯源体系。电子标签作为一种有效的溯源方法已经被开发出来[12],随着扩增片段长度多态性技术和数据库技术的结合,极大地促进了水产品的电子溯源技术的发展[13]。然而,该技术由于成本高,且不能有效提高生产商的利益,导致生产商没有使用此技术的积极性[14]。也有通过对鱼鳞形态分析以识别鱼类产地的报道,但该方法不是主流的研究方法,且难以标准化[15]。最新的研究报道了基于物联网的三文鱼真实性的判别系统[5],但该技术也存在费用高、需要多方协调以及面临标签造假的隐患[14]。因此,进口大西洋鲑鱼的产地识别仍然缺乏有效的鉴别技术手段以捍卫我国进口水产品的贸易秩序。综上,针对终端产品的产地溯源技术可有效提高监管效率,降低企业的管理成本,也更容易推广。本研究比较来自世界6 个主要产地的三文鱼产品中稳定同位素化学指纹特征,以期为构建快速、可靠的三文鱼进口产品的产地追踪技术提供科学依据。
1 材料与方法
1.1 材料与试剂
USGS 43、USGS 54、USGS 56稳定同位素固体标准物质,元素含量标准物质磺胺嘧啶 美国Thermo Fisher公司;IAEA-CO8液体标准物质 维也纳国际原子能机构;磷酸(优级纯) 德国默克公司;大西洋鲑鱼实验样品15~20 条,法罗群岛、挪威、加拿大、澳大利亚以及智利共5 个进口产地,每个产地采购3~4 条,且每条鱼均来自不同渔场;虹鳟(Oncorhynchus mykiss)2 条中国青海龙羊峡水库;大西洋鲑鱼验证样品(原产地为智利3 份(每份500 g)、挪威2 份(每份200 g)、加拿大1 份(每份200 g)) 深圳市海鲜超市。详细样品信息见表1。

表1 本研究采集到进口和国产三文鱼实验样品的详细信息Table 1 Detailed information about imported and domestic salmon collected in this study
1.2 仪器与设备
HT 2000元素分析仪、Delta V Advantage稳定同位素比率质谱仪、银杯、锡杯 美国Thermo Fisher公司;XS3DU百万分之一电子天平 瑞士梅特勒-托利多公司。
1.3 方法
1.3.1 样品前处理
所有三文鱼样品整鱼取背脊、肌肉、鳞片、脊椎骨以及表皮组织作为研究对象。分别取肌肉、表皮约20 g匀浆后放入50 mL离心管,加入30 mL正己烷,充分振荡后去脂,60 ℃烘干后研磨,过80 目筛。鳞片用去离子水清洗后烘干、研磨;脊椎骨剔除肌肉,取背脊处5 节,放入50 mL离心管加入20 mL正己烷去除油脂,60 ℃烘干后研磨,过80 目筛。
1.3.2 稳定同位素比值分析方法
样品的碳、氮、硫稳定同位素比值和含量采用耦合元素分析仪与稳定同位素比率质谱仪分析。用百万分之一电子天平准称取约2 mg样品用锡杯包裹备测。元素分析仪条件为:燃烧炉温度1 020 ℃,通氧时间3 s,流速250 mL/min,氦气流速50 mL/min。在元素分析仪中,样品的碳、氮、硫元素被分别氧化成CO2、N2以及SO2。色谱柱温70 ℃,待CO2和N2出峰后,将温度升至240 ℃加快SO2的出峰速度。同位素标准品采用USGS 43(δ13CV-PDB=-21.28‰、δ15NAir=+8.44‰、δ34SV-CDT=+10.46‰)作为质控用于碳、氮、硫稳定同位素分析。采用磺胺嘧啶(C=41.81%、N=16.25%、S=18.62%)作为碳氮硫含量的质控样品,每8 个样品插入1 个标准物质用于漂移校正。碳、氮、硫的稳定同位素比值测试精度分别为0.1‰、0.2‰、0.4‰。
氢、氧同位素采用稳定同位素比率质谱仪分析。称取约0.3 mg样品用银杯包裹后放入样品盘,然后将样品盘整体放入干燥器中干燥24 h,以降低空气中水分的影响。高温裂解分析方法的条件:燃烧炉温度1 400 ℃,色谱柱温80 ℃,氦气流速110 mL/min,进样器吹扫流速200 mL/min。样品的氢氧元素经过裂解管高温裂解后在碳环境中生成H2和CO,并通过He流送入质谱分析氢、氧的稳定同位素比值。稳定同位素标准品采用USGS 43(δ2HV-SMOW=-50.3‰、δ18OV-SMOW=+14.11‰)、USGS 54(δ2HV-SMOW=-150.4‰、δ18OV-SMOW=+17.79‰)、USGS 56(δ2HV-SMOW=-44‰、δ18OV-SMOW=+27.23‰)作为质控用于氢、氧稳定同位素的数据校正。氢、氧稳定同位素长期的实验室分析精度分别为1.2‰、0.3‰。
骨骼样品的碳酸盐碳、氧同位素比值采用水平衡-稳定同位素比率质谱法(gas bench-IRMS)分析。将1 mg骨骼样品加入12 mL具塞玻璃瓶中,用He吹扫5 min去除顶空空气,加入1 mL磷酸。在99 ℃水浴4 h后置入恒温样品盘内,再用Gasbench-IRMS系统测定生成CO2的碳、氧同位素比值。采用IAEA-CO8标准品作为质控标准(δ13CV-PDB=-5.76‰、δ18OV-SMOW=-22.7‰),每8 个样品插入一个标准物质用于仪器漂移校正。碳酸盐碳、氧稳定同位素比值测试精度分别为0.2‰、0.3‰。
1.4 数据处理
采用单因素方差分析用于分析骨骼中碳氧稳定同位素比值(取绝对值对数)的产地差异,SNK作为事后多重比较方法。双因素方差分析(two way-analysis of variance,two way-ANOVA)用于分析三文鱼不同组织以及不同产地的稳定同位素比值和元素含量的差异。近年来,产地溯源的模型算法越来越多样化,常见的有:基于无监督的主成分分析(principal component analysis,PCA)、聚类分析(clustering analysis,CA)、随机森林模型(random forest,RF);基于有监督的判别分析(discriminant analysis,DA)、人工神经网络(artificial neural network,ANN)、支持向量机(support vector machines,SVM)等。而DA是应用最为广泛的产地溯源方法,包括偏最小二乘法判别(partial least squares,PLS-DA)以及正交偏最小二乘法(orthogonal partial least square method,OPLS-DA)。DA作为一种多元统计方法已经在多种食品以及农产品的产地溯源中取得良好的应用效果[16]。该模型已经在大量产品溯源案例中(酒类[17]、乳制品[18]、肉制品[19]、农产品[16]以及中药材[20])得到成功应用。本研究采用DA对不同产地三文鱼进行区分,并分别对不同部位稳定同位素比值对产地的识别能力进行评估。对不同产地三文鱼的表皮、骨骼、鳞片以及肌肉的同位素分别进行DA,其中骨骼样品还加入骨骼中无机碳酸盐的碳、氧同位素比值。所有统计分析方法采用SPSS 22软件进行分析。采用Origin pro 2018软件绘制图形。
2 结果与分析
2.1 有机质稳定同位素比值
5 个国外产地和我国1 个产地的三文鱼骨骼、表皮、肌肉和鳞片有机质稳定同位素组成分析结果如图1。三文鱼不同产地不同部位的碳稳定同位素比值(δ13C)分布范围为-24.96‰~-16.93‰,氮稳定同位素比值(δ15N)分布范围为5.75‰~9.64‰,硫稳定同位素比值(δ34S)分布范围为2.08‰~12.24‰。从不同部位看,δ13C值大小顺序为鳞片>表皮,肌肉和骨骼的δ13C均低于鳞片和表皮,除中国虹鳟外,其他产地的肌肉和骨骼的δ13C差异不大,且不同产地比值大小不同,如CA、NW和CHL产地的肌肉δ13C值大于骨骼的对应值,其他产地则反之(图1a)。而δ15N呈现“肌肉>鳞片>表皮>骨骼”的趋势,不同组织的δ34S值差异不显著(表2)。整体而言,加拿大、智利和中国的虹鳟碳稳定同位素比值高于其他产地(图1a),加拿大以及法罗群岛氮稳定同位素比值高于其他产地(图1b),δ34S表现出显著的产地差异(图1c),但不同组织间差异不显著(表2)。
三文鱼有机质的氢稳定同位素比值(δ2H)变异较大,介于-20‰~-140‰之间(图1d),且显现出明显的组织间差异,表皮和鳞片的δ2H显著高于骨骼和肌肉。氧稳定同位素比值(δ18O)于3‰~18‰波动,且表现出较好的产地差异(图1e)。中国虹鳟的肌肉中δ18O最高达到17.79‰。除肌肉外的其他部位,中国的虹鳟具有最低的氧稳定同位素比值,其次为加拿大,其他4 个产地氧稳定同位素比值无明显变化趋势。双因素方差分析自由度,统计量(F值)评估组间差异等数据,F值越大,表示方程越显著,拟合程度越好。由表2可知,三文鱼不同组织以及不同产地的δ2H和δ18O均具有显著差异。

表2 不同产地三文鱼、不同部位稳定同位素和含量的双因素方差分析Table 2 Two way-analysis of variance (ANOVA) of stable isotopes and contents in salmon from different geographical origins and in different tissues
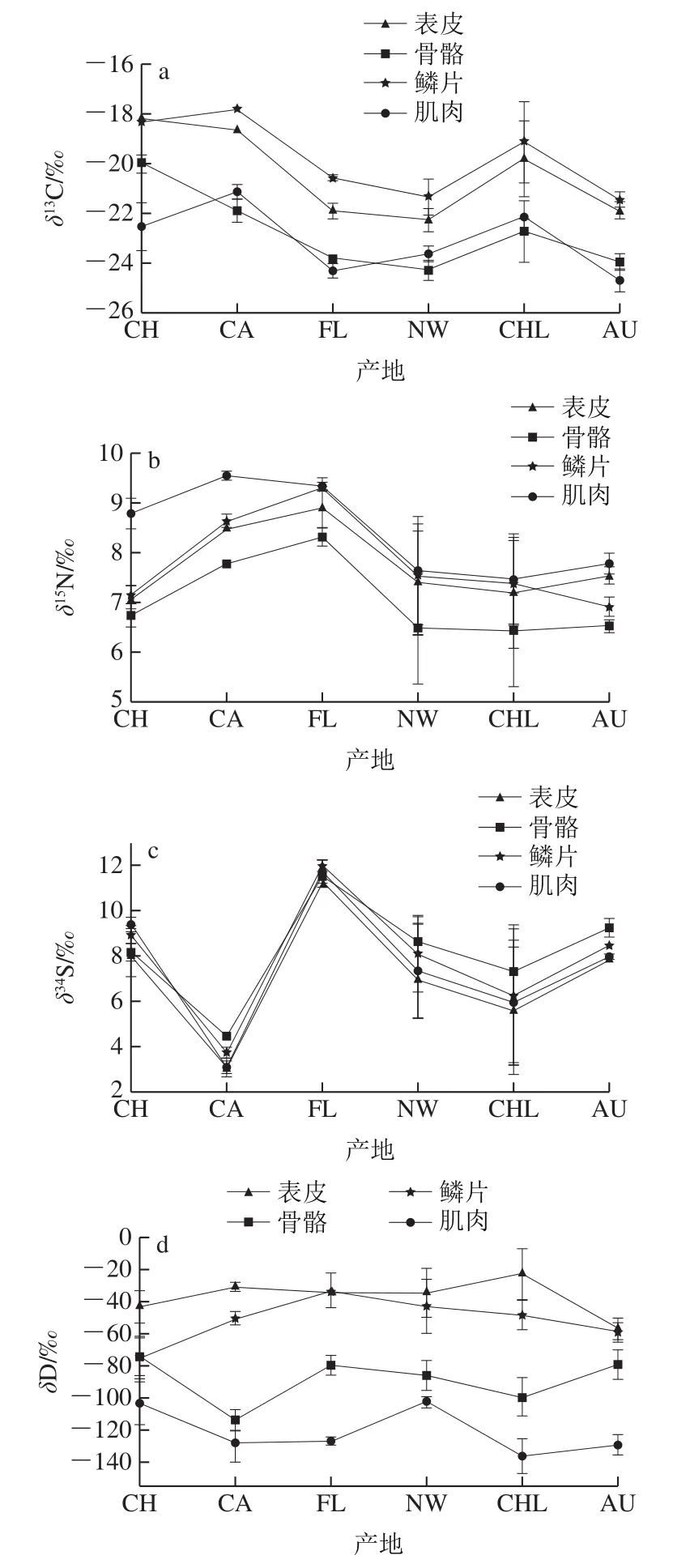

图1 不同产地三文鱼骨骼、表皮、肌肉和鳞片中碳(a)、氮(b)、硫(c)、氢(d)、氧(e)稳定同位素比值分布Fig. 1 Stable isotope ratio distribution of carbon (a), nitrogen (b),sulfur (c), hydrogen (d) and oxygen (e) in bones, skins, muscles and scales of salmon from different geographical origins
2.2 有机质碳、氮、硫元素含量
三文鱼不同组织碳、氮、硫含量差异较大(图2),因为肌肉和鳞片有交叉,且在CA、FL、CHL和AU产地中,其肌肉、鳞片的氮元素含量几乎相等,因此将氮元素含量中肌肉和鳞片归为一类表示为肌肉、鳞片。三文鱼中表皮、肌肉的碳含量,鳞片、表皮的硫含量同理。氮含量呈现“骨骼<肌肉、鳞片<表皮”的趋势,骨骼、肌肉、鳞片、表皮平均值分别为8.3%、23.1%、24.6%、34.0%;碳含量呈现“骨骼<鳞片<表皮、肌肉”的趋势,骨骼、鳞片、表皮、肌肉平均值分别为31.1%、37.7%、56.2%、62.2%;硫含量呈现“骨骼<鳞片、表皮<肌肉”的趋势,骨骼、鳞片、表皮、肌肉平均值分别为0.25%、0.50%、0.53%、0.72%。除了碳含量以外,氮、硫元素含量均未表现出显著的产地间差异(表2)。由图2可以看出,肌肉和鳞片的氮含量,肌肉和表皮的碳含量的分布趋势表现出不同的产地差异。单因素方差分析表明,肌肉/鳞片的氮元素含量(P=0.016)以及肌肉/表皮的碳元素含量(P=0.006)具有显著的产地差异。
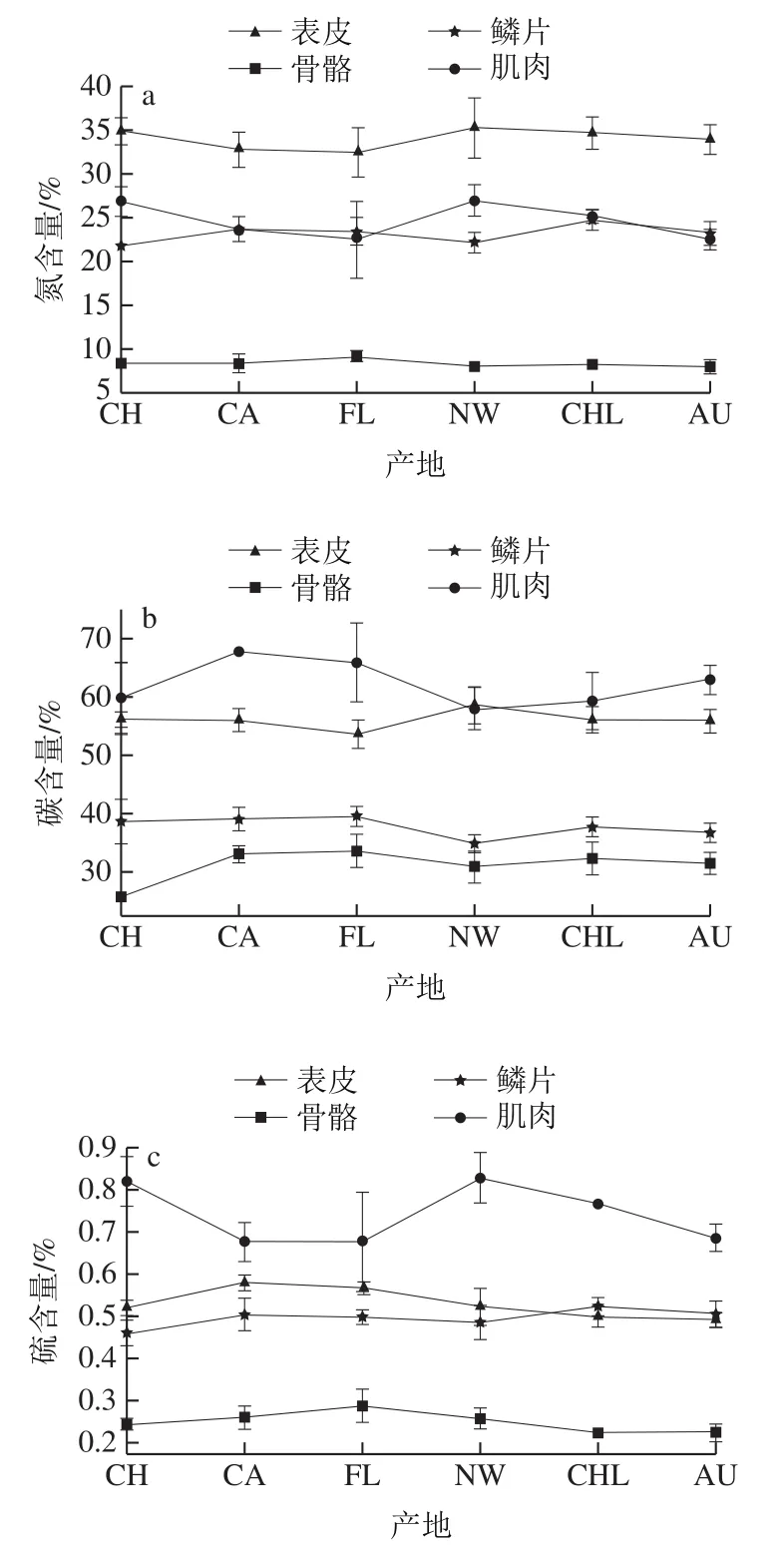
图2 三文鱼不同部位氮(a)、碳(b)、硫(c)含量Fig. 2 Nitrogen (a), carbon (b), and sulfur (c) contents in different tissues of salmon
2.3 骨骼碳酸盐碳、氧同位素比值
三文鱼骨骼碳酸盐的δ13C值范围-8.72‰~-6.31‰,其平均值为-7.29‰。δ18O范围-21.23‰~-17.14‰,其平均值为-19.47‰(图3)。整体而言,不同产地三文鱼的骨骼碳酸盐碳、氧同位素差异不显著(表2)。澳洲三文鱼骨骼δ13C显著低于其他产地(P<0.05),而中国虹鳟骨骼的δ18O低于其他产地。

图3 不同产地三文鱼骨骼碳酸盐的碳、氧稳定同位素的分布Fig. 3 Distribution of carbon and oxygen stable isotopes in bone carbonates of salmon from different geographical origins
2.4 三文鱼产地溯源与验证
所有三文鱼组织的稳定同位素以及含量数据的DA结果显示,6 个产地(包括5 个进口和1 个国产)的三文鱼可以全部区分开(图4)。法罗群岛和挪威的三文鱼样品分布比较接近,这主要是由于挪威和法罗群岛在地域和气候上均非常接近,说明同位素对地理差异的指示性非常好,可用于水产品的产地溯源。除此之外,中国的虹鳟也能与其他三文鱼产地样品实现区分。但由于本研究样品数量有限,未能包括所有子产地样品,所以该准确率仅代表本数据集的判别结果。

图4 不同国家三文鱼样品的产地DAFig. 4 DA plot for discrimination of salmon samples from different geographical origins
为了简化数据结构的复杂度,便于实际应用,本研究还分析了三文鱼不同组织和同位素比值的产地判别效率(表3)。对于同位素分析而言,现有的稳定同位素分析技术可在单次分析中取得δ13C、δ15N、δ34S或者δ2H与δ18O对其产地溯源,为了最小化分析测试的时间以及成本,分不同部位以及不同指标进行DA。结果表明,表皮、鳞片、骨骼的碳、氮、硫同位素可将5 个产地样品完全区分。如果只能取得三文鱼样品的肌肉,还需要氢、氧的同位素指标,才能达到较好的区分效果。单独采用氢、氧同位素分析则不能获得满意的区分效果。在实际的应用中,由于三文鱼的骨骼一般比较难获取,因此采用表皮、鳞片的碳、氮、硫同位素比值可获得最佳的产地判别效率。考虑到取鳞片不会破坏样品的经济价值,是一种无损的采样方法,可满足高价值水产品的采样需求。
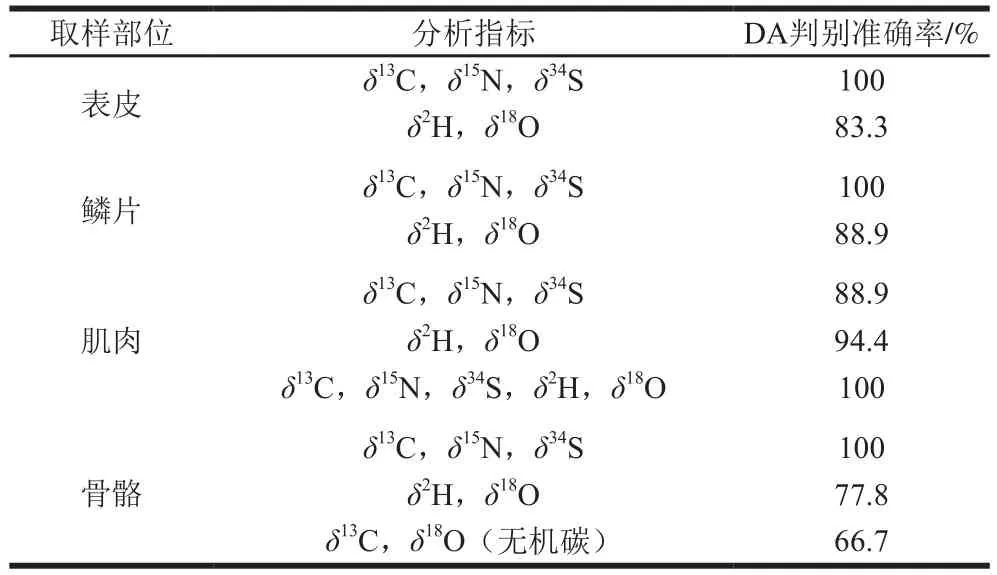
表3 三文鱼不同组织以及不同同位素的产地判别结果比较Table 3 Results of discriminant analysis of salmon from different geographical origins based on stable isotope indicators in different tissues
市场上三文鱼主要以切块的形式销售,多数情况下样品仅包含鳞片、表皮以及鱼肉。因此在实际应用过程中以鳞片、表皮以及肌肉等较易获取的部位作为分类指标,按照前述方法进行处理,分别分析不同组织样品的碳、氮、硫、氢、氧的稳定同位素比值。采用DA对中国、法罗群岛、澳洲、挪威、加拿大、智利共6 个国家的真实样品以及验证样品(T-加拿大、T-智利、T-挪威)的区分如图5所示。智利和加拿大样品被正确判断,而6 个挪威三文鱼样品有2 个被错误判断为智利产地样品。挪威、法罗群岛等高纬度冷水区域养殖的三文鱼由于脂肪含量高、口感好被消费者喜爱。因此,零售市场可能存在其他产地三文鱼冒充挪威和法罗群岛三文鱼的情况。

图5 市场购买的三文鱼产品与原产地产品稳定同位素指纹特征DA结果比较Fig. 5 Comparison of results of discriminant analysis of stable isotope finger characteristics between authentic and purchased salmon
3 讨 论
3.1 三文鱼不同部位的同位素分馏效应
鱼类生长过程需要的碳、氮、氢、氧、硫的稳定同位素均来自摄入食物的同化过程,动物机体在食物的同化过程会受到不同酶体系的作用,因此发生不同程度的动力学非平衡分馏[21]。三文鱼是杂食性鱼类,商业化的三文鱼饲料主要由豆粕、蔬菜等植物性原料以及鱼粉等动物性原料组成。食物源性的差异可能导致不同产地三文鱼具有较为明显的同位素差别。研究表明,动物的肌肉组织对食物的碳稳定同位素分馏效应比较小,约发生0‰~1.0‰的分馏[22],而氮的稳定同位素比值相对于食物的分馏系数约3.0‰~5.0‰,常被用于不同营养级关系的区分[21],三文鱼肌肉的δ15N对于饲料的中氮同位素分馏系数约在2.5‰~3.5‰之间[7]。由于缺乏不同国家饲料配比的信息,不同组织同位素比值无法与食物来源进行比较,但可与肌肉的分馏效应进行比较,考察不同组织之间的分馏效应差异。本研究结果表明,表皮和鳞片均具有相对偏正的碳、氢的稳定同位素比值,相比其他组织具有更大的碳、氢同位素分馏效应。相对于肌肉组织,表皮、鳞片的碳同位素分馏效应分别达到2‰、4‰;表皮、鳞片的氢稳定同位素的分馏效应达到约80‰、100‰,而硫的分馏效应不明显。
鱼类表皮是一种特殊的组织,负责对损伤的修复,分泌黏液等个体保护功能[23],处于非常活跃的生物代谢活动状态。而鳞片可认为是角质化的表皮[24],且鳞片等角质化的组织形成后基本不与体内发生同位素交换,因此可以整合三文鱼整个生长周期的同位素信号。已有研究表明,鳞片与肌肉的碳、氮稳定同位素比值具有较好的相关性[21]。Pearson相关系数越接近于1或-1,相关度越强;反之,则越弱。本研究肌肉和鳞片碳、氮、硫稳定同位素的Pearson相关系数分别为0.75、0.84和0.99,3 种同位素均具有极显著的正相关关系(P<0.01),鳞片可代替肌肉作为产地溯源的指标。鱼类在不同的生长环境可能会导致表皮对环境的不同响应,从而引起不同的分馏效应。鱼类表皮的稳定同位素可能在一定程度上反映了产地环境的差异。因此,鱼类表皮以及鳞片可以综合反映鱼类的生存环境和饲料的差异。
三文鱼骨基质是由无机质的磷酸钙和碳酸钙沉积在有机胶原基质中形成的[25]。而碳酸盐主要存在于磷灰石晶格中[26]。动物骨骼种碳酸盐的形成与血液中碳酸氢盐的沉积有关[27],在鱼骨骼中的含量约为5%~6%。因此其碳、氧同位素主要与血液中碳酸氢盐的来源有关,且不能完全由食物来源解释[27],可能还与水体中的碳酸盐密切相关,需要进一步研究骨骼中碳酸盐的碳、氧同位素比值与水环境之间的关联性,便于阐明骨骼碳酸盐对产地的指示原理。
3.2 产地环境对三文鱼同位素比值的影响
双因素方差分析结果显示,稳定同位素比值在产地间均具有极显著差异(P<0.01),鱼皮和肌肉的硫含量,骨骼的碳含量具有显著差异(P<0.05),表明稳定同位素可有效识别三文鱼产地(表2)。对于碳、氮同位素而言,三文鱼产地的差异主要体现在饲料的差异上,其次三文鱼养殖过程中饲料以外的食物来源也对可能对其稳定同位素比值产生影响,研究表明远海区系的δ13C比淡水输入的河口区系更偏正[28]。本研究中法罗群岛与挪威产地的地理位置和纬度上均非常接近,而法罗群岛三文鱼的碳、氮、硫的稳定同位素比值均高于挪威产地三文鱼的对应同位素比值,变化趋势相同。可能原因是挪威产地处于多条内陆河流影响,法罗群岛养殖区域更接近于远海,因此除了饲料的差别外,养殖区域受到陆源的影响也可能是导致同位素差异的原因之一。研究表明,水生动物组织中的氢、氧的稳定同位素主要受到环境水体影响[29-30]。Chesson等[31]的研究也表明,陆地和水生动物蛋白的氢、氧同位素比值主要由食物和环境水(包括饮用水)共同决定,同一水域的不同动物组织具有相近的氢、氧同位素比值,因此三文鱼蛋白中的氢、氧同位素比值可以反映水源的差异[9]。所以挪威产地三文鱼中氧稳定同位素比值较低的原因可能受到当地氧同位素比值偏低的水源影响。中国虹鳟养殖于青藏高原,由于青藏高原湖泊水域的氧同位素比值偏低,因此中国虹鳟除肌肉外的部位氧稳定同位素比值均低于其他产地,除肌肉外的部位,氧稳定同位素比值均为所有产地最低。因此可以说明环境水体可影响三文鱼表皮、骨骼以及鳞片等生长缓慢部位的氧稳定同位素比值。肌肉由于合成旺盛,其氧同位素比值主要受饲料的影响。
从产地看,加拿大样品δ34S最低,法罗群岛最高,其他产地差别较小。硫稳定同位素指示了三文鱼饲料中陆地来源和海洋来源饲料的比例,研究表明陆地生态系统中硫稳定同位素比值低于海洋来源。不同部位之间的δ34S差异较小,部分产地(澳洲、加拿大)表现出较为明显的“骨骼>鳞片>肌肉和表皮”趋势,表明硫同位素在动物生长过程中的角质化和骨骼形成过程中具有轻微的分馏现象。
4 结 论
采用多元素稳定同位素分析技术结合多元判别模型,可实现我国主要三文鱼进口产地的判别,且能将中国的虹鳟与三文鱼进行区分。在实际应用中,由于三文鱼的骨骼一般比较难获取,因此采用表皮、鳞片的碳、氮、硫共3 种同位素比值可获得最佳的产地判别效率。由于取鳞片不会破坏样品的经济价值,因此这是一种无损的采样方法,可满足高价值水产品的采样需求。鱼鳞和鱼皮的稳定同位素比值与产地环境相关,作为产地溯源指标优于肌肉。虽然本研究的数据量有限,产地溯源的可靠性和稳定性还需要大量收集样品以进一步验证此方法的准确性,但本研究建立的方法可为鉴别市场上三文鱼的真实性和溯源产地提供新的技术思路。在新冠肺炎持续肆虐全球的背景下,本研究的方法也有助于我国卫生检疫部门对新冠病毒污染食品的溯源工作提供技术支撑。
